Оглавление:













Подгруппа галлия
- Подгруппа галлия. Содержание каждого члена этой подгруппы в земной коре относительно некоторого количества галлия (4-10-4%)-Индия (2-10-6) — таллия (8-10-7) уменьшается. Все 3 элемента очень распылены, и быть в форме определенного минерала не характерно для них. Напротив, малейшая примесь их соединений содержит руды многих металлов. Ga, In и T1 получают из отходов при переработке таких руд.
- В свободном состоянии галлий, индий и таллий являются серебристо-белыми металлами. Плотность, е / см5 Температура плавления, ° C температура кипения,°С. 。Электронное сопротивление Иона(Hg-1) Т1 ОА 5.9 7.3 11.9 30 157 304 2200 2020 1476 2 116 Твердости галлий близок к свинцу, в, Т1 и еще мягче. В сухом воздухе галлий и индий не изменяются, а таллий покрывается серой оксидной пленкой. Сияя, все 3 элемента активно соединяются с кислородом и серой. Они взаимодействуют с хлором и бромом уже при комнатной температуре, а вместе с йодом-только при нагревании.
Наиболее важные константы для них сравниваются ниже. Людмила Фирмаль
Расположенные в ряду напряжений вблизи железа, Ga, In и T1 растворимы в кислотах 4> 5 Обычная валентность галлия и Индия равна 3.Таллий дает трехвалентные и одновалентные производные 16 Оксиды галлия и его аналоги-Белый Gaa03, желтый In2Oj, коричневый T1203-нерастворимы в воде. 。Белые гидроксиды Ga и In также растворяются в растворах сильной щелочи с образованием галловых и металлических солей, напоминающих алюминаты.
Таким образом, они обладают свойствами обоих полов, причем свойства кислоты слабее при 1n (OH)8,а при Ga (OH) 3 они сильнее, чем при A1 (OH) 3.So, в дополнение к сильному алкалиу, Ga (OH) 3 soluble в сильном NH ^ OH solution. In напротив, красно-коричневый T1 (OH) 3 не растворяется в щелочи. Га» и в «ионы бесцветны, не являются Т1 «желтыми».Большинство кислотных солей, полученных из них, хорошо растворимы в воде, но сильно гидролизуются.
Производные низковалентных Ga и In для них не характерны, но эти соединения наиболее характерны для таллия Она неизменна. Поэтому соль Tl3 ^обладает выраженным окислительным свойством. Оксид таллия (Т120) образуется в результате взаимодействия элементов при высоких температурах.
Это черный гигроскопичный порошок. Закись азота таллия формирует желтый гидрат нитрита (Tieh) внутри water. It легко режет воду при нагревании и возвращается в T120. Гидрат оксида таллия хорошо растворим в воде и является сильным основанием. Образованная им соль почти бесцветна、 Он кристаллизуется без воды. Хлорид, бромид и йодид почти нерастворимы, но некоторые другие соли растворимы в воде(рис. XI-41).
Производные Туна и слабые кислоты вызывают щелочную реакцию в растворе путем гидролиза. Если сильные окисляются (например, хлорированная вода), то 1-валентный таллий окисляется до 3-валентного. Что касается химических свойств элементов и их соединений, то подгруппа галлия во многом аналогична подгруппе Германия subgroup. So, Если Ge и Ga превышают 0, то самая высокая валентность стабильна, а для Pb и T1 химические свойства гидроксидов ряда Rh на 20, 40, 60, 80 С ниже. XI-4I. растворы Ge-Sn-Pb и Ga-In-Tl изменяют однородность соли таллия.
Иногда появляются даже более тонкие имплозии H20.Сходство, например, низкая растворимость И галоид Pb и TI1 (CI, Br, I) salts. In кроме того, существуют значительные различия между элементами обеих подгрупп(частично из-за различных валентностей).в отличие от PbF2, элементы в подгруппе Германия хорошо растворимы во фториде таллия. Добавь 1)все 3 члена рассматриваемой подгруппы обнаруживаются с помощью спектрометра.
Таллий-1861, Индий-1863, галлий-1875.Последний из этих элементов-Д. И. Менделеев (VI§ 1).Природный галлий состоит из изотопов с массовым числом 69 (60,2%) и 71 (39,8). иций-113 (4,3) и 115 (95,7): таллий-203 (29,5) и 205(70,5%). 2) в основном состоянии атомы элементов подгруппы галлия имеют структуру внешней электронной оболочки As4p (Ga), 5s25p (In), 6s * 6p (Tl) и являются одновалентными.
Возбуждение трехвалентного состояния требует затрат 108 (Ga), 100 (In) или 129 (Tl) ккал / г атомов. непрерывная энергия ioi ^ acnn составляет 6.00. 20.51; 30.70 в случае га. 5,785; 18,86; в 28.03: 6,106; 20,42; в T1: 29,8 эВ. Сродство атома таллия к электронам оценивается в 12 ккал / г атомов. 3) О Галлии, редком минерале Галланте(CuGaSs) известно. Следы этого элемента всегда встречаются в цинковых рудах. Обнаружено значительное количество (до 1,5%) угольной золы.
Однако Боксит, который обычно содержит следовые примеси(до 0,1%), становится основным сырьем для промышленного производства gallium. It извлекается электролизом из щелочной жидкости, являющейся промежуточным продуктом переработки природного боксита в промышленный alumina. So пока ежегодное мировое производство галлия исчисляется несколькими тоннами, но его можно значительно увеличить.
4 $Индий получают в основном как побочный продукт комплексной переработки сернистых руд Zn, Pb и Cu. Годовой объем производства составляет несколько десятков тонн. 5) таллий главным образом сконцентрирован в Пирите (FeS2).Поэтому шлам от производства серной кислоты является хорошим сырьем для получения этого элемента.
Мировое годовое производство таллия не только меньше, чем Индия, но и составляет несколько десятков тонн. в) для разделения Ga, In и T1 в свободном состоянии используют либо электролиз раствора их солей, либо раскаление оксида в потоке водорода. Значения теплоты плавления и испарения металла составляют 1,3 и 61 (Ga), 0,8 и 54(In). 1.0 n 39 ккал / г атом (TI).Теплота сублимации (25 ° С) составляет 65 (Ga), 57 (In) и 43 ккал / г атомов (T1). в парах все 3 элемента почти исключительно состоят из одноатомных молекул.
7) кристаллическая решетка галлия образована двухатомными молекулами (</=2.48 а), а не отдельными атомами (обычными в металлах).Таким образом, это интересный случай, в котором молекулярные и металлические структуры сосуществуют(III§ 8). Молекулы Ga * также удерживаются в жидком Галлии, и их плотность(6,1 г / см3) выше, чем у твердых металлов(аналогия воды и висмута).
Повышение давления сопровождается снижением температуры плавления gallium. At высокое давление, помимо обычной коррекции (Gal), установлено наличие еще 2-х форм. Тройные точки (с жидкой фазой) находятся при 12 000 АТ и 3°С в Галл-Галле, а при 3000°С в Галл-Галле-30 000. 8) галлий был очень склонен к переохлаждению и мог удерживаться в жидком состоянии до −40°С. повторная быстрая кристаллизация переохлажденного расплава может служить методом очистки gallium.
In очень чистое состояние (99,999%), оно было получено как электролизом, так и восстановлением водорода полностью очищенного GaCl3.Галлий является ценным материалом для заполнения высокотемпературных термометров, поскольку он практически равномерно расширяется при сильном кипении и нагревании.
Несмотря на сходство с ртутью снаружи, взаимная растворимость обоих металлов относительно невелика (в диапазоне от 10 до 95 СС она колеблется от 2,4 до 6,1 атомов% для Hg Ga и от 1,3 до 3,8 атомов% для Hg). Генеральная Ассамблея.)В отличие от ртути, жидкий галлий не растворяет щелочные металлы и не смачивает многие неметаллические поверхности well.
In в частности, это применяется к стеклу, и при нанесении галлия получается зеркало, которое сильно отражает свет(хотя показано, что очень чистый галлий, который не содержит примесей Индия, не смачивает стекло).Иногда применение галлия и пластиковой основы используется для быстрого получения радиосхемы. 88% сплавов Ga и 12% сплавов Sn плавятся при 15°C, а другие галлийсодержащие сплавы (61,5% Bi, 37,2-Sn и 1,3-Ga) предлагаются в качестве зубных пломб.
Они не меняют объем при определенной температуре, но прочно удерживают его. Галлий также может быть использован в качестве герметика для клапанов в вакуумной технике. Однако следует иметь в виду, что при высоких температурах стекло агрессивно по отношению ко многим металлам. 9) в связи с возможностью расширения производства галлия вопрос об усвоении этого элемента и его соединений (то есть развитие практики) становится актуальным, и необходимы исследования для поиска направлений его рационального использования.
Имеется обзорная статья*и монография по Галлию 10) степень сжатия Индия несколько выше, чем у алюминия (10 000 Ат., Объем будет равен исходному 0,84).Когда давление увеличивается, его проводимость уменьшается. * Вагнер Г.. Г и т е » и В. и успехи химии. 1953. НЗ. •* Шек и И. А.. Ч. С. И. .. Минорен Т. Т. Гвлльна. Гостехудат Киевского Советского Союза, 1963, 296 стр. Еремин Н. И. Галлий. М..«Металликс», 10 секунд、 тивленка(на 70 000.От начального значения 0,5) и температура плавления повышается(65 000 Ат. До 400°C).
Металлическая индиевая палочка будет гнуться и хрустеть, как олово. На бумаге он оставляет темный след line. An важное применение Индия связано с производством германиевых выпрямителей переменного тока (X§b дополнительно 15).Его плавкость позволяет играть роль смазки в подшипниках. 11) введение небольшого количества Индия в медный сплав значительно повышает стойкость к действию морской воды, а добавление Индия к серебру улучшает блеск и предотвращает обесцвечивание на воздухе.
Если вы добавите индий в сплав для пломбирования зубов, это увеличит его прочность. Электролитическое покрытие других металлов индием защищает их от corrosion. An сплав Индия и олова (по массе 1: 1) припаивает стекло к стеклянной или металлической лунке, а сплавы 24% In и 76% Ga расплавляют при 16°C. сплавы от 41,0 до 47°C расплавляют при 18,1% — Bi. 22.1-свинец 10.6-Sn и 8.2-Cd используются в медицине при сложных переломах вместо гипса. Есть монография по химии Индия.
12) коэффициент сжатия таллия почти такой же. Подобно Индию, известны 2 аллотропные модификации(шестиугольники и Кубы), точка перехода между которыми составляет 235°С. При высоком давлении произойдет еще одна. 3. все тройные точки находятся при 110 ° С при 37000 это давление соответствует резкому снижению электрического сопротивления металла примерно в 1,5 раза (*при 7 млн. Ат. Обычно это около 0,3). Под давлением 9 миллионов атмосфер 3-я форма таллия плавится при 650°C.
13) таллий главным образом использован в продукции сплавов олова и руководства с высокой кислотой resistance. In в частности, состав сплава составляет 70%Pb. 20%Sn и 10% T1 хорошо переносят смесь серной, соляной, азотной кислот. Есть монография о таллии. 14) Что касается воды, то галлий и компактный Индий стабильны, а присутствие воздушного таллия замедляется медрино, чтобы разрушить его от surface.
In нитрат галлия, реагирует только медрино. Таллий очень полезен. Напротив, серная кислота, особенно соляная кислота, легко растворяет Ga и In. С другой стороны, TI (за счет образования на поверхности защитной пленки плохо растворимых солей) взаимодействует с ними значительно медленнее. Раствор сильной щелочи легко растворяет галлий, медленно действует на индий и вступает в реакцию с таллием.
Галлий также замечательно растворяется в NH4OH. Летучие соединения всех трех элементов окрашивают бесцветное пламя в характерный цвет. Ga-темно-фиолетовый (4171 A X), In-темно-синий( A.»4511 A), T1-изумрудно-зеленый (A,= 5351 A). 15) галлий и индий явно не токсичны. Напротив, таллий очень токсичен, и по характеру своего действия сходен с Pb и As. Поражает нервную систему, пищеварительный тракт, почки.
Симптомы острого отравления появляются сразу же, через 12-20 часов. При хронической интоксикации (в том числе кожной), которая протекает медленно, наблюдается преимущественно возбуждение и сон disturbances. In медицина, препараты таллия применяют для удаления волос (при лишаях и др.).Соли таллия нашли применение в люминесцентных композициях в качестве вещества, продлевающего продолжительность свечения. Oii был также отличным средством от мышей и крыс.
16) в серии напряжений галлий находится между Zn и Fe. Индий и таллий находятся между Fe и Sn. и * 3 4-be=Эсхеме га и в переходах по схеме соответствуют обычным потенциалам: −0,56 и −0,33 в (в кислой среде) или −1,2 и −1,0 в (в щелочной среде).Таллий превращается в одновалентное состояние кислотой(обычно * Б л т ш Н И К и А. С. В.. Абрамова В. Ф. химия Индия. О’Лири. АИ от Kirg. ССР. I9S3. Страница 371 * * Кульбе Ф. В.. Миронов В. Е. таллий химический (составное соединение). Л. Госхим-изд. 1УШ. Страница 207 тиал −0.34^). Переход Tl + 3 + 2e = Tl + характеризуется стандартным потенциалом+1.28 в щелочи в кислой среде+0.02 В.
17) теплота образования e * Oe галлия и его аналогичных оксидов снижается в серии 2G0 (Ga). 221 (III) и 93 ккал / моль (T1).При нагревании воздуха галлий практически окисляется только до Гао. Таким образом, Gaa03 обычно получают дегидратацией ОА(ох).При нагревании на воздухе Индий образует Inj03,а таллий образует смесь Tlj03 и TljO, и чем ниже температура, тем выше содержание оксида. Если петь до t1203 таллия, он будет окислен озоном.
18) кислотный оксид E ^ 03 растворимость ряда Ga-In-Tl увеличивается. Такая же серия в кислороде и элементов прочности соединения уменьшена. Га / 03 составляет 1795°С разлагается без плавления, и 1п03 составляет 850°С превышает 1п304, и тонкодисперсным Т1} 03 уже около 90°С разделения кислорода начинается. Однако для полного преобразования TljO в TIjO необходима гораздо более высокая температура.
- При избыточном давлении кислорода 1n} 03 будет плавиться при 1910eC, а Tljj-при 716vC. 19) теплота гидратации оксида по схеме Е203 + ZN20 = 2 2 (OH) 3 составляет+ 22 ккал (Ga),+ 1 (In) и −45 (Tl).Таким образом, легкость удаления воды гидроксидом возрастает от Ga до XI. когда Ga (OH) 3 полностью обезвоживается только во время выпечки, T1 (OH) превращается в TljOi, даже если он находится под liquid. It был отделен от него.
20) нейтрализуя кислый раствор Галлиевой соли, ее гидроксид осаждается примерно с интервалами пи 3-4.Вновь осажденный Ga (OH) легко растворяется в сильном растворе аммиака, но растворимость уменьшается все больше и больше с течением времени. Его изоэлектрическая точка находится при рН * 6.8.И PR = 2-10 ″ M. Для 1p (OH) 3 были найдены PR = 1 * 10 и Tl (OH) 3-I * 10 45. H3Q » 03 / Са-5_П Га (о> 3 / СЈ-2.10 — «КЦ-СиДжей» ’*
21) для 2-й и 3-й констант диссоциации Ga (OH) 3 из типа кислоты и основания были определены следующие значения. Людмила Фирмаль
Таким образом, гидроксид галлия является случаем электролита, который очень близок к идеальному амфотерному. 22) разница в кислотных свойствах гидроксида галлия и его аналогов заключается в сильной щелочи(NaOH. It ярко проявляется при взаимодействии с раствором (KOH).Гидроксид галлия легко растворяется и образует соли галловой кислоты типа MfGafOHb). он стабилен как в растворе, так и в твердом состоянии.
При нагревании они легко теряют воду (соль 120 Na, соль 137 K) и поступают в соответствующую безводную соль типа MGaOa. Двухвалентный металл (Ca, Sr), полученный из раствора галловой кислоты, характеризуется различными типами-M3 | Ga (OH)»] J. Гидроксид Индия практически нерастворим в сильных щелочах (NaOH, KOH), но при очень высоких концентрациях он также образуется в виде MjlIn (OH)»] 2HtO.
Они полностью гидролизуются водой. Гидроксид таллия легко обесцвечивается сильной щелочью(образуются отрицательные золи), но он нерастворим в них и не дает Талата. Благодаря сухому способу (сплавление оксидов с соответствующими карбонатами) были получены производные типа Мео для всех 3 элементов подгруппы галлия. Но в случае таллия оказалось, что ИА представляет собой смесь оксидов.
23) эффективный радиус ионного газа. In1 и TP равны 0,62, 0,92 и 1,05 A, respectively. In водная среда, она ясно окружена сразу 6 молекулами воды. Такие гидратированные ионы диссоциируют в некоторой степени по схеме E (OH), 3(OHt) 5 OH » + H, а константы их диссоциации оцениваются как 3•10-«(Ga) и 2•10-4 (In). 24) Галоидные соли Ga5*, In3 *и Tls *в целом аналогичны соответствующим солям AI. В] Джей, TIBrs и черный Сезам. Безводный GaCb. Как Алкл Джей.
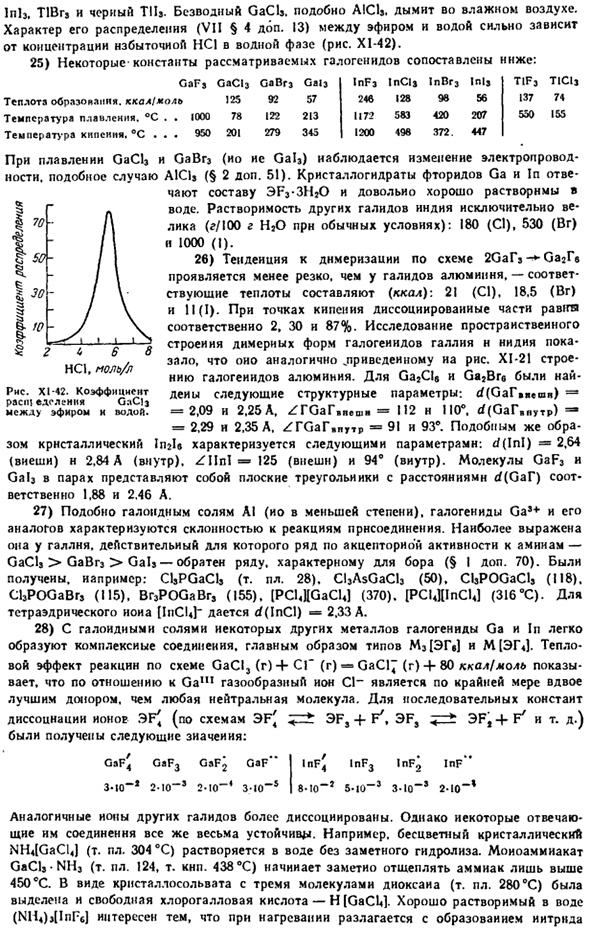
Вдыхайте влажный воздух. Характер распределения между эфиром и водой (VII§ 4 add.13) сильно зависит от концентрации избытка HCl в водной фазе(рисунок Х1-42). 25) сравните константы некоторых рассматриваемых галогенидов со следующими: GaFj GaClj GaBr3 Gai3 InF3 ВКЛ Injr3 Inlj теплота образования, ккал / моль 125 92 57 246 128 98 56 Температура плавления. °С. 1000 78 122 213 1172 583 420 207 температура кипения. С… 950 201 279 345 1200 498 372.
Четыреста сорок семь При расплавлении GaCl3 и GaBr3 (io Gal3) наблюдается изменение электропроводности. Как и в случае с AlClj (§ 2 ext.51). Кристаллические гидраты Ga и In fluoride соответствуют составу 3Fj-3HjO и очень растворимы в воде. Растворимость другого Галогенида Индия очень высока(при нормальных условиях г / 100 г HjO): 180 (C1). 530(br)и 1000(я).
26) тенденция димеризации по схеме 2GaI * ggajte менее выражена, чем у Галогенида алюминия-соответствующая теплота составляет (ккал): 21 (C1), 18,5(Vg)и 11(1).при температуре кипения диссоциационная часть равна 2, 30 и 87% соответственно. Структура галогенида алюминия из XI-21 путем исследования пространственной структуры Галогенида галлия и димерных димеров. Ga * Cle и Ga} для Bre были найдены следующие структурные параметры: 4 (OaGVyaevya)= » = 2.09 и 2.25 A, zrGar. НН — = 112 Н 110°.РФ (тогу «yTp)=» = 2.29 и 2.35 а, ZTGar. nyTp = 91 и 93.
Аналогично, Кристалл 1nr1v характеризуется следующими параметрами: d (lnl)= 2.64 (вес) n 2.84 A (внутренний), Zllnl = 125( внешний) и 94° (Viutra.) Пары молекул GaF3 и Gal3 представляют собой плоские треугольники с расстоянием d (GaI*) 1,88 и 2,46 А. 27) как галогенидная соль А1 (хотя и в меньшей степени), галогенид Га5 * и его аналоги характеризуются тенденцией к дополнительному reactions.
It наиболее выражен в Галлии, и фактический ряд акцепторной активности на аминах-GaClj> GaBr3> Gab-противоречит ряду свойств Бора (add§ 70).Например, были получены CUPGaCU (mp 28), CI3AsGaCl3(50), CUPOGaClj(118), CljPOGaBr(115), Br3POGaBr5(155), 1PCl»IGaCl«] (370). Pcinfo.Тетраэдрический IOIA[1pCC] — rf (ВКЛ) — = 2.33 A. 28) в Галогенидных солях других металлов, галогенидах Ga и в легко образующихся комплексных соединениях преимущественно m31eg $]и M [EG) типов.
Тепловой эффект реакции со схемой GaCl3 (g) 4-SG (g)= GaCIJ (g) 4-80 ккал! Моль указывает на то, что по отношению к Ga, n газообразный Ион C1〜по меньшей мере в 2 раза больше нейтральной молекулы. По постоянной непрерывной диссоциации ионов 3F ^(схема 3F ^ ^ * 3F, — {- F7, 3FS; — * SFj + F7 и др.), были получены следующие значения: GaF ^ GaFj Gafj GaF * * I InF ^ lnF3 InFj InF*’ 3-l0 — * 2-IO-s 2 * 10 4ЗУ «5 i 8-10» ’5-i0 ″» 9 3-Lo〜s 2-i «1 Подобные ионы других галогенидов более диссоциированы.
Но некоторые из соединений, соответствующих им, все еще очень стабильны. Например, бесцветный кристаллический NH4 (Gyacl4) (mp.304 ° С) растворяется в воде без заметного гидролиза. Моноаммония Garl3-NH3 (mp 124, mp 438°С) инициирует замечательное отделение аммиака только при 450°С и выше. 3. две молекулы диоксианина (Мп. Свободный хлоргаллат-H [GaCU] выделяли в виде кристаллического сольвата, содержащего (280°C).
Хорошо растворим в воде (NH4) 4InFe) интересен тем, что он разрушается при нагревании с образованием нитридов T1F3 TIClj 137 74550155 РНС. XI-42.Коэффициенты нечетной фракции составляют GnC] 3 msd>эфир и вода. В случае Индийского галлия свободный HsGaF *был получен как кристаллический ether. In щелочные соли, поведение температуры плавления (°с) несколько аномально:740(Li), 960(Na), 1010 (K). 950 (РБ). 850 (КС).
29) В отличие от Ga и In, когда T1 растворяется в кислоте, образуется одновалентная соль таллия. Tifj, полученный взаимодействием TlsOj с фтором, может быть расплавлен без разложения только в атмосфере фтора. Гигроскопичность очень высокая, быстро разлагается.
То же самое относится к MT1F4 fluorotareate(M-Li. это также относится к MjNaTlF, полученному Na) и сухому методу. (Здесь M-Cs. Rb. К. Т1″.НХ»). 30) трихлорид таллия получают обработкой t1cl хлорированной водой; tic1j-4HjO можно отделить от раствора в виде кристаллогидратов (mp * pl.43 * с). T1C1S отделяют от спиртовых и эфирных растворов в виде крупных бесцветных кристаллов ticb-CjHsOH или tici3•(CjHs) jO. Безводные TlCls легко объединяют аммиак с образованием tici * 3nhj аммиака.
Тип M (T1G4), M $ 1T1G.] — M»[TbClt) помимо наиболее характерных (т. е. ZMS1•2T1STs) галогенированных комплексообразующих солей со щелочными металлами. Известны комплексные кислоты без HTICI4-3HtO. Добавляя хлорированную воду к TlBr или воздействуя бромом на T1C1, получают смесь галогенидов T1C1 * Br-4HaO и t1c1br»•4H20. 31) термическая стабильность галогенида трехвалентного таллия низка (T1CU уже начинает диссоциировать хлор при 40°C) и деградирует в серии C1-Br-I.
Напротив, устойчивость комплексов типа M {T1G4]в растворе возрастает с тем же рядом. Получены следующие значения постоянной непрерывной диссоциации Иона T1P: T1C14 T1C13 TICIj TICI Z’Yu » 1 2. / 0 — * ш-й» * 5 ш-й〜* T1Br4 TlBr3 TIBr2 TlBr 9-I0 — * 3-J0-5 5.IO * 7 5-У— ПМ4 Т113 Т!! 2 тн * * 6-10-5 2.J0-7 3-й * * 10 4-10 Как видно из этих данных, не-T1 * * сочетается с Ионом CI, Br〜.«Очень сильные нейтральные соли типа T1G» представляют собой соединения с низкой степенью диссоциации.
Ядерное расстояние rf (TlT) молекул t1c19 и TlBrs составляет 2,33 и 2,46-A соответственно, А d (TlCl) Иона fTlCU1-2,54 A. 32) при длительном совместном нагреве GaP и Ga2Oj (в герметичных трубках) образуются оксогалиды галлия-Огара. Это бесцветные кристаллические вещества. Производные F, CI, Br стабильны в воздухе, и при выделении йода йодид постепенно разлагается (4GaOI +Оа= 2gajoj + 2ij по схеме).
Oxafluorides отличаются своей устойчивостью к высокой температуре концентрированной HjSOv 33) подобные оксогалиды Индия, как правило, рестимулируются в соответствии со схемой 301pg InjO, — f 1pG8 и быстро выполняются в атмосфере азота 320 (I), 360 (Br), 430 (C1) или 480 «C (F).Практически не растворяется в воде, постепенно подвергается гидролизу, а легкость течения соответствует ряду I> Br > CI> F. окрашен только OInl(желто-зеленый), но OTIBr и OT1C1 имеют коричневый цвет.
Его пиролиз (выше 250°С) протекает в соответствии с реакцией 30T1F = Tijo J + TIF + F, то есть при выделении свободного фтора. 34) GA ’ *и его аналоги сульфат бесцветны и легко растворимы в воде. Сульфат галлия(например, сульфат А1) обычно содержится в кристаллогидратах Gaj (SO » h-18HjO. Его растворимость разделяют в виде 170 г и 100 г HjO(20°C).При добавлении щелочи в раствор образование осадка начинается уже при рН 3.Соль превышает GajO $ 700 С.
Из нейтрального раствора сульфат Индия отделяется UN «0, а избыток H * SO < — отделяется в виде комплексной кислоты HlIn (SO») J » 31 / jHjO. (Tl (SO») j]•4НаО-форма nthallium. In случай ко-диссоциации основан на схеме (S04^ ^ InSO, — f SO4 и InS04 Ji в» + SO», значение 8-10 ″ 1 n 2-10- *. 35) при большом количестве сульфатов одновалентных металлов GaJ +и его аналогов сульфаты легко образуют комплексные соединения, преимущественно следующих типов: 3 Б Б Некрасова M3 (S04) j «12HjO и я (SO» h * 4Ha0.In случай Ga, первый (квасцы типа) гораздо больше characteristic.
In, количество воды в кристаллической воде сильно зависит от свойств одновалентных металлов (м) и соединений таллия, таких как алюминиевые квасцы, все эти соединения в разбавленных растворах сильно диссоциируют на отдельные не образующие соли. 36) светло-желтый Ga(NCS) s-3HiO синтезировали с Ba(NCS) i методом замещающего разложения Gaf (SOa). ln (NCS) s и In (CN) известны в indwa. Оба масла бесцветны и легко растворимы в воде и разлагаются ею.
Были также получены некоторые сложные роденды галлия и Индия. Константы диссоциации для ионов GaNCS «и InNCS» равны I * 10 ″ *и 5 * 10〜*.Четыре 37) бесцветные нитраты Ga * In *и Tl * 4 из раствора отделяются в виде кристаллогидратов и легко растворяются на воздухе. Растворимость Ga (NOj) s•9HjO составляет 100н, 295 あ, при 0 (20 С) на т. Основной нитрат галлия хорошо растворим, и когда щелочь Ga (NOs)»достаточно добавляется к раствору, GA (OH) j выпадает в осадок directly.
It интересно, потому что его можно сублимировать без разложения. Для галлия и таллия, общий тип 0 (DMCO) диметилсульфоксид Sandum (x§ 2 add.71), содержащий кристаллический нитрат комплексов.) (Нет, нет) с [т. к. пл. 202 (Ga) или П0°С (TI)). Установлено, что молекулы (CHj) iSO регулируются в молекуле с помощью кислорода atoms.
In нитрат щелочного металла, нитрат таллия образует комплексы типа MJTl (NOj) ’ J. аналогичные соединения, в том числе NH NO NOj, в (NO> h. 38) перхлорат галлия образуется при кипячении металла 72% — ной хлорной кислотой. Кристаллы Ga отделяются от охлаждающего раствора в виде гидратов (Cl04h-6Hi0).Эта соль очень растворима только в воде, Ио и alcohol.
In известен случай галлия и таллия, перхлоратного комплекса с диметилсульфоксидом (он взрывается при нагревании).Фосфат галлия (ГАПО») плавится только при 1670°С, а по свойствам близок к фосфату алюминия (§ 2 add.66).И галлий, и индий известны как ацетон ацетонат E (C * H; 0*). Ga) или 186°C (In).3-1p (C * H») получают с циклопентадонидом золотого цвета Индия 3.
39) Ga *и среди производных серы его аналогов GajSs представляет собой кристаллическое вещество желтого цвета, которое медленно разлагается уже охлажденной водой. При нагревании до температуры выше 950°c реакция протекает по схеме 2GaiSs * * Ga» S » + S. Кристаллическая структура титсульфида тетрагаллия-Ga Te, сульфид галлия (mp. Подобный 790 ° С) интересен тем, что последний обладает полупроводниковыми свойствами.
Теплота образования этих соединений составляет(ккал / моль): 137(S), 105(Se) и 65 (Te). Соединения типа 3GaT (G-CI, Br, 1), известные по сере и ее аналогам, гидролизуются во влажном воздухе. Они бесцветны, за исключением желтого теллура derivatives. It полученный N бесцветный Сгаф, аналогичный Огаф, характеризуется устойчивостью к высокотемпературным концентрированным Н * со.
40) В отличие от сульфида галлия, InaS (температура плавления 1050°C) разлагается не только в воде, но и в разбавленной кислоте. Поэтому ГФС можно получить, пропуская его через слабокислый раствор Ин salts. In исходное состояние, IniSa осаждается в виде желтого осадка, который легко растворяется в HNO.Последняя форма также получается в результате разделения Индия и серы, когда heated.
In сульфиды щелочных металлов, In2S » образуют млнитиоаты светло-желтого (LI, Na) или розового (K) цвета. Бесцветный кристаллический гидрат NalnSi-HjO был isolated. As с сульфидом Индия, InjSe » (mp.890)и 1n » те «(Мп.667°С) обладает полупроводниковыми свойствами. Теплота образования этих веществ составляет (ккал) моль: 102 (S), 82 (Se) и 47(Te).Смешанные соединения типа E1nG(где E-S、 Se, Te и G-CI, Br, I)известны во всех сочетаниях. Sinf и Selnp также были приобретены.
41) черный-Tl * Sj (Мп.260°C) ’ доступен только на сухих дорожках. Взаимодействие H2S с солями трибаллитового таллия приводит к восстановлению последнего по схеме ETT.«+3H2S = TljS + 2S + + 6Н невидимый инфракрасный. Его источником является нагретый предмет. 42) желтый трехвалентный нитрид галлия (GaN) получают взаимодействием аммиака с GaiO при 900°С и взаимодействием 1 * C1, InN черного и NHj 600.
Тепло, получаемое от элементов, составляет 25 (га) и 5 (В) ккал / моль. Оба нитрида обладают высокой твердостью и высокой устойчивостью к кислотам, но они разлагаются термической щелочью. При нагревании на воздухе ИАХ медленно переходит в соответствующий кислород. Свойства полупроводников характерны только для GaN, но InN очень хорошо проводит ток.
Также известен сероватый двойной нитрид Луган3, который менее стабилен, чем аналогичный алюминий производства. 43) рассматриваемый элемент фосфидно-оранжевого зазора (Мп.1500) и черный 1pR (mp.1062°с) получают прямым синтезом из elements. At при температуре плавления они уже сильно диссоциированы. Фосфид Индия (21 ккал / моль тепла) легко гидролизуется в кислой среде (пассивный концентрированный HNO).Оба вещества являются хорошими полупроводниками с запрещенной зоной 2,4(GaP) или 1,3 эВ (InP).Известен смешанный фосфидный состав L1 » GaP2.Для таллия перечислены TIPj и TP3.
44) на основе фосфида галлия был разработан миниатюрный (длина I, пластмассовый цилиндр диаметром 0,75 мкм) полупроводниковый красный свет. При включении тока ОИ «загорается „менее чем за 10〜С. Такая“ скорость роста » может использоваться в различных высокоскоростных установках. 45) подобно фосфиду, арсенид галлия и Индия и сурьма могут быть получены синтезом непосредственно из элементов. Все они стабильны в нормальных условиях и являются полупроводниками. Сравните некоторые из их свойств со следующими Теплота компколя, температура плавления ккал / моль. 9С*.
Запретная зона шукрукна, 9 век. I GaAs GsSb 1pa InSb 5 7 4 1245 712 5X22S 1.45 0.77 0.18 ОМ При образовании этих соединений происходит определенный сдвиг электронной плотности от Ga и t in к As и Sb. It можно объяснить величиной эффективной ставки (дополнение III§ 6.4).По приблизительным оценкам, 6 «±0,36 (GaAs), 0,16(GaSb), 0,54 ^ InAs), 0,36 (InSb). Проводимость Инсб сильно меняется под воздействием инфракрасного излучения, поэтому она часто служит основой для приборов, которые»видят»нагретые в темноте предметы.
Под давлением 3 миллионов атомов йода Индий изменяет свою кристаллическую структуру и, соответственно, его проводимость увеличивается в 100 миллионов раз. Двойной состав мышьяка Li $ известен в GaAs2. 4c) арсенид галлия действовал в качестве рабочего вещества первого лазера, состоящего из полупроводников (§ 2 add.30). ОИ работает при температуре жидкого азота и излучает излучение х = 8430 а, то есть инфракрасную область. Но при такой высокой мощности излучения глаз воспринимает его как очень красное свечение.
Для GaAs-лазера уже можно получить коэффициент полезного действия по току более 80% (тогда как для рубинового лазера он обычно превышает 0,1%). 47)в соответствии с GaClj + 4LiH-3LiCl, если GaCU взаимодействует с избыточной суспензией LiH в эфирной среде / + лигам галлия лития является formed. It можно отделить перегонкой эфира в вакууме. ОИ бесцветный З0 Кристаллическое вещество, которое медленно разлагается даже при комнатной температуре.
Его восстановительная активность не так выражена, как восстановительная активность LiAlH <и LiBH. При нагревании Лигаха до 100°С он разлагается по схеме ZNA: 3LiGaH4 = Li3GaH $ + 2Ga-f. 2Li3GaH » = 6LiH + 2Ga +ЗН2 дальнейшее разложение по схеме происходит при 240 ° с. За счет обменного разложения соответствующих солей с Лигах4 (в органических растворителях) были получены MGaH4 других щелочных металлов и несколько комплексных катионов, устойчивых при нормальной температуре.
Когда LiGaH4 взаимодействует с AgCl04 в эфирной среде, приблизительно −100 ° С осаждает оранжевый AgGaH4 (который распадается на элементы, которые уже превышают −75°С). 48) Эфнрат моногаллам а (GaH3) получали в качестве 2-го продукта реакции по схеме GaCl3 + 3L » A1H4 = 3LiCl|. — f Ga (A1H4) 3: галлий, образующийся в виде la и t, неустойчив, и (A1H3) X быстро выделяется из раствора уже при 0°C.
Испарение фильтрата под вакуумом дает стабильные кристаллы (Cjh35) до 35 ° С (jOGaH3).Соответствующее производное алюминия (§ 2 add.84) — аналогичные трн-метиламин-(CH3) 3ngah3 и (CHj) 3N’ljgah3-содержащие трифталевые соединения также были obtained. By первое рентгеноструктурное исследование этих соединений) » −1.97 а].Ближайшим аналогом является (CH3) 3PGaH3(mp 71°C), который имеет ту же структуру, что и соответствующие производные бора и алюминия(интересно, что они отличаются стабильностью в ряду B> Ga >> A1).
Взаимодействие GaH3 и HN3, по-видимому, дает азид галлия-Ga (Nj) 3. -GaHCU, более стабильный в качестве аддукта (CH3)$ NGaHCIj (mp 70°C) последний является представителем многих бесцветных кристаллических соединений общей формулы (CH3) 3NGaH3-nX.Где X-CI, Br. I, l от 0-s-3. 49) гидрид галлия-димерия Ga * H, подобный диборану, был обнаружен в 1942 году в виде бесцветной жидкости (mp 21, mp 139°C), разложение которой начинает превышать 130°C до элемента.
Однако, когда эти данные были проверены (1963), они подтвердились. Поэтому соединения, которые существовали в научной литературе (очень интересной с точки зрения теории), были » закрыты.- Похоже, это не подтверждается. Наличие полигалана-х(GaH3). 50) литий литий образуется при −25°с реакцией, аналогичной образованию галаята в эфирной среде, и может быть выделен в виде Эфира в составе LiInH4 * 3(CiH$) АО. За счет взаимодействия эфира с lnClj образуется полимер (1pH3) x(после фильтрации LiCl он постепенно выделяется из раствора).
Indogndrnd представляет собой белое твердое вещество, нерастворимое в воде и органических растворителях. При хранении на воздухе, под воздействием горячей воды, он медленно и быстро разлагается кислотами. Борят и алаят Индия также получены, и оба очень неустойчивы(они разлагаются, когда они превышают −40 ° C, соответственно). 51) тариумат лития образуется при −15 ° С, подобно иодиду лития. Белый, сильно гигроскопичный LiTIH4 выпущен без влияния.
Взаимодействие с T1C13 в эфирной среде дает белый легко разлагающийся (T1H3) W. трехвалентный таллий-галлиевая кислота стабильна только ниже −90°C, а аранаты и летучие вещества известны только в виде смешанных солей с еще меньшей стабильностью типа T1C1 (EN4). 52) формально известные 2-валентные соединения галлия, включая C1, Br, I, S, Se и Te. Однако исследования gaclj и газовых кристаллов показали, что все эти соединения имеют димеры и отличаются по своей внутренней структуре.
Хлорид GasCU представляет собой соль с катионом Ga * и тетраэдрическим анионом (GaCl4).{Где rf (GaCl)= 2,19 A]и ga3s2 сульфиды содержат анионы с Ga катионными * * [расстояние rf (GaGa)= 2,53 A) и S* -. таким образом, галлий фактически является двухвалентным желтым GasS2 (mp 970°С) и его аналогом является элемент(ккал! Тепло, выделяемое из моля) известны: 93 (Ga2Sa), 70 (GaaSe2) и 57 (GaaTej). 53) согласно схеме, GaaCl4, образованный при 150°C, в частности: 2HGaClj = H, f + Ga, CI4 изучены гораздо лучше, чем другие рассматриваемые производные.
Его бесцветные кристаллы плавятся при температуре 17 ° C, и полученная жидкость легко переохлаждается. Она дается и хорошо проводит ток. При температуре более 200°C становится заметным разложение Gaicia (GaCls и Ga).Измеряя молекулярную массу бензола, мы обнаружили, что раствор содержит молекулы GatCU с очень большими дипольными моментами (q = 8,9). он был отделен, и GajCU-QH был сольватирован.
GaaCl4 энергетически реагирует с водой для выделения водорода. Это связано с тем, что аналогичная реакция происходит, когда раствор ГК в небольшом количестве концентрированного HO разбавляется water. It весьма вероятно, что в этом растворе содержится Гасци. Из его аналогов бесцветный Ga3Br4 известен в двух формах, характеризующихся температурой плавления 153 и 165°C, и в 2 формах желтый Гату плавится при 211°C (расплавы темно-красные).
При дальнейшем нагревании он разлагается на галлы и Gal. In соли типа (N (CH3) 4l (Gajre) (Γ-CI, Bg, I), анионы, очевидно, имеют этанол-подобную структуру с прямыми связями Ga-Ga. 54) наиболее важным репрезентативным примером одновалентного производного галлия является черно-коричневый оксид GaiO. It образуется при нагревании Гайо *с металлическим галлием.
Его очистка может быть выполнена непосредственно вакуумной перегонкой при температуре 500°C. В Гаао молекула имеет параметр РФ (Гао)=> 1.84 A и^ GaOGa— » МО *.Теплота, с которой этот оксид выделяется из элемента, составляет 82 ккал / моль. При взаимодействии с серной кислотой HjSO * частично восстанавливается до H2S. серый сульфид серы, также известный как GaaS. It медленно разложена водой и разбавленной кислотой, которая уже в cold. At около 1000°C он диспропорционирует как GaiSi, так и Ga. 55)
В дополнение к вышеуказанным производным галогена, сольват Ga [AlCl <1 (mp 175 * C) и монохлорид галлия и 2 доноксисодержащие молекулы является described. In отдельные состояния, GaCl, по-видимому, получают при 820°C (под давлением 10 мм рт. ст.) взаимодействием Ga с хлористым водородом. 56) двухвалентный хлорид Индия может быть получен нагреванием Индия до 970°с в потоке хлористого водорода (при давлении| 0 мм рт. ст.): дистиллированная желтая жидкость дает бесцветные кристаллы при охлаждении(Мп.235, Мп.485 °с).
Плотность пара в диапазоне 500-700°С соответствует уравнению InClj, но в жидком и твердом состоянии вещество имеет двойную формулу с InllnCU structure. In вода, внутренняя и внутренняя часть разлагаются. Далее процесс переходит в 2 стадии: 21пС1 * = «1пс1» + incl, затем 31пс1 ″ = inclj + 2!n. в случае InClt, под действием 1 pVg холодной воды, 2-й продолжается сразу после 1-го (mp.240. mp. 638°C). на первой стадии разложение задерживается, а затем протекает относительно медленно.1p12 с нестабильным InFi (mp.225°C) было также объяснено.
Для красного сульфида (mp 692), Селена (660 ° С) и двухвалентного теллурида Индия известна теплота образования (ккал / моль) из элементов:34 (InS), 28(InSe)и 23(InTe).Последние 2 соединения обладают полупроводниковыми свойствами. 57) одновалентный хлорид Индия получают путем пропускания пара InCli через нагретый внутри. Известны 2 кристаллические формы: желтая, стабильная при комнатной температуре, и красная. Стабильная при 120°C или более около 1100 * C, плотность пара эквивалентна уравнению InCI [rf (lnCl)= 2.40 AJ.
Однако с дальнейшим повышением температуры плотность пара увеличивается. InCI разбивается на InCls и In. Некоторые характеристики различных хлоридов Индия сравниваются ниже. InClj InCI * InCI Теплота образования, ккал / моль 1 ″ 96 48 Температура Плавления,°C. 。 5v6 235 225 Чульт ф т ^ ну…….. 1 melt….Fighters. To желтые дьяволы. Загар, желтый, темно-красный Кпенная температура. ФС. 。 。 。 496 486 609 Оранжевый красный InBr (mp.285. mp.
Кипеть.656°С) и тепло, выделяемое от элементов коричнево-красного цвета в! (mp365. bp 712®С) составляет 42 и 28 ккал / моль, в парах<(1nG) — 2,54 и 2,86 А. радиус Иона 1n оценивается в 1,32 А. Его интересная производная желтоватая InJAlCIJ(mp.268-0.、 Взаимодействие с эфиром протекает по схеме (CIHA) до + InAlCU — (СЛ) ^ >А1С1, + + + вкл. Реакция по схеме СО, + 2in = i1шо + со850 ° с (при давлении 10 мм рт. ст.) позволяет получить черный оксид lnfo. In его молекулы rf (InO) −2.02 A и^ InOIn » 150е.
Взаимодействие Индия и сероводорода при высоких температурах явно приводит к образованию сажи в»S. полимер (1пн) образуется при слабом нагревании (1пн.) х в вакууме. Термически устойчивы до 340°с, нерастворимы в обычных растворителях, медленно разлагаются в теплой воде по схеме 3InH + 3H, 0 = 3H,+ 1 p (OH)+ 21p. также известно циклопетатиевое производное одновалентного Индия-1pC » H «и»полу-сэндвич«структуры расстояния</(1pC)= 2.62 A(x§2 add.34).
Желтоватые летучие кристаллы стабильны до 110°C 58) результирующая теплота некоторых одновалентных соединений таллия имеет следующее значение(kcal1e-eke): TIJO TIfS TljSa TLJTE TIP T | CI TIBr Til 21 10 9 4 78 49 41 30 Для молекулы TljO значение d (T10)= 2,19 A равно given.In воздух, оксид таллия (температура плавления 300, Мп.493 ° с) постепенно переходит в TlfO и реагирует с водой по формуле: T1aO + NaO-2PON + 4 ккал.
Когда раствор гидрата испаряется, закись азота таллия Oi обычно отделяется в виде кристаллогидратов TYUN•2HaO. Хейлит основной диссоциации Туна составляет 0,33. 59) некоторые характеристики Галогенида t1g сравниваются со следующими: Поцелуй………………… Расстояние A (T1G). ДЖ Энергия кристаллической решетки. kcal1 моль …………….. Температура плавления. С…….. Температура кипения,°С……… Совет TIC1 Тибр Т11 Чертов. Овкг.Хуан Хуан Вата! 2.08 2.48 2.81 2.82 3.44 3.82 3.84
Двести миллиардов сто семьдесят восемь миллионов сто семьдесят четыре тысячи сто шестьдесят восемь 327 431 461 442 Восемьсот двадцать шесть миллиардов восемьсот восемнадцать миллионов восемьсот шестнадцать тысяч восемьсот тридцать пять Содержание димерных молекул в паре ТСГ / температура кипения снижается в ряду F (-60%)> C1 (-15)> Br (незначительно)> I (u).Дипольный момент пары равен 4,44 (T1C1).
Существуют противоречивые данные о 4.49 (T1Br), 4.61(T11) и T1F (7.6 n 4.0).Константы мощности для Saya: 2.27 (T1F), 1.43(T1C1) и 1.25 (T1Vg). / 80) для T1I, в дополнение к желтому, известна стабильная Красная модификация при 168°C и выше. Монокристаллы Галогенида T1G (t CI, Br, I) поглощают большую часть длинноволнового инфракрасного излучения radiation. It применяется в приборах, обнаруживающих тепловое излучение (от людей в ночное время) и ночью signals.
In солнечный свет, хлорид таллия постепенно распадается на металл и галоген, поэтому он становится фиолетовым. Другие одновалентные галогенированные галогены также являются фоточувствительными. $ 1) в отличие от других Галоидных солей Tl, фторид таллия имеет сложную кристаллическую решеточную структуру и очень хорошо растворим в воде. Его концентрированный раствор показывает сильную щелочную реакцию.
Диссоциация цистита t1f составляет около 0,8, T1C1-0,2. Молекулы T1g, как правило, связывают ионы t «очень малы и изменяются в серии F» C1 <Br <1.Ионы T1 * вряд ли образуют комплексы С CN ioi или аммиаком. Кой участок диссоциации t1f при жирном HF (или 0°С) равен 1,0, то есть близок к водной среде ethin. 62) радиус ioia Tl * равен 1,49 А. некоторая приблизительная растворимость его солей в нормальных условиях (грамм соли ia H20 100 г) сравнивается со следующей: п RPG с героями No3 в ЅО3 ′ найти ’SJ3 poJ» SJ3 с/ НПШ ’1унц Бр’» 400 15 12 9 5 5 4 0.5 0L 0.3 0.3 0L6 0.04 O. OOv
При нагревании растворимость многих солей таллия возрастает очень сильно. 63) низкая растворимость T1I используется в аналитической химии, чтобы найти, что T1 \thallium thiocyanate (mp 234°С) диссоциирует столько же, сколько его галогенид (до 0,14).Желтое олово *(Мп.334°с) растворимость в роданиде и взрывчатых веществах зубного налета.
Нитрат и перхлорат плавятся при 206 и 501°с соответственно, практически нерастворимые в воде(пр = 7-10-1С)черные тла (Мп.448, Мп.1367°с) получают действием сульфида аммония и раствора. Соль гремучий и телевизора, он постепенно окисляется. TljSe(Мп.398°C) и T1 ″ Te также известны. Карбонат таллия (температура плавления 273°С) используется в стекольной промышленности для производства стекла, которое сильно преломляет свет.
Его пиролиза начинается с вакууме при 230 ° С и при со * давление 300 мм рт. Искусство. — Сульфат таллия 348°c прямой (Мп.645°C) широко используется для уничтожения грызунов и муравьев. Ацетилацетонат Талли (mp 161°С) растворим в бензоле и гидролизуется в воде. TCA1SC]также известен(Мп.308°с).
64) некоторые комплексные соли очень характерны для таллия, где oi входит одновременно в качестве как одновалентных, так и трехвалентных элементов. Это TCT1G4]. TYT1G») (T-CI или Br), фрукты TUTI <N (fc) t) и т. д. 65) в результате взаимодействия T1NO и KNHa в жидком аммиаке образуется одновалентный таллий (T ^ N) в виде черного осадка.
Это вещество очень неустойчиво и легко разрушается при взрыве под воздействием различных внешних воздействий (например, при контакте с жидкой водой).Энергия активации его разложения составляет около 40 ккал / моль. При контакте с водяным паром TljN гидролизуется в TUN и NH. 66) (TLD) разложение х приводит к образованию одновалентного таллиевого полимера hydrides.
It представляет собой коричневый порошок, термически устойчивый в отсутствие воды (разлагается на элементы в вакууме выше 270°С) и нерастворимый в обычных органических растворителях. Вода (T1H) X медленно гидролизуется по схеме T1H + HjO = Hj-f TUN. Заметим, что эти и приведенные выше литературные данные по высоте и Индию гидрида (EN) F и (EN) X сомнительны.
Также были приобретены T1bh»(стабильный до 40 * C) и T1A1H » (уже разобранный при −80°C).Таллий-циклопентадиенил(Т! C » H$) имеет ту же структуру, что и аналогичные соединения Индия(дополнительные 57).Интересно, что его образование при взаимодействии газа С»он и раствора Туна в нормальных условиях протекает количественно (как реакция нейтрального Засина).
67) сравните энергии диссоциации элементов подгрупп бора, алюминия и галлия (kcal1 моль)% газообразных двухатомных молекул EG B A1 Ga In T (F 18!158140123104 с!118 117 114 104 88 Vg 100104100 92 78 I 87 80 77 67 Как видно из представленных данных, эти энергии уменьшаются в сериях B-T1 и F-I. То есть, ядерное расстояние E — G увеличивается. Для 3Ф фтора, ядерного расстояние пары (а): 1.65 (ИИ) 1.77 (га); 1.99 (в); 2.08 (Тл).
Смотрите также:
| Алюминий | Подгруппа скандия |
| Физико-химический анализ | Семейство лантанидов |
