Оглавление:












Электролитическая диссоциация
- Электролитическая диссоциация. Вещества, проводящие ток в водных растворах-соли, основания, кислоты-в совокупности называются электролитами, непроводящими токами и т. д. non-electrolytes. In в связи с этим гипотеза ионизации после всех экспериментальных подтверждений получила название теории электролитической диссоциации.
- Природа ионов, образующихся при диссоциации различных электролитов, естественно должна быть different. In соленость, диссоциация всегда приводит к образованию катионов металлов и анионов кислотных остатков. Пример: KNO, » = K ’+ NOJ NajSO * » 2Nae + SO? MgCl2 Mg «+2СГMgS04» MG » + так?
Поэтому соль можно определить как соединение, которое обращает ионы металлов и кислотные остатки в водном растворе. Людмила Фирмаль
В основной молекуле 2 связей кислорода металлом и водородом, бывшие ионизируют много easier. So, при диссоциации образуется катион металла(он может быть разным) и на всех основаниях образуется общий гидроксильный анион (OH’).Таким образом, основание можно определить как соединение, которое дает гидроксильные ионы в водном растворе.
Пример: Nаон = Nа ’+ о ’Ба(о) г-Ба — Ф 20ч ’ Количество ионизируемых гидроксильных групп определяет кислотность основания (II§ 5). Наконец, диссоциация кислот происходит с образованием катионов водорода и анионов кислотных остатков. Эти остатки могут быть разными, но общей особенностью всех кислот является образование ионов водорода в водной среде. solutions. So, кислота-это соединение, которое дает ионы водорода в водных растворах.
Пример: HN03 = H ’ + N05 H2SO4 = 2H * 4-SOJ Количество ионизируемых атомов водорода определяет основные свойства кислоты. Как уже упоминалось (§ 4), природа электролитической диссоциации некоторых молекул в значительной степени определяется полярностью их валентных связей. Но полярность связей между элементами не является их инвариантной характеристикой, но они также несколько сильно зависят от других элементов, связанных друг с другом.
Например, полярность связей кислорода и водорода в соединениях типа ROH сильно зависит от химии атома или радикала R. In в этом случае полярности нет. И наоборот, если атом или радикал R имеет ярко выраженную полуметаллическую природу, то связь между ними и кислородом Неполярна, а связь O-H резко полярна. Грубо говоря, природа обеих связей определяется относительной легкостью кислорода, который притягивает электроны из R и N.
Из вышеизложенного видно, что диссоциация соединений типа ROH может происходить в 2 направлениях. Я ВТОРОЙ •> RjOjH: » Преобладание любого из них зависит от относительной легкости ионизации в связях R-O и O — H. Например, поскольку Na является гораздо более металлическим, чем водород, диссоциация NaOH фактически происходит только в соответствии с типом (I) base.
In азотная кислота (H0N02), напротив, радикалы NO2 являются гораздо более металлоидными, чем водород, и их диссоциация фактически происходит только в кислоте типа (II). Что делать, если химия R не сильно отличается от водорода? В этом случае ясно, что полярность обеих связей близка друг к другу.
Поэтому здесь мы должны рассмотреть возможность диссоциации в обоих направлениях. Аналогичное соединение, которое позволяет молекулам резать ионы воды в тех же условиях、 Род и гидроксильные ионы, называются амфотерными.1. преобладание той или иной природы диссоциации амфотерных соединений зависит от относительной ионогенности обеих рассматриваемых связей.
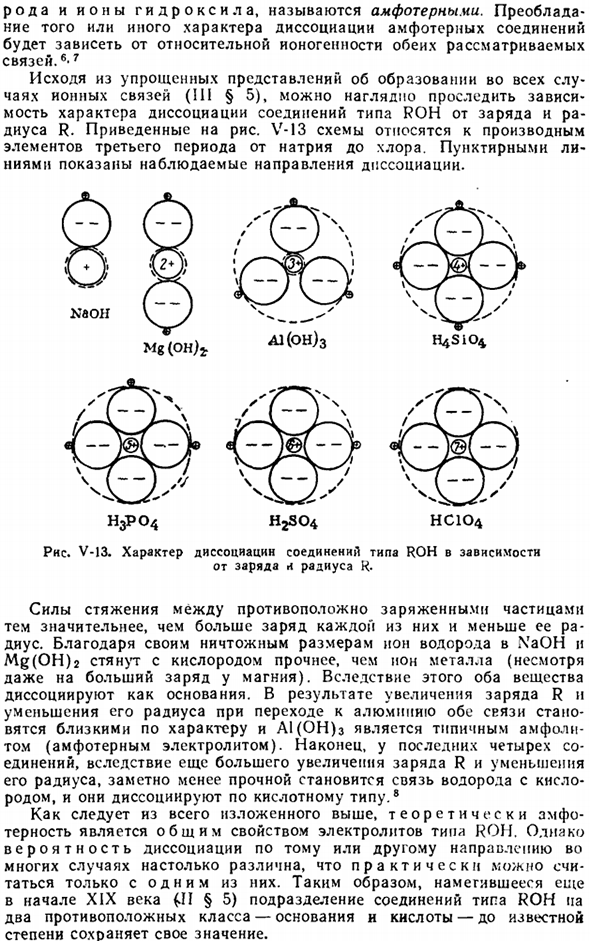
Основываясь на упрощенной идее (III§ 5) Об образовании ионных связей во всех случаях, мы можем четко проследить зависимость природы диссоциации соединений типа ROH от заряда и радиуса R. цепь V-13 связана с производными элементов 3-го периода, от натрия до хлора. Ломаная линия указывает направление наблюдаемой диссоциации. Као. Мг (0 н) г А1(он) 3 H4S iO ^ H3PO4HjSO *НСЮ4 Рисунок V-13.
Характер диссоциации соединений типа ROH зависит от заряда l радиуса K. Напряжение между противоположно заряженными частицами возрастает, заряд каждой частицы увеличивается, а радиус уменьшается. Благодаря своим ничтожным размерам, ионы водорода из раствора NaOH и MG (он) 2 объединить более решительно с кислородом, чем с ионами металлов(несмотря на еще больший заряд магния).
В результате, оба вещества диссоциируют в качестве базы. В результате увеличения заряда R и уменьшения радиуса при переходе к алюминию, как облигации становятся близкими по характеру, и А1 (он) 3 является типичным amphodiathite (амфотерный электролит).Наконец, в последних 4 соединениях, вследствие еще большего увеличения заряда R и уменьшения его радиуса, связи водорода и кислорода значительно ослабляются, диссоциируя в кислой форме8.
Из всего вышесказанного, в теории, змпф является общим свойством электролита типа ROH. Однако во многих случаях вероятность диссоциации в 1 направлении или в другом направлении очень различна, поэтому в действительности она может быть рассчитана только в 1 направлении.
Таким образом, разделение соединений типа ROH, намеченное в начале XIX века(JI§ 5) на 2 противоположных класса(основания и кислоты), в некоторой степени сохраняет свое значение. Простейшие амфотерные соединения-это вода, и когда они диссоциируют, они производят ионы H и OH. Однако эта диссоциация настолько мала, что концентрация как водорода, так и гидроксильных ионов в чистой воде составляет всего 10-7 г-Ион / л. девять
Опыт показывает, что содержание ионов в воде не изменяется со временем. При ионизации также происходит обратный процесс-образование молекул, не Диссоциированных от ионов (молярная концентрация).Аналогичная обратная реакция должна происходить и в растворе электролита. Когда ионы сталкиваются во время нерегулярного движения, они могут образовывать ионы из молекул.
Таким образом, электролитическая диссоциация является обратимой process. At каждый момент времени ионы образуются в результате ионизации молекул и столкновений ионов-молекул. Очевидно, что в результате равновесие является established. In единицы времени, как он разлагается, образуется много молекул. Например, для NaCl это может быть представлено следующей схемой: Ионизация Нацл на ’+ Си ’ Поляризация NaCl-подобные ионные молекулы в теории растворов часто называют парами ионов.
Количественная характеристика равновесного состояния электролита определяется степенью его диссоциации, то есть отношением числа молекул, разлагающихся на ионы, к общему числу растворенных молекул. Это соотношение часто умножают на «100», представляя таким образом диссоциированную часть в процентах от общего числа молекул.
Численное значение степени диссоциации можно найти с помощью закона разбавления растворов. Образцы. Найдя точку замерзания, можно найти степень диссоциации NaCl в растворе, содержащем 1000 г (1 грамм (58,5 г) этой молекулы соли на грамм воды. Для такого решения ожидается снижение на 1,86 градуса. С другой стороны, на самом деле это будет 3,36 градуса(§ 4).
При определении степени диссоциации, важно знать абсолютное число диссоциации молекул и растворенных молекул, но важно знать только соотношение между ними, поэтому рассуждения значительно упрощаются. Предположим, что 100 молекул NaCl растворяются, что приводит к снижению на 1,86 градуса в отсутствие dissociation. In на самом деле, последний оказался больше, по сравнению с 3.36: 1.86 = 1.80.
As в результате обнаруженное уменьшение составило не 100, а 180 растворенных частиц, то есть из 100 взятых молекул такие фракции разлагались на ионы, образуя в сумме 180 частиц. Это тот случай, когда на каждые 100 растворенных молекул распадается 80, 80 ионов. Это потому, что есть 20 не связанных молекул+ 80 не-Na * + 80 SG ионов и в общей сложности 180 particles. So, степень диссоциации NaCl с этим раствором составляет 0,80.То есть, 80% всех растворенных молекул диссоциируют.
Изменение концентрации раствора по-разному влияет на процесс ионизации и линьки. Поскольку на первую из них воздействуют только частицы воды, непосредственно окружающие молекулы электролита (их много в сильных растворах), разбавление существенно не влияет на скорость ионизации. Наоборот, в этом случае скорость морализации снижается. Это связано с зависимостью от числа столкновений между различными ионами, которое становится меньше, когда раствор diluted.
As в результате степень диссоциации электролита при равновесном сдвиге и разбавлении увеличивается Решение будет увеличиваться. Поэтому, говоря о степени диссоциации электролитов, необходимо одновременно указывать концентрацию раствора. При использовании раствора электролита удобно использовать так называемую стандартную концентрацию. Обычно (в) представляет собой раствор, содержащий 1 грамм растворимого вещества, эквивалентного 1 liter.
In общий случай, эквивалентный грамму, или, как его обычно называют, нормальному весу, определяется делением граммовой молекулярной массы электролита на число валентных связей между ионами, образующими его молекулы. Например, нормальные веса HN03, Ba (OH) 2, A12 (S04) 3 равны M, M / 2 и Af / b соответственно.
Основное преимущество этого способа выражения концентрации электролитов перед другими методами заключается в том, что, например, если стандартная степень раствора одинакова, то щелочь будет реагировать с кислотами равного объема. Что касается обозначения концентраций, то обычный раствор включает в себя все, что было сказано ранее о молярном растворе(§ 2).Одиннадцать
Вообще говоря, различные электролиты диссоциируют в разной степени, даже если нормальная концентрация раствора одинакова. Самая простая ситуация — это случай соли, где связь между металлом и кислотным остатком обычно проявляет ионные свойства. Однако здесь, в некоторых случаях, условия для диссоциации могут быть разными.
Например, молекула NaCI состоит из одновалентных ионов, в то время как молекула Mgso 4 состоит из двухвалентных ионов. Очевидно, что во 2-м случае напряжение между ионами должно быть больше. Следующий за ним степень диссоциации соли при прочих равных условиях, построенной на основе++ — +± Тип MA меньше, чем аналог типа MA.
Соль типа MA2 Четыре— А M2A (например, MgCl2 или Na2SO<) занимает промежуточное положение. Приведенная ниже таблица представляет собой экспериментальное прямое определение степени диссоциации различных типов солей, а также некоторых кислот и оснований. Некоторые представители отделяются очень по-разному, но во всех случаях вода также намного сильнее, чем стол.
Степень диссоциации (А) равна 0,1.Решение Электролитов к электролитам ч. Соль + — Кислота Тип Ма…. 0.80-0.90 80-90 0.014 ЧССУХ. 。 。 1.4 > МА2…. J 0.70-0.80 70-80Н2СО,….. 0.0017 0.17 «М. А.» 。 。 。 0.0001 0.01 +±Н2О…… 2-й «9 2-10» 7 > МАМА. 。 。 。 0.35-0.45 35-45 База кислота ХМ, НС! … 0.90-0.95 90-95 кон. НАО. 。 0.90-0.95 90-95 H, S04…… 0.60 60 ВА (О…. 0.77: 77 ВЧ……. 0.09 9. — О, — СКАЗАЛ ОН…. 0.014 1.4
В этих условиях более 30% диссоциированного электролита обычно называют сильным и диссоциирует внутри 30-3% — используют электролит средней прочности, а еще сложнее диссоциировать-используют electrolyte. As как видно из приведенных в таблице данных, соль (хотя есть и некоторые исключения, она отмечена в соответствующем месте книги) является сильным электролитом. 2-16 сентября.
Электролиты, содержащие поливалентные ионы, характеризуются ступенчатой диссоциацией, которая наиболее отчетливо наблюдается с многоосновной кислотой. Например, первая стадия ионизации фосфатов протекает по схеме. n3ro <Н#+ n2ro; Из-за отрицательного заряда Иона HgRO,<2-й ион водорода отделить намного сложнее, чем первый, поэтому 2-я стадия ионизации Н2РО4Н+НРО? Это происходит в гораздо меньшей степени.
Должно быть, последний ион водорода уже вышел. От двойных заряженных отрицательных ионов. Следовательно, третья стадия ионизации НРА? = «=H ’+ POJ» Он практически полностью отсутствует в растворе фосфорной кислоты. Электролитическая диссоциация является обратимым процессом, ведущим к равновесию.
Например, для уксусной кислоты CH3COOH CH3COO’ — fH#при применении закона действия массы к этому равновесию、 [SNzSOO ’](Н] _ [ЗП. Соон] В этом случае константа равновесия K называется константой диссоциации, поскольку она характеризует электролитическую диссоциацию CH3COOH. Чем выше значение, тем больше ионизация рассматриваемого соединения. *
Константа диссоциации не изменяется с изменением концентрации раствора, что дает более общую характеристику электролита, чем степень диссоциации. Однако это относится только к слабым электролитам, которые содержат относительно мало ионов в растворе.
Наличие электростатических взаимодействий между ионами, напротив, начинает существенно влиять на сильный электролит, в результате чего он отклоняется от закона массового действия, а к изменяется при растворении diluted. So, в приведенной таблице константа диссоциации (нормальная температура) дана только для некоторых слабых электролитов. Константа диссоциации
Электролитов к электролитам к Н, ПО «/ с,…….. к * …….. Кг…….. Н: Сөз К {…….. Ки.. …… N, 02 Кг…….. 7 * 10〜* е 6-кг * 4-У-’3 4•10 »» ’5-10- «2-1 <«СН, Соне……..Беззвучный………. Н20……….. ПЛ » он……… 2-10 «$ 6-10〜| 2- на ИГ, 2-10 » 5 Из сравнения значений констант, соответствующих ионизации 1-го, 2-го и 3-го водорода фосфорной кислоты(Ki, Ki, Kz), видно, насколько сильно увеличение заряда Диссоциированных частиц влияет на поэтапную диссоциацию. 7-30.
Благодаря тому, что константа диссоциации слабых электролитов при заданной температуре постоянна, можно искусственно изменять концентрацию отдельных ионов в растворе. solution. It часто используется для снижения концентрации ионов водорода или гидроксила, то есть кислотности или щелочности. Например, вы хотите понизить кислотность уксусного раствора.
Для нее с фронта: [Snzsoo’N*) [Snzsoo’N] — а Увеличение концентрации CH3COO снижает концентрацию ионов водорода за счет инвариантности к. увеличение концентрации ионов CH3COO может быть достигнуто очень легко. Например, в раствор добавляют соль уксусной кислоты, такую как CH3COONa.
Из-за того, что эта соль сильно диссоциирует, образуется много ионов CH3COO, что значительно снижает кислотность среды. Аналогично, когда соли аммония, такие как NH4Cl, добавляются в раствор NH * OH, концентрация ионов OH, то есть щелочность раствора, снижается. 3 / −32
Применяя закон массового действия к диссоциации самой воды, мы имеем. | H [H» o / 1 = K или [H] [OH ’] = / C [H20] Если/ C — (H20) представляет собой / C, мы получаем[H] [OH’] = / Cp. So, величина Cv является продуктом концентрации ионов водорода в воде и гидроксила, поэтому называется ионным продуктом воды. Поскольку K и [H20]известны, легко найти их значения.
Величина константы диссоциации (K) воды равна 1.8-10-16, причем концентрация его недиссоциативных молекул практически равна общему числу молекул воды в граммах (за счет малейшей степени диссоциации), то есть 1000:18 = 55,56.Таким Образом, Kw-1.8-Si-16-55.56 = Lyu. Ионный продукт воды-это значительное количество.
Это должно позволить водному раствору обнаружить концентрацию OH ’от известной концентрации H *.Например, 0,1 н. концентрация уксусной кислоты, ионов водорода составляет 1,4 ~ \ 0 ~ 3г-Ион / л. следовательно, в этом растворе = = = .10 — ’2 1 [H’ J 1.4-10-3 Чистая вода [H] = [O HI = \ P < — n = \ 0’7 г-Ион / л. тридцать три.
При использовании ионных продуктов воды реакция среды (кислой, нейтральной или щелочной) может быть выражена в концентрации только водорода ions. In нейтральный раствор, [H] (часто указывается в виде Cu) равен 10-7, так как before. It понятно, что в кислых растворах его больше, а в щелочных solutions-less. So, при переходе от нейтральной среды к более кислой Cu она становится равной 10-6, 10-5, 10-4 и т.
И наоборот, если увеличить щелочную среду, то Cs= 10— 8、10-9°、10° На основании водородного показателя (рН), который определяется соотношением, количественное обозначение реакции среды может быть дополнительно упрощено: рН = — IgCH. In в свою очередь, нейтральные среды характеризуются рН = 7, кислотные рН = 6. 5; 4; и др., щелочной рН = 8; 9; 10 и др. (рисунок V-14).
Излишне говорить, что могут быть все промежуточные значения водородного индекса (между целыми числами). На практике реакцию среды удобно определять с помощью indicators. It представляет собой вещество, изменяющее цвет в зависимости от относительной концентрации ионов H *и OH.
Наиболее известным индикатором является лакмусовая бумажка, которая окрашивается в красный цвет с избытком H ’(т. е. кислой среды) и с избытком OH7 (т. е. щелочной среды GN1 Вт-до 3 Вт * WS в * / о’ 7 / О 9 / О -» К ЖЖ. Один — Повышенная кислотность-повышенная щелочность -» ■ I «1■■I■■■i I I * i■I i■i pH g E * 6 S-7 at 9 / O / U. 12 * N РНС. В-14.
Указанная схема реакционной среды. средний) — синий и фиолетовый в нейтральном цвете medium. By погружая фильтровальную бумагу лакмусовой бумажки (лакмусовой бумажки) в тестовую жидкость, о реакции среды можно сразу же судить по ее цвету. Диссоциация электролитов на ионы чаще всего не связана с выраженным выделением или поглощением тепла.
Таким образом, небольшие изменения в температуре, как правило, имеют небольшой эффект. Вода находится в особом положении, так как ее диссоциация протекает со значительным поглощением тепла: ’Н20 + 13.5 ккал ч’ + о ’ Именно поэтому степень диссоциации воды при нагревании значительно возрастает. С этой ситуацией еще предстоит столкнуться, поскольку она очень важна для некоторых реакций в водных растворах.
Сорок один Добавь 1) свободный водород NOI в растворе (т. е. ядро атома водорода представляет собой голый Протон) немедленно связывается с молекулой воды и образует Ион ядра-H * 0.Последний далее гидратируется, давая ионы нуклонов и I-NeOb или H’.Оба эти названия используются относительно редко, но обычно просто означают неводород (Н -).
В общем случае протоны, которые сольватируются растворителем, иногда называют ионами, но не мной. Образование ионов оксония играет важную роль в диссоциации кислот, что является основной причиной того, что Полярная структура молекул кислоты переходит в ионную molecules.
As в результате процесс распада на ионы, например молекулы HC1, может быть выражен в Формуле HjO + HC1■■ » HjO ’+ CI’», в порядке очистки. Однако это необходимо. Потому что в обычном способе письма ионы водорода понимаются как гидратация (H\, а не H).
2) возможность первичной гидратации H4 не равна 1, и было также высказано предположение, что молекулы воды HsOj, HTOj или 2, 3 или 4 с этими гидратными структурами могут быть описаны такими выражениями, как HsO * — nHjO или H *(OHi). в первом случае молекулы воды координируются вблизи водорода и оксогония (рисунок V-15).
Во втором случае молекулы воды координируются вблизи протонов (это, вероятно, так Вилли.) rf (OO)= 2.5 A линейная структура (HjOHOHj) * установлена для H5OJ (внутри кристалла), и энергия генерации от H ^ O и H20 оценивается в 36 ккал / моль. 3) в случае невыполнения-о, первичной гидратации по 3 молекулы воды, образуя ч. Предполагается(диаграмма V-И6). 。
4) с точки зрения классической теории электролитической диссоциации определение кислот и оснований, приведенное в тексте, может быть применено только к водным растворам. Химическая природа таких веществ в среде йода, протонная теория кислот、 Структура без ГБО*.Кон. База (Бренстедовские.1923): кислоты-вещества, удаляющие протоны, основания-вещества, связывающие протоны.
Согласно теории протонов, связь между кислотами и основаниями задается схемой основания+Proton=acid. In система из 2-х веществ, которые могут взаимодействовать с протонами, основа всегда есть it. It связывает больше tightly. In другими словами, он характеризуется большим протонным сродством.
Например, в серии NHj-ю-ВЧ, протонного сродства уменьшается. Так, в смеси с аммиаком, вода действует как кислота, а в смеси с HF-в качестве базы. NHj 4-H, 0 = f = * NHJ + OH «n HjO + HF H, 0 * + F〜 В случае кислот, когда протонная обработка совпадает с обычной обработкой, а с ней распределяется только раствор йода, к получению кислот применяется существенно иной подход. base.
So считается, что N’AOH связан с тем, что этот Ион gndroxnl может связывать протоны (путем образования молекул H20), а не потому, что он может резать гидроксил ions. So, основание вообще не NaOH, то есть не-OH „(rf (HO)= 0.98 A).когда po30-самая сильная кислота, возможная в водной среде, это (аналогично) самое сильное основание non-OH“.
Поскольку сама вода имеет равновесие HjO H — + OH’, изменение концентрации одного из этих 2 ионов должно сопровождаться эквивалентным изменением концентрации другого. Поэтому в водном растворе оба подхода (классический и протонный) фактически дают одни и те же результаты. К теоретическому рассмотрению кислот и оснований применяются специальные монографии.*
5) экспериментальное определение протонного сродства молекул HjO при значении 169 ккал / моль. Для молекулы NHj она составляет 206 ккал / моль, а значения некоторых анионов сравниваются ниже(ккал / моль): Ф „С Г ВГ — Г О“ ш „NHJ ЦН“ нет-судиться » 352 331 311 313 zyaz 313 419 343 320 285 отметим, что все представленные данные были рассчитаны для газообразных систем, то есть они не могут быть применены непосредственно к реакции в растворе. *
Шатенштейн А. И. Теория от кислоты к основанию. М.. Госхнмиздат, 1949.315 секунды、 в) в большинстве случаев, когда полярность возрастает, целостность валентной связи увеличивается, но не всегда. Параллелизм обычно наблюдается в одних и тех же соединениях различных соединений, которые его содержат, и часто нарушается при сопоставлении различных соединений.
Например, связь H-O менее полярна, в то время как связь H — F и H — CI более полярна, а 2-я связь более неполярна. 7) однородность связи H-X (в том числе положительного водорода) зависит в первую очередь от поверхностной плотности отрицательного заряда X. Чем ниже эта плотность, тем больше вероятность того, что молекула HjO приблизится к Протону внешнего электронного слоя X и извлечет его (как HsO). в случае X, наоборот, обратный процесс извлечения Протона из HsO, тем легче, тем выше отрицательный заряд и плотность его поверхности.
8)из рисунка V-13 следует, что химические свойства гидроксида ROH напрямую зависят от валентного состояния R. Если один и тот же элемент(например, Mn) может указывать на низкую (+2).он может давать высокую (+7) положительную валентность, то в первом случае это основной гидроксид (Mn (OH), во втором кислота (HMn04).Упрощенное выражение «металл дает основание, металлоиды-кислоты» (II § 5)-большинство металлов характеризуются низкими положительными валентностями, а большинство из них-высокими, поэтому они верны в основных терминах.
Такой элемент, как марганец, можно назвать амфотерным. Это очень прискорбно. Потому что амфотерность-это не элемент, а свойство гидроксида ROH. In общие свойства элементов, некоторых металлов (Re, W и др.)следует называть полуметаллами, если они в одностороннем порядке ориентируются на характерные для них свойства гидроксидов. Из вышеизложенного следует, что определение (III§ 8), обычно используемое в науке и технике термина»металл»в связи с состоянием вещества, не всегда совпадает с определением того же понятия из-за свойств гидроксидов, свойственных определенным элементам(II§ 5).
с)как и в случае кислот, ионизация воды происходит с первоначального формирования оксония. То есть, если участвуют 2 молекулы: H20 + H20 = H»0 * — F OH’. Легко получить некоторые интересные числа, потому что мы знаем, что Ион грамма содержит 6,02> 10 «Ион (число Авогадро). = 6.02•10 days. So, на 1 кубический миллиметр воды, 6.02-10u/ 10 * 6.02〜содержит 10 ионов водорода. Далее, если мы знаем, что 1 литр содержит 1000: 18 = 55,56 грамма молекул воды.
То есть、55.56-6.02-10″= 335-10«молекулы. 335-10 «/6.02-10» = 556-из соотношения 10e видно, что из 5 миллиардов 6500 молекул воды только 1 находится в состоянии распада на ионы. Поэтому содержание ионов в чистой воде очень (в то же время) незначительно и мало (относительно). 10) если сжатие противоположно заряженных ионов происходит без разрушения сольватной оболочки, то понятие «Нейропара» имеет самостоятельное значение.
Иначе-при наличии прямого контакта несогласного с понятием»Ной молекулы».Есть обзорная статья о парах ионов Очевидно, что расстояние между центрами ионов непар (Непары разделены не менее чем 1 частицей растворителя) должно быть значительно больше суммы радиусов ионов, а Непары близки к этой сумме. Если экспериментально определить такое расстояние, то можно установить, что именно образуется в том или ином растворе.
- Однако до сих пор нет общего метода, подходящего для этого. Более или менее достоверная косвенная оценка возможна только в отдельных случаях. Например, константа диссоциации нефекло〜(K = 0,2) совпадает с предположением о наличии 2 молекул воды между Fe3 + nC10-.In другими словами, структура ионов сквоша в разбавленных водных растворах четко соответствует типу ионов * Шварц М..
Достижения в области химии. 1970.М7, 1260. Ясное дело!. Между тем, » дипольный момент в бензоле AgC10 (ji = s U. 7) и расстояние между центром Ag *и центром СУ, рассчитанное по скорости поляризации ионов, составило 3,09 А. следует отметить, что расстояние между центрами ионов отдельных молекул типичной соли всегда меньше суммы ионных радиусов(определяется из кристаллической решетки). 33 + 1.81 = 3.14 А. и условие пара-только 2.67 А.
Сумма ионных радиусов(1,13 + 2,36 = 3 49A) указывает на то, что этот раствор содержит ионные молекулы (а не пары). Людмила Фирмаль
11) следует отметить, что грамм-эквивалент вещества (включая электролит) зависит от характера реакции, с помощью которой оно определяется. Например, в NaHSO «реакция равна M / 1 nahso» — f NaOH = Na2SO + NA, но реакция NaHS04 + BaCl2 = BaSO + NaCl + HCl Ai / 2.
In в большинстве случаев обменная реакция электролита протекает с участием всех ионов (одного или другого знака), поэтому нормальная масса равна граммолекулярной фракции, которая обычно указывается в тексте. 12) ниже, в качестве примера, показана степень диссоциации некоторых электролитов, найденная экспериментально (с-стандартная концентрация раствора).
В Электролите 4^^. 0.1 0.05 НС1……. 94.4 92.6 97.2 98.1 99.0 Примесями КС1……. 86.0 88.9 94.1 95.6 97.9 MgClj …… 76.5 80.3 88.3 91.0 95.5 K2SO4…… 72.2 77.1 87.2 90.5 95.4 Мгсо»…… 44.9 50.6 66.9 74.0 873 CH3COOH …. 1.4 1.9 4.2 6.0 12.4 Как видно из таблицы, при разбавлении раствора степень диссоциации возрастает, а рассматриваемый электролит ослабевает.
13) степень диссоциации электролита при разбавлении раствора увеличивается, но это означает, что количество ионов в единице объема а постоянно increases. As степень диссоциации возрастает, это число увеличивается. Между тем, увеличение объема самого раствора снижает it.
As в результате мы обнаружили, что до определенного предела разбавления первый фактор играет доминирующую роль, концентрация ионов увеличивается, а при добавлении воды далее степень диссоциации начинает уменьшаться, даже при увеличении концентрации ионов. increase. So, в смысле концентрации ни одного, раствор определенной средней интенсивности обычно является наиболее выгодным.
Например, для HC1 и H2S04 это раствор 20 n 30%, соответственно. 14) непосредственно определенная экспериментально степень диссоциации сильного электролита ясна только в том смысле, что она соответствует действительной степени распада соответствующей молекулы Иона. Такие расхождения вызваны электростатическим взаимодействием ионов.
Это заметно в растворах сильных электролитов (там много ионов), что сказывается на результате экспериментального определения степени диссоциации (понижения).Если мы примем во внимание это взаимодействие, то увидим, что в разбавленных растворах сильные электролиты почти полностью диссоциированы(когда-то мы даже думали, что полностью).Напротив, при слабых электролитах (относительно мало ионов в растворе) такие взаимодействия невелики, а кажущаяся степень диссоциации inx фактически отсутствует coincides.
In в сильных электролитах существует расхождение между кажущейся степенью диссоциации и кажущейся степенью диссоциации, но кажущаяся степень диссоциации почти пропорциональна кажущейся степени диссоциации, поэтому последняя может быть использована для сравнительной оценки кислот, оснований и солей.
Фактическое присутствие сильных молекул электролита с ионной диссоциацией в этих водных растворах может быть обнаружено прямым опытом. Таким образом, на сильной кислоте наблюдается выраженное давление паров HCl, и этот типичный сильный электролит частично экстрагируется из водного раствора AgClO из бензола. По-видимому, наличие в достаточно сильных растворах сильных электролитов Ион-диссоциирующих молекул, установленных такими фактами, несовместимо с принципиальным отрицанием их существования в более разбавленных.
15) вода и мощный электролит ($2 доб.24) диссоциирует почти полностью в очень разбавленном и почти концентрированном растворе (то есть его расплаве).Это означает, что по мере увеличения концентрации раствора степень диссоциации таких электролитов сначала уменьшается, а затем снова уменьшается. 16) влияние поля ионных сил на различные свойства разбавленного раствора можно свести к так называемой ионной силе раствора.
Последнее понимается как полусумма произведения молярной концентрации Иона (A, B, C и др.), как квадрат его валентности (о). Например, одновременное применение nan03 с раствором BaClj 0,1 АФ против 0,01 м, u =!/ I 0.01•2 * + 0.02•I » + 0.1.1 * — f-0.1•I2) составит 0.13.При расчете ионной силы раствора сильные электролиты считаются полностью диссоциированными, а для слабых электролитов их концентрация предварительно рассчитывается по соответствующей степени диссоциации. dissociation.
In растворы с одинаковой ионной силой, растворенное вещество подвергается примерно одинаковому воздействию со стороны силового поля окружающих частиц. 17) константа полной диссоциации миозиновой кислоты равна произведению константы ступенчатой диссоциации. Например, Н3РО4 извлекает следующее значение k из данных в основной текстовой таблице. [Этот Ихъ. POJ 10-」
18) для некоторых сильных электролитов сравните значение 2-й константы диссоциации со следующим(соответствует схеме MX ’** M * — f X ’или MX * ** M’ — f X’). HjSOi Н » ССО » АГ » так «Са (он) 2 ва (он) Дж Калифорния(нос)» Ба(нос)J в ПБ (Ной) Дж Befj М0 «„1 М0 -С. ИО-1 3-П „1 2. Кг1 5.10 -’ 1 1 “ в „-10 * “ 1 б-д * Рисунок выше характеризует HSO. As NaSO как электролит средней прочности, а BeF-ion-также как слабый электролит.
В случае Феклы были получены следующие константы диссоциации: R fFeCfltCl’l(Fecrilcl nft ^ [Fe“] [Cll ■Р’, —25; К2 -: — гг.- −0.8; / С3-р — р ^ я-0-2 [FeCl.] [FeClaJ [FeCl] Эти данные относятся к растворам с интенсивностью Ионов, равной 1.Сравнение их с постоянными константами непрерывной диссоциации фосфорной кислоты показывает, что последние значительно больше отличаются друг от друга.
Таким образом, постепенная диссоциация FeClj значительно менее выражена, чем в случае IUPCV. 19) изменение общей ионной силы раствора сильно влияет на диссоциацию солей(увеличение q приводит к увеличению диссоциации). примером может служить усредненное измерение, показанное на рисунке сплошной линией. В-17.
Для сравнения обычно значения, полученные с различными ионными интенсивностями, приводят к экстраполяции на q0, и в качестве конечного результата исследования получают число, найденное таким образом (в данном случае 5-10»*).Аналогично prnc = 1 FeS04 константа диссоциации ионов составляет 9-10**, и по мере непрерывного уменьшения ионной силы она уменьшается при q = 0 до 2-10 *(то есть в 45 раз).
Диссоциация солей и изменение температуры также влияют. Например, если q = 0,5, константа диссоциации AgF равна 1,3 (1°C), 1,5 (25°C) и 1,8(35°C). при экстраполяции на q = 0 значение при 25 X равно 0,4. 20) влияние температуры на диссоциацию слабых электролитов очень специфично. Обычно существует температура для каждого данного электролита. Когда значение его константы диссоциации становится равным largest.
As это видно из рисунка V-18.Для уксусной кислоты такой максимум достигается уже при температуре около 23 ° C. тот же рисунок показывает, что ниже этой температуры CHjCOOH является несколько более сильным электролитом. Выше, чем NH OH OH, немного слабее.
Максимальное значение NHOHOH составляет около 150°C. автоматическое распознавание речи / g s ионная прочность рост Бора Рисунок V-17. Диссоциация ионов олова 21) как и в случае ионных сил, влияет диссоциация давления. Например, значение К1 фосфорной кислоты увеличивается примерно на 0,1, при переходе от с * = 0,5 к с = 0,5, а при изменении от нормального давления до 2000 атмосфер-примерно в 3 раза.
22) в среде йода соль обычно ведет себя как слабый электролит с умеренной силой. Например, константа диссоциации AGF для HF равна 9 * 10«»*. Итак, LlBr, 3-10-5.Для пиридина AgCl. Значение K AgNOj и AgC104 составляет 8-10 * \ 9-10 «4 и 2-10» \спирт AgN03 и KBr, K = 7-10 секунд и 1•10″}.
Для Агной и Надж е ацетона-к = 4•10 е и 8-10 ″ 3. 23) когда молярная концентрация электролита распадается на 2 ноннона через С, и указывает степень его диссоциации через А. После этого концентрация каждого Иона равна aC. Кроме того, концентрация молекул, которые не диссоциированы, становится (I-a) C.
Результат. В соответствии с законом коллективных действий、 АС-АС ’ в ’ (Я-А) C «с» НЛИ Эта формула, называемая законом разбавления, связывает порядок n с константой диссоциации, тем самым позволяя вычислить значение 1 из другого value. As пример, экспериментальные данные уксусной кислоты показаны ниже. С……. 0.001 0.005, 0.01, 0.05, 0.1, 0.2 Это не проблема…… 0,124 0,060 0,042 0,019 0,0095 / С-10 * ….. 1. * > 1.82 1.83 1.85 1.85 1.82
В очень разбавленном растворе величина а невелика, поэтому при приближенном расчете слабых электролитов можно предположить, что 1-а = 1. 24) Если известна константа диссоциации слабой кислоты (или основания), то можно легко рассчитать концентрацию ионов водорода (гидроксила) в растворе.
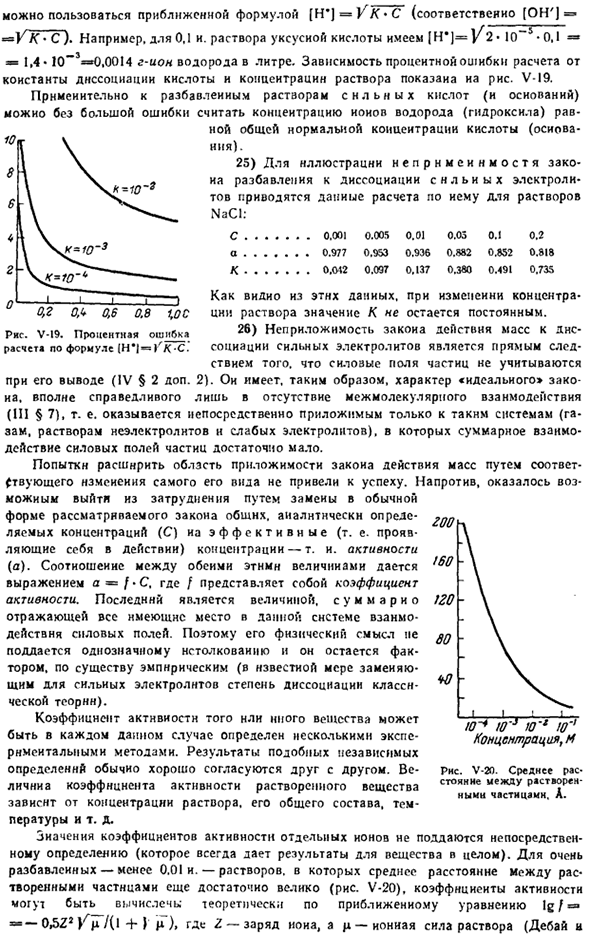
Для таких расчетов Юзо * около 50°C Это зависимость константы диссоциации от температуры. Приближенное выражение[H ’\ = VK * C ([OH ’ J = K * C например, 0.1 и. Раствор уксусной кислоты[H *) = l / 2 ″ 10 ″ * 0,1 = * 1.4 * 10 * 3 ″ 0.0014 г-на рисунке V-I9 показана постоянная диссоциации и зависимость погрешности диссоциации от концентрации раствора.
По отношению к разбавленным растворам сильных кислот(и оснований) концентрацию ионов водорода(гидроксила) можно считать равной общей нормальной концентрации кислот (оснований) без существенных погрешностей. 25) для объяснения неприменимости закона разбавления к диссоциации сильных электролитов приведены расчетные данные метода разбавления растворов. NaCl: С……. 0.001 0.005, 0.01, 0.03, 0.1 0.2 И……. 0.977 0.953 0.936 0.882 0.652 0.818 К……. 0.012 0.097 0.137 0.380 0.491 0.735 Как видно из этих данных, значение K не является постоянным при изменении концентрации раствора.
26) невозможность применения закона массового действия к диссоциации сильных электролитов является прямым следствием того, что силовое поле частиц не учитывается Исходя из его заключения (IV§ 2, 2).Таким образом, ОИ обладает свойством»идеального» закона, который совершенно справедлив только при отсутствии межмолекулярного взаимодействия(III§ 7).То есть он может быть непосредственно применен только к таким системам (газам, неэлектролитным растворам, слабым электролитам), где происходит все взаимодействие.
Попытки расширить область применимости законов массового поведения с соответствующими изменениями в самой форме успеха не принесли. Наоборот, оказывается, что можно выйти из затруднений, заменив общепринятую аналитически детерминированную концентрацию © и действенную (то есть проявляющуюся в действии) на обычную форму рассматриваемого закона. Деятельность (а).
Соотношение обоих этих значений задается выражением a * = / » C. Где/представляет фактор активности. Последняя представляет собой величину, суммирующую все, что происходит в той или иной системе взаимодействия силовых полей. Поэтому его физический смысл не поддается четкой интерпретации и остается фактором. Эмпирический характер (в некоторой степени заменяет степень диссоциации классической теории сильных электролитов).
Коэффициент активности конкретного вещества может быть определен в каждом конкретном случае несколькими экспериментальными методами. Результаты таких независимых решений обычно хорошо согласуются друг с другом. Величина коэффициента радиоактивности растворенного вещества зависит от концентрации раствора, его общего состава и температуры. д.
Коэффициент радиоактивности отдельных ионов не может быть определен непосредственно(всегда результат действия всего вещества).Если очень разбавленный-менее 0,01 и-среднее расстояние между растворенными частицами все еще достаточно большое растворение(рисунок V-20), то коэффициент активности можно теоретически рассчитать по приближенной формуле log /»0£Z2уц/(L+) р).Где 2 — ионный заряд, а с-ионная сила раствора (Дебай и Рисунок V-I9.
Выражение{H * / — «»’ / (- С. Рисунок V-20.Среднее расстояние между растворенными частицами. Один. Guccal, 1923).Переход от этих индивидуальных значений к суммарному (среднему) коэффициенту активности сильного электролита типа МКАУ задается формулой: / — Г-Yar7 27) на рисунке показаны общие характеристики зависимости коэффициента активности от q при малом значении ионной силы. В-21.
Более крутой градиент кривых многовалентных ионов в классической интерпретации соответствует более низкой степени диссоциации образуемых ими электролитов, по сравнению с М * A-type. As вы можете видеть из рисунка V-22 о’.ОГА ИИС работа i08 о./ о 0.5 / г Рисунок V-2I. средний коэффициент RNS активов. В-22.
Зависимость коэффициента Ионизировать ионы. активность от конусов ирнрода. В разбавленных растворах коэффициент активности однотипной соли сильно зависит от свойств катионов и anions. In в сильном растворе(и неводном) значение коэффициента радиоактивности часто превышает 1 large.
An примером может служить значение коэффициента активности NaOH при высокой молярной концентрации раствора: М……. 5 10 15 20 25 ф……. 1.07 3.27 9.79 19.4 28.2 Основное преимущество метода активности 2ft (Lewis, 1923) состоит в том, что он позволяет более общую и точную количественную интерпретацию различных свойств растворов сильных электролитов, чем это возможно на основе классической теории электролитической диссоциации.
Однако в силу эмпирического характера самого коэффициента активности эта интерпретация носит формальный характер, и для понимания сущности явления имеется мало достижений. Необходимое обобщение (например, ионная сила) возможно только в отношении разбавленных растворов, так как с увеличением концентрации индивидуальные характеристики отдельных частиц начинают светиться все более резко.
Его сфера применения практически еще не ограничена широкой применимостью рассматриваемых методов. 29) константу диссоциации электролитов можно рассчитать исходя из концентрации молекул и ионов (КС) или их активности (ка). в первом случае эти константы часто называют классическими, а во втором-термодинамическими.
Строго говоря, классическая константа диссоциации(большая часть которой не показана в литературе) правильно характеризует электролит только в том случае, если q равно 0, то есть в бесконечном растворе разбавления. Однако если электролит слабый, то разница между Ks и Ka обычно невелика(например, в 0,1 м растворе уксусной кислоты Ks при 25°c, 1,85 10 −5, Ka = 1,70 * 10 ″ 5).
Они становятся более важными по мере того, как рассматриваемый электролит становится сильнее и общая концентрация раствора увеличивается. 30)Как видно из того, что было дано дополнительно. Из 29 данных (см. Также дополнения 19 и 21) численный результат диссоциации зависит не только от природы электролита (и растворителя), но и от условий измерения.
Если последний не полый Если вы согласны, то только приблизительная оценка константы имеет смысл(nvoernmer, 2 * 10 ″* Для уксусной кислоты).Однако в литературе»точное» значение константы часто дается без упоминания всех условий ее определения.
31) концентрацию ионов водорода (гидроксила) в растворе слабой кислоты (основания) в присутствии солей можно рассчитать по следующей приближенной формуле:(H’J = KC / a (соответственно, основание[OH1-KC / a), где концентрация кислоты-диссоциация С-концентрация кислоты (основания)-солнечная концентрация.0,1 и нанометров.
При этом раствор уксусной кислоты, содержащий стандартный вес данные (Н = М = 82) (ч = литр к ней, концентрация ионов водорода[ГДж= 0.1•2-10-5 / 0.01 = 2•10 «\то есть 0,0002 г-Ион / л. Оли (приложение 24) содержит 0.0014 г ионов водорода, из-за отсутствия раствор уксусной кислоты такой же 0,1 Н. видно, что добавление даже небольшого количества соли, например, 0,8 грамм на литр, приводит к снижению концентрации ионов водорода в 7 раз.
32) для длины константы диссоциации уксусной кислоты формула, описанная в тексте, может быть переписана следующим образом: [SNDSUH]lH J [Chjcoo’J * Из этого видно, что в условиях[CH3COOH] = [CHjCOO’j концентрация ионов водорода численно равна константе диссоциации. Такая ситуация в растворе слабой одноосновной кислоты возникает, когда он наполовину нейтрализован сильной щелочью.
Таким образом, экспериментальное определение концентрации Nova-водорода в таких растворах позволяет непосредственно установить величину константы диссоциации. Аналогичный аргумент справедлив и для слабых геокислотных оснований. 33) строго говоря, величину ионного продукта воды можно считать независимой от состава раствора только в том случае, если он получен на основе активности, а не концентрации.
При обычном выражении Ko эта независимость больше не будет иметь места(из-за изменения коэффициента активности).Например, в нормальном решении KC1 значение Ki равно 1 * 10 «’4, а не 1. 7-10» м. При изменении температуры значение параметра / Ce изменяется следующим образом: Температура Солнца……. 0 10 20 25 30 40 50 60 70 80 90100 / СД-ю ’ 4……….. 0.11 0.30 0.6 е 1.00 1.47 2.92 5.46 9.64 15.9 25.1 38.1 53.7
Когда достигается максимальное значение / Sv (I•I0-11), оно становится 275еС, а затем начинает уменьшаться (см. дополнительные 20).Увеличение давления сопровождается увеличением CL (для 25 SS, для 1000 при 2,2 RPA, для 8000 при 51 разе).По грубым оценкам, все эти изменения / Sv обычно не принимаются во внимание.
34) по существу, водородный индекс не соответствует концентрации.«Активность ионов водорода(т. е. pH =-1 ^ en). при прямых экспериментальных измерениях рН это значение обычно устанавливается мной. Водородный индикатор имеет монографию. 35) подобно водороду, можно ввести «гидроксильный индекс» — rOH.
Из Формулы ионного продукта воды видно, что он равен pH + pOH = p / C. При нормальных условиях pOH = 14-pH. 36) имеет аналогичный рН и определяется соотношением p / C-log / C (где/ C выступает при диссоциации).Индикаторы также иногда используются для характеристики прочности кислот и оснований. Например, уксусная кислота (K = 2 «10») соответствует P / C = «4.7.it следует отметить, что с увеличением Р/ С электролит становится слабым.
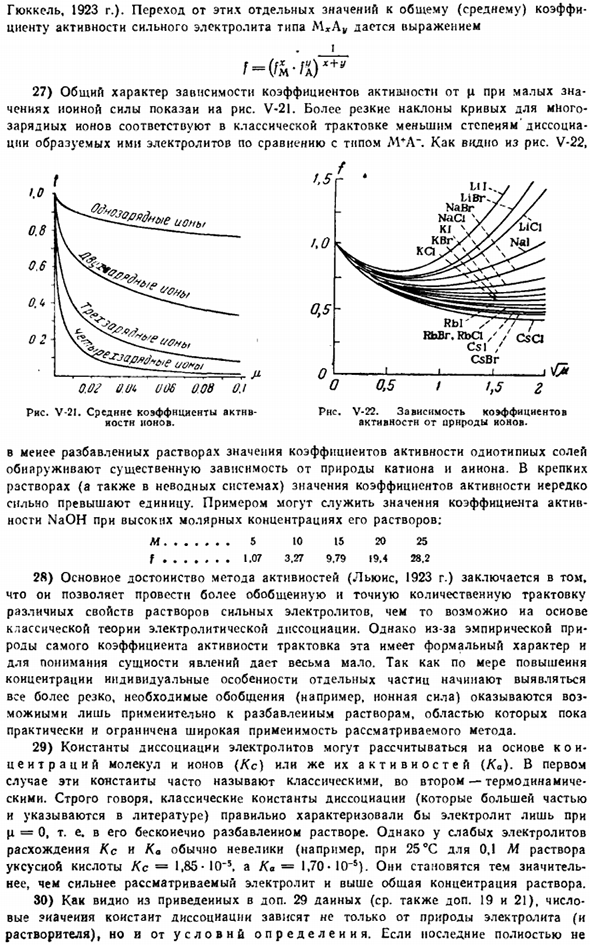
37) значение рН нейтральной среды= 7 допустимо только при нормальной температуре (точнее, 25°С). Как видно из рисунка V-23, в диапазоне 0-100°С рассчитаны свойства нейтральной среды; она претерпевает довольно существенные изменения. Например, при 40°С ему соответствует рН = 6,7. На РН это влияет незначительно * Удар P рН измерения. Теория и практика. Эд. 2 Эл. С английского, Изд. Б. Н. Никольский и М. М. Шульц. Химия-Анджелеса. Он умер в декабре 1972 года. 400 р.
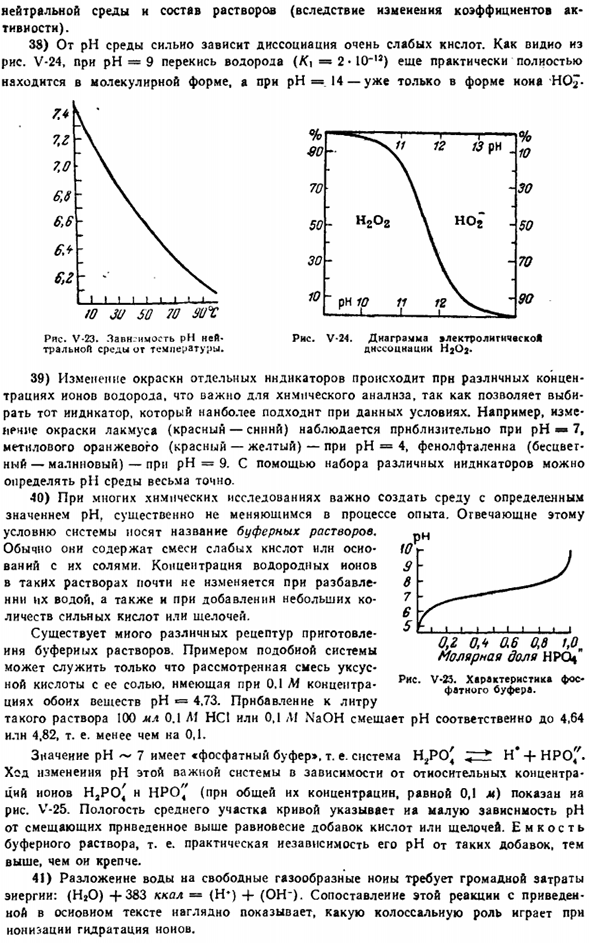
Состав раствора с нейтральной средой(за счет изменения коэффициента активности). 38) очень слабая кислотная диссоциация сильно зависит от рН среды. medium. As видео с рисунка V-24, при рН = 9, перекись водорода (K, −2•10«, a) все еще почти полностью находится в молекулярной форме, а при рН = 14, только в форме HOJ-ионов. Рисунок V-24. Схема электролитической диссоциации HjOj. 39) изменение цвета отдельных индикаторов происходит при различных концентрациях ионов водорода.
Это важно для химического анализа. Это потому, что вы можете выбрать лучший индикатор в этих условиях. Например, изменение цвета лакмуса (красно-синий) наблюдается примерно при рН■■7, метилового оранжевого (красно-желтого)-рН = 4, фенолфталеина (бесцветно — малинового) — рН = 9 Пи 1 среды очень точно. 40) во многих химических исследованиях важно создать среду с определенным значением рН, которое существенно не изменяется в ходе эксперимента.
Система, соответствующая этому состоянию, называется буфером. рН обычно содержит слабую кислоту или смесь слабых оснований и солей. Концентрация ионов водорода в таком растворе, разбавленном водой, практически не изменяется, и даже при добавлении небольшого количества сильной кислоты или щелочи.
Есть много различных препаратов для подготовки buffer. An примером такой системы является как раз рассматриваемая смесь уксусной кислоты и ее солей, которые имеют рН 0,1 при концентрации 4,73 м обоих веществ. Добавьте 1 литр такого раствора к 100 мл 0,1 Л1 HCl или 0,1 а! NaOH сдвигает рН до 4,64 или 4,82, или менее 0,1, соответственно. Значение рН −7 имеет «фосфатный буфер», то есть систему H2PO ^ H ■+■NRO.
Ход изменения рН в этой критической системе, зависящий от относительной концентрации NAOO, показан на рисунке nHP04 (при общей концентрации 0,1 м). В-25.Плоскостность центральной части кривой указывает на небольшую зависимость рН от движения равновесных добавок вышеуказанных кислот или щелочей. Емкость буфера, то есть практическая независимость рН от таких добавок, чем она выше, тем прочнее.
41) для разложения воды в свободную форму газа требуются огромные энергетические затраты:(Н20)+383 ккал> =(Н)-f(ОН -).Сравнение этой реакции с реакцией, показанной в тексте, ясно показывает большую роль, которую ионная гидратация играет в ионизации. / О JO 60 70 Вт? Ряса. В-23.Зависимость нейтрального рН между температурами. НР nr0.6 0, ННЦХ мольной концентрации в 1,0 Рисунок V-25.Характеристика фосфатного буфера.
Смотрите также:
| Свойства растворов | Ионные реакции |
| Гипотеза ионизации | Гидролиз |
