Оглавление:





Гипотеза ионизации
- Гипотеза ионизации. Количественные исследования зависимости свойств разбавленных растворов от концентрации растворенных веществ показали, что для всех этих свойств эффективны одни и те же законы разбавления растворов-снижение давления пара, повышение температуры кипения, снижение температуры замерзания и явление осмоса(Raul-Vant-Hoff, 1886): свойства разбавленных растворов изменяются в зависимости от концентрации растворенных веществ.
- Это позволило разработать методы определения молекулярной массы веществ, в которых измерение плотности паров не применимо. Для такого решения можно использовать любую из приведенных выше общих характеристик разбавленного раствора. Поток суждений в этом случае раскрывается из приведенного ниже примера. Examples. In при исследовании водного раствора вещества с известной молекулярной массой, когда молекула растворяется в 1 грамме воды 1000 г, температура замерзания падает до 1,86 degrees.
Чаще Наслаждайтесь только падением температуры замерзания. Людмила Фирмаль
So, согласно закону разбавления растворов, при растворении молекулы 4 т в таком же количестве воды температура замерзания падает на 0,93 градуса, а при растворении 0,1 г молекул она падает на 0,1 С6 градусов. Далее определяют молекулярную массу глюкозы. 。Анализ этого соединенияпоказывает простейшую формулу Чао(общий атомный вес равен 30).Правда, что рецепт глюкозы будет (SNGO).»Где n будет 1, 2 или 3, etc. to решают задачу о величине n, растворяют 30 г глюкозы в 1000 г воды и определяют температуру замерзания раствора.
Согласно опыту, УВР уменьшается на 0,31 degrees. In ’ / в 1.86 град. Результат. 30 г соответствует / граммовой молекуле. То есть при n = 6 истинной формулой глюкозы является SvMtsO * 1**. Приведенная выше теория разбавленных растворов явилась большим научным достижением, сведя вариацию различных свойств к 1 простой закономерности. Но в нем содержалось внутреннее противоречие, которое, как обычно кажется, послужило толчком к дальнейшему развитию.
Выводы теории были полностью подтверждены экспериментами, но оказалось, что водный раствор органических веществ и водный раствор других растворителей(эфира, бензола и др.) были изучены, которые не могли быть применены к водному раствору кислот, оснований и солей. Например, для раствора, содержащего 1000 г молекул NaCl (58,5 г) на 1 г воды, температура замерзания снизилась на 3,36 градуса. То есть она стала намного больше необходимой теории.
То же самое наблюдалось и в других растворах солей, кислот и bases. It оказывается, что снижение температуры замерзания (и изменение общих характеристик остального раствора) всегда носит более теоретический характер. Выход из этой ситуации определяется в 2-х направлениях: сама теория была неверна по отношению к водному раствору кислот, оснований и солей, или, наоборот, в данном случае она оставалась верной, а кажущееся отклонение от нее было обусловлено неверным расчетом количества растворенных частиц.
Поскольку эффект всегда оказывался больше, чем требуется в теории, например, при растворении 100 молекул NaCl в растворе получается более 100 частиц, то есть некоторые молекулы соли могут быть разделены на несколько мелких частиц. Решение вопроса было основано на результатах исследования электропроводности раствора. Раствор в таком растворителе, как эфир, бензол не пропускает электрический ток, а в водном растворе хорошо проводят только кислоты, основания и соли, то есть вещества, в которых наблюдаются отклонения, хорошо известны из закона разбавленных растворов.
Гипотеза ионизации, предложенная Аррениусом (1887), связывает эти особенности кислот, оснований и солей с проводимостью в растворе, которая не только качественно объясняет оба явления, но и может количественно вычислить 1 из них на основе результатов, полученных в других исследованиях. Суть ионизационной гипотезы заключалась в том, что молекулы кислот, оснований и солей в водном растворе частично разлагались на независимые ионы.
Чем больше таких ионов, тем больше проводимость раствора. Но когда молекула коллапсирует в Ион、 При этом общее число растворенных частиц берется от 1 до 2 (или более). в результате закон разбавления растворов справедлив не только для молекул, но и для водных растворов кислот, оснований и солей с учетом ионов, возникающих при их распаде как самостоятельные частицы.
- Арлениус, который является приверженцем «физической» теории растворов (§ 2), не учел взаимодействия растворенного вещества с растворителем, но считал, например, что молекулы разлагаются на свободные ионы по схеме. © NaCl = Na + + CI » © Индивидуальное рассмотрение процесса ионизации не давало возможности для правильного понимания. Около @ Правильное понимание процесса ионизации молекул в растворе стало возможным только на основе концепции Аррениуса и синтеза ориентации по химической теории растворимых молекул Менделеева.
Первый признак необходимости для Иона такого синтеза близок, я сформулировал суть вопроса следующим образом. А. принадлежит Каблукову (1891). Согласно Аррениусу, ионы движутся свободно, подобно отдельным атомам, возникающим при диссоциации молекул галогена при высоких температурах. И. А.
Вода, которая расщепляет молекулы растворенного тела, входит вместе с хрупкими соединениями в диссоциативное состояние с ионами. Людмила Фирмаль
С точки зрения Каблукова, гидратированные ионы — это не свободные, а гидратированные ионы, и гидратация является основной причиной ионизации molecules. To различают гидратированные и свободные (негидратированные) ионы, начальный заряд обозначают точками, а отрицательный заряд-цифрами. strokes.
So например, ионизацию раствором NaCl следует представлять не по приведенной выше, а по следующей схеме. NaCl = Na * + CI ’ И. А. интерпретация ионизации растворенных веществ, данная кабульковым, в настоящее время общепринята. Ионы с положительным зарядом называются катионами. В-11.
Процесс, посредством которого ионные молекулы разлагаются на отдельные ионы вблизи^ noinoможет диполями и отрицательно заряженные диполи анионами, может быть выражен следующим образом: вблизи каждого Иона молекулы в растворе, скажем NaCl, Полярные молекулы воды ориентированы, как показано на рисунке V-10 в случае Na*. в положении A отрицательный полюс диполя притягивается к ионам, а положительный полюс repels.
As в результате молекула вращается и перемещается в положение B. Но значения положительного и отрицательного зарядов диполя равны, а расстояние от ионов различно. Таким образом, притяжение к последнему действует сильнее, чем сила отталкивания, и вращающиеся молекулы притягиваются к ионам(в).Очевидно, что подобные явления происходят вблизи отрицательных ions.
As в результате рядом с обоими ионами собирается ряд молекул воды, притянутых к ним (рис. V-11). Но » все процессы природы двусторонни. Они основаны на соотношении не менее 2-х активных частей, основанных на действии и реакции»(Энгельс)、Диполь притягивается к ионам, а последний-к диполю.
Таким образом, сила сжатия между ионами в растворе ослаблена, поэтому энергии молекулярного движения достаточно, чтобы отделить ионы друг от друга. В растворителе, который является менее полярным, чем вода, направление диполя вблизи Иона намного меньше.
Таким образом, ослабление сцепления между ионами, вызванное им, также уменьшается, и поэтому энергия молекулярного движения в растворе может оказаться недостаточной, чтобы отделить их друг от друга. Поэтому разложение молекул на ионы обычно не наблюдается в низкополярных растворителях, таких как эфир, бензол, и только относительно слабо в растворителях промежуточной полярности, таких как спирты.
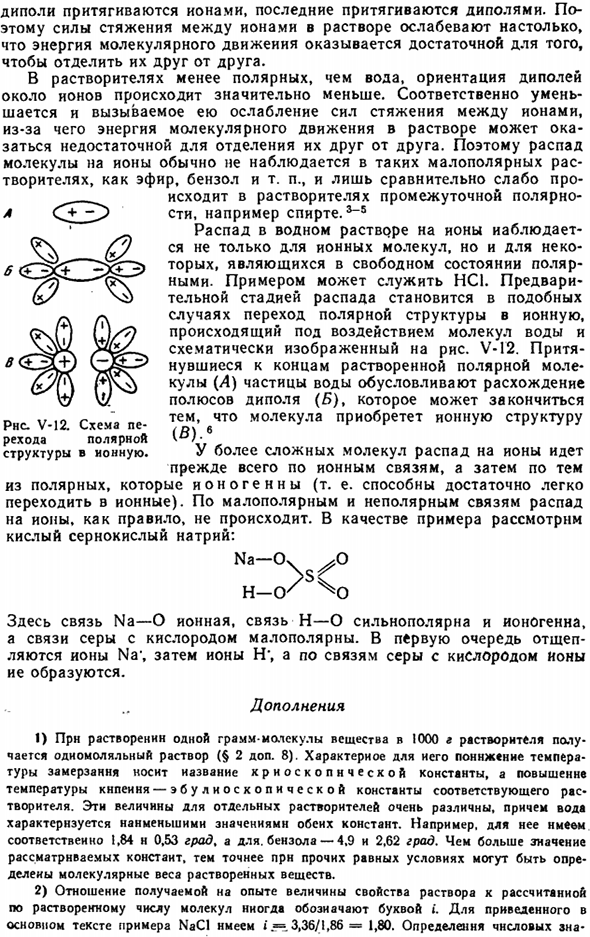
Распад на ионы в водных растворах наблюдается не только в ионных молекулах, но и в тех, которые полярны в свободном State. An пример есть HC1.In в таких случаях переход от полярной структуры к ионной, происходящий под воздействием молекул воды и схематично изображенный на Рис.2, становится предварительной стадией разложения. В-И2.
Частицы воды(а), притянутые к краю растворенных полярных молекул, вызывают расхождение полюсов диполя(Б), и в результате молекулы приобретают ионную структуру (в).Шесть В более сложных молекулах распад на ионы происходит в основном через ионные связи, а затем через распад от ионных полярных связей(то есть они могут очень легко переходить к ионным связям).в неполярных и неполярных комбинациях, как правило, распад на ионные связи отсутствует. ions.
As в качестве примера рассмотрим гидросульфат натрия. На-Оч. О > Южная Каролина Ч-0 / ^ 0 Здесь связь Na-O является ионной, связь Н-О является сильной полярностью и ионообразующим свойством, а связь сера-кислород не полярна. Сначала отделяются Ионы Na1, затем ионы H1, а из связей серы и кислорода образуются ионы. Добавь 1) растворить в растворителе 1000 г вещества 1 г молекулы и получить эквимолярный раствор (§ 2 add.8).
Характерное падение температуры замерзания для него называют постоянной замерзания, а увеличение температуры кипения называют постоянной температуры соответствующего растворителя. Эти значения отдельных растворителей существенно различаются, а вода характеризуется наименьшими значениями обеих констант.
Например, в ее случае, 1,84 и 0,53 градуса, соответственно. Бензол-4,9 и 2,62 градуса. Чем больше значение рассматриваемой константы, тем точнее можно определить молекулярную массу растворенного вещества при прочих равных условиях. 2) соотношение экспериментально полученных характерных значений раствора и рассчитанных характерных значений от числа растворенных молекул может быть обозначено буквами.
Для примера NaCl в теле, 3.36 / 1.86 = 1.80.Определение чисел Рисунок V-12.Схема перехода от полярной структуры к ионной. Ченнаи I приносит обычно последовательные результаты, основанные на различных характеристиках одного и того же решения. 3) поскольку большинство кристаллов соли образуются ионами, процесс растворения этих кристаллов может быть связан с первоначальным переходом в раствор отдельных катионов и анионов, а не самих молекул(однако они должны находиться в равных пропорциях).
Частичное образование молекулы в этом случае является вторичным процессом, который уже протекал в растворе. Конечным результатом, соответствующим состоянию равновесия, очевидно, остается same. As при общем подходе рассматривать решение в решении, представленном в основном тексте. 4) ослабление напряжения между ноннонами зависит от диэлектрической проницаемости (е) растворителя (§ 2).12).
Последнее входит в полное представление Основного Закона статического электричества, следовательно,/ e: * * 2 / е * dl. Для воды, в нормальных условиях, e80.So, в водном растворе напряжение между ионами в 80 раз меньше. H * m в кристалле (для окружающего пространства частиц e 1). дл значение? Спирт, эфир и бензол равны 24 4 и 2 соответственно.
5) использовать основной закон статического электричества (дополнение III§ 7.См.1). можно произвести приблизительный расчет 2 невзаимодействующих энергий в водном растворе. Например, для ионов Na * n CI», радиус которых равен 0,98 л и 1,81 а Е. — Е.4.80-х-10. 4.80-10 ″* 10 1—_________4 -T-JT-g 10.3-10 14 erg e * d 80(0.98-10 «8+ 1.81 * 10’8)полученное значение энергии взаимодействия является максимальным.
Это связано с тем, что он соответствует прямому контакту неслабых ионов (это следует считать предельным случаем для раствора). Средняя энергия теплового движения частиц равна «LT», T-абсолютная температура, k-постоянная величина(1.38-10 * 6 это хорошая идея. Возьмите температуру, равную + 20 * C= 1.50-1.38-10 «»-293 = 6.1•10〜 «эрг. Если мы сравним это значение с приведенным выше, то увидим, что оба имеют одинаковую степень. То есть энергия теплового движения разлагается на ионы соли, растворенные в воде.
В) для возможности ионизации полярных связей растворенных веществ основное значение обычно имеет не общая полярность растворителя (характеризующаяся диэлектрической проницаемостью), а 1 из специфических полярных связей атома NC (чаще всего наличие в молекуле атомов, способных взаимодействовать с атомами водорода). он ионизирован гораздо больше с алкоголем (Е 110) чем (е 24).Эти примеры наглядно показывают, насколько большое значение ионизации могут иметь индивидуальные характеристики обоих компонентов раствора.
Смотрите также:
| Молекулярные растворы | Электролитическая диссоциация |
| Свойства растворов | Ионные реакции |
