Оглавление:


Электролиты и неэлектролиты. Механизм растворения веществ в воде. Электролитическая диссоциация
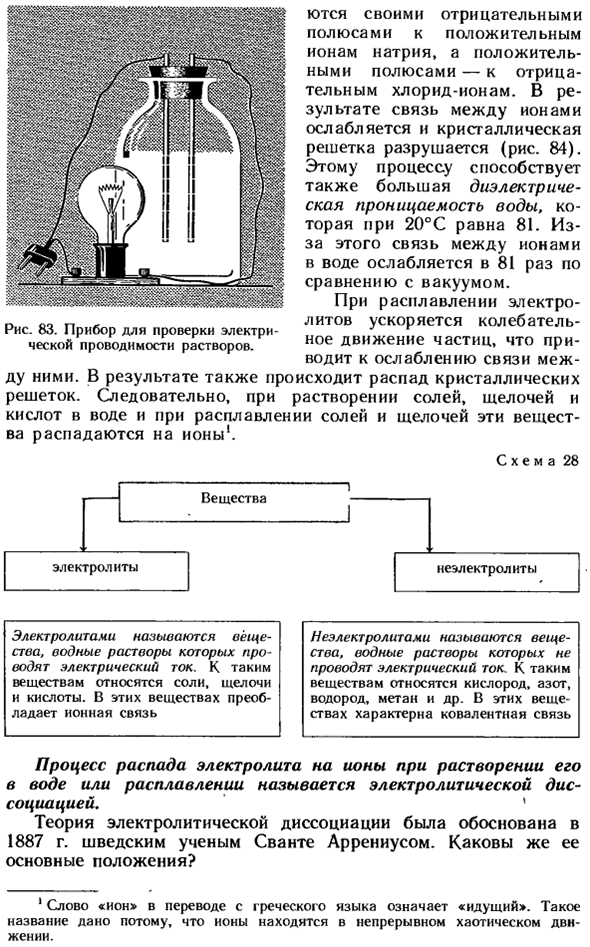
- Электролиты и неэлектролиты. Механизм, по которому вещества растворяются в воде. Электролитическая диссоциация Используя устройства, показанные на рисунке 83 для проверки электропроводности растворов этих веществ, мы можем экспериментально найти механизм, посредством которого вещества с различными видами химических связей растворяются в воде.
- Например, если вы окунете электроды устройства в сухой хлорид натрия, лампочка не загорится. Такой же результат получается, если электрод находится в дистиллированной воде. Но когда электрод погружен в водный раствор хлорида натрия, свет входит внутрь. Другие растворимые соли, щелочи и кислоты работают аналогично хлориду натрия.
Соли и щелочи проводят электрический ток даже в расплавленном состоянии. Людмила Фирмаль
Водные растворы, например сахар, глюкоза, спирт, кислород, азот не пропускают ток. Исходя из этих свойств, все вещества делятся на электролитные и неэлектролитные (схема 28). Почему соли и щелочи в водных растворах проходят через электрический ток, в то время как другие вещества не проходят через него? Чтобы ответить на этот вопрос, необходимо вспомнить, что свойства вещества определяются его структурой(I, с. 130).
Например, структура кристаллов хлорида натрия (I, с. 129) отличается от структуры молекул кислорода, водорода и аналогичных веществ. Для того чтобы правильно понять механизм, посредством которого ионно-связанные вещества растворяются в воде, необходимо также учитывать, что в молекулах воды существует ковалентная полярная связь между атомами водорода и кислорода, направленная под углом 104,5°.Поэтому молекулы воды являются polar.
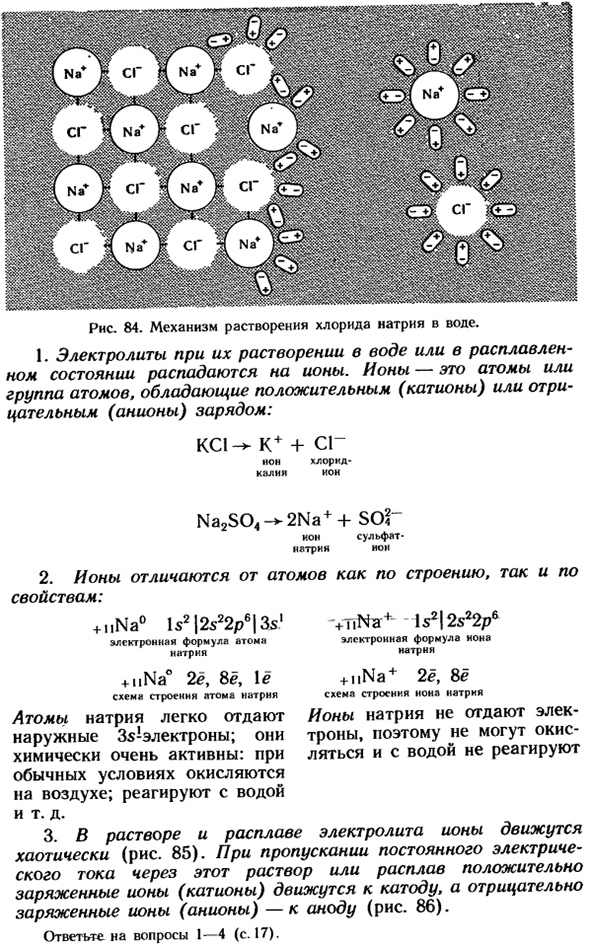
As в результате при растворении, например, хлорида натрия, молекулы воды притягиваются Это отрицательный полюс к положительному Иону натрия и положительный полюс к отрицательному хлориду ion. As в результате ослабляются связи между ионами и разрушается кристаллическая решетка (рис. 84).Этому процессу также способствует большая диэлектрическая проницаемость воды, которая составляет 20 при 81°С.
- По этой причине связи между ионами в воде ослабляются в 81 раз по сравнению с вакуумом. При растворении электролита вибрация ускоряется Рисунок 83. Устройство для контроля ППН элект-пвнжрнир чягтип Проводимость раствора. Движение частиц Это приводит к ослаблению связи между them. As в результате кристаллическая решетка также разрушается.
Поэтому при растворении солей, щелочей и кислот в воде, а также при растворении солей и щелочей эти вещества va распадается на Ион 1 Схема 28 Вещество Неэлектролиты Неэлектролиты Электролит-это вещество, в котором водный раствор проводит электрический ток. К таким веществам относятся соли, щелочи и acids. In в этих веществах доминируют ионные связи.
Неэлектролиты-это вещества, в которых ток не протекает в водном растворе. Людмила Фирмаль
К таким веществам относятся кислород, азот, водород, метан и др. Эти вещества характеризуются ковалентными связями Процесс, посредством которого электролиты распадаются на ионы при растворении или растворении в воде, называется электролитической диссоциацией. «» Теория электролитической диссоциации была продемонстрирована в 1887 году шведским ученым свантеарениусом.
В чем его главный смысл? 1 греческое слово » Ион «означает » идти».»Это название было дано из-за того, что ионы имеют непрерывное движение хаоса. Рис.84.Механизм растворения хлорида натрия в воде. 1.Электролиты разлагаются на ионы при растворении в воде или в расплавленном состоянии.
Ионы-это атомы или группы атомов с положительным (катион) или отрицательным (анион) зарядом. КС1- * К + + СГ Без калия хлорид-Иона Na2S04 2Na + + Итак?」 Сульфат-ион натрия 2.Ионы отличаются от атомов как по структуре, так и по свойствам. + УНА°Ис2 | 2s22p6 / 3 С1 Электронная формула атомов натрия + нна°2yo8ë, Структура атома натрия Атом натрия легко высвобождает внешние электроны Zy. Они очень химически активны.
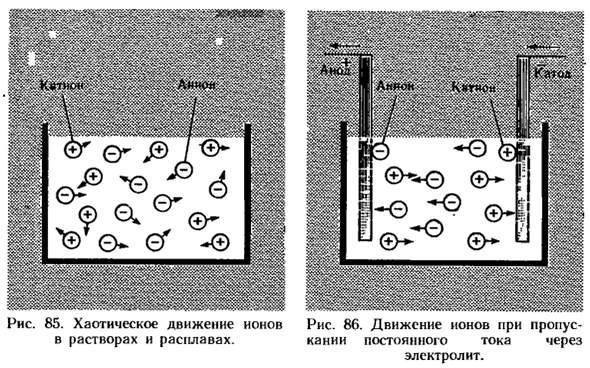
В нормальных условиях он окисляется на воздухе. Реагирует с водой и т. д. 3.In раствор и электролит расплавляются, ионы перемещаются хаотично(рис. 85).При приложении постоянного тока к этому раствору или расплаву положительно заряженные ионы (катионы) перемещаются к катоду, а отрицательно заряженные ионы(анионы) — к аноду (рис.86).
Вопрос 1-4 (стр. 17). > nNa + ls2 | 2s22p6 Электронная формула Иона натрия + нна +2ё, 8ё Структурная схема Иона натрия Ионы натрия не выделяют электронов, поэтому они не могут окисляться и не вступают в реакцию с водой Рисунок 85.Хаотическое движение ионов в растворах и расплавах. Рис.86.Движение ионов при приложении постоянного тока к электролиту.
Смотрите также:
| Расчеты, связанные с определением массовых долей растворенных веществ | Тепловые явления при растворении. Гидратация ионов |
| Расчеты по термохимическим уравнениям | Диссоциация кислот, щелочей и солей |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
