Оглавление:




Тепловые явления при растворении. Гидратация ионов
- Тепловые явления при растворении. Ионная гидратация Шведский ученый С. Аррениус не смог в полной мере раскрыть тонкости процесса электролитической диссоциации. Он не принимал во внимание активную роль молекул растворителя, полагая, что свободные ионы находятся в водных растворах.
- Эта теория была разработана русскими учеными И. А. Каблуковым и В. А. To чтобы понять суть теоретических концепций этих ученых, необходимо ознакомиться с явлениями, возникающими при растворении вещества в воде. Когда твердый гидроксид натрия NaOH или концентрированная серная кислота H2S04 растворяются в воде, происходит сильный нагрев (рис. 87).
Она получила дальнейшее развитие при изучении Kistyakovsky. Людмила Фирмаль
Особую осторожность следует проявлять при растворении серной кислоты, так как из-за повышенной температуры часть воды может превратиться в пар, а кислота может выделиться из емкости под ее воздействием. pressure. To избегайте этого, влейте серную кислоту в воду тонкой струйкой, постоянно помешивая (и наоборот! это не. Например, если тонкостенный стакан аммиачной селитры, который помещают на влажную тарелку, растворить в воде, то охлаждение будет интенсивным, и стекло может даже замерзнуть(рис.88).
Почему при растворении веществ наблюдается обратное явление? На этот вопрос можно ответить, опираясь на положения атомно-молекулярной теории(I, с. 27). При растворении твердые частицы распределяются между молекулами solvent. In в этом случае необходимая энергия поглощается извне и происходит охлаждение. Исходя из этого, процесс растворения следует отнести к физическим явлениям. Рис.87.
Нагревание во время растворения 88.Охлаждение, когда некоторые вещества растворяются в воде. Некоторые вещества в воде. Почему растворение некоторых веществ вызывает нагревание? Выделение тепла (I, 10) является признаком химической реакции. Поэтому при растворении также осуществляется химическая реакция. Например, молекулы серной кислоты вступают в реакцию с молекулами воды, образуя соединения в составе H2S04•Н20 (моногидрат серной кислоты) и H2S04•2Н20 (дигидрат серной кислоты).
Молекулы серной кислоты связываются с 1 или 2 молекулами воды1. Взаимодействие молекул воды с молекулами серной кислоты относится к реакции гидратации (I, 91), и образующееся вещество называется гидратами. Когда твердое вещество растворяется в воде, происходят как физические, так и химические процессы. Если в результате гидратации выделяется больше энергии, чем тратится на разрушение кристалла вещества, то растворение сопровождается нагревом, а в обратном случае-охлаждением. _
Растворение-это физико-химический процесс, а раствор-это физико-химическая система. Такое объяснение сущности процесса растворения и природы раствора впервые было теоретически продемонстрировано великим русским ученым Д. И. Менделеевым•Он разработал теорию гидратации растворов. Кристаллогидрат. Когда раствор испаряется, вещество часто отделяется в виде кристаллов, содержащих химически связанные water.
- So например, если добавить воду к сульфату меди (II) CuSO4 (белый порошок), то произойдет нагревание, и образуется синий раствор. При выпаривании выделяется голубое кристаллическое вещество-сульфат меди, который имеет состав CuS04•5H20.Медицинское образование 1 точка между уравнениями не является знаком умножения, но указывает на то, что вода химически связана с веществом.
Сульфаты из сульфата меди (II) выражаются следующим уравнением: Cu SO <+5H20CuS04 * 5Н20 Кристаллогидрат сульфата меди (II) (Белый) сульфат меди (II) (Синий) При прокаливании медного купороса отделяется вода-обезвоживание: CuS04•5H20 4. CuS04 + 5H20 Кристаллический гидрат сульфата меди (II) Сульфат меди (II) (Белый) (Синий)
Кристаллические вещества, содержащие химически связанную воду, называются кристаллогидратами. Людмила Фирмаль
Вода, которая является частью кристалла, называется кристаллической водой. Многие вещества образуют кристаллогидраты. Например, FeS04•7H20-кристаллогидрат сульфата железа (II) (сульфат железа), CaS04•2H20-кристаллогидрат сульфата кальция (гипс), Na2CO3•10H20-кристаллогидрат карбоната натрия(кристаллическая сода).
При изучении процесса гидратации у ученых возникает вопрос: какие частицы, молекулы или ионы вступают в реакцию с водой? И. А. Кабульков предположил, что ионы электролита вступают в реакцию с молекулами воды, то есть происходит гидратация ионов. Это было далее полностью подтверждено. Так, например, было обнаружено, что сульфат меди безводный (II) CuSO4 не содержит цветков. Безводные Cu2 +и S04-ионы также бесцветны.
При растворении сульфата меди (II) в воде происходит гидратация ионов. При испарении такого раствора образуются кристаллы, узлы которых имеют синий гидратированный Ион меди Cu (H20) 4+ и бесцветный гидратированный сульфат-ион S04•Н202 -.Это медный купорос CuS04•5H20.
Также за счет диссоциации молекул кислот образуются не свободные ионы водорода, а их гидраты — гидроксониевые ионы: n * + Hr0-H30 + Диссоциацию молекул кислоты можно объяснить образованием дополнительного ковалента bonds. It характеризуется тем, что оба атома не дают общей пары связанных электронов, а только 1 из них.
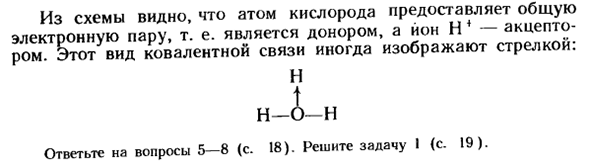
Атом, дающий общую связную электронную пару, называется донором, а атом, который ее приобретает, — акцептором, и механизм этой реакции-донор-акцептор. Образование ионов гидроксония при диссоциации молекул соляной кислоты схематично показано следующим образом:
Н Н: Б: и Н: ИЦ:+ и: о: и-•••• Или нсl + Н2О — ^ h3o ++ ки ’ Этот рисунок показывает, что атом кислорода обеспечивает общую пару электронов, то есть атом кислорода является донором, а Ион H4-акцептором. отот-это тип ковалентного соединения, обозначенный стрелкой. Н л Н Вопрос 5-8 (стр. 18).Решите задачу I (стр. 19).
Смотрите также:
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
