Оглавление:


Электролиз. Общие понятия
- Общая концепция. Электролиз это процесс Электроды под воздействием тока, Поставляется из внешнего источника. Когда происходит электролиз Преобразование электрической энергии в химическую энергию. клетка Электролиз, называемый электролизером, состоит из двух электрических Тред и электролит.
- Электрод, где происходит реакция Формирование (катод), электролизер подключен отрицательно На полюсе внешнего источника тока. электрод Происходит реакция окисления (анод), положительное соединение К противоположному полюсу источника тока. Расплавленный хлорид натрия *. Для расплава хлорида натрия Ион Na ‘^ и С1 ~.
Рассмотрим электродную реакцию на примере электролиза. Людмила Фирмаль
Замочите два грамма в расплавленной соли Установите электрод и подключите его к полюсу внешнего источника. Ток, затем направленное движение начинается с электролита Ионы и электроды продвигают следующую реакцию. а) Восстановление ионного натрия до металлического натрия ( Метод) отрицательный электрод, т.е. электрод Электроны поступают от внешнего источника тока: Ma ‘^ + e “_> Na:
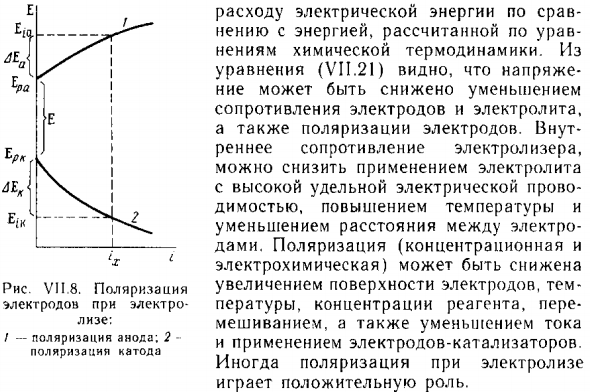
б) Окисление иона С1 в газообразный хлор (анод) Процесс) От положительного электрода Переход к внешнему контуру: реакция С1 «-е» N301- \ a + ‘/ s C b Электролиз следует закону Фарадея и уравнению ки Электродный процесс. Изменения по мере прохождения тока Электродный потенциал электролизера, т.е. Электродная поляризация. Катодной поляризацией Потенциал катода становится более отрицательным, Поляризация, анодный потенциал становится более положительным n (рисунок P.8).
- Следовательно, разность потенциалов электрода Ток £ pass; = E, a-E, k при электролизе. Разница в потенциале равновесного электрода £ = E ,, n-E ,. Напряжение на ячейке состоит из разницы баланса Потенциал Å, (ЭДДС), анодная и катодная поляризация ДЯ Омическое падение напряжения на первом и втором по проводниках Да / (G | + Gg): {V = I, + AN + / (l, + r), (V I 1.2 1) Где Δ £ ‘= + AE ^.
Следовательно, увеличение напряжения на элементе Ток увеличивается из-за поляризации и омических потерь. В расплаве в электролит вводятся хлорид кальция или хлорид калия и фтор Натрия. Рисунок V II, 8. поляризация Электрический электрод Lise; / — анодная поляризация; 2- Катодная поляризация Сравнение энергопотребления Энергия рассчитывается по уравнению.
Когда напряжение увеличивается по сравнению с EDC, * Для снижения температуры плавления и растворимости электролита Людмила Фирмаль
Научная химическая термодинамика. от Уравнение (V II.21) Это может быть уменьшено путем уменьшения Сопротивление электрода и электролита, То же, что и поляризация электрода. внутри Ранняя устойчивость клеток, Может быть уменьшен электролитом Провод с высокой удельной массой Достичь, лихорадка.
Уменьшить расстояние между электро Манекен, поляризация (концентрация и Электрохимическое) восстановление Увеличение поверхности электрода, Температура, концентрация реагента, Смешивание и уменьшение тока И использование каталитических электродов. Иногда поляризован во время электролиза Играть активную роль
Смотрите также:
| Концентрационная поляризация | Последовательность электродных процессов |
| Электрохимическая поляризация (перенапряжение) | Применение электролиза |
