Оглавление:




Электролиз
- Электролиз Суть электролиза. Электролитический процесс можно найти с помощью устройства, показанного на рисунке 119.Раствор хлорида меди (II) заливают в U-образную трубку, соединяющую устройство с источником постоянного тока.
- Металлическая медь выделяется в катоде, а хлор, обнаруженный в запахе, выделяется в аноде. Что случилось с катодом и анодом? Уже известно, что при растворении в воде соли, содержащей хлорид меди (II), происходит диссоциация. CuC12 Cu2 + + 2C1〜 При подаче постоянного тока катионы (в данном случае ионы Cu2f) перемещаются к катоду, а анионы (в данном случае ионы C1′) — к аноду.
Катод-это отрицательный электрод, в котором электроны находятся в избытке. Людмила Фирмаль
Действие постоянного тока на ионы Cu2f аналогично действию водорода на медь (II) oxide. In в этом случае атом водорода отдает электроны атому меди в состоянии окисления-F2. Ci2 * +2ё — сі Из-за отсутствия электронов в аноде анод обладает способностью втягивать электроны в себя, воздействуя на Ион, например марганцевый элемент со степенью окисления+ 7 в реакции соляной кислоты с перманганатом калия(стр. 16).
Перенос электронов ионами происходит как при взаимодействии соляной кислоты с перманганатом калия, так и при электролизе. О 2С1 — + Cl2t 2е Таким образом, электролиз является окислительно-восстановительным процессом. Рис. 119.Электролиз раствора хлорида меди (II). Электролиз-это окислительно-восстановительная реакция, протекающая на электроде при протекании постоянного тока через раствор или расплавленный электролит.
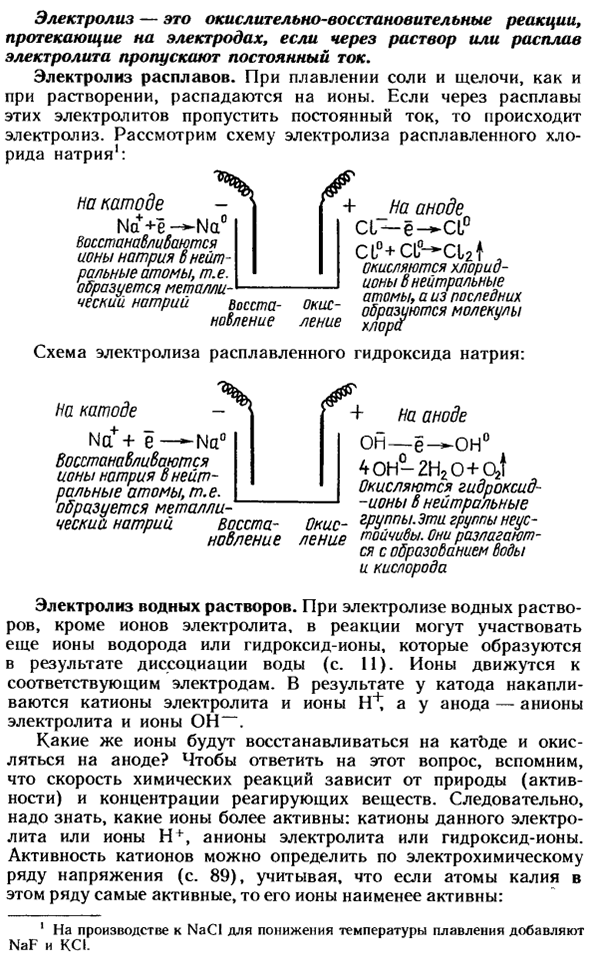
Электролиз расплава. При растворении соль и щелочь разлагаются на ионы, а также при растворении. Когда постоянный ток протекает через расплав этих электролитов, происходит электролиз. Рассмотрим электролиз расплава хлором Мне. Натрий свинцовый: На катоде Na + e-4 \ la ° ионы натрия образуют восстановленный нейтральный атом, то есть металл натрия Административный указ + Анод CL-ё-C1°ci°+ a° — cl2I.
Ион хлора окисляется, чтобы стать нейтральным атомом, и из последнего образуется молекула хлора Окисление Схема электролиза расплавленного гидроксида натрия: На катоде На4 —на°ионы натрия восстанавливаются до нейтральных атомов. Образуется металлический натрий. Восстановление На аноде, OH-e-on0 Гидроксид-ионы 40H-2H20 + 02t окисляются до нейтральных групп. Эти группы нестабильны.
Они разлагаются и образуют воду и кислород. Окисление Электролиз водного раствора. Во время электролиза водного раствора, помимо ионов электролита, в реакции могут также участвовать ионы водорода или гидроксида, которые образуются в результате диссоциации воды(стр. 11).
- Ионы движутся к соответствующему electrodes. As в результате катионы электролита и ионы H накапливаются в катоде, а анионы электролита и ионы OH накапливаются в аноде. Какие ионы восстанавливаются в разрезе, да и окисляется на аноде? Чтобы ответить на этот вопрос, вспомним, что скорость химической реакции зависит от природы (активности) и концентрации реагирующего вещества.
Поэтому необходимо знать, какие ионы более активны. Специфическим электролитом является катион, электролит H \ion или гидроксид-Ион. Активность катиона определяется электрохимической последовательностью напряжений (с. 89).Если атомы калия этого ряда наиболее активны, то их ионы считаются наименее активными.
1 в производстве добавьте NaF и KCI к NaCI, чтобы снизить температуру плавления. Людмила Фирмаль
К, Са, Na, Мг, Алюминия, Цинка, Железа, Никеля, Олова, Свинца, Ч, КР, РТ, А. Г. Пт. АС Химическая активность составляет 2 +.3 + _ 2 Я — _ 2 + 2+ _.2Т уменьшить К * р * КЛ + ка 2+ ai3 + я 2″■_2 + … 2_2+ +. П.. П+ 3Ф, Са, Na, мг, Ма, цинка, железа, никеля, олова. РЬ, Ч, КР, РТ, Серебро, Платина. АУ、
Повышенная химическая активность Эта серия показывает, что при равных условиях катионы от Cu2 +до Au3 +восстанавливаются водными катодами, а ионы H +остаются в растворе из-за их низкой активности. При электролизе солей, содержащих катионы от K +до Pb, ионы H восстанавливаются при равных условиях.
Поскольку скорость химической реакции также зависит от концентрации реагирующего вещества, то при низкой концентрации ионов водорода (в нейтральной среде) некоторые катионы металлов восстанавливаются с помощью cathode. In электрохимическое напряжение тока серии к hydrogen.
It используется для никелирования, лужения, хромирования и др. В зависимости от окислительной способности, отрицательные ионы располагаются в следующем порядке: Я», Бр〜, С2″, С1 -, о » S042″ И другие отрицательные ионы кислородсодержащих кислот Химическая активность снижается Используя эту серию, нужно помнить, что анионы бескислородных кислот более активны, чем гидроксидные ионы OH
Учитывая вышеизложенную закономерность, можно предсказать, как будет протекать электролиз водного раствора электролита в зависимости от medium. So например, водный раствор сульфата никеля имеет следующие ионы: NiS04 ^ ni2 и + — hS042 ″ H20 ^: H + — OH » в кислой среде концентрация ионов H +возрастает. Когда он становится более активным, он уменьшается, и ионы Ni2 +остаются в растворе.
Более активные гидроксидные ионы окисляются на аноде. Катоды в нл2 + н ++ е н°+и На аноде Так… \ OH-ё — » — OH1 + 02ф северный° Н20 40х В нейтральной среде ионов Н +меньше, поэтому в катоде (хотя ионы Н +более активны) концентрация ионов Ni2 +снижается. .В Oh-ионов, они окисляются на аноде. Диаграмма процесса: Восхождение-песня окисления Это хорошая вещь. Да!」 О-Е-4 0×2-2×20 + 02т Окисление На катоде Н Гнида + 2е
Восстановление Применение электролиза. Электролиз широко применяется при получении наиболее активных металлов (K, Na, Ca, Mg, A1), некоторых активных неметаллов (Cl2, F2), а также сложных веществ (NaOH, KOH, KSYu3).Электролиз используется для покрытия металлических предметов никелем, хромом, цинком, оловом, золотом и др.
В производственной среде может быть необходимо быстро предсказать, какие продукты будут образованы в конкретном электролитическом случае. Для этих целей можно использовать таблицу 63. Таблица 63.Электролитический продукт водного раствора электролита Электролитические электролитические продукты Щелочей, кислородсодержащих кислот, кислородсодержащих кислот и солей активных металлов(К. На активных солей металлов с бескислородной кислоты и бескислородные кислоты
(Калифорния, Калифорния)К. Н. Калифорния бескислородных кислот и солей инертных металлов (медь, ртуть, серебро, платина, литий), и средне-активных металлов (со, Ni, СГ, СН) кислородсодержащих кислот и малоактивных металлов (cu, HG и AG, в, р (Ас), соли и средне-активных металлов (со, Ni, СГ, Н2) Н2) и 02, потому что только галоген, галоген, и H +ионов металла и высокой концентрации, и галогенные. причем металл как 02, так и с высокой концентрацией H+, H2 также выделяется. Упражнения 4-6 (стр. 95).Решите задачу 1-3(стр. 96).
Смотрите также:
