Оглавление:




Характерные химические свойства металлов
- Характеристика химических свойств металлов Наиболее распространенным химическим свойством металла является способность атома испускать валентные электроны и становиться положительно заряженными ионами во время химической реакции.
- Металл наиболее бурно реагирует с электроотрицательными галогенами, кислородом и серой(I стр.): 0 0 + 2 1 Ca + C12 — * CaC12 Меня—меня. О> 2-2 2Mg + 02 — > 2MgO О 0 + 1-2 2Na + S — * Na2S Металл также окисляется водородом и другими ионами металлов. Например, реакция металла с водой, кислотой и растворами солей уже известна. Мне.} Ой. 2Na + 2NOH 2NaOH + H2t Zn + 2HCI ZnCl2 + H2t Пи Джей. Zn + 2H + — * Zn2f + H2t Fe + CuS04 FeS04 + Cu \ г-2И-Джей Фе + Си2 Ф Fe2 + с + + с°у \
В этих реакциях окислителем является соответствующий неметалл. Людмила Фирмаль
Из Формулы реакции видно, что окислителем являются ионы водорода и металла. Однако не все металлы обладают одинаковой способностью к reduce. So например, цинк может восстанавливать ионы водорода, но не медь(медь не заменяет водород из кислот). Железо восстанавливает ионы меди Cu2+, но медь не восстанавливает ионы железа Fe2 +(медь не замещает железо из раствора его солей). чтобы иметь возможность предсказать, при каких условиях металл участвует в каких реакциях, необходимо знать их восстановительную способность.
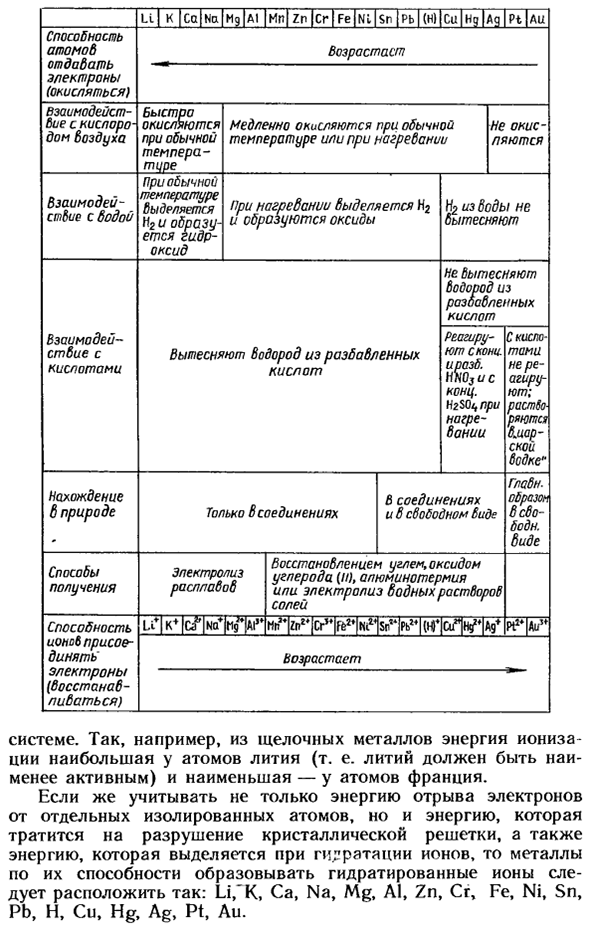
Рассматривая только энергию отделения валентных электронов от отдельных изолированных атомов, металл можно расположить в определенном порядке (I, с. Русский ученый Н. Н. устройство этого металла, впервые предложенное в 1865 году Бекетовым、 Ll / To / Ca Na Mg AI Mn Zn Cr / Fe Ni Sn Pb (H) / Ca Nd / Hell Pt / li повышается способность атомов испускать (окислять) электроны Взаимодействие с кислородом воздух будет окисляться быстро при нормальной температуре или медленно при нагревании не окисляется
Взаимодействие с водой на нормальной температуре, оно выпустит Х2 и произведет гидросодержащую окись, но нагреванный, оно выпустит Х2 и произведет окись Х2 от воды. Реакция с кислотой водород замещен из разбавленной кислоты водород не замещен из разбавленной кислоты Скопье реагирует, ирасб.
Теперь конц. H2 SOz при нагревании не вступает в реакцию с кислотами. Раст&о рстчця вмар-ской водки » Найти естественное соединение только соединение и бесплатный просмотр основного изображения бесплатно. Биде способ получения электролиза с раслабобом уменьшает электролиз водного раствора угля, монооксида углерода (n), алюмотермической или солевой кислоты ионообменная адгезионная способность (восстановление) Mn’v ’ [cr ^ VKI (iriaiWI A9f PtJ * Au » Он растет. System.
- So например, в щелочных металлах энергия ионизации максимальна у атома лития (то есть литий должен быть наименее активным) и у атома Франции. Если учесть не только энергию отделения электронов от отдельных изолированных атомов, но и энергию, затраченную на разрушение кристаллической решетки, и энергию, выделяющуюся при гидратации ионов, то металл следует располагать в соответствии с его способностью образовывать гидратированные ионы: Li, » K, Ca, Na, Mg, Zn, Cr, Ni, Sn, H, Cu, Ag, Hg, Au.
Эта серия называется электрохимической серией напряжения металла (схема 37) 1.In эта серия, литий является наиболее активным. Чтобы ответить на этот вопрос, следует отметить, что из 3 факторов, рассматриваемых при помещении металла в электрохимический ряд напряжений, только 1 из них, то есть энергия ионизации, определяется расположением металла в периодической системе.
Противоречит ли расположение этого металла в электрохимическом ряду напряжений законам периодической системы? Людмила Фирмаль
Поэтому нет никаких оснований ожидать, что положение металла в электрохимическом ряду напряжений всегда должно соответствовать положению металла в периодической системе. По величине энергии ионизации уже известно, что литий из щелочных металлов должен быть наименее активным. Однако радиус ионов лития значительно меньше радиуса ионов натрия и калия.
Поэтому электрическое поле, возникающее вблизи ионов лития, сильнее электрического поля ионов натрия и калия. По этой причине гидратация ионов лития протекает более активно по сравнению с гидратацией натрия и калия ions. As в результате процесс перехода ионов лития в раствор становится более интенсивным, что объясняет его расположение в электрохимическом ряду напряжений.
С серией электрохимических напряжений, левый металл может вытеснить правый металл из раствора соли. Используя эту серию, например, можно предсказать, что железо вытеснит медь из водного раствора ее солей. Водород также включен в электрохимическую серию напряжения тока. Это позволяет нам предсказать, какие металлы могут заменить водород из кислоты solution.
So например, железо заменяет водород из кислотного раствора, потому что оно находится на его левой стороне, но медь не заменяет водород, потому что она находится на его правой стороне. На рисунке 37 показано описание электрохимического ряда напряжений металла. Например, использование этой серии часто приводит к ошибочному представлению о том, что наиболее активные металлы (Li, Na, K, Ca) могут замещать менее активные металлы из солей в водных растворах.
Но из схемы 37 видно, что металлы(Li, Na, K, Ca) реагируют с водой в нормальных условиях. Поэтому, используя эти металлы, нельзя заменить другие металлы из водных растворов. По схеме можно определить не только условия, но и характер реакции. Например, цинк реагирует с водой только при высоких температурах, что приводит к образованию оксида цинка. Zn-f H20-iZn0 + H2t
Последовательность активности наиболее важных катионов также показана на схеме, которая позволяет прогнозировать, как протекает процесс электролиза электролита в водном растворе(с. 84). Вопрос 9-11 (стр. 95) и вопросы 4 и 5(стр. 96). 1 Название серии электрохимических напряжений описано на стр. 94.
Смотрите также:
| Электролиз | Сплавы |
| Физические свойства металлов | Коррозия металлов и ее предупреждение |
