Оглавление:






Коррозия металлов и ее предупреждение
- Коррозия металлов и их предотвращение Все знают, что железные изделия в сыром воздухе ржавые. Это приводит к некоторым Часть станка и различные инструменты будут непригодны для использования. Это каждый год приносит большие убытки национальной экономике. Процесс разрушения металла называется коррозией(лат. Корродере-разъедать).
- Коррозия-это химическое и электрохимическое разрушение металлов и их сплавов в результате воздействия на них реагентов окружающей среды. Железо и его сплавы наиболее подвержены коррозии. Суть этого процесса заключается в том, что атомы железа под воздействием кислорода, воды и ионов водорода постепенно окисляются.
Суть процесса коррозии. Людмила Фирмаль
В общем, процесс коррозии железа и его сплавов можно представить следующим образом: О Fe-Fe2 + Fe2 + — Fe3 + Обычно окислителем является кислород: I-2 * — J 0 + 2 Fe + H0H + 0-Fe (0H)2 o 0 * 2 2Fe + 2 HOH + 02 — ^ 2Fe (0H) 2 B2 0 +3 2Fe (OH) 2+ HOH + O — * 2Fe (OH)3 Р-Я. 4Fe (OH)2 + 2HOH + 02 — * 4Fe (OH)3 Поскольку оксид углерода (IV), оксид серы (IV), может содержаться в воздухе, кислоты образуются в результате взаимодействия с водой.
При диссоциации последнего образуются ионы водорода, которые также окисляют атомы металла. Я-2У О компании / about Экспериментально установлено, что металлы Fe +2Hf Fe2 f + H2t быстрее окисляются ионами водорода при их контакте с другим металлом с низкой activity. So например, если положить кусочек цинка в раствор серной кислоты, реакция сначала будет протекать бурно, а затем постепенно замедляться.
Однако если прикоснуться к кусочку цинка медной проволокой (рис. 120), реакция значительно ускорится. Возникает вопрос, почему реакция цинка и серной кислоты постепенно замедляется, а при соприкосновении с ней меди ускоряется. Рисунок 120.Рисунок 12 121 при контакте с copper. It ускоряется взаимным хошакте серной кислоты и zinc. In в присутствии электролитов один из металлов заряжен отрицательно, а другой положительно.
В реакции с кислотами, атомы цинка окислены ионами водопода для того чтобы стать ионами цинка, которые после этого двигают к solution. As в результате в кристалле цинка накапливаются избыточные электроны lattice. As они накапливаются, дальнейший переход ионов Zrr +в растворы затрудняется, так как они все больше задерживаются за счет избытка электронов в кристаллической решетке.
Процесс взаимодействия цинка и серной кислоты замедляется. Медь электрохимической серии напряжения металла находится за водородом и не вступает в реакцию с разбавленной серной кислотой(медь не посылает катионы в раствор). В кристаллической решетке меди (в отличие от цинка), свободные электроны не накапливаются.
Когда эти 2 металла вступают в контакт, свободные электроны цинка перемещаются к меди, восстанавливая окружающие ионы водорода. 2Н + + H2t Когда избыток электронов устраняется, цинк снова энергетически посылает катионы в раствор. Вновь возникшие избыточные электроны движутся в сторону меди и тому подобного. Вот почему цинк реагирует быстрее, когда он вступает в контакт с медью.
Рассматриваемое явление — это не только цинк и медь, но и свойства любых 2-х различных металлов. При контакте друг с другом в присутствии электролитов один из металлов (расположенный в левом электрохимическом ряду напряжений) заряжен отрицательно, а другой положительно. Если эти металлы соединены с проводником через гальванометр, то последний указывает на наличие тока(гальванические элементы).
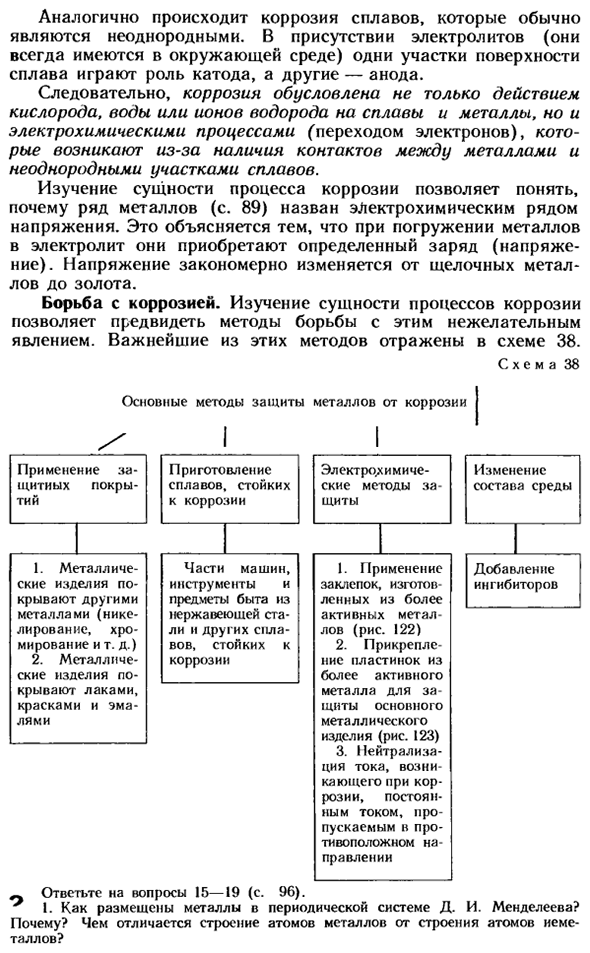
Более активный металл быстро разрушается(рис. 121). Аналогично, коррозия обычно возникает в гетерогенных alloys. In наличие электролитов (они всегда присутствуют в окружающей среде), часть поверхности сплава играет роль катода, а другая часть-в роли анода. Так, коррозия вызывается не только действием ионов кислорода, воды или водорода на сплавы, металлы, но и электрохимическими процессами (электронными переходами), которые возникают вследствие наличия контакта между металлом и неравномерными участками сплава.
- Изучая сущность процесса коррозии, ряд металлов (стр. 89) может понять, почему его называют электрохимическим рядом напряжений. Это объясняется тем, что при погружении металла в электролит он приобретает определенный заряд(напряжение).Напряжение тока естественно меняет от щелочного металла к золоту. Борьба с коррозией. Изучая сущность процесса коррозии, можно спрогнозировать, как справиться с этим нежелательным явлением.
Наиболее значимый из этих методов отражен на схеме 38. Рисунок 38 Основные способы защиты металла от коррозии Вопрос 15-19 (стр. 96) просьба ответить. И. Д. И. Как расположен металл в периодической системе Менделеева? Почему? В чем разница между структурой атома металла и структурой атома неметалла? Ч ИК // Дж Cu Рисунок 122.
Склеивание металлических деталей с использованием более активных металлических заклепок. Рисунок 123 Людмила Фирмаль
Пластины из более активного металла (цинка) крепятся к устройству, защищенному от коррозии. 2.В чем заключается суть склеивания металлов? 3.В чем отличие кристаллической решетки металлов по структуре и свойствам: а)от ионов, Б) от атомов? 4.Какие формы металлов встречаются в природе, такие как калий, магний, хром и цинк?
Напишите химические формулы этих соединений и используйте формулы соответствующих реакций, чтобы показать, как эти металлы получаются в свободной форме. 5.Объясните, как происходит электролиз раствора вещества. Его формула: b)H2S04; c) K NO ;; G) NaOH. 6-бром получается: а) действует на раствор бромида калия с хлорированной водой. б)применять раствор бромида калия для электролиза.
Что общего в сущности этих процессов? 7.Каковы общие физические свойства металлов? Эти характеристики должны быть объяснены на основе представлений о металлических соединениях. 8.Почему пластичные металлы (такие как медь) и другие металлы (такие как сурьма) так хрупки? 9.Основываясь на учении о строении атома, мы опишем, как отличаются металлы от неметаллов и по своим химическим свойствам.
10.Какие металлы более химически активны: литий или натрий? Можем ли мы объяснить, что литий обычно находится на левой стороне натрия в электрохимической серии металлических напряжений? I. нарисуйте таблицу в блокноте, запишите в соответствующую графу уравнения реакций, которые реально осуществимы, и укажите условия их возникновения(см. схему 37).
12.Опишите суть процесса формирования сплава. Почему сплав обычно тверже, чем исходный металл? Реакционноспособные вещества, уравнение практической реакции с металлами. На СА ЗН Си o2 H2O Pb (L03) 2, раствор HCI HsS04 13.Почему сплав железа широко используется в технологии, а не чистое железо? Какие сплавы железа используются в производстве и повседневной жизни?
14.Опишите свойства и области применения известных цветных сплавов. 15.Сплав железа помещали в воду, содержащую следующие ингредиенты: б) кислород и окись углерода (IV). в каких случаях коррозия сплава протекает более активно? Напишите уравнение соответствующей реакции. 16.Кусок железа в растворе соляной кислоты трогают цинковой проволокой. Влияет ли это на скорость и характер химической реакции?
17.Из курса физики знаю понятия «разность потенциалов», «напряжение».Серия металлов, представленная на схеме 37, объясняет, почему она называется электрохимической серией напряжения. 18. T / >пытается исправить железные детали. Какую заклепку следует использовать-медную или цинковую для предотвращения коррозии деталей, и почему?
19.Почему отдельные механические детали быстрее ржавеют вблизи промышленных объектов? * I. при электролизе раствора хлорида меди (II) масса катода увеличивается на 8.I. С точки зрения массы и объема (ионов), какие газы и в каком количестве были выпущены? При электролизе раствора нитрата серебра (I) выделялось 2.5.6 литра газа. Сколько граммов металла было нанесено на катод?
3.При электролизе раствора хлорида калия образовалось 112 кг гидроксида калия. Выделившийся газ и его количество (н.) 4. Мы поместили 4,8 г порошка железа в раствор, содержащий 16 г медного купороса (II).Какие вещества и сколько их было после реакции? 5.Железный лист массой 5 г долго выдерживали в растворе, содержащем 1,6 г медного купороса (II).
Затем пластины вынимали из раствора, сушили и взвешивали. Какова его масса? 6. Оксиды Pb, PB (II) и олова (IV) были восстановлены с получением 0,34 массовой доли (34%), Sn и 0,66 массовой доли, или 66% 500 г припоя. Если металлы, содержащиеся в них, были полностью восстановлены, сколько из этих оксидов было необходимо?
Лабораторные опыты Взаимодействие металлов с солями. В 1 пробирку наливают 2-3 мл раствора нитрата серебра, 2-й 2-3 мл раствора меди (II) серной кислоты, 3-й такое же количество свинца (II) nitrate. In в первую пробирку мы кладем тонкую медную проволоку, 2-ю железную стружку, 3-ю медную стружку. После 5-10 миссий в первой пробирке медная проволока покрывается слоем серебра, во второй-железная стружка покрывается красным налетом, в третьей-кристаллы покрываются голубоватым металлическим блеском.
Задача. Какие вещества образуются в каждой пробирке? Какие закономерности проявляются в этих процессах? Опишите уравнения соответствующей реакции в виде молекул, ионов и сокращенных ионов. Ускорение химических реакций, когда 2 различных металла вступают в контакт. I. налейте 2-3 мл разбавленной серной кислоты в пробирку и положите в нее кусочек цинка, который ранее не был обработан acid.
At во-первых, реакция протекает очень активно. Тогда скорость реакции будет постепенно замедляться. 2.Прикоснитесь к кусочку цинка медной проволокой, как показано на рисунке 120.Реакция снова ускорится. Задача. Почему водород выделяется так рано, когда серная кислота касается цинка в растворе, расплавленном медной проволокой? Какие выводы можно сделать из этого опыта по защите металла от коррозии?
Смотрите также:
| Характерные химические свойства металлов | Положение щелочных металлов в периодической системе и строение их атомов |
| Сплавы | Нахождение щелочных металлов в природе, их получение, свойства и применение |
