Оглавление:


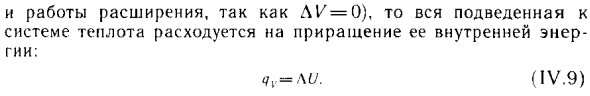

Энтальпия системы
- Система энтальпии. Для химического взаимодействия Наиболее типичная работа расширения обычно Отдельно от общей цены: (P = c1) L1), (I V. 3) Здесь все виды работ, кроме расширения рабочих мест. р-ех Ее давление; DK-система изменения объема, равна разнице V2-V \ (k’g — количество продукта реакции, V¡ — начальное количество. Вещи).
- Когда работа расширяется в процессе Рений — единственный вид уравнения работы (1U.Z) Принять форму Далее математическое выражение первого закона термодинамики Мики (IV .2) записывается следующим образом. q „= \ U + p. \ V. (IV.5) Учитывая тот факт, что Λ = U 2- и / W = V 2-V \, уравнение (IV .5) можно преобразовать путем группировки величин O и V.
Где qp — тепло, подводимое к системе при постоянном давлении Забытый лаз. Людмила Фирмаль
Индекс, связанный с конечным состоянием и начальным состоянием система: q, = (U2-U>) — \ — p (V2-V ^) = iU2 + pV,] — {U, + pVil (IV.6) Общая {U- {~ pV) называется энтальпией системы, С письмом: II = U + PV. (IV.7) Подстановка энтальпии // в уравнение (IV .6) дает следующее: л //. (IV.8) t — тепло, подводимое к системе при постоянном давлении, * Потратил на увеличение энтальпии системы. Аналогично внутренней энергии, абсолютное значение Энтальпия системы не может быть определена экспериментально.
Изменение энтальпии стало возможным благодаря измерению qp \ H tipn Системный переход из одного состояния в другое. Значение AI Если энтальпия системы увеличивается, она считается положительной (AI> 0) Это тает. Потому что значение AN определяется разностью (// 2— // i) И Ipoucca, независимо от того, как и как выполнять энтальпию, Как и внутренняя энергия, они называются термодинамическими функциями.
- Состояние системы. Термодинамическая функция состояния характеризует тепло Динамические свойства вещества. Вместе с внутренней Его энергия U и энтальпия N включают энтропию 5, энергию Гельмгольц F и энергия Гиббса О. Значение этих функций Связанный со структурой и функциями внутренней структуры Состояние и внешние условия: давление, температура, Концентрация растворенных веществ.
Функции состояния имеют широкий спектр свойств: Маска зависит от количества материала. AU, AI, AS, A F и AG обычно назначаются на 1 моль вещества, Выражается в кДж / моль **, а объем V равен Дозировка по pV (см. Уравнение (IV .7)) — молярный объем газа Разные вещества. Процесс 1 / = const и система не будет работать.
Когда в автоклаве происходит химическая реакция (изобъем) Людмила Фирмаль
Это утверждение относится к следующим процессам: Только расширенная работа | см, уравнение (1U.5) | ** L5 измеряется в Dw / (моль-К). И ΛK = 0), поэтому работа расширения и целого суммируется Система потребляет тепло для увеличения внутренней энергии Geek: (1U.9
Смотрите также:
| Теплота и работа | Тепловые эффекты химических реакций |
| Первый закон термодинамики | Термохимические законы |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.
