Оглавление:




Энтропия
- Охарактеризовать состояние постоянной энтропии Вещества, которые представляют собой большое количество агрегатов Может указывать на медленную молекулу, температуру, давление и т. Д. Термодинамические параметры состояния системы, или Мгновенные координаты (; c, y „r,) и скорость каждой молекулы.
- Двигаться во всех трех направлениях (r> ,,, ^ сначала Случай характеризуется макро-состоянием системы. ВТО Ром — микро-государство. Каждое макро состояние * «Химическое сродство» как стремление вещества к взаимодействию минимум Алхимия и донк’дгний подсвечивают 1 до последнего дня. Общее количество микросостояний.
Количество микросостояний для использования. Людмила Фирмаль
Это называется тер, что это макросостояние реализовано Состояние системы и заданная динамика Yutto Термодинамическая вероятность состояния системы. Всего 10 молекул газа, около 1000, В 1 см3 газа содержится 2,7 Ю молекул (н.д.). Перейти к Полезно для чтения и расчета термодинамических значений Микрофон не использует значение, но использует логарифм 1pi7.
Последний Можно дать размерность (D w / K) и умножить на постоянную Больцману: (IV .14) 5 называется системной энтропией. Термодинамическая функция энтропийного состояния Стебель и его размер зависят от количества Вещество. Следовательно, значение энтропии 1 моль вещества [D w / (моль-K)] и /? 1pG-5, (IV .15) Где R ■ = кН ^ — молярная газовая постоянная.
M a-константа Авогадро. Из уравнения (IV .15) видно, что энтропия системы увеличилась Пропорционально логарифму термодинамики Государственная ясность Это соотношение является основой современности Статистическая термодинамика. Вообразите 1 моль воды (18 gH ^ O) в комнате Температура и атмосферное давление. (X) это термодия Динамическая вероятность состояния этой системы.
При опускании Вода замерзает при температуре до 0 ° С и превращается в лед. в В этом случае молекула Н2О остается закрепленной на кристаллическом узле. Решетка состояния системы и термодинамическая вероятность Уменьшение: 1 ^ (k) <и ^ (x). Поэтому Энтро падает Система прямых иностранных инвестиций: наоборот, более быстрыми темпами Вода до 100 ° C будет кипеть и превращаться в пар.
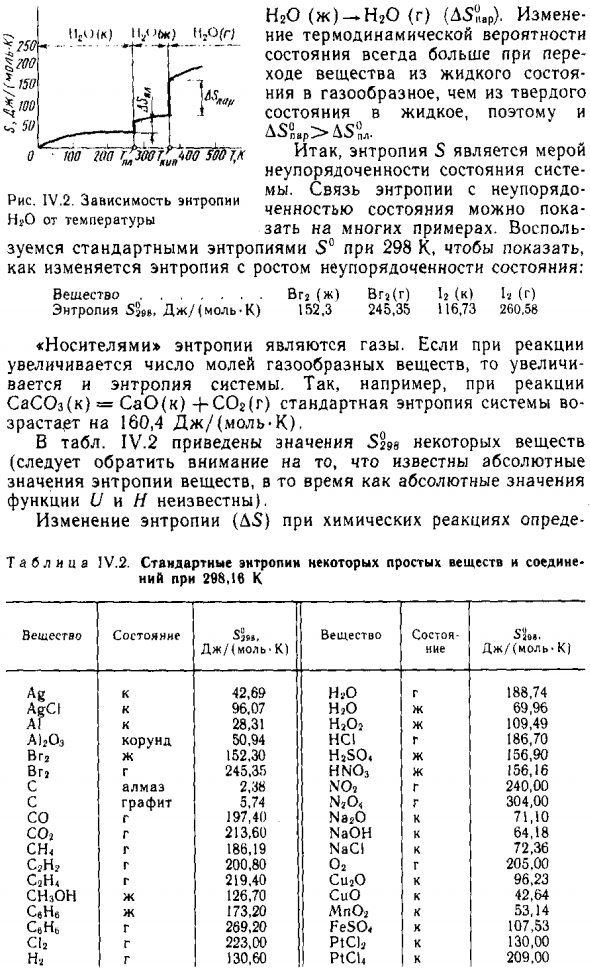
- Увеличивает термодинамическую вероятность состояния системы (Пара молекул H 2 O быстрее, чем жидкость Вода) ^^ (R)> u ^ (x). Следовательно, энтропия также велика. система 5c.O (r)> 5n :. () (; y-so p = const [энтропия Функция температуры Т и температуры замерзания Точка кипения воды — энтропия 0С0bin изменений} 10 Внезапно дергается.
Сначала в направлении темпов роста температуры T от p до 101 кПа Энтропийный скачок соответствует температуре плавления Лед (0 ° С) — Изменения энтропии при переходе -Н2 0 (к) -Н2 0 (ж) (L5?, L). Второй скачок энтропии соответствует температуре тюка Вода (100 ° С); L5z7:! 16-энтропийное изменение при переходе | L7 (7 V; 50 1 гО (к) ¿ .1’яа // О ■ ЮО ‘тТ ^ (Ю7 ^ иМ〜500 7 / Рисунок IV.2.
На рисунке IV.2 показана зависимость энтропии H 2 O. Людмила Фирмаль
Энтропия зависит Температура NgO HgO (г) -Н20 (г) (D5 & delta; Ar). измена Термодинамическая вероятность В случае транс, государство всегда будет расти Выход веществ из жидкого состояния Из Нью-Йорка в газ, из твердого Следовательно, жидкое состояние Энтропия 5 — это шкала Сбой системы Мы есть Связь между энтропией и беспорядком Значение условия Много примеров.
Доброжелательно Используя стандартную энтропию 5 ° при 298 К, Как изменяется энтропия с ростом нарушений состояния? Кроме того, Vg? (G) гИр) b (k) 1 ^ (r) Энтропия 5абв. D j / (м прибл. L-K) 152,3 245,35 116,73 260,58 «Носителем» энтропии является газ. реакция Количество молей газообразных веществ увеличивается, а затем увеличивается Системная энтропия также отображается.
Так, например, в реакции Стандартная энтропия системы CaCO s (k) = C a O (k) -b C O g (g) Он растет при 160,4 D w / (моль-К). В таблице. Значение IV .2 5298 дано для конкретного вещества (Никогда не нужно быть осторожным Энтропийная ценность вещества, абсолютная величина Функции и т и неизвестны), Определены изменения энтропии (L5) химических реакций.
Таблица 1U.2, Стандартные энтропии для некоторых простых веществ и соединений 298,16 К Материальное состояние CO Дж / (моль ■ К) Сделано из материала Дж / Беспорядочный S¿ –5i, S 2 — сумма всех энтропий [Продукт реакции, а является суммой всех начальных энтропий вещество
Смотрите также:
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.
