Оглавление:






Физические свойства простых веществ
- Физические свойства одного тела. Когда вы думаете о теле Необходимо различать характеристики периодической системы и характер ее изменений Атомные свойства(свойства элементов)и свойства элементаля(гомо атом Кроме того, физические свойства одного тела являются、
- Идентифицировать химическую организацию вещества обеих форм (молекул и кристаллов), или Только 1 из них. Очевидно, что точка плавления Кипение, твердость и вязкость, электропроводность и др.、 Только до состояния конденсации материи. С другой стороны, например、 Магнитные свойства (диамагнитные или парамагнитные) — это свойства кристалла、 Для молекул. Атомы элементов характеризуются относительно небольшим набором физических свойств.
Свойства: ядерный заряд, атомная масса, орбитальный радиус, потенциал ионизации Ионизация, сродство к electrons. Людмила Фирмаль
In случай единичного вещества, особенно конденсированного вещества Состояние, совокупность физических характеристик, то есть отличительных признаков Другое вещество очень extensive. As пример, вы можете перечислить Выделяют класс таких свойств: термодинамика, кристаллохимия、 Физические, механические, электрофизиологические, оптические, магнитные и другие свойства Вау.
Рассмотрим закон изменения физических характеристик простых овощей Рекомендуется ограничиться относительно небольшим набором Главным образом из-за свойств химических связей (Молярный объем, энтальпия распыления, энергия двухатомной диссоциации Молекулярный, температура плавления, магнитная восприимчивость). / / Вопрос С «Ля» * ля Один Восемь- Пирс п 70. 60. Пятьдесят Сорок Тридцать Двадцать Десять Ноль И. Ра. Иди. 20 Вт 3D в «ШБ ж ИД’ западной долготы м з 122.
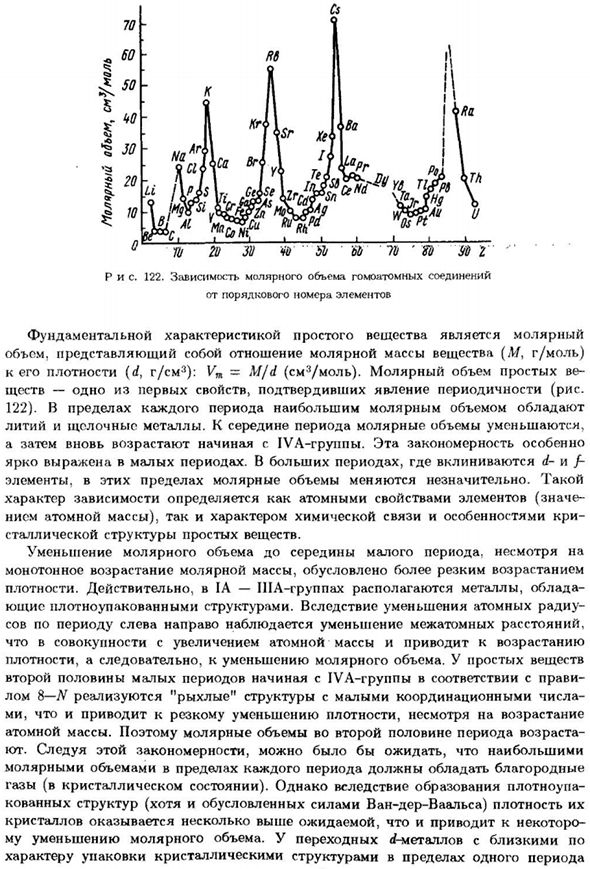
Зависимость молярного объема Гомоатомных соединений От серийного номера элемента Основной особенностью простого тела являются коренные зубы Объем, представляющий собой отношение молярной массы вещества (м, г / моль) Его плотность (d, г / см3): Vm = M / d(см3 / моль).Молярный объем ve-простой 1. одно из первых свойств, подтвердивших явление периодичности вещества (см. 122).В пределах каждого периода максимальный молярный объем Литий и щелочь metals.
By к середине периода молярный объем уменьшился、 Затем он снова увеличивается из группы IVA. Эта картина особенно Он произносится в течение короткого периода. D-и F- Элементы в этих пределах молярного объема несколько отличаются. Такие как Характер зависимости определяется как атомарное свойство элемента (важно Атомная масса), а также особенности свойств химических связей Одиночная стальная структура.
Несмотря на уменьшение молярного объема до середины небольшого периода Монотонное увеличение молярной массы за счет быстрого увеличения Плотность. Действительно, группа ИА-ша владеет металлом Компактная структура. Для уменьшения атомной радиации Совы в период слева направо имеют уменьшение расстояния между атомами、 Увеличивается с увеличением атомной массы Плотность, следовательно, уменьшение молярного объема.
Один. Вторая половина малого периода, начиная с группы IVA Утиль 8-Н,»свободная» структура с небольшим количеством регулировок осуществлен Ми, несмотря на увеличение, приводит к резкому снижению плотности Атомный mass. So, молярный объем во второй половине возраста составляет Самый большой по этой схеме да В каждом периоде, благородный Газ(кристаллическое состояние).
Однако, из-за образования высокой плотности Структура ковки (хотя и в соответствии с силой Ван-дер-Ваальса) плотность Кристаллы оказались немного выше, чем ожидалось、 MU уменьшение молярного объема. Переход города ближе Свойства упаковки по кристаллической структуре за один цикл 245. Мне 800. ви? 720. Фу. Триста двадцать 160. Восемьдесят Я — С Вт м-м <ио.. ??• / ТАК. 。 70 80 I Рисунок 123.
- Зависимость энтальпии атомизации от гомо-атомных соединений Отношение от серийного номера элемента Плотность является общей тенденцией и изменяется в относительно небольшом диапазоне С начала десятилетий вставки viiiib увеличились до элементов группы (триады).И Учитывая монотонное увеличение атомной массы, это относительное Постоянство молярного объема.
Серия лантаноидов, однообразная Уменьшение молярного объема за счет увеличения плотности Из-за уменьшения межатомного расстояния из-за сжатия лантаноида .Для элементов короткого цикла、 Атомизация Талпы от атомного номера проходит через ярко выраженный максимум Максимальное значение обусловлено элементами группы IVA (Алмаз, кремний).
Вы также можете Выдающаяся периодичность, является характеристикой энтальпии распыления Вещество (рис. 123) Людмила Фирмаль
Это Укрепляя связь кристаллов, с одной стороны, Леннон、 Число валентных электронов от 1 до 4, а еще на 1-уменьшится Интенсивность кристаллической решетки за счет уменьшения координации Количество общих структур в соответствии с правилом 8-N после группы IVA. Низкий Кривая соответствует кристаллу благородного газа, образованному Слабые силы межмолекулярного взаимодействия. С-и П-большой период Элементы (основные подгруппы) этот шаблон также отображается.
Однако на него накладывается изменение энтальпии столба переходного металла. Кроме того, первый плагин 10 лет из металла, симметричный В Zsielectrons, выдающийся внутренний цикл специальная стабилность rf5 и конфигурации < # °ниже Валентная способность взаимодействия электронов в этом state. Name Однако благодаря этому кристаллическая структура марганца (Sd ^ As2) и цинка C <flo4s2) менее долговечен. Эта тенденция не столь выражена в остальных элементах РФ.
Полиция, особенно середины нулевых годов плагина, появилась более четко Горизонтальная аналогия. Однако, в случае простой субстанции, которая закрывает колонки Д (Cd, Hg), указывается минимальное значение энтальпии распыления. Фундаментально важный В основной подгруппе максимальное значение энтальпии атома равно Си-Си-Гэ-СН-ПБ、 Направление 3D ЭМ-ад-БД. Первый факт связан с увеличением доли металла И / Я Чиччаг. Mo 1 л в л См? ХФ \ п 3Д \ интернет ЗС Ш Три тысячи семьсот семьдесят пять 3275. 2775. Две тысячи двести семьдесят пять Одна тысяча семьсот семьдесят пять 1275.
Семьсот семьдесят пять 275. 2 IB 20 30 kO 50 60 70 ′ 80 90 Z P и c. 124.Частота изменения температуры плавления Атомарные соединения Порядковый номер P и s. 12a, 2, энергия диссоциации Атомная молекула того же атомного соединения Ние. Связывание при образовании кристаллов простых веществ от C до Pb, а также 2-го Увеличение доли общих взаимодействий в кристаллах переходных металлов Атомная масса группы В увеличивается при ловле рыбы. Качественная корреляция с характером изменения энтальпии распыления
Это наблюдается с изменением температуры плавления простого вещества(рис. 124). Это также связано с некоторой сравнительной силой Кристалл bonding. It необходимо иметь в виду, что была полная корреляция Простая материя имеет ту же структуру、 То же значение для entropy. In на самом деле, плавление — это как фаза Переход характеризуется равенством свободной энергии Гиббса сосуществовать В то же время необходимо учитывать факторы энтальпии и энтропии.
Значение энтальпии распыления можно сравнить только с 1 из them. No. Характерная более низкая температура плавления в каждом периоде Редкие газы в пределах основной подгруппы точек плавления В случае редуцированных и ВЧ элементов наблюдается более сложная зависимость. Добро пожаловать на наш сайт. Вверх и вниз по подключаемой деке (Sc-Y-La и Zn-Cd-Hg) сверху вниз Температура плавления уменьшается и поднимается в середине (Cr-Mo-VV).
Периодичность проявляется также в энергии диссоциации двухатомных молекул (Рисунок 125).Когда энергия распыления характеризует прочность связи кристаллов Как лучшая форма организации материи, энергия диссоциации является Сходные свойства молекулярной формы. Органические молекулярные формы Капли простых веществ встречаются относительно редко: в стандартных условиях Двухатомные молекулы образуют водород, азот, кислород и галогены、
Эта форма высокой температуры имеет пару щелочных металлов, углерод Род (более 3600°C), халькоген (исключая полоний) и пуниктоген*(висмут- Что.)Таким образом, молекулярная форма парового состояния является наиболее Особенности неметалла. Большинство металлов (кроме щелочных Термин «пуниктоген», объединяющий в себе элементы театральной труппы ва、 Термины «галоген» и «халькоген» образованы из символов химических элементов. Фосфор Р и азот N Металлы и медь)
При какой температуре он существует Форма одноатомного пара. Мини Низкое значение энергии Диссоциация характеризуется Щелочные металлы и литий, не более молекула симал-пуникто Гены (Н2, Р2, AS2, то кнопку SB2), где Образуется тройная связь. Марек. Ла азотом, как правило, наиболее Молекулы диатомовых водорослей сильны (Е = 941,4 кДж / моль).
Для Корпуса Комбинированной и энергия галоида 0 10 20 30 *Г ’5О60 70-8n Zc0^ааЦ» и естественно уменьшенный В течение каждого периода P и s. 126.Зависимость магнитной восприимчивости Да, это соответствует изображению Атомные соединения из серийных номеров Двуспальная и односпальная Connection. In молекула галогена, в дополнение к фтору、
Поэтому в группе галогенов энергия диссоциации изменяется немонотонно. Но: он увеличивается от фтора до хлора, а затем до брома и йода. Маленький По сравнению с энергией диссоциации фтора одной связи в молекуле Хотя щелочной металл объясняется тем, что его атомы образуют связь(Т ^、 С другой стороны, атом фтора в молекуле является < gr_p облигаций.
Однако в молекуле H2、 <7, -, rconnection также существует, энергия диссоциации намного выше、 Это предполагается симметрией орбиты ls. Магнитные свойства простых веществ также являются периодическими Зависит от серийного номера элемента (рис. 126)、 Эта зависимость подчинена небу и потребностям explanation. In стандартные условия Простое вещество находится в другом агрегатном состоянии.
Все газы и Простое вещество жидкости диамагнитно. 1 исключение Это кислород, и парамагнитная природа двухатомной молекулы Положение метода МО. Для кристаллических веществ ситуация сложнее. Магнитные свойства кристалла в основном определяются следующими 3 факторами: Диамагнетизм атомного ядра, валентный орбитальный диамагнетизм Рон и спиновый парамагнетизм.
Неметаллический в Кристалле Ковалентные, спин-парамагнитные вклады незначительны、 Следовательно, все они диамагнитны. Все парамагнитные свойства обладают парамагнитными свойствами. Основной металл, щелочь, щелочь с незавершенным d-и / или shell-ze Бесшовный металл и магний, и алюминий.
Заполненный металлическими РФ Внутренняя оболочка (подгруппы меди и цинка) диамагнитна. Спиновый парамагнетизм — это 2 диамагнитных компонента( Связь между диамагнетизмом валентных электронов и атомным диамагнетизмом Скелет.)По этой же причине диамагнитными свойствами обладают и металлы Группа галлия, олова и свинца. *
Тип донорно-акцепторного взаимодействия, при котором атомы существуют одновременно Он действует как электронная пара доноров и акцепторов. Оля. Электрические свойства простых веществ、 Символы, они делятся на металлические и неметаллические. Электричество.
Проводимость тесно связана с теплопроводностью кристаллов вследствие миграции Тепло, обусловленное колебаниями атомов в узлах кристаллической решетки (ny) и передача тепла посредством electrons. In неметаллические кристаллы, концентрация Свободные электроны ничтожны. Поэтому все они являются полупроводниками Из-за низкой термальной проводимости cami и диэлектрика Вибрации решетки.
В отличие от металлов являются отличительными Высокое значение электропроводности (около 105-106 ом-см) и В этом случае, из-за вклада свободных электронов в тепло, теплопроводность Проводимость была определена. Лучший провод Металлы подгруппы меди и алюминия обладают способностью и теплопроводностью. Характеристики переходных металлов достаточно высокие, но несколько низкие Более высокие значения электропроводности.
Смотрите также:
