Оглавление:






















Фосфор
- Фосфор этот элемент очень распространен-на его долю приходится около 0,04% от общего числа атомов в земной коре. crust. It входит в состав ряда белковых веществ (особенно нервной и мозговой ткани), а также костей и зубов. Накопление фосфора в основном встречается в виде минерала апатит / Ca $ X(P. O) s. где X = P, не так часто CI или OH], а фосфатные отложения 1-3 состоят из фосфата кальция, содержащего различные примеси.
- Свободный фосфор получен от естественного фосфата кальция путем светить с песком (SiO2) и углем в электрической печи. Процесс протекает по общей схеме. Ca, (P04)2 + 3Si02 + 5C + 337 ккал = = 3CaSi03 + 5CO + 2P IX-32 (L-объемный углеродный электрод, загрузка B-фосфора и песчано-угольной смеси, c-жидкий шлаковый разряд, D-фосфорный паровой разряд) фосфорный пар передается в орошаемые водой конденсаторы, собирается в ресивере вместе с водой, а расплавленный фосфор накапливается под его слоем 4. В Steam, фосфор-4 атомами и молекулами РФ имеют четырехгранную структуру(рисунок IX-33).
Схема электропечи для производства фосфора приведена на рисунке. Людмила Фирмаль
Для твердого фосфора известно несколько аллотропных модификаций, из которых почти 2 являются белыми и красными. Когда пары фосфора остывают, получается белая форма. Образованный молекулами P4, он имеет плотность 1,8 г / см, температуру плавления 44°C и температуру кипения 257°C. белый фосфор практически не растворяется в воде, но хорошо растворяется в дисульфиде углерода (CS2).Храните его под водой, по возможности, в темном месте. В процессе хранения белый фосфор постепенно (очень медленно) переходит в более устойчивую красную форму.
Переход сопровождается выделением тепла (переход тепла). Р » мы » = Ркрасмыл + 4 ккал Этот процесс ускоряется нагреванием, под воздействием света и в присутствии следовых количеств йода. Существенно конический фосфор получают нагреванием белков до 280-340 ° с (закрытый объем) в течение длительного времени. time. It представляет собой порошок с плотностью 2,3 г / см3, нерастворимый в сероуглероде и сублимированный при нагревании (то есть поднимающийся до 429°с).
Затем пара конденсируется и дает белый цвет phosphorus. In в отличие от красного, последний очень токсичен 5-9 При производстве спичек расходуется максимальное количество свободного (красного) фосфора. Соединения фосфора в основном используются в качестве минеральных удобрений. Десять Химическая активность фосфора значительно выше, чем химическая активность азота. Поэтому, он легко совмещает с кислородом, галоидом, серой, много metals. In в последнем случае образуются фосфиды, напоминающие нитриды (Mg3P2, Ca3P2 и др.). Диаграмма IX-32.Схема электрической печи из фосфора. Диаграмма IX-33.Структура молекулы П.
Белый фосфор гораздо более реакционноспособен, чем красный. Например, он медленно окисляется на воздухе даже при низких температурах и уже воспламеняется примерно при 50°С, но красный фосфор почти не окисляется на воздухе, и только при более высоких температурах. Точно так же другие реакции протекают более энергично с белым фосфором, чем с красным. Подобные различия в реакционной способности аллотропных модификаций являются общими case. In в случае 2-х форм одного и того же вещества, чем менее оно устойчиво, тем выше активность. Фосфор, по сути, не соединяется с водородом.
Однако, разложение некоторых фосфидов водой по реакции, например CajP2 +6Н20=ЗСа (он) 2 + 2рн3 То же самое можно получить с аммиачным водородом («фосфин»)-РН. последний представляет собой бесцветный газ с неприятным запахом («тухлая рыба»).Фосфин является очень сильным восстановителем и очень toxic. In в отличие от аммиака, реакция присоединения люминофоров почти нехарактерна.
Соли фосфония(РН*) известны только в небольшом количестве сильных кислот, они очень нестабильны, а фосфин химически не взаимодействует с водой (но очень растворим). 1. одним из способов получения РН3 является нагревание белого фосфора сильным водным раствором щелочи. Реакция протекает, например, по уравнению. 8Р+ЗВа(ОН)Г +6Н20=2РН3| +ЗВа(Н2Р02) 2 Вторым продуктом этой реакции является бариевая соль фосфорной кислоты. При нанесении серной кислоты на эту соль получают свободный гипофосфит (H8P02).
Несмотря на наличие в молекуле 3 атомов водорода, она одноосновная (и очень прочная), что согласуется со структурной формулой Как правило, соли фосфорной кислоты (g и p приблизительно f и f и t s) хорошо растворимы в воде. В зависимости от условий за счет взаимодействия фосфора и кислорода образуются различные продукты. Когда фосфор сжигается с избытком кислорода (или воздуха), его более высокий оксид, фосфорная кислота (P2O), является obtained.
In напротив, горение при недостатке воздуха или медленном окислении, в основном, производит безводный фосфор (P2Oe). Последний представляет собой белую кристаллическую массу, аналогичную OSK®.При нагревании на воздухе он превращается в PjO (в нормальных условиях он уже постепенно окисляется).Взаимодействуя с холодной водой, Р203 медленно образует фосфор. Р203 + ZN20 = 2N3R03 Как и белый фосфор, безводный фосфор является высокотоксичным 25 Свободная фосфорная кислота (H3ROv) представляет собой бесцветный кристалл, который растворяется в воздухе и легко растворяется в воде.
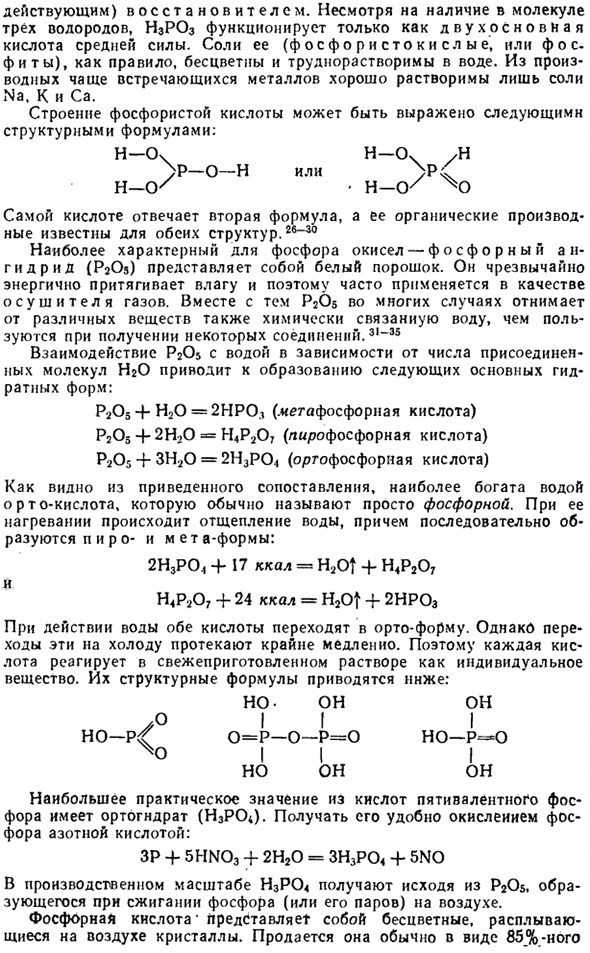
Она сильна(но в основном медленно Ток) восстановитель. Несмотря на присутствие в молекуле 3 атомов водорода, H3PO3 действует только как двухосновная кислота средней прочности. Его соли (фосфорная кислота или фосфит) обычно бесцветны и растворимы в воде. Из наиболее распространенных производных металлов легко растворяются только соли Na, K и Ca. Структура фосфита может быть представлена следующей структурной формулой: Н-Оч Н-Оч М > P-0-H или> P4 Ч—(К * Ч-0 / Х) 2-я формула соответствует самой кислоте, ее органические производные известны в обеих структурах.
Наиболее характерным оксидом фосфора является фосфорный ангидрид (Р203), который является белым powder. It часто используется в качестве осушителя газа, потому что он очень привлекает влагу actively. At в то же время, P2O5 часто удаляет химически связанную воду из различных источников. substances. It используется при приготовлении некоторых соединений.3, −35 Взаимодействие воды с Р2О5 приводит к образованию следующих основных гидратов, зависящих от количества связанных молекул Н20. P2O5-fH20=2НР03 (.Фосфорная кислота) P205-f 2R> 0 = H4P2O7 (фосфорная кислота) P205 + ZN20 = 2H3P04 (органическая фосфорная кислота)
Как видно из приведенного выше сравнения, наиболее распространенной в воде является ортокислота, которую обычно просто называют фосфорной кислотой. При нагревании вода отделяется, и непрерывно образуются Р И р О и метасформа. 2Х3Х./ + 17 ккал = H20 / + H4P207 И LFR207 + 24 ккал = H20 | — f 2HP03 Благодаря действию воды обе кислоты становятся ортотропными. Но эти холодные изменения происходят очень медленно. Таким образом, каждая кислота реагирует как отдельное вещество в свежеприготовленном растворе.
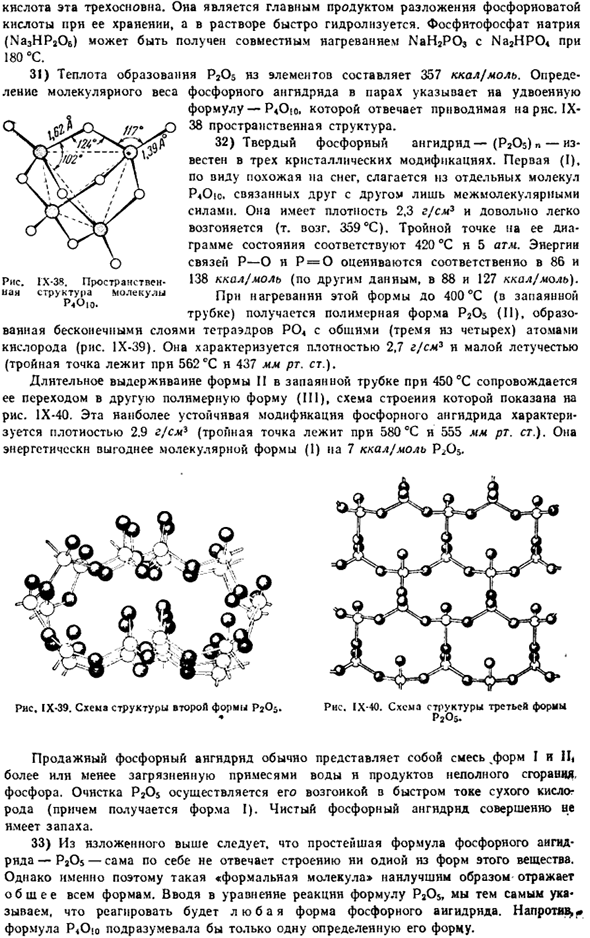
Их структурные формулы следующие: Но он > 0 | / я НО-ПК 0 = П-О-П = 0 НО-Р-С Обо мне Но он Наибольшее практическое значение пентавалентных фосфатов имеет Орто-зидерат (H3PO4), который удобно получать окислением фосфора азотной кислотой: ЗР + 5HN03 + 2Н20 = ЗН3РО4+ 5N0 В промышленном масштабе H3PO происходит от P20, который образуется при сжигании фосфора(или его паров) в воздухе. Фосфорная кислота представляет собой бесцветный кристалл, который растворяется в воде. air.
It обычно продается в виде 85% Состав 2h3p04 * водный раствор с консистенцией густого сиропа, почти соответствующей Н20.В отличие от многих других производных фосфора, H3Pb4 не токсичен. Окислительные свойства его совсем не характерны. Поскольку H3P04 является трехосновной кислотой средней прочности, он может производить ряды из 3 солей: /
Первичный фосфат натрия NaH2P04 Кислоты соли Вторичный фосфат натрия; третичный фосфат натрия О Na2HP04 Na3PO < Средняя Соль Все первичные фосфаты очень хорошо растворимы в воде, лишь небольшая доля растворимых вторичных и третичных, особенно Na солей (рис. IX-34). как правило, фосфаты бесцветны. 3Е-52 Производные фосфорной кислоты имеют различное применение в различных отраслях промышленности. Тем не менее, значение для сельского хозяйства особенно great.
In в частности, это относится к кислому фосфату кальция состава Ca (H2P04) 2-H20, который является основой суперфосфата, являющегося важнейшим фосфорсодержащим минеральным удобрением. Галогенные соединения фосфора образуются при взаимодействии элементов и, как правило, протекают очень энергично. Типы HAL и Рг5 галогенидов (за исключением Р15) известны для всех галогенов, но производные хлора являются небольшим исключением и имеют практическое значение.
Трихлорид (PCI*) образуется при действии сухого хлора на избыток фосфора. Последний воспламеняется и горит светло-желтым пламенем, в зависимости от реакции 2Р+ЗС12 = 2RS13 + 159 ккал Трихлорид фосфора представляет собой бесцветную жидкость, которая в больших количествах дымит во влажном воздухе и интенсивно взаимодействует с водой согласно уравнениям. РС!3 + ZN20 = N3P03 4-3HCI Итак, PC13 — это кислотный хлорид фосфита.
Под действием в ПК!3 образуются избыток хлора, бесцветные кристаллы пентагидрата фосфора. PC13 + S12 PC15 4-31 ккал •я Как видно из уравнения, эта реакция обратима. При нормальных условиях его равновесие смещается вправо, при более чем 300°С-влево. т. Является ли PCIg полностью разложенным, потому что он фосфорилирован? Он нагревается водой и образует Н30404 и НС1.
Реакция протекает в 2 стадии(2-я стадия протекает медленнее, чем первая): PC15 + H20 = POC13-f HC1 и POC13 + ZN20-N3RO4 + ZNS1 Они происходят от первого оксихлорида фосфора (ROSC). это бесцветная жидкость. Как и хлориды фосфора, хлороксиды используются в органическом синтезе. 3 соединения все пары токсичны. 60 на юг. Диаграмма IX-34.Растворимость фосфата натрия(моль / л Н20). Добавь л 1) фосфор был обнаружен в 1669.It является «чистым» элементом, состоящим только из 3n атомов R. существует монография по химии фосфора.
2) в основном состоянии атом фосфора имеет структуру внешнего электронного слоя 3s23p * n и является 3-валентным. Его непрерывная энергия ионизации составляет (eo): 10.48. Лондон: 19.72; 30.16; 51.35; 65.01.Сродство атома фосфора к электронам оценивается в 20 ккал / г атомов. 3) минеральная основа кости-gndroxoapatnt (Cas (OH) (PO) s1.Кроме того, зубы сложнее Фторапатнт (Ca5F (PO» hJ)).Общее содержание фосфора в организме человека составляет около 1 wt.
It есть В экскрементах животных обнаружено значительное количество соединений фосфора (наряду с азотом).Например, каждая тонна удобрения содержит около 3 кг фосфата (в моче человека за 1 день выделяется около 4 г).Еще больше фосфора содержится в экскрементах рыбоядных seabirds. As в результате деятельности их огромных стай на некоторых морских островах образуются отложения птичьих экскрементов («гуано»), которые подлежат промышленному использованию в качестве превосходного удобрения.
Под действием дождя азотные соединения гуано nc вымываются, оставляя большинство производных фосфора неповрежденными, постепенно образуя фосфат deposits. By выщелачивая азотные соединения из остатков, вызванных распадом, фосфаты образуются также в местах массовой гибели различных животных. Доказано это происхождение (из экскрементов или трупов животных) отдельных отложений фосфатов.
Другие месторождения образовались в результате деятельности фосфобактерий, и их крупномасштабное освоение происходило в древних морях. Наконец, есть месторождения фосфитов, которые могут иметь чисто минеральное происхождение. Фосфат и Апатит являются первыми продуктами производства фосфорных удобрений, поэтому достаточные запасы этих минералов имеют большое значение для развития сельского хозяйства в регионе. country. In в СССР известно много крупных месторождений фосфоритовой руды, а на Кольском полуострове имеются огромные залежи Апатитов.
Апатит является минералом неорганического происхождения и имеет множество применений. «Изначально считалось, что Апатиты используются только как средство удобрения советской земли, это один из 1 важнейших видов технического сырья, используемого более чем в 20 отраслях промышленности. 。 4) Процесс получения элементарного фосфора протекает при температуре около 1500°С и проходит 2 основные стадии. Во-первых, согласно формуле Ca3 (PO») 2 + 8C» = 8CO-f Ca3P2, фосфид кальция образуется и реагирует с Ca3 (PO») 2. Дают CaO и фосфор: ZCa3 (PO») * — f 5Ca3Pj = 24CaO-f-16P.
Ka указывает на опыт присутствия SiOj в исходной смеси, который не является необходимым для процесса, но в то же время значительно ускоряется (за счет снижения температуры плавления Ca3 (PO») 2 и связывания CaO по реакции: CaO +Sia= Casi03]. Тепло, необходимое для производства фосфора, может быть передано в систему не только для выработки электроэнергии (1 килограмм на 15 000 кВт), но и для сжигания Кокса.
Если частота использования 2-го варианта значительно ниже, то процесс проводят в доменной печи. Ежегодное мировое производство фосфора превышает 50 млн г(за исключением СССР). 5) в жидком или растворенном состоянии (и парах при температуре ниже 1000 * С) фосфор составляет 4 атома. Энергия связи молекулы P P P составляет 48 ккал / моль, а ее силовая постоянная равна k k 2.1. Более 1000°C、 * Ван Вель, r, фосфор I < sch > соединен.
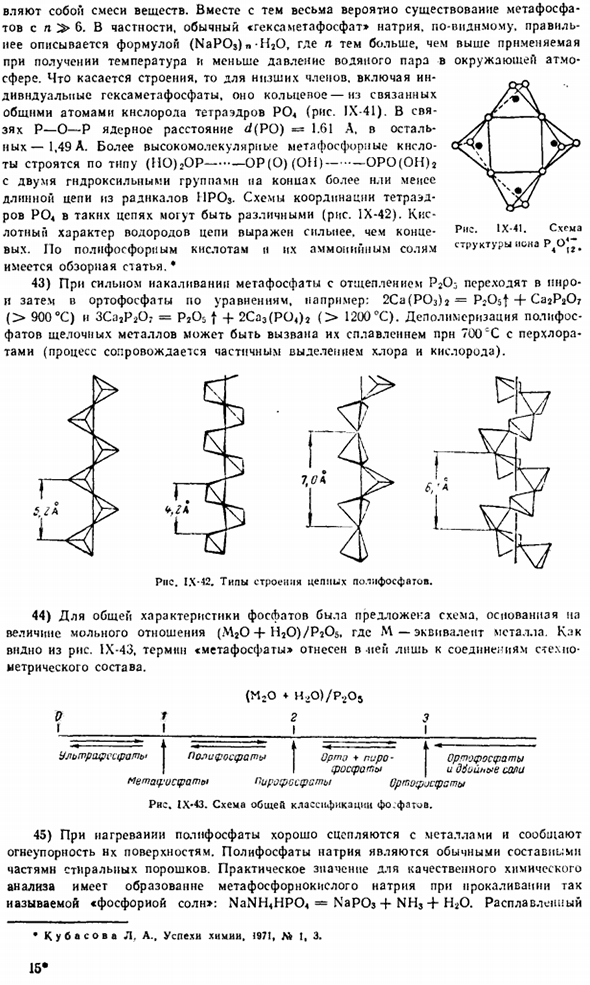
С английского, Изд. А. И. Шагшайский. М., Yzdalshlmt. 1962.687 секунд Выраженная диссоциация по схеме: P < — f-55 ккал = 2P2.Содержится в молекуле: река: длина тройной связи составляет 1,90 а, энергия 117 ккал! Молярная, постоянная силы* = » 5.5. Дальнейшее разложение молекулы Pt на атомы происходит только при 2000°C и выше. Теплота распыления фосфора (25°С) составляет 76 ккал! Моль. При температуре менее −78°с нормальный белый фосфор превращается в другой бесцветный модифинкаин с плотностью 1,9 г/см.
При нагревании белой формы при давлении 500 атмосфер образуется фиолетовый фосфор с плотностью 2,34 г / с * 3. По данным рентгена data. It имеет полимерную структуру, состоящую из взаимосвязанной группы P, со средним значением d (PP)P * = 2.22 A и ZPPP SO. Тройная точка диаграммы состояния соответствует температуре 590 ° C и давлению 43 АТМ. Нормальный красный фосфор, по-видимому, является тонкой модификацией фиалок, содержащих след impurities.
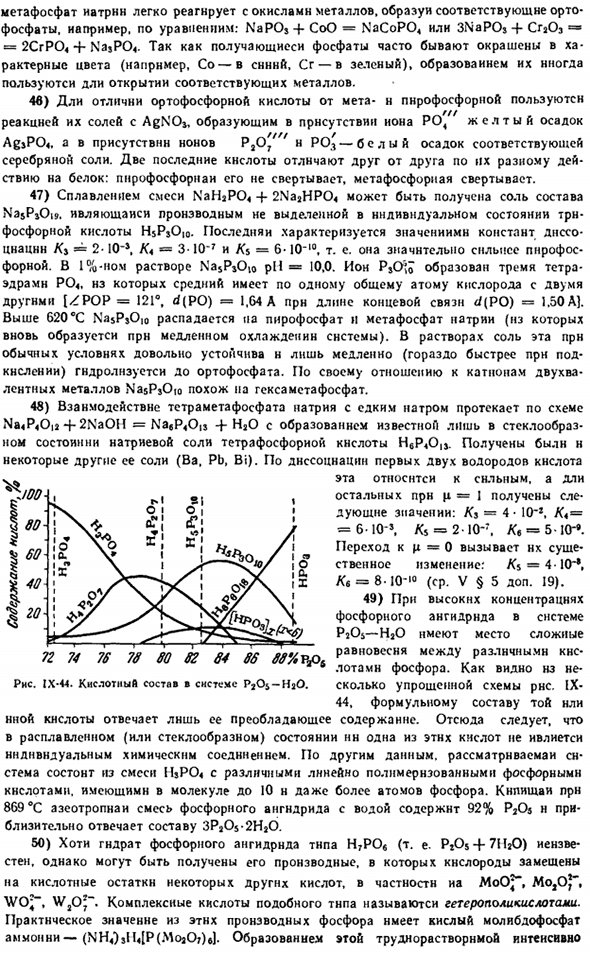
It известен в нескольких различных формах. При сублимации образуется молекула Р | (из которой образуется молекула Р <).Теплота сублимации красного фосфора составляет 29 ккал / моль Р4. 6) под давлением 12 000 атмосфер (или при 25°C в условиях 35 000 атмосфер) путем поддержания белого фосфора при 220°C、 2.7 г / с ?Теплота перехода белого фосфорасоставляет 9 ккал / г atoms. In при наличии ртути этот переход составляет 370°С, который осуществляется медленно, без высокого давления(но полностью освободить конечный продукт от ртути не представляется возможным).
Черный фосфор Диаграмма ix-35.Структурная схема * структура слоя 1X ~ 35, черный фосфор*.Каждый атом образует 2 связи в слое (d»= 2.22 A, Z»97°) и ID слоя «» 2.24 A, Z * 102°). он подобен по внешнему виду графиту и имеет полупроводниковую проводимость(bandgap 0.33 V), и свои химические свойства подобны красному фосфору(но он очень стабилизирован в воздухе и только воспламеняет на 400°C и выше). 18000 Ат. Давление режима черного фосфора плавит на около 1000°C. И только пар над 550°C повернет пурпур когда давление приложено. На 111 000.
Выше, по-видимому, простая кубическая структура и металлическая фаза rf (PP) фосфора-2,38 А. 7) теплота плавления белого фосфора составляет 0,6 ккал, а теплота испарения-12 ккал (р <на моль).Обычно он продается с формовочным стержнем, который можно легко разрезать ножом. Эту операцию следует проводить под водой (оптимально в 20-25 т).Из-за того, что воздух отрезан, фосфор может воспламениться из-за трения.
По этой же причине кусочки белого фосфора необходимо сушить, прикладывая к ним полоски фильтровальной бумаги, избегая трения и pressure. In ни в коем случае не берите белый фосфор пальцами (а только пинцетом или пинцетом). Растворимость белого фосфора в сероуглероде очень высока (около 10: 1 в нормальных условиях).ПРН-УП вабанин в таком растворе фосфора выделяется в виде идеально сформированных бесцветных кристаллов.
Белый фосфор растворим во многих других органических жидкостях (бензоле, эфире и др.), а также в жидких SOi и NHj. Технические продукты характеризуются рекристаллизацией или перегонкой в атмосфере азота. Расплавленный белый фосфор очень склонен к переохлаждению(капли диаметром 1 мм смогли переохлаждаться до −71°с). 8) Первая помощь при отравлении фосфором — это 1% раствор CuS04 (каждые 5 минут до появления рвоты 1 чайная ложка).
Сжигание фосфора делает его болезненным и трудноизлечимым, что также является причиной общей интоксикации всего организма. Первая помощь при ожогах фосфором — это влажная повязка, смоченная в 5%CuSO. Раствор CuSO также рекомендуется для тушения горящего фосфора. Его работа основана на восстановлении меди до металла (2P + 5cuso Схема » 4-8H?0 — » * 2HzP04 + 5Cu-f by 5H2SO).
Его мембрана еще не обволакивает окисленное phosphorus. In суть этой реакции аналогична замещению меди цинком (V§ 8). Это ясно указывает на наличие элементарной (белой) фосфорной электродот-функции (III§ 5 add.4). 9) красный фосфор окисляется значительно сильнее белого, но медленные взаимодействия с атмосферным кислородом все же происходят(особенно при наличии следов Fe или Cu).
В результате образуется небольшое количество очень гигроскопичных продуктов окисления, которые»впитывают» красный фосфор, пока он хранится в неплотно закрытой банке. Замоченный красный фосфор перед использованием следует перенести на фильтр, тщательно промыть водой и высушить в духовке. Красный фосфор может быть удален из примесей путем кипячения в течение длительного времени в 7% растворе гидроксида натрия и воде.
10) из-за токсичности белого фосфора использование спичек(воспламеняющихся из-за трения о твердые поверхности) запрещено. Обычные спички, изготовленные на основе красного фосфора, сгорают только при выскабливании специально подготовленной поверхности(спичечная замазка), их изготавливают по разным рецептурам.
Примерами являются следующие составы (масса%): Ним голову Красный фосфор. 。 。 Хромированный пик………. 。 1.5 три серистика и сурьма. 。 。 。 41.8 цинковые белила. 。 。 。 。 。 3.8 удушье……….. цинковые белила. 。 。 。 。 。 1.5 Матовое стекло….. Костный клей……. 。 11.5 Пока голова трется о спред, мельчайшие частицы фосфора воспламеняются, и воздух обжигает голову composition. To чтобы снизить риск возникновения пожара, спичка из осинового материала («солома») пропитывается примерно наполовину раствором фосфата аммония в момент изготовления, а затем гаснет без тления.
I) как и в случае азота, наиболее характерные валентные состояния фосфора соответствуют значениям—3, 0,+ 3,+ 5.Схема окислительно-восстановительного потенциала ©, соответствующая переходу между ними, показана ниже. — z около+3 +5 Кислая среда…. \ +0.06 j-0.50 j-020 J щелочная среда… {-0.89 / −1.73! −1.12 1 Имеется обзорная статья по химии 5-валентного фосфора. 12) реакция фосфора (белого) и водорода слабо пирогенная: 2Р-f 3Hf * * 2РНз-F 3 kcal.
At заметная скорость, если выход фосфна не превышает процентную норму, то он будет только прогрессировать за пределы 300°С. Используя высокое давление, вы можете немного увеличить его, но все же prn 350°Cn 200 атм составляет всего 2%.Равновесие в этих условиях устанавливается только через 6 суток. 13) молекула РН полярна (q * = 0.58)и имеет структуру треугольной пирамиды с атомами р на вершине (<*(HP)= 1.42 A, ZHPH = 93.5 e].
Его ионизационный потенциал составляет 10,2 э. сродство протонов составляет 184 ккал / моль. средняя энергия переноса рН оценивается в 77 ккал / моль, а его силовая постоянная равна = 3,2″.Инверсионный барьер составляет 32 ккал / моль и значительно выше, чем у аммиака(§доп.18). Фосфин (mp.-133.Mp.-88°C)довольно неустойчив, но при комнатной температуре не разлагается naturally. In воздух, он воспламеняется при температуре около 150°С.
Отравление Фосфоном ПРН в основном поражает нервную систему (одышка, слабость, судороги).в качестве первой помощи рекомендуется вдыхание кислорода. Предельно допустимой концентрацией рН в воздухе производственных помещений считается 0,0001 мг/л. * Витти Г. Г. успехи в химии. /% S. 。> 7.1238.
Растворимость фосфина в воде составляет около 1: 4 по объему (в органических растворителях она значительно выше).По его словам, очень нестабильный ах кристаллический hydramorphic PHj-ю известен. Состав соответствующего гидроксида фосфония (PH » OH).Электролитическая диссоциация фосфина незначительна и обладает свойством обоих полов. Для реакций по схеме PH3 + H30 — ^ PH. + H20 и PH3 + H20 ^ PH ^ + NaO-установлено, что константы равновесия составляют 4 10 «29 и 2-U» 29 соответственно. 14) pH\ d (PH)= 1,42 а / соль фосфония представляет собой бесцветное кристаллическое вещество.
Перхлорат фосфония (RN4SYU4) взрывоопасна. Галогениды нагреваются, когда heated. In кроме того, в парах они почти полностью диссоциируют на PH3 и соответствующие галогенированные hydrogen. As из приведенного выше сравнения температур видно, что их термостойкость не меньше термостойкости аналогичных аммониевых солей. Температура, при которой давление пара в результате диссоциации достигает 1 атм: Я уш ПИИ «РН-С1, РН Н» Ф «сл NH4Br Нью-Хэмпшир»» я 339383400 −28 35 G2 ° С Как и сам PHj, галогенированный фосфоний является очень сильным восстановителем agent.
By в воде они разлагаются на фосфор и соответствующую ему галогеновую кислоту. Особенно простым является подобное разложение в присутствии щелочи, которая используется для получения чистого PHj. Другим способом получения чистого фосфина является нагревание белого фосфора с помощью крепкого спиртового раствора CPC. 15) Что касается донорской деятельности, то рН не может быть сопоставлен с ня. Кто является типичным донором(§ 2 add.2).
Замена водорода органическими радикалами ® несколько ослабит опорную функцию аммиака, но эта функция фосфина будет значительно усилена. Таким образом, замещенные фосфолипиды PR3 входят во внутреннюю область многих комплексных соединений. 1С) продукт, который частично заменил металл водородом РН3, плохо understood. In в частности, Марх2 получают путем взаимодействия РН3 с раствором металлического натрия в жидком аммиаке, представляющем собой белое твердое вещество с ионной структурой (радиус Иона РН-2,12 а). на воздухе Нафж самопроизвольно воспламеняется.
При нагревании до 100°C в вакууме он превращается в Na2Pll (по реакции 2marnga= PH3f + Na2PH) и сразу же разлагается на RP3 и NaOH с водой. Реакции, протекающие в водных растворах по формуле PH3 + 3HgCl2 = P (HgCl) 3J-f-±3HCl, могут быть использованы для определения фосфина. 17) те фосфид Р!13. состав последнего можно считать продуктом полного замещения водорода на нитрид металла (§ 1 add.35), не обязательно соответствует валентному отношению.
Например, для металлов, которые уже были рассмотрены, E3P (Mn, Re, Cr, Mo), E2P(Mn, Re, Cr, W), ER (Mn, Re, Cr, Cr, Mo. Вт), ЭР2(Ре, СГ, МО. W), ER3(Mp. Re иитри: как и женщины, многие фосфаты очень устойчивы не только к воде, но и к молочным продуктам products. As для фосфатов есть резюме монографии. 18) С PH3, когда разложенный водой, фосфид всегда будет формировать yeball. чем больше количество D и f osf и a, тем P2H будет.
Последняя представляет собой бесцветную жидкость (Мп.-99, депутат.63°с). структура молекулы Oi аналогична гидразину[d (PP)= 2.22. РФ (РН)= 1,45 а, ЖПХ = 91 е). Р-р связи характеризуются энергией. Гия 74 (по другим данным, 61) мкал / моль и постоянной силы К1 = 1,9.Потенциал ионизации фосфина задается величиной 8,7.Оранжевый кроль*.При взаимодействии белого фосфора и щелочных металлов в жидком аммиаке отчетливо образуется воображаемый продукт замещения водорода в нем.
ДНП-фосфин («жидкий водород») не вступает в реакцию с кислотами и самовоспламеняется в воздухе. сообщается, что был получен тртсфосфин (P3H$), характеристики которого не были определены. Чачсино » Г. В.. Вот к ним и относятся Л. Л. Фосфиды.1д Академии наук Киевской УССР. 1961.128 п. 19) во время хранения P2H постепенно разлагается на PH3 и желтые аморфные твердые вещества. Это было связано с формулой PijHe или P5H5.
Описан также оранжевый гидрид состава P9H2.Эти «твердые фосфорные водороды» явно представляют собой специфическое химическое соединение и раствор РН3 в белом фосфоре. В то же время получают желтый твердый полимер (РН) х(например, путем взаимодействия LiH с эфирным раствором PC13).Нерастворим во всех распространенных растворителях, устойчив к щелочам и кислотам, а при нагревании выше 400 ° С (в вакууме) разлагается по схеме: 6РН = р » — f2рн3.
Имеются также признаки возможности получения более высокой фосфидной смеси, такой как цепная PnP + 2 и кольцевая RPN».Имеется обзорная статья по гидрогенизированному фосфору. 20) гипофосфит бария легко очищается путем перекристаллизации. После обменного разложения с H2SO4 из конденсированного и охлажденного фильтрата(из BaSO) выделяются фосфористые кислоты в виде крупных кристаллов, которые плавятся при 27 ° С (далее разлагаются при нагревании).
Он также четко получается при взаимодействии РН3 с водной суспензией йода (по схеме 212 + — f2H 0-f PHf = 4HI-fH3P02).в растворе H3P02 имеет тенденцию к распаду с выделением водорода и образованием H3P03 и H3PO. Однако это разложение без использования катализатора (такого как Pd) действительно заметно только в высокотемпературных или сильно щелочных средах. При нагревании его также можно использовать по схеме: 2Н3РОг = н3ро » — fрнэ.
Водород в момент освобождения, фосфорная кислота (К-9-10″*) восстанавливается до PH3.In сильно кислая окружающая среда(особенно во время топления), это очень с высокой энергией разбавитель. Например, соли ртути восстанавливаются до металлов. — Ф-ХГ-Ф 2HCI. In разбавленный раствор холода, наоборот, Н3Р02 не будет окисляться кислородом или свободным йодом в воздухе. (OH) 5 * IR (OH) 2 N2RO: слот должен иметь равновесие схемы, возможно, гораздо более левый сдвиг.
21) значение фосфора в фосфорной кислоте (VII§ 5), которое обнаруживается обычным способом, зависит от оценки состояния водорода в р-н связи. Именно поэтому, из-за электрической нейтральности молекулы, значения+ 1, 0 или-я даю следующую схему: ■ 2 ♦1-2 О Не имеет значения, какую из этих схем вы будете использовать при выборе коэффициентов.3.
Окисление молекулы H3P02 во всех случаях происходит за счет потери одного и того же количества электронов (например, при окислении до H3P04-4).Разница лишь в том, что по первой схеме потерянные электроны приписываются только фосфору, а по 2-й-водороду фосфора и р-н связям, а по 3-й-только этим водородам.
Поскольку истинное распределение заряда в молекуле неизвестно, практически можно использовать любое из вышеперечисленных schemes. It следует отметить, что поднятые здесь вопросы имеют достаточно общий смысл. 22) реакция медленного окисления фосфора кислородом воздуха интересна с разных точек зрения. Прежде всего, это сопровождается хорошо видимым свечением в воздухе. dark.
In параллельно с окислением фосфора постоянно образуется озон. Это, очевидно, связано с промежуточным образованием фосфонильного радикала (PO) по схеме P + O «- PO + O и последующими побочными реакциями O-f Oj■■O».Наконец, ионизация окружающего воздуха связана с окислением фосфора, что резко влияет на проводимость. Этот эффект является * Осадченхо И. М.. Химия А. П. О М И Л успеха. 1969, м. 6.i08S.
В некоторых других химических процессах, например, окисление натрия или кальция в воздухе. 23) люминесценция во время химической реакции, протекающей без заметного нагрева, называется chemiluminescence. It наблюдается не только при медленном окислении фосфора, но и при некоторых других химических и биохимических процессах, вызывающих блеск, особенно у светлячков, гнилых мух и др.
Хемилюминесценция зеленого фосфора во влажных средах, по-видимому, связана с промежуточным поколением МРТ. НРА молекулу окислению (д (л. с.)= 1.43, д (по) 1.51 А. ZHPO = 105°). 24) реакция окисления фосфора протекает только в известном диапазоне концентраций кислорода. При парциальном давлении ниже определенного минимума (порядка 0,05 мм рт. ст.) и выше определенного максимума окисление практически не происходит.
Диапазон концентраций, предпочтительный для самой реакции, зависит от температуры (и других факторов).Поэтому в нормальных условиях давление должно составлять 300 м. При повышении его до k скорость окисления фосфора чистым кислородом возрастает. Искусство. После этого давление и давление 700 мм рт начнет уменьшаться. Искусство.
И она будет близка к нулю. Поэтому в чистом кислороде фосфор практически не окисляется в нормальных условиях. Наличие нижнего и верхнего давления связано с цепным характером окислительных реакций. Аналогичные случаи были также изучены для мышьяка и серы. 25) безводный фосфор (Мп 24, Мп.(175°C) можно отделить от менее испаряющего Pa05 мимо distillation.
In органические растворители, P2O легко растворяется. Определение молекулярной массы оксида дифосфата как в газообразном состоянии, так и в согласованном растворе позволило получить формулу 2-кратной. 1X-36 пространственная структура. Теплота образования элемента P » 0>оценивается в 392 ккал моль-1, а энергия связи P-O оценивается в 86 ккал моль-1.
При взаимодействии P4Ov с холодной водой образуется только PdROz. Горячая вода и газ Нсl, реакция в основном следующее уравнение выполняется по: P4Ov + 61120 = * = PHj +ЗН3РО4 и Р4Ов+6НС1= 2HjP03 +2РС1.Безводный фосфор также очень энергично реагирует с хлором, бромом и серой (150°C или более). 26) фосфористая кислота (mp 74°C. Kx= 6-10 * K2 = s = 2-7 ′ 7)получается гидролизом трихлорида и последующим испарением жидкости до начала кристаллизации.
Структура молекул Н3РО3, установленная рентгеноструктурным кристаллографическим анализом, показана на рисунке. 1X-37 (пунктирные линии указывают на водородные связи с соседними молекулами).Для не-HPOjH значение постоянной силы равно: k (P-OH) −5,8,k(P = 0)= 7,8, # c(PH)= 3,3. В растворе равновесие по схеме NRO (OH) 2″P (OH) 3 перемешивается влево, что явно больше равновесия фосфорной кислоты(см. 20).
При этом указывается, что фосфит может связывать протоны, а константа равновесия таких функций задается значениями| H, PO.] (H ] / [H4P03) = 10 В момент выделения водорода LbO3 восстанавливается до РН3, а при нагревании безводной кислоты или ее концентрированного раствора процесс растворения протекает по схеме:4Х3Х3=х3 +55×04.
Кислородный раствор фосфорной кислоты в нормальных условиях заметно окисляется только в присутствии следовых количеств йода, а чистая (азотная) азотная кислота, не содержащая оксидов азота, при кипячении не окисляется. Взаимодействие фосфора и хлорида ртути протекает медленно по следующему уравнению: H, P03 4-2HgCl2-f H20 = H3P04 + HgzClj-f-2HCI.
Что касается фосфитов, то известны только кислотные соли n, а не средние. Оба примера-NaaHPOj-5HaO и NaHjPOs ^ ’ / jHjO. Я понял. Рисунок 1 X-Zb. Р40 ″ пространственно-шахматная структура молекул. Н Ри,\ IX-37. Структура молекул HjPOj. Кроме того, некоторые комплексные производные HjPO, например, зеленая кислота H3(Cr (11 PO3) — UNOO и некоторые ее соли).При нагревании фосфита он распадается на соответствующие фосфаты и производные с низкой степенью фосфорилирования, приводящей к рН. 、
27) NaiHjPjO можно получить нагреванием NaHjPOj при 150°C в вакууме до тех пор, пока не прекратится появление воды, это соль пирофосфорной кислоты (H4P * Os).Свободную кислоту (mp 36°С) получали по схеме: 5НеР03-f PCI, ЗНС1-F 3H4P2OS. It является двухосновной, неустойчивой, имеет симметричную структуру и выражается формулой HO (H) (O) POP (O) (H) OH. раствор о-фосфитного пирита натрия стабилен в нормальных условиях, но когда он кипит(или в кислой среде), к нему добавляют воду с образованием ортофосфата.
Соли, соответствующие метаплиновой кислоте (HPO2), также могут быть obtained. In свободное состояние, оно образуется частично при сжигании фосфатов. 28) при окислении влажного фосфора кислородом вместе с P20 и P2O3 всегда образуется фосфорная кислота-IUPjO (по результатам исследования молекулярной массы и магнитных свойств необходимо сделать простейшую формулу 2 раза доказанной), ее структура соответствует формуле (НО) 2OP » оба атома фосфора непосредственно связаны.
Соли фосфорной кислоты отделяются от других кислот этого элемента нерастворимыми (2: 100) солями najhapa06-6H20.Последний можно легко получить обработкой красного фосфора смесью сильного раствора Н2О2 и NaOH. IonH2P, 0; — характеризуется параметрами RF (PP)= 2.17, d (P-OH)= r 1.57,<(P = 0) −1.50 A.
Обычно свободные кислоты отделяются метаболическим разложением соли бария, которая почти нерастворима, с разбавленным H2S04.После выпаривания раствора, фосфорная кислота кристаллизуется в виде больших бесцветных пластин с состав Н4Р»06-22020 и плавится при 62 С。.В воздухе эти кристаллы легко растворяются, но после длительного хранения в вакууме больше, чем Р205 AnhydrusH»Р206, они растворяются при 73°С (с барабанами), а затем теряют свои кристаллические воды. Что касается кислоты, характеризуется умеренной интенсивности(/ с,> 10 / ЦС = 2-10 «а»=*5 10 3, 9-10 ЦС»).
При хранении фосфат разлагается gradually. In раствор низкой температуры, он очень стабилен. H4PjOe•+■Н20<= HjPOj-fH$Р04,причем процесс нагрева включает его разложение, и чем выше концентрация ионов водорода, тем быстрее протекает процесс. Безводный фосфор неизвестен. Оксид фосфора p4ob состава (add.35) затем происходит переход к фосфорной кислоте, и обратный переход удается. Фосфорная кислота окисляется до фосфорной кислоты только под действием самого сильного окислителя (такого как KMp04).Между тем, он сам по себе является окислителем.
Все 4 гидрогенфосфата могут быть заменены металлом, и полученная соль(гидрофильная кислота) обычно бесцветна, почти нерастворима в воде. Хорошо растворяются только производные наиболее активных одновальных металлов. Их решение очень стабильно. И сам H4PaOb, и его соли имеют ярко выраженную склонность к реакциям присоединения. 29)В H4P20 существует прямая связь только между атомами P. И в некоторых других молекулах фосфорной кислоты. К ним относятся H4P204, HbPjO » и равнобедренный пирофосфат h4p20 (1 p-P связь), HbPbO. nН4Р40л(каждый с 2 совмещенных), сайт нажмите кнопку Н4Р40ю(2 в сочетании), Н «Р»Ои(6 соединений).
Эти кислоты известны в основном в виде солей. H4P несколько лучше изучен, чем другие H4P. его структура четко соответствует формуле HO (H) или-PO (H) OH. Эта кислота была выделена из продукта гидролиза Pil4 в виде слаборастворимой соли бария (BaH2Pr04). в растворе она легко окисляется. 30) в результате реакции по схеме PC13-±2HaO + H3P04-3HCl + H4PaOb образуется фосфорная кислота того же общего состава, что и фосфорная кислота. От его структурной формуле Хо (Ч) (О) Р-О-Р(О) (О) следующим образом、
Эта кислота есть trissible. It является основным продуктом разложения фосфорной кислоты при хранении и быстро гидролизуется в растворе. Фосфат натрия (Na3HP2Ob) получают совместным нагреванием N’ahjpoj при 180°C с Na2HP04. 31) P205 теплота образования элемента ns составляет 357 ккал / моль. Определение молекулярной массы фосфорного ангидрида в парах указывает на его удвоение Формула-Р » Ой.«Это рисунок IX-38 пространственной структуры.
32) твердая безводная фосфорная кислота-(P2Os) p-известна для 3 кристаллических метаморфоз. Первый (I)выглядит как снег, состоящий из отдельных молекул Р » 0|, и только межмолекулярные силы связаны между собой. Плотность составляет 2,3 г / см3 и сублимируется очень легко (то есть сублимация 359 ° С).Тройные точки его диаграммы состояния соответствуют 420°C и 5 атмосферам. Энергии связи P-O и P = 0 оцениваются как 86. 1Х-38.Пространство составляет 138 ккал / моль(88 и 127 ккал / моль, согласно другим источникам).
Блок молекулярной структуры при нагревании этой формы до 400°C (герметично Он характеризуется плотностью 2,7 г / см3 и низкой летучестью (тройные точки находятся на уровне 562 см3 и 437 мм рт. ст.). Длительное воздействие формы II с закрытой трубкой при 450°с влечет за собой переход к другой полимерной форме (III). 1Х-40.Эта наиболее стабильная модификация безводной фосфорной кислоты характеризуется плотностью 2,9 г / см2 (положение трона составляет 580°С и 555 мм рт. ст.).
- Только молекулярная форма (1) более 7 ккал / моль P ^ Os является энергетически выгодной. США, IX-39. Схема структуры вторичной формы Р20*. Диаграмма IX-40. Схема строения 3-й формы Пжо. Коммерческая безводная фосфорная кислота представляет собой смесь типа I и типа H, которая обычно слабо загрязнена примесями фосфора, являющегося продуктом воды и неполного сгорания. Очистка Р2О осуществляется сублимацией при высоких скоростях сухого кислорода (кроме того, получается форма I).
33) из вышесказанного следует, что простейшая формула безводной фосфорной кислоты-ПАО * — сама по себе не соответствует ни одной из 3-х форм строения этого вещества. Но именно поэтому такая «молекула формы» лучше всего отражает то, что является общим для всех форм. Выражение P2Os вводится в уравнение реакции, чтобы указать, что все формы безводной фосфорной кислоты вступают в реакцию.
Чистая фосфорная кислота совершенно не имеет запаха. Людмила Фирмаль
Напротив, формула «P * Oio» означает только одну определенную ее форму-1. 34) сравните остаточное давление водяного пара (мм рт. ст. при 20°C) в некоторых наиболее распространенных осушителях ниже. Чем ниже эти давления, тем более энергично этот осушитель будет работать. C11SO4 ZnClj CaCl * NaOH H2SO4 KOH Mg (C / 04h PjOj 1.4 0.8 0L6 0.16 0.003 0.002 0.0005 0.(XO02 Это сравнение показывает, что сила дренажного действия Р205 намного превосходит все остальные вещества.
Однако при использовании технических продуктов необходимо учитывать возможность загрязнения очищенного газа фосфорсодержащим водородом (из-за наличия примесей низких оксидов фосфора P2O).во многих случаях не исключается возможность химических процессов при сушке (например, хлористый водород может вступать в реакцию по схеме: P 0, 0 + 3HCI = POC13 + ZNROz).
Взаимодействие безводной фосфорной кислоты с водой очень активно и требует значительного нагрева (до 46 ккал / моль PjOs). 35) пиролиз Р40 ((add.25) сопровождается частичным расщеплением элемента фосфор с образованием смеси оксидов элементов P. P4Oe, P40?, P4oe аналогичной структуры (без части окружающего атома кислорода).
Лучшее исследование этих P40s может быть получено индивидуально с использованием схемы 4P40 $-P4-f-3P40 $путем нагрева тетрафосфоксида в течение длительного времени в герметичной трубке, немного превышающей 210°C. Это блестящий бесцветный кристалл, который возгоняется при температуре более 180°C, является термостойким (в отсутствие воздуха), нерастворимым в органических растворителях и медленно взаимодействует с водой по схеме: P4Ov + 6H20-2P (OH) 3 + 2H3P04 этот оксид, в свою очередь, представляет собой смесь фосфорная кислота и фосфорный ангидрид.
36) интересный метод, реакция Р4-f16H20=4Н3Р044-UN — + 312 ккал следует по ссылке и водяной пар, взаимодействуя с которым produce3 produce04 производят. Присутствие катализатора (например, мелкодисперсной меди), который протекает достаточно быстро при температуре около 700°С, Как видно из этой формулы, в данном случае фосфор ведет себя подобно цинку или железу(IV§ 1). Использование водорода, полученного в то же время в синтезе NH3, рассматриваемый процесс особенно подходит для получения аммофоса(см. 53).
37) по данным реитгеоструктурного анализа кристаллов h3p04.Молекулы фосфорной кислоты характеризуются ядерным расстоянием Р = 0 и р-он соответственно под углом 1,52 и 1,57 а:/ 0 = р-он = 112°и Жо-Р-ом = 106°.Хорошо известное расположение обоих расстояний коротко внутри кристалла(</(0—0)= 2.53 a] водородная связь H! Это связано с тем, что сохранение таких связей типа PO_H-0 = P также определяет вязкость сильного фосфатного раствора. 38) безводный фосфат (mp 42°C) склонен к переохлаждению.
А при нагревании он значительно улетучивается. Жидкое состояние, высокая диэлектрическая проницаемость (при 25°С Е = 61)характеризуется по схеме: 2Н3Р04〜Н4РО * — fh2p07 по саморазложению очень сильно represented. In Агарикус активно разъедает стекло и почти все металлы. в случае с Денди, кристаллический гидрат 2H3P0 известно. H20 (mp. 30CC).в водных растворах h3p04 диссоциирует умеренно (Ki = 710 с, K3 = 6-YL K3 = 4•10-13).
С его 0.1.РН раствора составляет 1,5. Раствор 48% имеет наибольшую электропроводность, а раствор 65% замерзает только около −85°С. Среди других применений, фосфорная кислота иногда используется в производстве безалкогольных напитков. 39) присутствие фосфорной кислоты указывает на выраженный признак амфотерности, который обнаруживается при взаимодействии с HC104.
Реакция протекает(в отсутствие воды), но по формуле: PO (OH) 3 + HSC4 = [P (OH) 4] C4.Полученное солеобразное соединение представляет собой бесцветный кристалл (Мп.47°с).Аналогично, H3P04 взаимодействует с серной кислотой. 40) ионы POJ содержатся в фосфатном тетраэдре ftf (PO)= 1.54 A. Он имеет структуру / s (PO)= 9.1].Разбавленный (1%) раствор фосфата натрия характеризуется следующими значениями концентрации ионов водорода: Nall2P04-pI = 4,6, Na2HP04-pH = 8,9 и Na3P04-pH = 12,1 15 Б, В. Некрасов
Из-за накаливания первичных фосфатов, когда выделяется вода, они мигрируют в соответствующие фосфатные фосфаты, вторичные фосфаты дают фосфаты, а третичные фосфаты не изменяются. Вышеизложенное является общим case. In специфический случай термически нестабильных катионов во время обжига, высвобождение летучих продуктов разложения приводит к разложению соли.
Например, из слаборастворимого смешанного трифосфата (MgNH4P04) магния и аммония, Nils и H20 *магний фосфор являются released-Mg2P207.It используется при определении фосфорной кислоты (и магния). 41) пирофосфорная кислота образуется при постепенном нагревании ортофосфорной кислоты до 260°С. мягкая стекловидная масса (Мп.61°C), растворим в воде. Обратный переход к Орто-гидрату становится очень медленным и холодным. Кипячение раствора, особенно в присутствии сильных кислот, значительно ускоряется.
Поскольку пирофосфорная кислота имеет 4 основания и легко диссоциируется, первые 2 водорода значительно отличаются от других 2 водородов (/Cf = 3-10 «J,/ CF = 410» 3 / C C2 = 310-7, K<).-6-10-10 это не так. Ионы PaOJ состоят из 1 тетраэдра P04 с 2 общими атомами кислорода [ «(NaP03) 3 — >(NaP03)e Гексаметафосфат натрия (Мп.610 ° С) гигроскопичен, при хранении в воздухе растворяется и постепенно превращается в фосфаты, затем в ортофосфаты. Раствор имеет слабокислую реакцию (рН „6,5“), поэтому он сильно сочетается с двухвалентным металлическим катализатором (№ 4ER» Ohmnl Na232P » путем обменного разложения с образованием 0/3), даже в BaS04 медленно растворяется.
Гексафосфат патринии используется для смягчения воды, удаления масляных теплообменников из паровых котлов и предотвращения коррозии металла. Следует отметить, что вопрос о составе и структуре метионита не ясен. Некоторые из перечисленных соединений этого типа являются、 Они представляют собой смесь substances. At в то же время, очень вероятно, что будет N> 6 metallates. In в частности, обычный «гексаметафосфат натрия» более точно описывается формулой (NaPOs) p H20.Где n больше, температура, используемая для приготовления, выше, а давление паров окружающей атмосферы равно lower.
As для структуры, для нижних элементов, содержащих индивидуальные гексаметафосфаты, она является круговой от тетраэдра по, Соединенного общим атомом knlslorol(рис. IX-41). В связи P — O-P ядерное расстояние d (PO) 1. 1.61 А. Другие-1.49 А. высокомолекулярные кислоты methylphosphoric построена по типу (но) ДУ — — — — — или(0)(0н) — — — — — Оро(о)、 Радикал противоракетной обороны имеет 2 индолоксильные группы на обоих концах более или менее длинной цепи.
Схема координации тетраэдра Р04 такой цепи может быть различной(рис. 1Х-42).Кислотная природа цепного водорода более выражена, чем терминальная. Есть обзорная статья о полифосфорной кислоте и ее аммонийных солях. 43) во время сильного свечения P2Oj удаляется и метарилат поступает в inlo по формуле, а затем в ортофосфат. Например: 2са(POj)2 = Р-ОСФ + Ca2P207(> 900°С)и ЗСа2Р207=Р20ьf-f2Ca3(Р04) 2О1200°С).Деполимеризация полифосфатов щелочных металлов вызвана слиянием перхлоратов с 700: С(процесс сопровождается частичным образованием хлора и кислорода).
Рига 1X-41.Схема сооружения 7.0 в Рисунок I. V42.Типы фосфатов, которые цепляются за структуру. 44) для общей характеристики фосфатов была предложена схема, основанная на молярном соотношении (MgO + Mj0)/ Pj04.Где M-металл equivalent. As вы можете видеть из рисунка 1X-43. Термин»methalate» относится к* е.\Относится к неметрических только соединений. (М: О♦Н О)/ Р., о5 или Г с II 1 1 1 Поли (ОРТ) ОРТ о ДФ пиро•1 фосфат фосфат Српо и dfouhve ша Orpoflfsts рисунок IX-43.Схема общей классификации легких жиров.
45) при нагревании полифосфаты хорошо прилипают к металлу, придавая поверхности огнестойкость. Полифосфат натрия является распространенным ингредиентом в стиральных порошках. Образование металата натрия при обжиге так называемого «фосфата» имеет практическое значение для качественного химического анализа: NaNH4HP04 = NaPOj-f NH3 + H20.
Плавящийся * Кубасова Л. А. прорыв в химии, 1971.Сти, 3. Металаты легко реагируют с оксидами металлов и образуют соответствующие ортофосфаты по следующему уравнению, например: NaPOj + CoO = NaCoP04 или 3NaPO $ + CrAoE = 2CrO + Na Na PO полученные фосфаты часто окрашиваются в характерные цвета (например, Co -, Cr-зеленый), так что их образование может выделяться. имеется соответствующее металлическое отверстие.
48) для различения ортофосфорной кислоты и метаосновной кислоты и фосфорной кислоты они образуют желтый осадок Ag3P04 в присутствии ионов P04, используя реакцию с солями AgNOj, а в присутствии ионов P207 и P03 образуют белый осадок соответствующих солей серебра. Последние 2 кислоты отличаются друг от друга различным воздействием на белки. Фосфорная кислота не коагулирует, и металл коагулируется.
47) сплавляя смесь NaH2PO4-f 2Na2HP04, можно получить соль в составе Na5PiOi9.An неделимое производное трн-фосфата HsPsOio, которое не выделено отдельно. Последний характеризуется значениями константы диссоциации K * = 2-10 — \ KA * = 3-10 ′ 7 и Kb = 6-10-10.То есть он гораздо мощнее фосфатов. РН при Наспсов0 1% раствора = 10,0. Ионы PsO * Jo образованы 3 тетраэдрами P04,в центре которых находятся 1 общий атом кислорода и 2 других атома кислорода(y / POP = 121°, d (PO)= 1.64 A, Длина терминальной связи</(PO)= 1.50 A).
При температуре более 620°C Наспжоио расщепляет папирофосфат и натриевую метатную кислоту (образующуюся снова при постепенном охлаждении системы).В нормальных условиях эта соль в растворе очень стабильна и медленно (гораздо быстрее при субмесях) гидролизуется до ортофосфата. NasPjOio похож на гексаметафосфат, когда дело доходит до катионами двухвалентных металлов. 48) взаимодействие тетрамата натрия и гидроксида натрия протекает по схеме Na4P4Ou-f-2na011i = NaeP4Ou-f H20, сопровождающееся образованием натриевой соли тетрафосфориновой кислоты HBP40. 3, известный только в стекловидном состоянии.
Были получены также несколько других его солей(Ba. Pb, Bi). при диссоциации первых 2 водорода кислота Это связано с прочностью, а остальные длины при q = 1 были получены следующим образом: Kr= 4 * 10, / C4 = 6-10 С. / Cs〜2-10〜 \ Kt = 5-10 «®.когда вы перейдете к q= o, в них произойдут большие изменения./ Cs = 4-10〜,/С» = 8-10-0 (V.§ 5 доп.19). 49) система PjOs-HjO, если комплекс содержит высокую концентрацию фосфорного ангидрида THB 64 66 66% RaBpO_BISON между разными phosphates. As вы можете видеть, что слегка упрощенная фигура фиг рецептурного состава IX-44, 1 или другой кислоты, соответствует только ее основному составу. content. So, в расплавленном (или стеклянном) состоянии ни одна из этих кислот не подвергается воздействию отдельных соединений.
Согласно другим источникам, рассматриваемая система состоит из смеси 1P04 и различных линейных полноразмерных фосфатов с числом атомов фосфора в молекуле до 10 и более. При 869°с азеотропная смесь безводной фосфорной кислоты с водой содержит 92% P2Oj и примерно соответствует составу ЗР205-2Н20. 50) безводная фосфорная кислота типа H7PO (PiOs-f 7l!
Неизвестно, но можно получить производные, в которых углеводороды замещаются кислотными остатками других кислот, в частности MoOj, MoaO\ ВАО* -.Этот тип комплексной кислоты называется гетерополикислотой. К числу практических производных этих фосфорсодержащих производных относится молибдофосфат аммония — (NH4) sH4 [P (Moa07) e).Интенсивное формирование этого сложного решения 72 74 76 76 60 Диаграмма IX-44. Кислотный состав системы PjOj-HjO. Уоч- Желтая соль, используемая для обнаружения Неро.
Реакция протекает по следующему уравнению: Н3Р044-4-l2 (NHH hMoO — f 21HNO,=(NH4) 3H4 [P (Mo207) 6] \ + 21NH NO + + JNA интересно, что аналогичное производное фосфорной кислоты-no(P(MyOg) h] ’ •ШН20-последнее равно 3. 5!В случае фосфора известны 2 o кислоты. Соответствующие суперкислоты серы (VIII§ 1) аналогичны по структуре дифосфату (И4Р20″) и монофосфату (Н3РО$).Оба могут быть приобретены через взаимодействие P20.Или 30% перекиси водорода, в том числе NROe (схема Р20*4-2НаОа4-> 1 * 0 =2И3Р04 и 2НР034-Н} 02 Н4Р-Ов по).
Кислотные свойства фосфорной кислоты (Ki-2.Кей?= 3-10″, К3 = 7-Ил / С4 = 2-ЮВ) более выражен, чем пирофосфат. А тип м2!Он характеризуется типами 12P2Ov и M4P2Ov. Наиболее распространенным из них является K » PjO, который растворяется easily. It удобно приобретать KудобноP04O методом анодного окисления (по схеме 2hpoj «4-o * i20 4-pjoj).
Эта соль режет кислород только при 340 к Плохое исследование Н3РО * (/С、= 8 10 »*、/ 0 = 3-YLK3= 210 — ’ 5) характеризуется легким окислением мельницы до HMn04.KI раствор в фосфатном буфере (v§ 5 add.40), мгновенно высвобождает йод и высвобождает H4P203 очень медленно (возможно только путем гидролиза: M4P2Ov 4-H20 s * H3PO » 4-P3P05″).
Помимо iadslotslots и их солей, многие производные фосфора (Na2IIP04-H202 и др.) известны, которые образуются при взаимодействии Н202 с фосфатами и содержат кристаллизованную перекись водорода. Такие соединения отличаются от истинных супероксидных солей. Йод не отделяется от сильного раствора К1 в фосфатном буфере (как и сам Н; ОА).Но он ломается с выпуском oxygen.
At в то же время, (в отличие от H202) истинная йодная кислота не взаимодействует с KMnO<. 52) Р20 $описан также пероксид фосфора, образующийся при действии разряда на смесь пара и кислорода(при пониженном давлении).Это соединение имеет фиолетовый цвет (по-видимому, из-за смешивания свободных радикалов), но состоит в основном из бесцветного p4oc peroxides. It разлагается только при 130°С и гидролизуется в воде по схеме. P «Oc + 4H20 = H4P20; 4″и P2Oa.
53) суперфосфат получают обработкой предварительно измельченного природного фосфата (или апатитового концентрата) серной кислотой. После полного перемешивания влажной массы будут»дозревать» какое-то время. Кроме того, в соответствии со схемой сертификации $(P04) 24-2HjS04 = 2C3SO 4-ка (H2P04) 2, смесь сульфата кальция и первичного фосфата кальция, который после измельчения используется в качестве удобрения(под названием простого суперфосфата).
Фосфор, входящий в состав легкорастворимого Ca (Н200д) 2, хорошо усваивается растениями. Большим недостатком этого удобрения является наличие бесполезного «балласта» в виде CaS04. Получают тфосфорную кислоту сначала выделяют из природных фосфатов, но реакция протекает следующим образом: вместо этого нейтрализуют H3P04 гидроксидом кальция и осаждают осадок(CaHP04-2Hj0).
Осадки также являются отличным удобрением. Для дальнейшего обогащения растений необходимыми элементами очень важна разработка смешанных удобрений. Наиболее важным из них является T. am m ofos [NH4H2P04 и(NH4)?HP04)] получены прямым взаимодействием аммиака и фосфорной кислоты. 1 тоннаммофоса заменяет 3 тонны простого суперфосфата и 1 тонну (NH4) 2S04.Особенно полезна смесь калийных солей (то есть азофоска) и аммофоса, содержащая все»удобряющие»элементы, наиболее необходимые для растения-N. P и K. соотношение между ними может меняться в зависимости от почвы и особенностей культуры.
54) пространственная структура галогена РГЗ соответствует треугольной пирамиде с атомом р на вершине. Сравните некоторые из их свойств ниже. Тепловая субстанция образования. структура ккал / моль * энергия канала передачи данных RG. ккал / моль дипольный момент физическое состояние при нормальных условиях температура. °С < / (RG) a кипит PF3 229 1.55 104°120 1.03 −15! −101 PClj 75 2.04100®77 0.78 КБК. Жидкость. 。 +75 PBrj 42 2.23 Дж 00°е 0.52 декабря. Жидкость. 。 40/17 173 Pis II 2.52 94e 44, 0.34 красный кристалл+01 Lael.
Энергия связи (ккал / моль) и ее силовые константы равны 120 и 5,3 (ПФ). 76 и 2.0 (PC1). 62 и 1.7 (РВГ).Значения 12,3°и 290°c указаны для потенциала ионизации и критической температуры (PClj). Смешанный галогенид типа PIV PF2CI (mp 165-160, queue.-47°С), PF2Br(Мп.-134, Мп.- И6°с), PFC1 (Мп. .-144.Т. Кипятить.14°С). PFBr2 (mp 115, mp 78°C).Фтороронолид PF2I, PFS и P! Как правило, очень легко disassemble. It показывается.
Равновесие смеси PClj и Rvg3 устанавливается по схеме: PClj-f PBrs » PCbBr-f PC1Vg2.In в воде все рассматриваемые соединения разлагаются(медленнее других-ПФС), и образуются соответствующие галогенид водорода и фосфорная кислота(при гидролизе Плж также частично образуется РНЕ).в щелочной среде гидролиз протекает сложнее-образуется много различных продуктов. 55) взаимодействие по уравнению РГ-2! + HI-L 2Hg-Hg2l2 + HPF2 получали в газообразной форме при нормальных условиях (mp −124. (ПФ) = 1.58 А. м = 1.3£].
Его щелочной гидролиз протекает медленно по параллельной схеме: PF2H-f HOH = lla + PF2OH и PHFa +2НОН = 2HF + НР (он) 2.Наличие первой реакции указывает на отрицательную поляризацию водорода, связанного с фосфором. 56) высокотоксичные ПФ3 могут выступать в качестве доноров, в основном в связи с переходными металлами большой продолжительности(§ 2 дополнительных 2).
Таким образом, для элементов, которые уже были изучены комплекс 9 (ПФ3) 6 известен(е СГ, Мо и W). 0 (PF3b)a (E is Mn. Re), rRe (PF3)$(Γ-CI. Br. 1) и KRe (PFj) s. Из приведенной выше формулы значение металла выглядит следующим образом: (0, = bl). это совершенно нехарактерно для обычных соединений. Как правило, эти и подобные им продукты присоединения ПФС являются бесцветными, несколько летучими в вакууме кристаллами, нерастворимыми в воде, но растворимыми в органических растворителях, устойчивыми к разбавленным кислотам.
Но он легко разлагается щелочью. Получить его можно разными способами. Например, вольфрамовые комплексы синтезируются при 250 * C путем взаимодействия медного порошка с WCI6 под давлением PF3 при 250 АТМ. Кристаллы \ V (PF3) e легко сублимируются в высоком вакууме при температуре около 40°С, плавятся при температуре 214 ° С и начинают разлагаться при температуре не менее 320°с. 57) Rg3 жидкие железы растворяют белый фосфор, но нет химического вещества interaction.
At в то же время известны фториды, хлориды и нитриды общего типа GaP_RHA с молекулярной структурой grax. Первое из этих соединений получают реакцией 2PFaI-f 2Hg-Hg2l2 + P2F4, при нормальных условиях газообразной (mp.-86.Bp. It было −6°С).Молекула ФАП-ПФ2.По-видимому, частично разлагается на радикал PF2 (см.§ 1 дополнительно 92). Под влиянием привет, он легко делится на ПФА! И Пфах. Интересным производным радикалов PF2 является бесцветный P (PF2) 3 (mp.-68 ° С), и по крайней мере 10°С уже быстро разлагаются.
Сообщалось также о взрывчатом веществе F2NPF2. Хлорид (P2CU) образуется при действии Тихого разряда на смесь пара PC13 и hydrogen. It представляет собой бесцветную жидкость (Мп.-28, mp. At 180°C), он разлагается медленно даже при нормальных условиях. Соответствующий ионид (Р214) может быть получен непосредственно из элемента. Образует оранжевый Кристалл (mp. 126°C). он состоит из полярной (q = 0.45) молекулы, как показано на рисунке IX-45 структура (c /(PP)= 2.21.</(P1)=■= * 2.48 A. ZIPI ™ 102°).
Для комбинированной энергии PP приведено значение 73 ккал / моль. 58) тепло, выделяемое элементом NS галогенидов RG5, быстро уменьшается в количестве 381 (F), 104(CI). 55 (ВГ).Производные йода неизвестны. Энергия связи равна PO (RG). 62 (PCI) и 50 (Rvg) ккал / моль фторированного фосфора представляет собой бесцветный газообразный (mp.-94.Т. ВР.-85°с),
Пентахлорид является летучим твердым веществом (Мп.159. mp.160°C, под давлением). кроме того, 5 бромидов (т. 11l. decomp.10GeC) известен в 2 формах: красный и светло-желтый Пара RVGz-это полностью lpssonnernai, RVGz и Vg2.А остальные 2 молекулы непта галогена и рыбалки являются структурами тригонального кристалла type. As это видно из рисунка IX-46.
В молекуле PC1 хлор 3 расположен рядом с фосфором, близко к другому хлору 2. Молекула PFS имеет аналогичную структуру, где< / (PF)= 1.54 и 1.58 A(но другие данные * 1.50 n 1.60 A).Кристаллическая сетка PCI5 состоит из [PCl «J *и (PCI») — ионов, а кристаллический PBrj состоит из [Rvg4 | * и Br «ионов. Ядерные расстояния [RCC] *и [PCIe]ионов P — O равны 1,98 и 2,07 A. первые имеют тетраэдрическую форму. 2-й-это октаэдр с фосфором и центром. Для тетраэдрических ионов расстояние 1pbr4) * P — Br равно 2,15 а (то есть оно значительно меньше, чем молекула pbrz).
Энергия кристаллической решетки[Rvg4) * Br-оценивается в 89 ккал / моль. Тот же катион [</(PBr)= 2.17 AJ содержится в бромиде PBrr. Интересно, что почти линейный апиот этого соединения, BrJ(см. VII§ 4, 39), асимметричен[J (BrBr)= 2.91 11 2.39 A]. 59) PF * молекула характеризуется сильной склонностью к слипанию с iohair F». она добавляется к октаэдру. Известно большое количество соединений, которые образуются таким образом. [Опп]соли-как производные неустойчивых катионных ОЖ при нормальных условиях (раздел VIII§ 1 добавить.13).
Существует обзорная статья о фториде фосфора-бесцветном твердом веществе, образованном из xefa и PFS 2XeFa — •PFS (диссоциирует при давлении 20°C 7 мм рт. ст.). 60) в дополнение к любым производным галогенов известны смешанные галогениды RG5.Например, RG4S1 (mp-132.т. температура кипения-43 эк). PFxClj (mp.-125.Mp.7°C) и PFjBrj(mp.-20°С).Интересно, что молекула PFSCI2 полярна (q = 0.68).С другой стороны, молекула PF3CI3 является гиперорегулятором (q = 0).
Стабильность такой смеси галогенидов обычно ниже нормы, и при нагревании она будет длиться. To: согласно функциональной схеме: SPFjCIj-3PF $ — f■+ * 2PCI5.Температура, необходимая для быстрого осуществления таких переходов, составляет 200°C. С другой стороны, в случае RG3Vga это уже произошло при+ 15°C. димеры типа PFjCIj и PFjBr2, типа (Pr ^ PFe) кристаллического вещества также были obtained. At 100 ° C в вакууме, PCI4 разлагается до 2PF3C12. Раствор йода PC1 $имеет фиолетовый цвет, что свидетельствует об отсутствии химического взаимодействия(с образованием PCI3I2).
61) особый интерес представляет тетрахлорид фосфора, в состав которого входят PC14F (mp 63, mp 67 SS, q = 0,21) и Ион — [PC14] F(T. subl.175. mp 177°С под давлением).При хранении первые из них медленно переходят во 2-ю (энергия активации таких переходов составляет около 11 ккал / м * л).в 2-х аналогичных формах, рассмотренных выше, также был получен PBr4F. Яб Рио IX-15. Схема строения молекулы P2I4. Рисунок IX-J6.
Структура молекулы PCI5. * Дрозд Г: и.. Преуспевающий химик. 1970.S* 1, 3. 62) на основе безводного HF и H3P02 или H3P03, смешанного гидрофторида вивалентного фосфора-H5PF3 (Мп.-47, депутат.+ 1°C) и HPF4 (mp.- 89. Mp. C) в полученной газовой фазе (-36°) оба соединения являются мономерами. Они стабильны только при низких температурах.
63) галогенид фосфора характеризуется склонностью к дополнительным реакциям. PC13•2Br2, PCl3-9Br2 перечислены. PCI3-5NH3. PCIs-8NH3, PBrs 9NH3. ПС15 Nj04. 2PCIs-ScCI4, PCIs-MoC14 и так далее. Некоторые из них (например, PC13-5NH3) могут существовать только при низких температурах, другие очень стабильны. Например, PC13-8XH3 разлагается только при температуре около 175°C. Однако соли металлов типа M[RG6) (G — CI, Br. I) есть unknown. At в то же время для некоторых очень громоздких катионов сложный азид M [P (^3) e в M)-
64) в качестве специфического признака ненасыщенности РС13 можно рассматривать окисление до Р0С13 атмосферным кислородом (т. Ил. — I, т. Кип.107 в нормальных условиях эта реакция протекает очень медленно, но кислород переносится ею в присутствии озона или нагретого катализатора (Платиновая сажа).При дальнейших сильных взрывах образование газа POF3 протекает в нормальных условиях(Мп.-39°C(под давлением).mp.-40°C). реакция путем пропускать смесь PF3 и 02 el начальный нажим ctric Искра.
Бромистые аналоги хлоридов фосфора ROWg3(mp 5 g, mp.192°с) относительно неустойчив и постепенно разлагается под воздействием света. Соответствующий йодид не является постоянным. Среди смешанных оксо-галогенидов, Pofcbr(mp.79°C) является наиболее интересным. Существует opfjh в прямой связи водорода и фосфора (</(НР)= 1.39 a).Кипячение сухого эфирного раствора, содержащего металлический магний POWg3, привело к образованию полимерного оксида (PO)*.
Общая формула (RG) G известна для галогенида полимера. 65) структура молекулы ORG3 соответствует несколько искаженному тетраэдру с фосфором вблизи центра (rf (OP) −1.45,</(PF)= 1.52.Д (ЧКВ)= 1.99 А. ZTPG х 103 е). Нижние моменты OPF3 и OPC13 равны 1,77 и 2,40 соответственно. Интересным является тот факт, что многие галогены F (130) — C1(122) — Br(119 ккал! Энергия связи (моль) 0 = P уменьшается. Но не увеличивается (как и ожидалось из-за ослабления Р-D связи в той же серии).
Для постоянной силы сцепления были найдены k(PF)= * 5.6 и k (PC1)= 2.5.величина k(OR) зависит от природы галогена:11.9(F), 10.2 (C1), 9.7. (ВГ).Существует обзорная статья о оксо-галиде фосфора*. 66) для получения P0C13 можно использовать реакцию, протекающую при нагревании по формуле: ZRS1 * + PaO $ = 5ROC13.Оксихлорид фосфора характеризуется диэлектрической проницаемостью e = 14 (22°C).в небольшой степени opci3 ^ Z ^ opclj-f диссоциирует по схеме CP и может растворять некоторые неорганические вещества(например, 0,3 г / л NaCl или 0,6 г / л KCI).
Интересно, что растр KI в нем (растворимость 1,7 г / л) имеет коричнево-красный цвет, но не содержит свободного йода. Как галогенированный фосфор. OPC13 склонен к дополнительным реакциям. 67) в дополнение к производным вышеупомянутого типа ORG3.Некоторые другие оксогариды Линга также known. An примером является газообразный (т. е. −18 ° C) фторид 0 (PF2) 2, который при нормальных условиях полностью разлагается на PF3 и (POF) K в течение ночи.
Из продукта взаимодействия PF3 и O? Жидкость 0 (P0F2) 2(точка плавления 0. t. температура кипения 72 ° С) и Кристалл (FP02) x разделяли бесшумным разрядом при низких температурах. Эти вещества являются ангидридами dentro phospholia и miofluorophosphate, соответственно. 68) бесцветное маслянистое Р0211 и многие другие производные типа P * OvCli известны хлором.
Популярным методом их приготовления является нагревание смесительной трубкой POC13 и P20$.Жидкость 0 (P0C12) 2 (mp.16.Mp.65°C) была изучена лучше, чем другие жидкости. Благодаря взаимодействию со льдом при низких температурах, дихлорфосфат-HPO-C12 (mp.-28°С) получается. Наумова Т. Н.. Введенская Т. С. Степки Г. Д..
Достижения в области химии. ! 72. б. 977. Он сам по себе очень стабилен, но в водном растворе он гидролизуется до HCl и H3PO4.Бромфосфат аналогичного состава образовывался при эндолизе ROVg3 в водном растворе ацетона, но не отделялся. Известны некоторые соли обеих этих кислот. 69) для химии фосфора важна реакция по схеме: MF + PFs * * HPF«.в подходящей среде низкой температуры(например, жидкий SOj при −20°C) этот процесс протекает слева направо, приводя к образованию фторфосфата hsa(HPF<).
Последний представляет собой бесцветную маслянистую жидкость, которая постепенно разлагается при нормальной температуре, чтобы стать исходным материалом. Свой кристаллический гидрат, HPF-6H20 (mp 32°C) немножко stable. It удобно получить соль HPFe (гидроксилурольфат) действием BrF3 на соответствуя metharylate.
In в щелочных и нейтральных растворах гексафторфосфат стабилен, в то время как в кислых растворах он гидролизуется. Ионы PF, входящие в их состав, имеют октаэдрическую структуру с фосфором в центре 1α/(PF)= 1,59 л]. При добавлении P203 к 40%HF (или при нагревании NHF F, содержащего PrO до 135 ° С) параллельно с HPFe образуются другие 2 кислоты-монофосфат (H2P03F) и дилататная кислота (HP02Fj).
Оба они разделены в индивидуальном состоянии и представляют собой бесцветные жидкости (плотности 1,8 и 1,6 г / см3 соответственно), которые при взаимодействии с водой подвергаются гидролизу(до H3PO4 и HF) и относительно легче HPFe. HP02F2 дается так называемый Ил. — 91 и так далее. 108 X (частично разобран). Все 3 кислоты очень сильны, поэтому соль с активным металлом проявляет нейтральную реакцию в растворе.
Из них производные H [Pojfjjj и iipf * сходны по растворимости с НСУ «солью», производные HJ [P03FJ сходны с h2so » солью. Для HjP03F, K1 = 5•I0 ″ s и K2 = 7-10 В. Ион (PO: F2) — характеризуется структурными параметрами 97°. 70) растворенный белый фосфор хорошо растворяет серу, но химическое взаимодействие между двумя элементами происходит только при достаточном нагревании их смеси(в виде раствора сероуглерода).таким образом, было подтверждено наличие сульфида фосфора, плавящегося при следующей температуре (°с).
P * S2 P4S3 P4S5 P «Se PiSr P, S> P» S:0 46 174 162 с paj. i. 232 секунды 30 <250 секунд paj. i. двести восемьдесят три Наиболее важным и изученным из них является Р23. P, S7 и P * S | 0.Образование определенных соединений зависит от относительного количества обоих элементов. Получение их при нагревании (в атмосфере COj) полезно для работы с красным фосфором Диаграмма IX-47. 。Структурная схема 1X-4.«СТПО <?: н: е моль- Молекула P2S3.Кули Я» ; Как бурно реагирует Белый.
При перекристаллизации (например, из расплавленного нафталина) все 3 сульфида отделяются в виде правильно сформированных желтых кристаллов. Интересно, что P2S3 несравнимо лучше, чем другие 2 сульфида (1: 1 по массе при нормальных условиях), которые растворимы в дисульфиде углерода. По структуре молекула P4S10 подобна молекуле P4O, 0 (рисунок 1X-38), и</(PS)= 2.10 и 1.9 | A. Для P4S структура показана на рисунке. ІХ-47 (РФ (пп)= 2.21.Если d(ПС)= 2.17 AJ, а р, S-структура схематически показана на Рис. 1, 18(д(пп)= 2.33 ЭйДжей.
Несмотря на то, что температура кипения рассматриваемого сульфида очень высока(соответственно 408.523 и 514°С).При нагревании в отсутствие воздуха Они кипят без разложения, и плотность паров первых 2 соединений соответствует приведенной выше формуле, последняя соответствует формуле PjSs. In твердое состояние, этот сульфид может образовывать 2 различных модификации.
Из них он более стабилен. Тот, который образуется молекулой p4sw, имеет более темный цвет и растворяется в дисульфиде углерода. В сухом воздухе все 3 сульфида стабильны при нормальной температуре, а при нагревании они воспламеняются (P3S3 уже при 100°C) и сгорают с образованием ПАО SOa. In присутствие влаги P2S3 не изменяется при нормальной температуре, но P4S7 и P4S10 медленно разлагаются за счет выделения HjS и образования фосфорной кислоты. 7!)
Получают фосфид и селен концентрируют в виде желтого P4Se3(mp.243°с) изучен лучше других и близок по структуре к P2S3(J(PSe)= 2.24, d (PP) −2, 25 A).Черный хрупкий Теллурид и фосфор соответствуют составу паштета.«При нагревании он распадается на элементы. 72) среди серных производных фосфора, сходных с кислородными кислотами, лучше всего характеризуются соли следующих фосфорной кислоты (HjPS4) и тиолиновой (HjPSj) кислот, полученные сплавлением соответствующего металла, количества фосфора, серы, обычно получаемые из расчета.
Из их расплавов эти соединения чаще всего окрашиваются и часто отделяются в виде хорошо сформированных плавящихся кристаллов, без разложения. Ион (PS.) 3 представляет собой тетраэдр с</(PS)= 2.05 A. H3PS3(в отличие от H3P03) интересно, что при образовании соли он действует как трехосновная кислота. Большинство рассматриваемых солей нерастворимы в воде и растворимы в воде (Na salt, kit P).
С выделением сероводорода и образованием ряда продуктов замещения серы кислородом она постепенно разлагается следующим образом: Na3PS4, Na3psa0», Na3PSa02, Na3PS03. Na3P04.Все промежуточные члены этого ряда известны даже в твердом состоянии. Для H3P03S были найдены значения K * = I * 10 «„и K3 = 2-10“»». 73) P4OeS4 экстрагировали из ОКСОСУЛЬФИДА фосфора(mp 102, mp 295°C).Его пространственная структура напоминает структуру P4Oy (рисунок 1X-38), где</(PS)= s 1.86 A.
были также оксосульфиды P404Se и P404S3. 74) за счет взаимодействия солей монотиофосфорной кислоты и йода в соляной кислой среде возможно получение солей дитиоадриновой кислоты (H4PaSaO -), структура которых аналогична суперфосфату. Свободные кислоты образуются в результате обменного разложения относительно плохо растворимых K2H2P2SaOe и HC104.It известен только в solution. In кислотная среда, только сильно диссоциированная и стабильная, под воздействием избытка щелочи, HJS, серы и соответствующих фосфатов образуется вследствие разложения.
75) ближайший аналог H4PjS504-общая формула (HO) aOPS» po (OH) acid of l = 34-10 of a—получают конденсацией с хлорсульфуром h20p03s в эфире при 20°C(VI11§ 1).47).Их бесцветные или желтоватые кулачки бария стабильны в нормальных условиях, а свободные кислоты медленно разлагаются на воздухе и быстро с водой. 78)Codesisney H3PS4, содержащие по Scia и S2CI2, соответственно (PiSn) и (PaS14) были получены.
Эти желтые пластичные вещества обладают свойствами полимеров. Они стабильны в нормальных условиях и нерастворимы в воде и органических растворителях, но разлагаются при нагревании до более чем 200°C или щелочи. 77) при нагревании плотной смеси NailS04 и NaaHP04 до плавления образуется натриевая соль смешанного пиросульфата (H»PSOj), структура которой соответствует формуле HOSOr-O-PO (OH).Эта соль легко растворяется и очень устойчива в растворе.
Соль бария Ba3 (PSO;) a-2НаО также была получена заменой decomposition. In кислотная среда H3PSO; быстро гидролизуется до HjS04 и H » P04.Очевидно, что также возможно присутствие производного пироклимолиновой кислоты (H3RSgO;). 78) П $ С13 (в 1.41; Мп.-36, Мп.+ 125°С), между Тио-галогенированные фосфины, PSBr известен(Мп 37, Мп 206eC), пси(Мп.47вС) и PSF, (ji -. = 0,63. Т. ЛП. −149,Т. −52°С).Последний Андере — это Андере, который самовоспламеняется в воздухе.
Аналогично К (или) оксогарида (добавить 65).При измерении ослабления Галогенидного поля силовые константы связей серы и фосфора не увеличиваются, а уменьшаются: K(SP)= 5.4(F). 5.1 (ки). 4.7 (Бр). Также было получено смешанное производное типа SPr3(rf (SP) 1. 1.86 D. K (SP) 3.0 3.0). В том числе SPFClBr (mp.98°с).Валентная связь между водородом и хинолинами содержит стабильный spfjh при комнатной температуре.
Хлориды Тио хорошо растворяют ковалентные неорганические хлориды (такие как SbCl3 и SbCls).При гидролизе в водной среде ацетона он четко образуется. H0P(Ы) С12. Взаимодействие между SPCl3 и P4Oi привело к смешанному оксихлориду в композициях P202SC11 и PiOsSjCIc. 。 «/(ПП)= 2,20.D (Pi)-2.48 A. рисунок MQ. Известны также красные производные клеточной шкалы p4sjl2, сходные по составу. Лена (депутат.155°с).
79) взаимодействие галогенированного фосфора с избытком жидкого аммиака приводит к первичному образованию Амида Р (MH2) 3 или Р (NH*).Дальнейшие преобразования при непрерывном нагреве системы описаны в следующей схеме: — NHj-NH3-H2-Nj П(НГ.), — > HNPNH, — ►Р3(Нью-Хэмпшир) 3 — * р «н»-►ПН т.- Н} — NН3 NН3-NHj-NН3 (PNHj)$ -> ГНП (NHzb-> НП(Нью-Хэмпшир: б-> NPNH-> P3Nrs Линамиды очень нестабильны и не дают выхода. Продукт расщепления от HNPNHj, 1 молекулы аммиака, до HNP (NHt)*также является unstable.
In напротив, другие азотные производные фосфора термически несколько stable. So удаление аммиака из Нпфнхтб осуществляется только в том случае, если он нагревается в вакууме до 125°С и более. Полученный NPNII (т. е. фосфум) представляет собой легкий белый порошок, нерастворимый в воде, щелочах и кислотах. Раскаление фосфора в вакууме выше 400°С сопровождается удалением аммиака с образованием 5-валентного нитрида-P3NS.
Последнее раскаление выше 700°С далее приводит к разложению его желтого (при 700°С) или красно-коричневого (при 700°С) трехвалентного нитрида фосфора (ПН) и свободного азота. Только выше 700°С будут бесцветными смешанные нитриды-P Ne Ne с PN и 3-валентным и 5-валентным фосфором (следует отметить, что химическая идентичность этого аморфного и самовоспламеняющегося вещества в воздухе не вызывает сомнений). Молекула PN газа, в котором растворяется PN (</=1,49 А. энергия диссоциации c = 2,75) оценивается в 147 ккал / моль. Оба основных нитрида фосфора очень устойчивы к воздействию воды, щелочи и кислоты.
80) родом из NC hosfam. LiNH2-f HNPN = * = nhjf + Lipn’a протекает при 600°C, в результате чего образуется бесцветный кристаллический Липк. Этот двойной нитрид стабилен в вакууме до 1000°C и не взаимодействует с кислотами или щелочами. 81) opc13 или SPC13 и их взаимодействие с аммиаком (в низкотемпературном хлороформе), соответственно OP(NH2) или SP (NI!* ) Формируется. Оба эти триамида представляют собой бесцветные кристаллические вещества, легко растворимые в воде (но постепенно гидролизующиеся).
Молекула OP(NH3) 3 представляет собой искаженный тетраэдр с атомом Р в центре, параметр D (OP)= 1,51. д {ПН)= 1.66 л, к(ОП) −7.0. к(ПН)= 3.6.Было также получено аналогичное производное гидразина, OP (N2H3) j. Энергия простой связи P-N оценивается в 67 ккал / моль. 82) большое количество продуктов, в которых гидроксильная группа или атом кислорода кислорода избетиумурина замещены аминогруппой (- NH«).Иминогруппа (=NH) или атом азота (seN). в частности, аминокислоты-NHaPO (OH) 2 и(NH2)2PO (OH) являются бесцветными кристаллическими веществами, которые легко растворимы в воде. Первая из этих кислот двухосновная(K | = 1•10 «\ K * » = 6-10 -«), вторая (/ C = 1 * 10_>) — 5 оснований (для замещения металлом, а также гидроксилом).
У нас есть амнн Роды.)Наиболее характерными для обеих рассматриваемых кислот являются плохо растворимые золи серебра. Уже при температуре около 100°C NHaPO (OH)} легко поглощается NH P P03. При нагревании до 210°С в вакууме аминофосфат натрия (EI * NPO (OKa)) превращается в HN {PO (ONa) h (immunodi phosphate), затем 450 ° С-NTlPO(ONTa) 2] 3 (нитрилтрисфосфат).Другими хорошими примерами соединений рассматриваемого типа являются 0 [PO(NH) a) a (TETRAMIDE PNP phosphate) и HN {PO (NH2)2J2 (tetramide nm phosphate) той же структуры, что и он. Интересным является тот факт, что солнечная гидразидная кислота-(HO) 2OPNHNHPO (OH) 2.
Окисление (например, перекись водорода) может привести к образованию соответствующего солнечного дифосфата — (HO) 2OPN = NPO (011) интересное производное также (OP (NHa) NHJ», по-видимому, представляет собой 8-членное кольцо. Расположены группы OPNHj и NH. При его нагревании аммиак удаляется по схеме: OP (NH) NH = NH3 f + OPN. Полученный оксонитрид представляет собой аморфный белый порошок и является нелетучим, нерастворимым в 1 НН обычного растворителя и не изменяется даже при нагревании до 750°С. Эта температура (ОПН) «медленно разлагается на Р205 и PN.
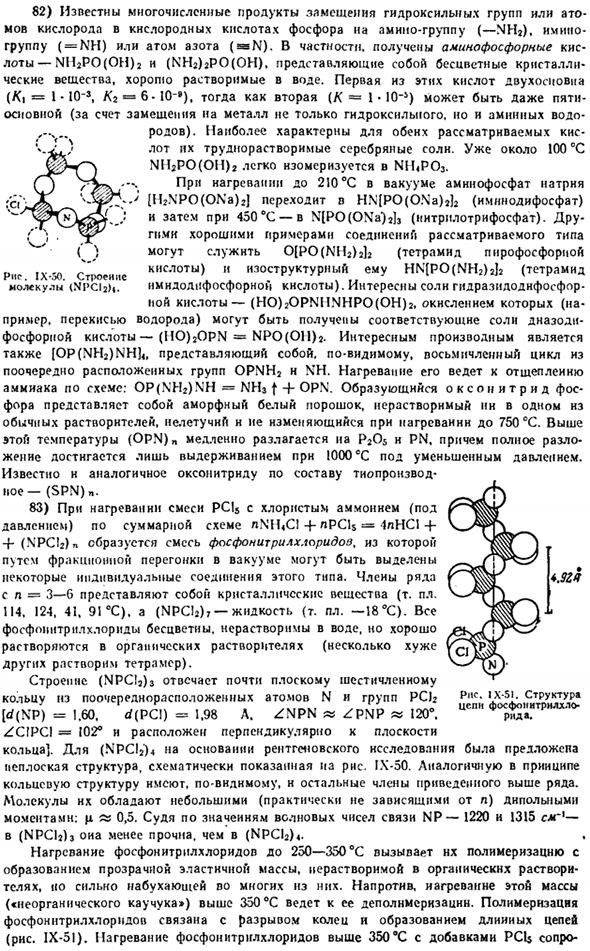
In кроме того, полная разборка достигается просто путем поддержания prn под пониженным давлением до 1000°C. Тиопуронат-подобный (SPN) n аналогичен по составу оксо-нитриду. 83) при нагревании смеси PC15 и хлорида аммония (под давлением) по общей схеме nNH4Cl + nPCls = 1lHCl + -f-(NPCI*) образуется смесь хлорида фосфонитрила, из которой несколько отдельных соединений этого типа могут быть отделены друг от друга перегонкой в вакууме. членами ряда n = 3-G являются кристаллические вещества (Мп 114. 124, 41. 91°С). а (НИП!2) 7-жидкость (Мп.-18°С).
Весь фосфорилхлорид бесцветен и не растворим в воде, но растворим в органических растворителях(слабо растворим в тетрамере). Структура (NPCI2) 3 соответствует почти плоскому 6-членному кольцу с чередующимися N атомами и группами PC12[<f(NP)= 1.60. d {PCI)= 1.98 L. ZPN „ZPNP“ 120°. ZCIPCI-102°и расположен перпендикулярно плоскости кольца]. Для (NPCls) 4 была предложена неплоская структура, основанная на рентгеновских исследованиях. IX-50.По-видимому, остальные члены вышеупомянутой серии также, по-видимому, имеют аналогичную кольцевую структуру.
Молекула hx имеет небольшой (практически не зависящий от l) дипольный момент: μ » 0.5.Судя по значениям волновых чисел облигаций, NP-1220 и 1315 emg1 — (NPCbh менее долговечны, чем (NPC12) 4) 4. При нагревании фосфонитолилхлорида до 250-350 ° С происходит полимеризация с образованием прозрачных эластичных тел, которые нерастворимы в органических растворителях и во многих из них сильно набухают.
Напротив, когда эта масса («органический Каучук») нагревается выше 350°С, происходит деполимеризация. Полимеризация фосфонитолилхлорида связана с расщеплением кольца и образованием длинных цепей (рис.1Х-5и). Нагревание фосфонитрилхлорида выше 350°C с добавками Ric Рисунок ix-так. Молекулярная структура (NPCI2).」 Рисунок IX-5I. структура! Фосфонитридро-ридная цепь.」 Это обусловлено появлением линейных полимеров типа PCI ((NHC12) LS1) с относительно небольшими значениями l.
неорганические полимеры имеют обзорную статью 84) с химической стороны фосфонитолилхлорид характеризуется устойчивостью к действию оксидов, кислот и щелочей. Это естественно. Очевидно, больше всего на свете. Что они мокрые в воде water. In в эфирном растворе при взаимодействии с водой хлор постепенно замещает гидроксильную группу, а при взаимодействии с аммиаком он замещает аммиак group.
An интересный продукт / NPCl? B * * 3SO3. (NPCl2J, — HCIO «и[NPCI2] »- 2HCI0″.Фосфонитолилхлоридамид демонстрирует потенциал функции среднего донора. Когда смесь нагревают (NPCI2)+ЗРС15 (в закрытой трубке), соединение предполагаемой структуры [pcljlfnpci ;!Это был первый раз за долгое время. Кристаллическое вещество, соответствующее формуле CbPNP (0) CI2 (mp 35°C), CI. P (NPCb) 3 mp 170°C, с разложением) иCljPNPClJ (mp ZJ °C). 85) известны(но хуже изучены) аналогичные производные фтора и брома фосфонитолилхлорида ixd.
Представители низших слоев — (NPF2) S, (NPF3).«(Нпбр?) 3 и (NPBfj) 4-28. 30, respectively. It плавится при 192 Н (202°С). Как видно из рисунка IX-52.Фосфонитолилфторид ((NPFj) известен как»/] является относительно летучим. Структура (NPF2) 3 подобна соответствующему хлориду ( ИРН.1 га. ЖЛ-> С. ’ С. (NP (CH«) a) 4 или (NP (OCH3) 5Jn, n = 3-t-8.Имеется обзорная статья о галогенированном фосфонитолиле и его производных. 88) подобно азоту, фосфор претерпевает в природе определенные циклы превращения.
Во время формирования земной коры часть фосфора, вероятно, была связана с металлом, и полученный фосфид стал частью более глубоких слоев земной оболочки. Другая часть соединена с кислородом PjOa. Этот кислотный ангидрид в сочетании с оксидами металлов образовал много минералов, большинство из которых вместе с Р20$ содержали и другие кислоты oxides. In в более поздние геологические эпохи под воздействием воды и углекислого газа подобные фосфаты или смешанные минералы постепенно разлагались, а растворимые соли фосфорной кислоты частично высвобождались.
Последнее, пожалуй, сыграло важную роль в исполнении простейших организмов. Дальнейшее развитие растительного покрова на планете привело к извлечению фосфатов из почвы с превращением в сложное фосфорсодержащее белковое вещество, которое вместе с растительной пищей поступало в организм животных и далее перерабатывалось там. После гибели животных и растений их остатки возвращаются в почву, постепенно разлагая фосфорсодержащие соединения с образованием солей фосфорной кислоты.
Таким образом, весь цикл фосфора в природе можно выразить в простой сводной схеме: Р почвы, Р белка. Таким образом, почва получает такое же количество фосфора, какое было взято из почвы.1. содержание фосфора на той или иной части поверхности земли при свободном течении природных процессов не изменяется со временем или изменяется незначительно, так как фосфаты удерживаются плотно и почти не смываются водой.
Этот баланс значительно корректируется сознательной деятельностью человека. person. As например, следующие культурные растения извлекают из почвы меньше среднего количества фосфора (кг на тонну) во время роста. Озимая рожь яровая пшеница картофель Топ л корень Asrio соломы солома зерновых клубневые бот 3.7, 1.1, 3.7, 0.9, 0.7, 0.7, 0.7, 0.4, 0.4
В результате ежегодно с полей по всему миру собирается около 1000 миллионов граммов фосфора. Потому что есть несколько природных источников, которые пополняют почву своими соединениями. Постепенно развивающийся в нем «фосфорный голод» проявляется острее, чем азотный.
Смотрите также:
| Кислородные соединения азота | Подгруппа мышьяка |
| Круговорот азота | Подгруппа ванадия |
