Оглавление:













Подгруппа ванадия
- Подгруппы ванадия. Члены этой подгруппы-ванадий, ниобий и тантал-почти так же похожи друг на друга, как и Cr. МО и В. 1-3 Ванадий очень распространен в природе и составляет около 0,005%от общего числа атомов в земной коре. Но месторождения, богатые его полезными ископаемыми, есть rare.
- In помимо таких месторождений, железная руда с примесями в соединениях этого элемента является важным источником сырья для промышленного производства ванадия 4. Содержание ниобия (2 * 10 Н%) и тантала (2•10-5%) в земной коре значительно ниже, чем у ванадия. Они встречаются в основном в виде минерала колумбита а [M (NbOj) 2] и Танталита[M (TaOZY (M-Fc, Mn)).Обычно они образуют смесь друг с другом. Техническая обработка руды V, Nb, Ta очень complicated.
Важной рудой ниобия является сложный минерал лопарит (около 11%Nb205). Людмила Фирмаль
To получение свободных элементов, взаимодействие их оксидов с металлами кальция можно использовать по схеме E205-L 5Ca = 5CaO + 2E Когда исходная смесь нагревается, начинается реакция, и происходит большое выделение тепла. Пять Ванадий, ниобий и тантал-серые металлы, которые не изменяются в воздухе и могут быть хорошо обработаны в чистом виде. Некоторые из этих констант сравниваются со следующими: Плотность, г / см3…………. Температура плавления,°С……..
Температура кипения. С……… Относительная электропроводность (НД = л) В компактном состоянии все 3 металла очень устойчивы к различным химическим воздействиям. Ванадий растворим только в HF или кислотах, которые одновременно являются сильными окислителями. Ниобий и тантал нерастворимы во всех нормальных кислотах и их смесях (таких как царская водка).Исключение составляет КВ. Сам HF действует только медленно на оба металла, но, например, по реакции, он легко растворяется в присутствии сильного окислителя HAZ-21HF + 5HN03 = 3H2 [TaF7)+ 5NO + 10H20 Раствор щелочи почти не влияет на рассматриваемый металл, но он растворяется в расплавленной щелочи.
Порошкообразные V, Nb и Ta при нагревании соединяются с кислородом, галогеном, серой и азотом. Все 3 металла могут поглощать значительное количество водорода, но никаких специфических соединений не образуется. Основной сферой применения ванадия является металлургия специальной стали, которая передает очень ценные качества. Использование ниобия и тантала все еще относительно невелико, но оно имеет тенденцию быстро развиваться.
Производные пятивалентных элементов наиболее характерны для ванадия и его аналогов. Кроме того, соединения, соответствующие валентности в IV, III и II известны. Число V-Nb-Ta при прохождении через ряд в НБ ти 6.1 8.6 16.6 1890 2470 3000 3390 4840 5300 4, 6, 6. Такие соединения и их стабильность будут снижены. Низковалентные производные ниобия и Тантала до сих пор не имеют практического значения. Оксид пятивалентного элемента (E2O5) образуется при нагревании металла, который тонко разделяется в потоке кислорода.
Из них V2O5 имеет ярко выраженные кислотные признаки, но в случае Nb2Os и Ta205 он значительно слабее. Красный безводный ванадия (v2o5) незначительно растворяется в воде. Его желтый раствор содержит довольно слабую ванадиевую кислоту (HV03). в щелочи V2Os легко растворяется и образует соответствующий ванадат, но наиболее важным является ванадат аммония (NH4VO3), который имеет относительно низкую растворимость, распространенную коммерческую рецептуру ванадия. 3_18
Бесцветные Nb2O и Ta20 $нерастворимы в воде и почти нерастворимы. Соответствующая соль, ниобат и оба могут быть получены сплавлением соответствующего ангидрида со щелочью (или оксидом металла). в водных растворах они сильно гидролизуются. При подкислении и разделении этих растворов образуется белый желатиновый осадок переменного состава E205’an20.
Оба гидроксида растворимы не только в сильных щелочных растворах, но и в сильных кислотах, что указывает на амфотерные свойства. 9-23 Галоидное производное элемента Пятикнижия не является характеристикой самого ванадия(известен только VF5). Для NB и TA, вы можете получить все возможные EH5 пять галогенидов. Они являются легкоплавкими и летучими кристаллическими веществами.
Фториды и хлориды бесцветны, в то время как бромиды и нитриды различаются по цвету от желтого до белого. black. In вода, все пять галогенидов разлагаются и осаждают ниобат или танталат соответственно (E205 * xH20).Фториды характеризуются склонностью к комплексообразованию, причем большинство комплексов Где M-одновалентный элемент Высокий.
Низшая валентная производная от рассматриваемого элемента является свойством только ванадия. Темно-синий диоксид (V02) является амфотерным (с преобладанием основных свойств над кислотными), оба низших оксидов черного цвета. V2O3 и VO имеют только основные properties. As как правило, соли этих оксидов и различных кислот в растворе имеют характерный цвет: V02-синий, V2O3-зеленый, VO-фиолетовый.
Четырехвалентные производные ванадия являются наиболее стабильными в кислых средах, в то время как пятивалентные производные ванадия являются наиболее стабильными в щелочных средах. Если сравнить элементы ванадиевой подгруппы с фосфором и азотом, то возникает резкое противоречие между свойствами низковалентных производных и закономерностью изменения свойств high-oxides.
In дело в том, что при переходе по ряду N2O5, P2O5, V2O5, Nb20$, Ta20$ кислотные свойства оксида очень постепенно ослабевают. От N до Br. Хороший пример вышесказанного можно привести ниже, сравнивая теплоту образования оксида Е205 (ккал / моль) из элементов. Sb As P N P V Nb Ta 241 222 357 10 357 372. Четыреста пятьдесят четыре тысячи четыреста восемьдесят девять Тип подключения Добавь 1) ванадий был открыт в 1830 году.. Ниобий-1801, Тантал-1802.
Природный ванадий состоит из 2 изотопов) и тантал (|in / ta) являются «чистыми» элементами. 2) аналог тантала. Радиоактивным элементам L и 105 были предложены названия»Ганни а»(па) и»Нильс бориум» (НС). … 3) Как видно из рисунка 1Х-64, в основном состоянии атомы Nb отличаются по структуре внешней электронной оболочки от атомов V и Ta, но переход к структуре связан с расходом только 3 ккал / г атомов. — .
Оболочка(обычно характеризующаяся повышенной устойчивостью) требует в этих случаях очень большой энергии возбуждения. 1 II 111 IV В….. 6.74 14.65 29.31 48 Nb…. 6.88 14.32 25.04 38.3 Те…. 7.88 (12.7) (22.3) (33.1) 4) при выветривании ванадийсодержащих минералов в земной коре соединения этого элемента частично удерживают почву и частично удаляют поверхностные воды земли. sea. So современные донные отложения как в Кольском заливе, так и в Каспийском море содержат около 0,02% ванадия.
У меня есть несколько. Железная руда, нефть и ископаемые виды топлива осадочного происхождения указывают на большую биологическую роль этого элемента для отдельных видов животных и растительных организмов прошлых эпох. Некоторые современные растения и даже простейшие морские животные(асидия, голотрия и др.) избирательно извлекают ванадий из окружающей среды и накапливают его в organism.
In в теплокровном организме растворимые соединения ванадия действуют как сильнодействующие яды. 5) плавка ванадия по схеме, описанной в тексте, сопровождается большим тепловыделением (193 ккал / г-атом в).Металл выделяется в виде податливого короля. Для промышленного производства ниобия и тантала, электролиз расплавленного фторида K? 3FY (включая растворенную окись 3 * Os).Металл выделяется в виде порошка, который преобразуется порошковой металлургией в компактное состояние (VIII,§ 5, 17). 6) проходя через серию V-Nb-Tech, металл потемнеет.
Теплота плавления составляет 5,0 (V), 6,4 (Nb) и 7,5 (Tot) ккал / г атомов, а теплота распыления (25°C) — 123 (V). 173 (Nb) и 187 (Ta) атомов ккал / г. 7) высокая химическая стойкость Nb и Ta обусловлена образованием, которое легко происходит на поверхности как самого тонкого металла, так и очень плотной оксидной пленки, что делает их»пассивными«(см. VIII,§ 5, 20).Если комплекс не образуется, то эта Tribeca будет защищать Nb и Nb любого рН среды.
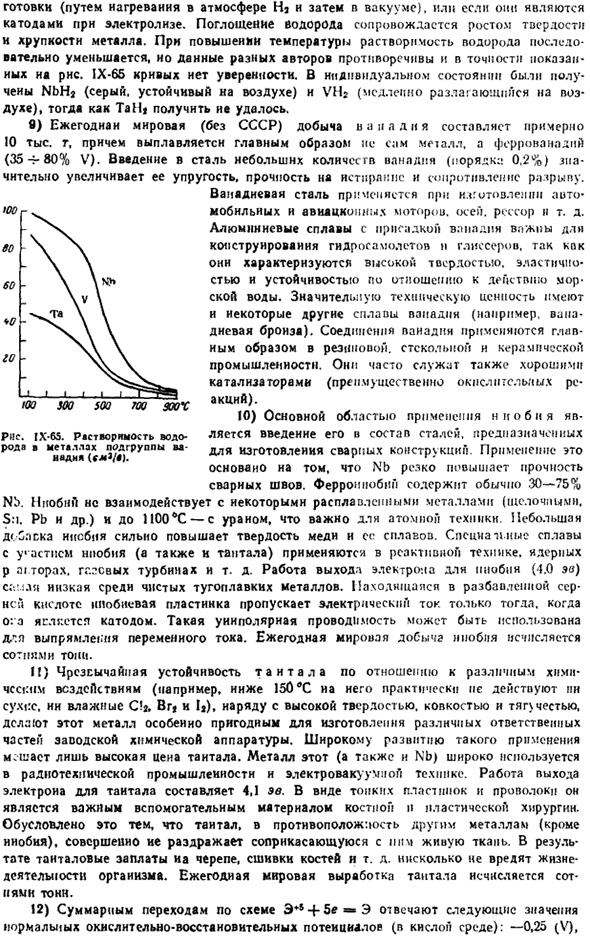
8) растворимость водорода в металлах подгруппы ванадия очень высока, но компактный металл поглощает водород только после прохождения предварительных стадий * Самсонов Г. В.. Константинов В. И. Тантал и ниобий. М.. Металлургия > 1959.264 дата Р. Горошейко Ю. Г. химия ниобия и тантала. Кир. Нойкова Думка. 1965.483 секунды Firebrother M. «химия», (972.276 секунды、 15 Б. В. Некрасов Для Пятьдесят < > У 5д- < * Д5 ″ Тридцать Я Я Внимание! Я Я Иди. V 65.2 ИТАК (44.8) Тот… Вес 3Д \ с ’ О СЦГ-з $ aJ6s * Рига 1Х.64.
Энергетический уровень V. Он соответствует Nb и Ta (kkol-g-otome). Если это катод во время приготовления пищи (вакуум после нагрева в атмосфере Na), или электролиз. Поглощение водорода сопровождается увеличением твердости и хрупкости металла. При повышении температуры растворимость водорода постепенно уменьшается, данные разных авторов противоречивы и точно показано на рисунках.
Кривая IX-65 не является reliable. In были получены отдельные состояния, NghJ(серый, стабильный в воздухе) и VH (медленно разлагающийся в воздухе), но не TaH. в) ежегодное производство ванадия в мире (за исключением Советского Союза) также составляет около 1 млн. g. In кроме того, выплавляется не сам металл, а феррованадий (35-80% V).
Введение небольшого количества ванадия в сталь (порядка 0,2%) значительно повышает ее эластичность, износостойкость и сопротивление разрыву. Ванадиевая сталь применяется при изготовлении автомобильных и авиационных двигателей, мостов, рессор и др. Алюминиевые сплавы с ванадиевыми добавками характеризуются высокой твердостью, эластичностью и устойчивостью к воздействию морской воды, поэтому они имеют важное значение в конструкции гидросамолетов и самолетов.
Некоторые другие ванадиевые сплавы(например, ванадиевая бронза) также имеют большую техническую ценность. Соединения ванадия в основном используются в резине, стекле и керамике Industries. In во многих случаях они также выступают в качестве превосходного катализатора (главным образом, реакция реголита окна). 10) Основной областью применения ниобия является введение в состав стали, предназначенной для производства сварных конструкций.
Это приложение основано на том, что Nb резко увеличивает прочность сварного шва. Феромон повиум обычно содержит 30-75% Nb. Ниобий входит в состав расплавленного металла (щелочи. S: i. Pb и т. д.) и не взаимодействуют до 1100 года.* С-с Ураном, важным в атомной энергетике. d <чем меньше сасканий, тем больше твердость меди и ее сплавов. Специальные сплавы с участием ниобия (и тантала) используются в реактивной технике, ядерных реакторах, газовых турбинах и др.
Электронная функция работы ниобия (4,0 в) заключается в следующем: ниобиевая пластина, которая находится в серии кислот, разбавленных кислотой, несет электрический ток только в том случае, если o: a является катодом. Такая монопольная проводимость может быть использована для выпрямления переменного тока. Ежегодное мировое производство ниобия составляет несколько сотен тонн. 1!
Предельная устойчивость тантала к различным химическим воздействиям (например, не менее 150, причем ни сухим, ни влажным с! J, Brj и I *фактически действуют), а также высокая твердость, податливость, тяга\честь, которая реализует металл, особенно подходящий для изготовления различных важных частей Заводского химического оборудования. М. обширным развитием такого применения часта является усовершенствованный цетановый Тантал.
Этот металл (и Nb) широко используется в радиотехнической промышленности и электровакуумной технике. Электронная функция работы тантала 4,1 9v. In форма тонких пластин и проволок, это важный вспомогательный материал для костной и пластической хирургии. Это связано с тем, что Тантал прекрасно стимулирует живую ткань при контакте, в отличие от других металлов (кроме ниобия).в результате появляются неестественные пятна на черепе, мостовидные кости и т. д., не вредят жизни организма.
Ежегодное мировое производство тантала составляет несколько сотен тонн. 12) е * * + 5е » — следующие значения нормального окислительно-восстановительного потенциала, соответствующие полному переходу по е-схеме (в кислой среде): −0,25 (в)、 Рисунок IX-6с. растворимость водорода » подгруппа VL-Madia metal (» > / *)• -0.65(НБ) и −0.81(ТП).Для ванадия также может быть представлена более подробная схема. o+2 +3 +4 +5 Нормальное программное обеспечение — \ TCMIUU.1. в… Я 1-1. 2) I-ОМ {+0.34 | / I. 0j I 13) удобно нагреть NH V VOj в воздухе для получения ванадия anhydride.
In мелкодисперсное состояние, оно будет оранжевым или желтым. Растопленный Вжой(Мп.685°C) ток. V205 VO ^ 4-f VO » если имеется 500-600°летучих паров, то оксид ванадия-нитрида явно летуч, и это, по-видимому, связано с наличием равновесия по схеме: VjOs(tb.) 4-4-2нао (масло) \ \ » 0) (0i)«(газообразный) водный раствор, насыщенный в нормальных условиях, содержит около 0,04% v2o. по этой причине состав соответствует Орто-3,2 и 1Н20 кристаллическим ГИДРАТАМ.
ИРО-и мета-формы ванадиевой кислоты. Растворимость V ^ Os в разбавленных сильных кислотах значительно выше, чем в воде, а появление ванадиевого ангидрида имеет ярко выраженные признаки амфотерности. 14) ванадиевая кислота (/С-2-10 4 в случае) обоих направлений электролитической диссоциации VOj +Н* VO. OH ^ Tt VO * — f OH, но вероятность возникновения эквивалентна каждому other.
In сильнокислые растворы (рН <1,5), он в основном присутствует в виде положительных ионов VOJ, которые характеризуются четким окислением properties. So в сильно кислой среде хлористый водород медленно окисляется до свободного хлора. Реакция протекает по схеме. 2VOJ 4-2HC1 ^ 2VO 4-C \ 7 4-20H. Только ванадат некоторых одновалентных металлов хорошо растворим в воде. Их раствор бесцветный или желтый.
Чистый ванадат аммония бесцветен, но при нагревании до 30°C и более часть аммиака легко теряется и желтеет. Его раствор также желтого цвета (растворимость 1: 100 при нормальной температуре). как правило, ванадатные соли двухвалентных и трехвалентных металлов слабо растворимы в воде. 15) желтый цвет раствора ванадата аммония обнаружен в схеме 3VO,< V30 «’(для константы равновесия этой реакции в нейтральной среде значение K * [VO3» * 3 * 10. — 6) * в кислой среде ванадий характеризуется образованием солей Ma (VeOi7) или M, [V6016](так называемых гексабенадиатов), большинство из которых окрашены от золотисто-желтого до рубиново-красного цвета.
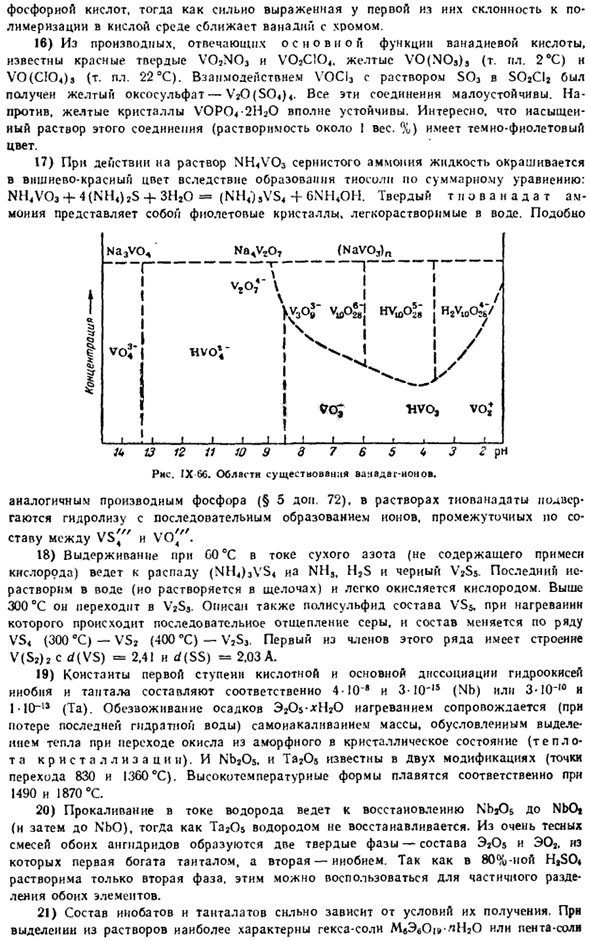
Надаты (связка ВОС, или растворов, схема, соответствующая гексавианской датировке: 2V, 0 «’4-2H’ ^ H, 0 4-VeO [y ’»или 2V, 0 «’ 4-4H * ^ Zt 2H, 0 4-V40 *.По другим данным, основной формой присутствия ванадиевых кислот в средне кислых средах (рН = 1,5–6,5) является llvieo *(рис. IX-66) последние 2 константы диссоциации этой кислоты (IM раствор NaCl-C4):/ C * = 2-10y и/ C «= 8-10 ′ 7.
Когда кислотная реакция заменяется щелочной реакцией, образуется пирроян-ортованат по схеме: 2Vj0 «’4-60H’ — ZN, 0 4-3VtO «»и V, 0 «»4-4-20Н’ — Н204-2VO»».Ортованадат натрия (Na3VO») гидролизуется в пированадат (Na » VjOr) в холодной воде, и когда он закипает, он становится метабиадатом (NaVOs). при правильном введении рН соответствующая соль серебра может быть отделена от слабокислого раствора во всех трех формах.
Водородный показатель. ……… 4.3-4.7 5.5-5.8 6.0-6.5 Осадки….. AgV03 Ag4VjO; Ae3V04 Метта калия, пиро и ортовия расплавляются при 520, 910 и 1300°C соответственно. Благодаря наличию таких солей установлено сходство гидратов ванадия n. Фосфорная кислота имеет сильную тенденцию к полимеризации в кислой среде, и в первой ванадий становится хромом.
16) среди производных, соответствующих основным функциям ванадиевой кислоты, известны красный твердый войной и V02C104.Желтый во (нет») $(Мп.2°C) и V0 (CI04)$(mp.22°С). Взаимодействие между VOCI и раствором SOjCI S03 привело к образованию » желтого оксо сульфата-VjO(SO)».Все эти соединения являются unstable. In напротив, желтые кристаллы V0P04-2H20 очень стабильны.
Интересно, что насыщенный раствор этого соединения (около 1 мас.(%Растворимости) имеет темно-фиолетовый цвет. 17) когда в отеле NH 4 Вос действует на раствор аммония сульфида общей формулы NH4VO3ПУТЕМ + 4(Нью-Хэмпшир»)2S3HjO » (NН4) с образованием thiosols по jVS4 + 6NH * ах, жидкость приобретает вишнево-красный. Твердый тиобиат аммония представляет собой фиолетовый кристалл, который легко растворим в воде.
Хорошо. Na3vo4 Na4v, О7 (Navo3)Н 1! 1 1 1 ф-МФЛ> Р Ф. Я Ю 13 12 11 10 9 7 6 5 Д < * 3 г рН рис 66. ванвдаг-область существования нон. Аналогичные производные фосфора (§ 5 add.72). в растворе тубанадат подвергается гидролизу, и в ряду образуются промежуточные ионы、 .. «.// г,,» /// Я поставил его между VS4 и V04. 18) при выдержке при С0°С с сухим потоком азота (без примесей кислорода) разлагаются (NH4) 3Vs ia NMS, H, S и черный V2S$.
Последний не растворяется в воде(растворяется в щелочи) и легко окисляется кислородом. Когда он превышает 300°C, он входит в V2S3. Описан также полисульфидный состав ВС. При нагревании происходит непрерывное удаление серы, состав изменяется в серии VSA (300°С)-VS2 (400 eC) — V2S3.Структура первых членов этой серии равна V (S2) 2, Где d (VS)= 2.41 и d (SS)= 2.03 A. 19) константы 1-й стадии кислотной и основной диссоциации гидроксидов ниобия и тантала составляют 4-10 «и 3-U’, $(Nb) или 3-10 „°n MO “ 14(Ta) соответственно.
Нагрев предполагает самоохлаждение (тепло кристаллизации) кристалла за счет термогенеза при переходе оксида из аморфного состояния в кристаллическое(с потерей последней гидратационной воды). при 1490 и 1870°с соответственно 20) обжиг в потоке водорода приводит к восстановлению NbjO до NbOi(и NBO до NBO), но Ta2Os не восстанавливается водородом. Из очень близкой смеси обоих ангидридов образуются 2 твердые фазы-композиции Е20 $и Е02.1 из них богат танталом, а 2-й-ниобием.
Только Фаза 2 составляет 80% H, растворимый в SOt, так что это может быть использовано для частичного выделения обоих элементов. 21) состав Ивата и танталата во многом зависит от условий его получения. При отделении от раствора наиболее характерным является гексасальт МвЭ40 / » lh20 или пентасальт M73s0, е -?H20 (M-одновалентный металл, n обычно 12-16); me0 $ — ph20 плюсневая кость не очень характерна.
Некоторые Орто-соли типов M3EO и M $ EO $также были получены сухим методом. Большинство ниобатов и таитратов слабо растворимы в оболочке. Растворимые соли (в основном производные калия) подвергаются сильному гидролизу. 22) e (OH)$ $ производных, соответствующих основным функциям гидроксидов. Сульфаты и фосфаты изучены лучше других.
Сульфат оксида NbjO «SO», Nbj03(S0″ h и Nb20 (S0j») описаны для ниобия, нормальный сульфат Ta2 (SO») s также известен для тантала. L как водонерастворимых солей оксолиновой кислоты EORO, так и обычных фосфатов EZ (PO) элементов были получены сухим методом. 23) для всех элементов рассматриваемой подгруппы характерно образование pscrexid соединений, стабильность которых возрастает вдоль ряда V — Nb — Ta. Они производятся главным образом из гидратов Орто (NZEO») или метамфата (NEOz), заменяя некоторые или все некислородные атомы-O-и-O-O-групп.
Таким образом, при действии HjOj на V205 в плотной щелочной среде образуются сине-фиолетовые ионы VOJ, а в разбавленной нейтральной среде — желтый VO ’ — Ион. к синему во?* .Свободная сернистая кислота ванадия не была отделена, но некоторые супер надаты (такие как Na3VO) также были получены в твердом состоянии. Под действием HjOj водные растворы сплавов Kb и NbjOj и Ta20 *образуют бесцветные красноватые соли в составе CsEOv. Для нескольких других катионов были выделены аналогичные соли.
Свободные ионные кислоты также получают действием разбавленного H2SO2 на раствор иодобата и иадантарата(в виде кристаллогидратов).Оба являются мета-форматами и очень стабильны. Например. Лимонно-желтый кристаллогидрат HNbO » LH20 разлагается в разбавленной серной кислоте только при нагревании (H2Oj удаляется), а бесцветный кристаллогидрат НТа04лН20 выдерживает нагрев до 100°C без разрушения.
24) пятивалентный фторид ванадия представляет собой бесцветное кристаллическое вещество, полученное взаимодействием элементов при 300°с(теплота образования 352 ккал / моль) (Мп 19, Мп.48°с). Молекула VF $имеет форму равносторонней двойной пирамиды. А связь VF в нем характеризуется длиной 1,71 а и энергией 114 ккал / моль. Очевидно, что в жидком состоянии происходит частичная ионизация ванадия Hsheitaflorond по схеме VFS + VFS VFj * — f-VF^. он очень бурно реагирует со многими веществами (например, RS1E) и полностью гидролизуется в воде.
Молярная растворимость VFS в жидком NR составляет приблизительно 1: 15.In кроме того, тенденция к образованию Хвфэ слабо выражена, а сама комплексная кислота не отделяется. Тем не менее, некоторые соли, полученные из него являются obtained. As для отопления это не особо важно stable. So K | VFe) разлагаются при 330°C уже до KF и VFS.
Также были получены твердый 2XeFeVF(давление пара 5 мм рт. ст.) и жидкий 2xeofal-VF (mp 37°C).Интересно, G. It не удалось получить аналогичный рекрутинговый продукт с молекулярным соотношением 1. 25) сравните теплоту, полученную от элементов, температуру плавления и кипения галогенидов PEB Nb и Ta ниже. NbF6 НБКО KbBr * Nbls Прогнозы TAF TaCI5 TaBrj Tal5 Теплота образования, ккал / моль 433> 91133 <102) 4S5 205143 (U7) Температура плавления. °С. 。 79205268320 97217280496 Температура кипения, ° С. 。 。 。 234 248 362 раза. 230 234 349 543
Плотность их паров соответствует простой молекуле ЭГ. Людмила Фирмаль
Последний имеет структуру тройного bpnramnda с атомом E в центре (rf(NbT) 1.88(F), 2.28(CI), 2.46 A(Br)и d [TaG)= 1.86(F), 2.27 (C1). 2.45 А (Бр)).Для энергии связи выражаются следующие значения (ккал / моль): 98(NbCl). 102(TaCl), 82 (NbBr), 86 (TaBi).Пять плоскостопием ниобий Тантал склонен к hypothermia. In в расплаве, согласно схеме 3FS-f-3FS-t * 3F * — b, происходит незначительная (<1%) электролитическая диссоциация. Взаимодействия между НСБ и нашатырного спирта, произведенного блестящий желтый аммиак NbFj-2NH3.
Пентохроичный ниобий известен в двух формах: белой и желтой (точка перехода 183СС).Рассматриваемые пять галогенидов хорошо растворимы в эфире и могут образовывать кристаллы EG5 (C»Hb esters. It интересно, что растворимость уменьшается в серии C1-Bg-I (обычно обратное имеет место с неорганическими галогенами и органическими растворителями).
Желтоватый хлорид-фторид NbCl4F, вероятно, присутствует как в ионной, так и в молекулярной формах(ср.§B добавить.61).Бесцветный TaCl F F (mp.214 * С) также является known. In твердое состояние, он представляет собой тетраэдр. 26) структура ниобия и тантала[Ион ER » R » имеет тот же тип(<*(3F) — I. S6A] соответствует тому, что показано на рисунке 1X-67. Получены типы M ’[3Fe] и Mu (3F|) t. для танталовых комплексов типа Mj’ltafe).Например, K «(TaF$] (mp 780 * C).
Бесплатные фторированные органические кислоты Н [3Ф$) — 6ч. О, известен как бесцветный кристаллический гидрат, который плавится при около 15°С. Все эти сложные производные, наиболее важным является бесцветной к * [TaFy], что составляет чуть менее растворим в холодной воде (Мп 775 * C) и легко образует при растворении TajOj в плавиковой кислоте, содержащей кг. Он растворяется при нагревании, а не при охлаждении, и может быть легко очищен путем перекристаллизации (для предотвращения гидролиза фтористого водорода из раствора).
Это, как правило, используется для разделения тантала от примесей, особенно от ниобия.{NbOFe) оксофториды комплекса КТ относительно растворимы в виде избытка МФ. 27) желтые двойные соединения, включая фторид ксеноноида типа XeF * — 3F5 и XeFa-23F, известны для пентафторида ниобия и пентафторида тантала. Они являются легкоплавкими и нестабильными кристаллическими веществами, возможно, сходными по структуре с аналогичными производными SbF (§ 6 add.45). Также описаны XeFe TaF5 и 2xega-TaG5. XeF4 не образует таких соединений.
28) для других галогенидов Петаха, ниобия и тантала образование комплексных производных не характерно. Однако некоторые из этих соединений являются новостью. Примерами являются K (NbCU) (mp396®С) и Cs [TaCJe] (mp 5481 C).Производные тантала несколько более стабильны, чем аналогичные соединения ниобия, такие как CSCL +ЭС1$схема теплоты образования солей цезия. = Cs3CIe составляет 21 (\b) или 28 (Ta) ккал / моль.(Так!!(Так!)) = 2.65 A и k(TaC1) 1.96 даны.
Взаимодействие расплава Najtacle с металлическим кальцием] (т. decomp и 47СеС) иногда используются для получения тантала. 29) ni-хлорированный Тантал-хлорид тантала образует кристаллическое диморфное соединение с оксихлоридом фосфора. NbCU-POCI (mp 124 * C) в желтом и ахроматическом TaC. с-Б(mp133.Их структура похожа на рисунок 1X-G. 3c1s-N0C1 (3-Nb.), которые могут получать одно и то же соединение, начиная с оксокролидов PC15 и EOS1a. Ta) NbCls-NO и TaSC-N0 * Cell *также были зарегистрированы.
30) ванадий и ниобий характеризуются оксо-галогенидами общей формулы EOG *в дополнение к чистым галогеновым соединениям. Из них VOF3 представляет собой желтоватый Кристалл (V. 110c).Используя фторид калия и ряд других металлов, можно получать бинарные соединения комплексов типов MF-VOF * 2MF-VOF®и 3MF-2VOF * 3MF-2V03F и 2MF V02F. Желтый Лос! В жидких условиях (Мп.- 77, Мп.128 ° с) получают действием сухого HCl на нагретый vjoj (в присутствии PjOs он связывает воду, образующуюся в ходе реакции).
Молекула OVClj имеет слегка искаженную тетраэдрическую структуру с атомом ванадия в центре[d(VO) −1.56,<f (VClj = 2.12 A. ZC1VC1 = 11!как пользоваться Рисунок IXC7. схема структуры кон INbFTl7″. Общая силовая постоянная муфты: k (VO) −7,9 и(VCI)= 1,4.Этот оксо-хлорид не взаимодействует с металлическим натрием даже при кипячении, но легко гидролизуется водой. Соль-как смесь в нем не растворяется, но MjVOCI типа $(М-это CS. Rb. К. Х.») известна Зеленая соль.
VOCIj Озон произвел оранжевый VOjCl. Также известен темно-красный неустойчивый Вобр. 31) NbO2F и NbOFj известны из фторида ниобия-оксо. То же самое относится к некоторым одновалентным металлам типа 2MF-Nbof и 3MF-NbOF$, а также к бинарным соединениям, полученным из последних. Бесцветный NbOCl сублимируется при температуре около 300°C».При дальнейшем нагревании NbCI » nbaoa ломается.
В отличие от VOCI, он образует специфический хлорид одновалентного металла и двойное соединение типа MCl-NbOCb 2 2MCI-NbOCIj. Бромид эомр неустойчив (нбобр3 может быть очищен сублимацией).Йодидов, XbOI3 и NbO2I, которые образуются при гидролизе, известны. Красное пероксидное производное ниобия представляет собой красную комплексную соль типа M * [M ^ Oa] SC) (здесь M-Cs, Rb. К. NН4).
32) в случае тантала оксо-галиды не столь характерны. Из фторида известен taofj, и комплексы формы M ^ TaOF, полученные из него, известны. Где M-это K. Это NH. сказал он. Неустойчивая Летучая TaOCIj образуется в g00—700°С обратимой реакцией: Ta20 $ — F-ЗТаС1$ oTaOCIj. In индивидуальное состояние, взаимодействие между TaSC и C120 (в пределах CC14) может быть равно нулю. Это белое вещество обладает очень высокой гигроскопичностью, нерастворимо в неполярных растворителях и разлагается выше 327°С по указанной выше схеме.
Дао немного термически устойчиво. (До 526°C).при нагревании TaBr5 при 150-200CC в потоке кислорода также был получен TaOBr3.Такой маршрут также подходит для генерации NbOCIj и NbOBr3 (не TaOC13). Оба кристаллических оксогила типа ЭО известны как для тантала, так и для ниобия. 33) производная азота элемента пятивалентной характерно в основном для тантала. Красные Ta3Ns образуются при 900°C в результате взаимодействия с TaaO *и NH3.
Если процесс проводить при 800°С, то образуется желто-зеленый ТАОН. Известен и в’Бон. VOCl3-f- + CIN3 = rC12+ VOCI? Согласно схеме N3 и VOCI2N3 = N2-f-Clj-f VON, аналогичный оксонот ванадия был obtained. In кроме того, нитрилхлориды ниобия и тантала синтезированы, в состав фосфония входит нитрилхлорен дам (§ 5 add.83), но представляет собой твердое кристаллическое вещество. Tan NNbCI2 отделяет хлор при температуре около 450°C, а желто-зеленая NTeCIa удаляется при гораздо более сильном нагревании. Из Nntrilfluorondes, мы получили NNbF2.
Известен также состав винилхлорида Ta2 \ g3Cl. Природный хлорид ванадия синтезировали по схеме: VCI $ + CIN + = CI * — + — VCI4N3 и VCJ4N $ — th N * — f-CI3VNCI (но его можно получить, непосредственно взаимодействуя с VN при 130°С C1).В отличие от полимер-нитрильных желез тантала и ниобия, это соединение (mp 132°C) монотонно и легко сублимируется. Для всех 3 элементов ванадиевой подгруппы используется двойной нитрид Li73N4(кроме того, для ванадия используются U7VP4 и Li7VAs4).
34) изменение цвета, вызванное уменьшением валентности ванадия, выявляется действием Zn на раствор соляной кислоты NH4V03.Конечным продуктом восстановления в этом случае является V * 2, а Bn » восстанавливает V * 5 только до Vs и Г-V * 4. Пятиатомный ниобий восстанавливается до Nb°цинком в кислой среде, но Ta°не восстанавливается вообще. 35) синий оксид, соответствующий 4-валентному ванадию (VOj), может быть получен тщательным восстановлением V2O (например, прокаливанием с избытком щавелевой кислоты).
Сине-черный NbO *(Мп.2080 ° С) водородом при 1200°С Nb. It образуется в результате сокращения Oj. To чтобы получить чай черный Ta02, нужно очень логичное снижение TaaO *(например, высокая концентрация магния Температура.)При нагревании на воздухе диоксид легко переходит в соответствующий ангидрид ErO$. 36) для ванадия очень характерен продукт частичного восстановления ванадата в приближенном составе M * V2Os(0 <dg <I. А M-щелочной металл, Nha, Cu, Ag, Pb).
Эти «ванадиевые бронзы» по некоторым свойствам сходны с аналогичными соединениями вольфрама (VIII§ 5 add.44).Очевидно, типа Ми. \ b03 (где M-Na. К. С. Ба) «Новиумная бронза» еще больше похожа на последнюю. Имеются также признаки присутствия типа Ба «Тантал бронза »» Дао«. 37) гидроксид ванадия четырехвалентного соответствует формуле VO (OH) J.
It это розовый цвет. Амфифильный и слабо растворимый в воде (Г1Р= 2-10 «22).Желтая или коричневая соль, образующаяся при взаимодействии Vo(mp 1545°С) и щелочей, называется vaiaditon n и обычно называется hjv» 09 (т. е. HjO-4VOj).Ванадий калий и натрий легко растворимы в соответствии с типом mjv4o9j•711 * 0 кристаллизуется. Мета и илованит натрия получали 2nav03 + 2NaNj 3Njf + + 2NajVOj и VN, согласно реакции. ’3 = 3N3f-f NajVjOs.
Виаудит 2-и 3-валентных металлов, содержащихся в воде, практически нерастворим. Раскаленные добела VOj соответствуя металл и окись в вакууме. 38) соли, образованные из кислот с диоксидом ванадия, получают из VO3 * катионного (viazyl).Они очень устойчивы в кислой среде(даже при нагревании).Из них, воки? Он наиболее легко получен путем растворять VjOs в сильном хлористоводородном acid.
In твердое состояние, ванадилхлорид является green. It очень гигроскопичен, легко растворяется в воде и окрашивает раствор синим или коричневым цветом (в зависимости от условий).в синем, черно-коричневом Вобрж также растворяется в воде. Аналогичные иодиды были получены в виде коричневых кристаллогидратов 2V0lj-5H20.Легко растворяется в воде.
То же самое относится и к синим кристаллогидратам V0S04-3H? Это также верно для 0(тогда как ваныриловый безводный сульфат зеленый и практически нерастворим в воде). в некоторых других сульфатах металлов VOSO *в основном относится к типу M? И что?•2V0S04 и М? S04 * образует бинарное соединение Восои. И тому, и другому обычно назначают кристальную воду.
Следует также рассмотреть соли виадила(VO(VOsh-2HjO||, очень характерный промежуточный гидроксид V30 $(0H) 4) ванадия. Во (Нью-Хэмпшир? Hl уже имид (Vo NH)|и нитрид ((VObNjj. 39) тетрахлорид ванадия получают взаимодействием элементов при температуре около 200°C. It представляет собой тяжелую красно-коричневую жидкость (mp. −20. Mp. 153°C). плотность ее паров соответствует формуле VCI4.Эта молекула имеет тетраэдрическую структуру с атомом ванадия в центре frf (VCl)= 2,14 A].
Структура молекулы vbr4 стабильна только ниже −4°C [d (VBr)= 2.30 A). Для раствора тетрахлорида ванадия в CC14, существование равновесия между простыми молекулами и 1-мерными молекулами (численно характеризуется отношением fVC!]] * /(VjCle] = 2-10 ’при температуре 24°C).При нагревании VC14 медленно разлагается на VCI3 и хлор. А при взаимодействии с водой она гидролизуется по следующему уравнению: VCl4-f HjO = VOCIj + 2HCI Благодаря пропусканию пара VCI4 по хлоридам K, Rb и Cs, нагретым до 400 ° С, образуется добавочный продукт типа MjVCIe.
Они окрашены в коричневый, розовый красный и фиолетовый цвета, соответственно. Действие хлора на смесь VCI4■S2Clj может привести к образованию черных кристаллов бинарных соединений vcl4 SCl4 (mp32°С). Из-за взаимодействия vcl4 с жидким аммиаком, зеленовато-коричневый хлорамидо VCI (когда NHaK осаждается и реагирует с NO, VCl NO. V9CI7NO. Твердое вещество в составе VjCle (NO) j легко сублимируется. Огнезащитный полимер[V (NO) jClJ «.
Длительное нагревание VCI4 с безводным HF дает коричневатый порошок VF4. При нагревании до 100°C и более VF $и VF неоднородны * тетрафторид ванадия гигроскопичен, растворим в воде и легко гидролизуется* С образованием синего (желтого безводного) фторида VOFj. Последний, который включает в себя фторид многих металлов, в основном дает M2-тип синих двойных соединений (V0F4H20).Также известна безводная соль, например KjfVOFj и (NH) slVOFsJ. М * ВФ ((к, RB. Цезий.)
40) пурпурно-черный цвет тетрахлориобия получают при 4 ° С по схеме 4NbCl5 + Nb-5NbCl4.It начинает сублимироваться примерно при 275°С. Более 300°С (при отсутствии избытка ’ bC15) он разлагается по схеме: в небольшом количестве воды или разбавленной кислоты NbCl4 растворяется в жидкой синеве. Такой раствор характеризуется очень сильными восстановительными свойствами.
Близкими по своим свойствам к хлориду, полученных черный NbF4 и коричневый NbBr являются. При длительном нагревании Nbl до 270°C в вакууме образуется серый Nb. Плавление при 503°C, когда часть йода удаляется, он переходит в Nb3l$.Известны также бромиды и хлориды аналогичного состава. РХБЗ! И сплавление хлорида щелочного металла образует нестабильное соединение типа MjNbCle. Для многих Cs- * Na термическая стабильность снижается.
41) зеленовато-черный TaC1 получают при 600°C по следующей схеме: 4TaCB + 4-Ta = «5TaC1». При отсутствии превышения TaCl1 выше 280°с диспропорционирование происходит по схеме 2TaCl1 = TaCl1-4-TaC13(обратная реакция происходит при 210X).Тетрахлор тантала является еще более сильным восстановителем, чем СКПК. Таким образом, при 320°с реакция протекает по схеме: Tacl * — f NbCl $ TaCl * -f-NbCl4.Cs, содержащий хлорид. Rb.
К танталотетрахлорид может образовывать Абтаск типа фиолетовых комплексных солей. Полученный темно-серый Ta1″. ОКСОХЛОРИД TaOCI и NhOCI *были синтезированы сухим способом (нагревание смеси E, E20 *и 3Clj с герметичной трубкой).Черный NbOl *также известен. 42) сульфиды ниобия и тантала 3s2 получают прямым взаимодействием элементов или нагреванием потока сероводорода насухо с металлом.
Наиболее хорошо изученным Тас3 является черный порошок с высокой термостабильностью (при отсутствии воздуха), нерастворимый в растворе соляной кислоты или каустической соды. Кристаллическая фаза состава nbse2 также известна. NbTe2, NbSe3, TaSe2, TaTc2, TaSj. Тасе3. Тэйт4. 43) черный оксид трехвалентного ванадия (V203″) получают восстановлением VaOs водородом при 700°С. медленно взаимодействуя с кислотой, он образует соль, которая является очень сильным восстановителем.
Очень легко окисляется на воздухе. 44) V203 (Мп.1970°C) растворяют в плавиковой кислоте и раствор выпаривают с получением темно-зеленого VF3-3H20.С многочисленными 1-валентными (и 2-валентными) фторидами металлов VF3 образует тип MjVF $(обычно выделяется с кристаллической водой) и mjvfe compound. An примером может служить светло-зеленый K3VFe (mp 1020°C).Безводный VFj удобно получают термическим разложением (NH4) 3VF».
Он имеет зеленовато-желтый цвет и нерастворим в обычных растворителях и растворяется только при температуре около 1400°C. оксо-фтор-VOF также известен. Трихлоридные Виас могут быть получены разложением VCI4 путем benitengdal. It представляет собой фиолетовый Нелетучий Кристалл, легко растворимый в воде и зеленом растворе.
При концентрировании последнего (при отсутствии кислорода в атмосфере) выделяется зеленый гигроскопический кристаллогидрат VCI3-6H20.Черный бромид и йодид, подобные трихлориду ванадия, как правило, схожи по свойствам, но менее стабильны. Образование комплексов С галогенидами других металлов рассматриваемого соединения не является типичным, но известны некоторые производные этого типа.
Например, красная соль a \ 2VC! Ы-Ч/) (М-К здесь. Rb. Cs, NH4) и K3VC! (Mp. 744°C).интересное изменение цвета KaVCls lNgO по значению N \ violet(0).Красный(1).Зеленый(4). ВК! При взаимодействии аммиака с 3 образуется v (MH2) Cl2, который составляет около 300 ° С Введите в(Н’Х) конфигурации, тогда ВН».В жидком аммиаке, красно-коричневый[в (NН3) 6) С!3 даст. 45) схема 2voc1 * DN протекает в соответствии с VOCl3-f VOCs 300 eC! (Или VJOJ и VC в запечатанной трубке!)3.
При нагревании смеси в течение длительного времени) оксокролид 3-валентного ванадия может быть obtained. It является твердым brown. It практически нерастворим в воде, щелочах и кислотах. Термическое разложение VOCI происходит только при температуре около 800°C. знаменитый фиолетовый VOBr. 46) среди сульфатных производных трехвалентного ванадия наиболее характерной является зеленая комплексная кислота H [V(S04h) — lH3O (n * = 4 или 6) и ее соли, преимущественно типа M {V (S04j2) — 12Н?0.
Они в основном окрашены в различные оттенки фиолетового, но они обеспечивают зеленый цвет solution. At достаточно высокие концентрации этих растворов по отношению к кислороду воздуха относительно стабильны и лишь медленно окисляются. V *(S04) 3 безводный желтый цвет и плавит очень медленно к iodine. In вакуум около 400°С, он разлагается по схеме:\’; (S04) 3 = SOi-2VOSOj.3-валентный сульфид ванадия, который является темно-серым, представляет собой фазу с другим составом(VSi. от него до ВС: диапазон однородности диапазона).
47) производные, соответствующие кислотной функции V (OH) 3.Получают сухим методом-Vs03 и путем плавления наиболее активного оксида металла. Эти примеры-Ливо *и Навой. Представляет собой нерастворимый в воде черный порошок. 48) коричневый NbCI*, нерастворимый в воде и разбавленных кислотах, получают путем восстановления NbCU при 400°C водородом. Черный N’Br3 и N’bl3 находятся рядом с ним в собственности. Темно-синий NbF3 был получен нагреванием водородного ниобия в потоке Hj-f-HP. Устойчивый к сильным узлам и алкалиу.
49) трифторид тантала сходен с N’B3 как по своему составу, так и по своим свойствам. Зеленый TaC13 может быть приобретен tac14 dismutney (дополнительный 41). В отличие от нерастворимого NbCU с водой, он образует зеленый раствор с сильными восстановительными свойствами. Щелочь выделяет зеленый осадок Ta (OD) 3 из этого раствора. Этот осадок при нагревании окисляется водой (образуется водород). Если TaC13 сплавлен с Cs. Rb.
Тип mjtaclj Красной комплексной соли сформирован в K и отличает точкой плавления 710.642 и 560 ° С. Серо-зеленый TaBr3 был получен восстановлением TaBr водородом при 700°C. 50) 下記分 分割されたv.NB и Ta, заполняя поток азота, можно получить общую формулу три N их серого нитрида. 一 一般式式3nの 灰色色の 窒化物化物は、一 一般式式3nの 灰色化物を すする す。Все они водостойкие и высокая степень огнестойкости(ВН плавится при 2050 ° с).NbN при 2300°C, TaN растворяется только при Л090СС).
Известен также фосфид с аналогичным составом ER. Opsai, характеристики элементов, рассматривающих кристаллическую фазу с другими кристаллическими фазами по in-VjN, также были низкими. НБ, Н Nb3N4, Таан, Ta4N *. ТАС.\ Е. ВП. V3Pj. V2P. V, p. NbPa, TaP2. Нитрил VN характеризуется очень высокой твердостью. 51) формально для трехвалентного ниобия и тантала установлено присутствие селенида EbBe3.Кристаллическая фаза Nb33a состав тоже известен(Е С. ЮВ.- Тэ).
52) размерный оксид (VO), соответствующий двухвалентному ванадию, образуется при нагревании до 1700°C V/) с потоком водорода. {Na Tin и d (VO)■2.05 L] для инвариантности кристаллической структуры состав имеет формулу VO (VOnk-VOi. существует возможность достаточно большого отклонения от строгого соответствия с (в ТС).Оксид ванадия-это очень скрытая вещь, которая проводит электрический ток.
Нерастворим в воде, но растворим в разбавленных кислотах, образуя соответствующие соли (окрашенные катионной кислотой V).Последний является очень сильным восстановителем, в отсутствие окислителя газообразный водород постепенно выделяется из воды. Сера получается, когда щелочь воздействует на раствор. Но поскольку он очень легко окисляется, фиолетовый осадок V (OH) 2 выделяется в чистом виде.
53) бихлорид (VCIj) получают с использованием 2VC1S»VC14 + VCIj при температурах выше 500°C, согласно схеме. Его зеленые кристаллы растворяются только при температуре около 1350°C, и из—за окисления от V-до V-фиолетовый водный раствор немедленно становится зеленым. Является ли свойство сокращения VCIj еще более мощным, чем свойство сокращения CrCl? (ВИМ§ 5 добавить.
66).Свойства коричневого бромида (VBrs) и красного noidnd (Vla) подобны. Первый иногда используется в фотографиях (как быстрый разработчик).Второй-получить очень чистый ванадий (за счет пиролиза при 1400°С).Бледно-зеленый VF * выделяли в виде сине-фиолетового кристаллогидрата VFj-4HjO. При слиянии KS с VCI}! KVClj(Мп.946°C) и нестабильным KjVCli является formed. In в случае галогеновой извести VT2, аммиак достаточно стабилен. 54) двухвалентный сульфат ванадия образуется при восстановлении (или электролизе) металлического цинка из сульфатного раствора соединения ванадия.
Принимая специальные меры предосторожности против окисления, он может быть отделен в виде фиолетового кристаллогидрата VSOt-7HjO. In некоторые 1-валентные сульфаты металлов, VSO образуют фиолетовый комплекс»Mj-типа (V (S04))» 1-6Hj0.Последний относительно более нерастворим и более стабилен, чем сам сульфат ванадия, который имеет 2 валентности. 55) черный ВС получают непосредственно взаимодействием элементов при 1000°С. Его кристаллы содержат определенный избыток серы (состав вси. Я? Вы также можете импортировать свои собственные файлы (до определенного момента).
То же самое характерно для NbS и NbSe. Также известны NbTe и TaSe. н в…«Рисунок 1Х-6я. Схема гтгос- 56) низшие оксиды тиобия и тантала, полугруппы E $ C1 | 3. По схеме 3iOi-4-ЗС » ЗСО-4-2эо, величина в вакууме при 1100 ° с. Хорошо изученный серый НБО(Мп.1935 ° C) имеет металлический вид и довольно хорошо проводит ток. 57) NbCl $паром (в потоке аргона) и действием металла ниобия, нагретого до 700 эк, получают черно-коричневый NbCJt. Адихлорид кнопки стабилизирован в воздухе и неразрешим в воде.
Восстановление N’BLJ водородом при 300°C было вдвое меньше, чем у Черного Nblj. В отличие от хлорида, он медленно расщепляется водой, что также известно (он был получен путем восстановления NbBrs водородом во время разряда). 58) темно-зеленый энергонезависимый TaCli может быть получен путем вычисления tac1 при 440°с в соответствии с уравнением ЗТаС1 > — Tacit + 2тас1щ. Несмотря на факт.
Поскольку TaClj фактически не растворяется в воде, водород уже выделяется на холоде и постепенно окисляется TaClj. 5c) тантал и другие оба имеют отличительную атомную группу ECC (/его структура показана на рисунке IX-68 (rf (NbNb) 2.85.Дж(Тата)= » 2.88.»I {НКО-2.41, rf (TaCl) 2.44 A].Эта группа содержит зеленые кристаллы, отделенные от раствора ES HCI! Продукты восстановления, содержащие металлический свинец, 600°C прямо. Состав этих кристаллов-E C! R-7I20 еще не ясно, но в последнем случае он должен содержать e-атом с другой точностью.
Смотрите также:
| Фосфор | Углерод |
| Подгруппа мышьяка | Органические соединения |
