Оглавление:





























Органические соединения
- Органических компонентов. Далеко позади всех остальных элементов богатство и разнообразие производных его углеродных листьев суммировалось: химическое соединение не кипело, а в его составе изучался С, который содержит много, углеродных соединений из полученных менее трехсот тысяч ближе к 300 million. To в этой ситуации детальное изучение химического состава угля выделяет самостоятельную область, обычно называемую органической химией, по типу.
- Один Исключительное разнообразие соединений углерода обусловлено некоторыми особенностями самого атома углерода. С другой стороны, атомы, которые накапливаются в этой молекуле, и молекулы с другими элементами устойчивы, в условиях обычного YC, в котором пищевая композиция цепных атомов углерода, содержащихся в ней, несколько хрупки. После большей части длины углерода цепочка идентичных атомов Nye, как известно, является серой.
Наиболее важным из них является способность образовывать прочные связи свя друг с другом. Людмила Фирмаль
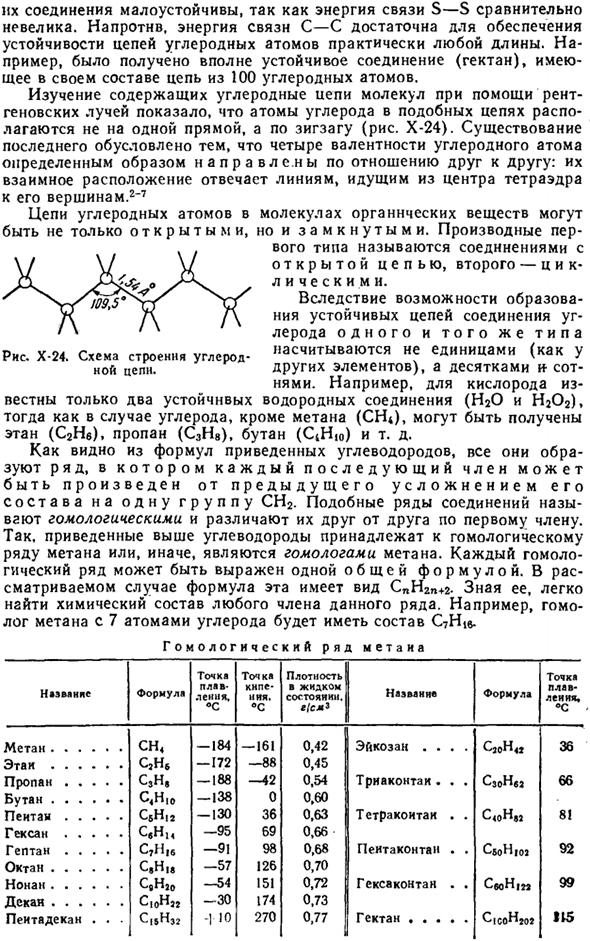
Однако、 Соединения, которые их содержат, нестабильны. Энергия связи S-S относительно мала. Напротив, энергия связи с-с достаточна для обеспечения устойчивости цепочек атомов углерода практически любой длины. Например, полностью стабильное соединение (гектан) получается в этой схеме со структурой 100 атомов углерода. Исследование y-лучей, содержащих молекулы углеродной цепи методом рента, показало, что атомы углерода в цепи Распауд-лага расположены не по прямой линии, а зигзагообразно (рис. х-24).
Наличие последнего обусловлено тем, что 4 валентности атомов углерода направлены в определенном направлении друг к другу. Их взаимное расположение соответствует линии от центра тетраэдра до его вершины.2-7 Цепь атомов углерода в органических молекулах Но и закрыто тоже. Производные представляют собой соединения с первым типом цепи Лейна, вторым-ЦИК-Кристалла. УЗ лерода однотипного стабильного контура соединения ближних из-за возможности образования имеет не один (как и другие элементы), а десятки и сотни нями.
Например, из большего количества кислорода Вестн 2 можно получить только одно стабильное водородное соединение (Н2О и Н2О), метан (в случае углерода, отличного от СН, с другой стороны 4), Этан (в С2Н2), пропан (С3н8), Бутан (С4н10) и др. Не только атом открыт、 Рисунок Х-24. Схема конфигурации углеродной цепи соляной кислоты. Как видно из вышеописанного термина углеводороды образуют оболочку, состав которой может быть получен из предшествующей сложности 1 группы, серии CH 2.
Подобные серии соединений называются вают различают друг друга в 1-м члене homology. So вышеуказанные углеводороды являются гомологами метана или иным образом метана. Каждая гомология калибровки номер один может выражать общее formula. In в расе присутствует случай, вид этой формулы C имеющий N H 2 N + 2-найдя химический состав любого члена этой серии легко его узнать.
Например, 7 атомов углерода гомолога метана, становятся частью C7 HTE. Серия гомологов метана Позиция Формула* Точка расплавленного льна. «*In C Вейл Пойнт Ниджа. Плотность жидкостей Условия. * От 1 до 3 Позиция Формула Тает Леня、 °С CH 4 — 184. −161. 0.42 Товары славы…. Тридцать шесть С. Р № 6 −172. −88 0.45 Пропан 3 В Н — 188. −42. 0.54 | Контакт с Триером.。。 С 3 О ВА Шестьдесят шесть C 4 Ч,<> −138. Ноль 0.60 Пейтон Мэннинг 5 N 2 | — 130. Тридцать шесть 0.63 Тетра Котай Таиланд.。
Есть „ой“ Восемьдесят один Мистер Хак. Н 4 — 95. Шестьдесят девять 0.66 С 7 н с −91 Девяносто восемь 0.68 Не рекомендуется использовать это лекарство.。 С М Ч С IOS 92. Октановый. С н» −57. Сто двадцать шесть 0.70 Нунан. От C до H2O −54 Сто пятьдесят один 0.72 Гекса Контан.。 «О | и Девяносто девять Настоятель. C / 0 H} 2 −30 Сто семьдесят четыре 0.73 1 Это уничижительный термин.。• С $ Н Е2 — МИССУРИ. 270. 0.77 С / Кон} 07 Сто пятнадцать Гомологичные последовательности являются яркими примерами работы if-переходов quality.
In факт, «если вы каждый раз добавляете группу CH2, вы получите качественно отличное тело от предыдущего» (Энгельс). Данные в следующей таблице показывают, что первые 4 члена конгениальной последовательности-метан при нормальных условиях являются газами, а следующие-жидкостями, затем твердыми телами. Физические константы гомологов перестановок достаточно законны.
Плавление и регулярность по отношению к его температуре кипения (как с увеличением константы молека, т. е. с увеличением массы Урала) обычно сохраняются для других гомологичных рдо, а в связи с плотностью имеют иногда обратную характеристику Тер (т. e. As молекулярная масса увеличивается, плотность уменьшается). Все члены одного и того же гомологического ряда являются similar. In в частности, гомологи метана характеризуются той же реакцией, что и сам CSC, и разница становится очевидной только тогда, когда курс несколько легче.
Ряд естественных изменений физических констант значительно облегчает изучение органической химии. Зная 1 характеристику членов ряда, можно получить достаточно четкое представление об остальных характеристиках. Углерод характеризуется тем, что, помимо наличия устойчивой цепи, прочность валентной связи между водородом и различными полуметаллами относительно близка. Последнее можно увидеть из обычно цитируемых данных о средней энергии связи.
Параллель Менно, и ее средняя длина: Связь C-C, C-N, C-O C S C-N C-F C-C1 C-BR CI Длина связывания, а 1.54 1.10 1.43 1.82 1.47 1.38 1.77 1.94 2.13 энергия связывания、 ккал / моль… 83 99 86 65 73116 81 68 51 Как правило, не все рассматриваемые отношения являются o и O gen. 8-9. Это влечет за собой значительные последствия в отношении противостояния органическим реакциям меттл Кания.
Большинство неионогенных валентно-связанных углеродов не подвергают практическому соединению с помощью электролитической диссоциации. Но реакция обмена между электролитами протекает практически мгновенно, поскольку АИС сводится к сочетанию тех или иных сочетаний, а существующая ions. In напротив, химические взаимодействия между нейтральными молекулами происходят гораздо медленнее в лени, что связано с их частичным разделением.
С другой стороны, отсутствие резкой разницы между энергиями образования другого звена также медленно, несовершенно протекает процесс Kania. As в результате время, необходимое для завершения данной реакции между измеряемыми органическими соединениями, обычно составляет несколько секунд или несколько минут, а не час, и реакция не достигает круглого конца, который часто протекает со значительной скоростью только до повышения температуры.
И-12 Отсутствие ионных связей является основным фактором в низкополярном скрапе большинства органических молекул в обуслов лении цэ. Внешне это проявляется в относительно низких температурах плавления и кипения образуемых ими веществ. Например, NaCl плавится при 800 и кипит при 1465°C, но почти все органические соединения плавятся и кипят при температуре менее 300°C и разлагаются при нагревании до высоких температур.13 ″ 15 Простейшими органическими соединениями являются hydrocarbons.
In помимо простых связей C-H и C-C, их молекулы могут содержать двойную связь C = C и тройную связь C»C. Средняя энергия этих связей обычно равна 146 и 200 ккал / моль. Химические свойства углеводородов не имеют множественных (двойная соляная кислота для общих свойств метана повторяющихся или тройных) связей. Множественное связывание обычно сигнализируется к ее наклонам, добавление введения Носта реакции к molecule.
It отмечается, ссылаясь на щенное ненасыщение его состава природой ненасыщенных (ненасыщенных) веществ, содержащихся в множественных связях. Например, углеводы, ненасыщенные, простейшие, этилен (H2C = CH2) и ацетилен (H-BES-H) — легко присоединяются. Реакция присоединения связана с переходом множественных связей между атомами углерода в простые связи.
Относительная легкость перехода приводит к однородности в N-ненасыщенном характере. 1 * » 34 C-H, Halo (средственно ненасыщенное углеводородное присоединение галогена путем замещения NLI водорода на NEPO) органически образованные производные галогена. Поэтому при замещении водорода на хлор в метаноформированном метилхлориде (CH3 REC C1) вытесняется водород-хлористый этилэтан (C2 HjCl) D. As это видно из примеров. Т от названия дятся названия проду Галогенида, содержащего углеводородные радикалы или алкил (в этом случае такими радикалами будут метил-СН3 и этил-С2Н5).
Формула вводит следующее ограничение реакции между углеводородами и галогенами. Резус + г 2 = нг + ИГ Пухлый, алкилгалогенид (РТ) в большинстве случаев представляет собой бесцветную жидкость, как и другие простые производные. carbohydrates. In вода, она почти нерастворима. Соединение между другими галогенуглеродами уменьшает ряд F-C1-BR I, в то время как тот же ряд увеличивает реакционную способность алкилгалогенидов.
Большинство из этих реакций обмена галогенов основаны на различных свойствах (NH2, OH и др.), и поэтому используется в синтезе алкилгалогенида Ши Рокко.35-45. Взаимодействие аммиака (в спиртовом растворе) с алкилгалогенидами по схеме Rr-f NH3 = s NG-f RNH 2 Образовавшиеся Амины (RNH-2) являются органическими производными аммиака. Нижние члены конгенеров Аминов не являются достаточно растворимыми в воде, и по мере их увеличения растворимость R уменьшается.
Переход к гомологии такого рода приводит к снижению ском рядных характеристик в водорастворимых не только в аминах, но и в других видах органических соединений. Водный раствор Аминов подвергается щелочной реакции в результате комплексообразования по схеме RNH 2 + HOH [RNHsl * + OH » Кислота Амины (такие как большинство и NH Ы) прямая ППР поколения -например, в форме солей. RNH 2 + HC1 = [RNH 3] C1 Поэтому введение аминогруппы (- NHa) в органическое соединение раскрывает свойства основания.
44-51 Под действием воды на Галогенированные алкилы их гидролиз наиболее легко протекает постепенно (узелковый алкил): Rr + HOH ^ ROH + NG Добавление алкалиа значительно ускорит ход реакции и перенесет его все еще весие right. As в результате, алкоголь (ROH) является formed. It можно считать продуктом замещения 1 алкильного радикала водорода в воде. Введение гидроксильных групп передает свойства амфотерных соединений органическим молекулам.
Однако диссоциация спирта (другими словами, спирта) еще меньше, чем диссоциация воды, поэтому сам спирт и его водный раствор не проводят электрического тока. Бисексуальный характер, с одной стороны, доказательство алкоголя, провинция обратимо-дегенеративная, с другой, реакция их образования выше (если на спиртовой основе) — протекает по контуру 2ROH + 2Na = 2RONa + H 2 Взаимодействие с металлическим натрием (если спирт действует как кислота); 64 ″ 2 Если спирт можно рассматривать как продукт замещения 1 алкильной группы водорода водой, то оба водорода в одном и том же ного замещения аналогичными продуктами эфира(ROR).
Их взаимодействие с водой приводит к равновесию ROR + HOH 2ROH Это, однако, лишь значительный процент, когда температура потышенных устанавливается. В этих условиях использование водных соединений (например, Р2О5) позволяет получить простой эфир, равновесие которого почти полностью смещено влево, начиная со спирта. Эфир-довольно инертное вещество. Например, металлический натрий не работает при комнатной температуре. Летучесть больше, чем у спирта, из которого они происходят сложные эфиры(т. е. Растворимость в тельных водах меньше их температуры кипения), причем значительная.63-71 Присутствие гидроксильной группы (- он) в молекуле спирта значительно снижает прочность соседних С-Н bonds.
In с точки зрения спирта, каждый углерод легче окисляется водородом. Их окисление, например, по схеме CH3CH2OH + O (от окислителя)= H 2 0 + CH 3 CHO Соединение, характеризующееся наличием радикала CHO в молекуле, называется альдегидом (общая формула RCHO). Двойная связь c = 0, имеющаяся в альдегиде, очень просто re продолжает тип с отпуском валентности угля к простому (C-O) и oxygen. In в связи с этим Реа действует на типичные альдегиды. Однако (=со) группа карбонила кислорода сильно активирует соседние с-Н связи, причем вода в последней может быть легко заменена на ОН-группу.
Такое замещение связано с введением атомов кислорода в молекулу, и поэтому оно сводится к окислению aldehydes. In в поле зрения альдегидов возникает восстание сенаторов, и к тому же оно довольно сильное. Многие из них постепенно окисляются кислородом воздуха.72 * 75 Кетоновое соединение Формулы R 2 CO тесно связано с альдегидами. Из-за наличия карбонильных групп кетонов, но это полезно для альдегидов, в то время как смягчающие свойства не характерны для них, склонны к дополнительным реакциям.76 ″ 80 Продукт, полученный в результате окисления альдегидов, содержит карбоксильную группу (- COOH) и называется органической кислотой (общая формула RCOOH).
Например, окисление уксусного альдегида приводит к образованию уксусной кислоты. CH3 CHO-f O (от окислителя)= CH3 COOH Наличие связей C = 0 и C — OH вблизи одного и того же атома углерода сильно влияет на его свойства. Под влиянием первой группы он (в отличие от альдегидов, кетонов, N) реакция присоединения актеристической кислоты вылечивается, становясь Неха. С другой стороны, йод, благодаря эффекту связи C = 0, водород гидроксильной группы становится кислым.
Заметим, что органическая кислота диссоциирует много спирта и воды, но характерны «минеральные» кислоты (DK, по сравнению с HNO3, H2S * и R).Н.), разобщенность их подавляющим большиством еще невелика. Поэтому можно сказать, что органическое соединение типа RCOOH обычно является слабой кислотой.81 ″ 90 Реакция Тимая при взаимодействии кислот со спиртом обра медленная эте р и Р и q и формально аналогичная нейтральная: RCOOH-f-HOR H 2 0 4-RCOOR Таким образом, полученный сложный эфир (общая формула RCOOR) является веществом, сходным по образованию с солью. Но они существенно отличаются от солей по свойствам, они представляют собой бесцветную, летучую жидкость, плохо растворимую в воде. Основная причина такого несоответствия в природе и сложности соли в руках одного из правительств, а-Эстера заключается в резком различии ионогенности связи О-М (металл М) О-Р С-Н. К классу сложных эфиров относятся жиры, которые широко используются в технологии: органические растворители, пахучие вещества и др., и входят в состав почти всех живых организмов и служат 1 из основных продуктов питания человека.
91-9 Благодаря обратимости сложноэфирного реакционного препарата за счет реакции воды и последней реакции, частичному гидролизу катионов подвергают кислоты и спирты. Только под влиянием гидролитической воды (обычно называемой их собственным эфирным омылением) сложное правительство чая очень медленно прогрессирует, но особенно в присутствии кислоты и щелочи оно означает ускоренные тельные процессы. При кипячении в растворе NaOH эфир быстро кенилизуется по схеме. RCOOR-f NaOH = ROH-f RCOONa В частности, существует мыльная, предварительно полученная из природных жирных веществ смесь натриевой (реже калиевой) органической соли, входившей в состав масла Сгиачовой кислоты.97 ″ 99 Помимо жиров, животные и растения содержат вещества, относящиеся к классу углеводов и белков.
Противоположность этому-единый тип углеводородной группы, характерная группа(OH, CHO и др.). D. In помимо вышеперечисленных производных, содержащихся в молекуле, углеводы и белки представляют собой соединения со смешанной функцией. Молекулы углеводов, наряду с некоторыми он-группами, обычно включают группу CHO. In в связи с этим одновременно характеризуют углеводную природу шипов и спирт, и альдегиды. Само название этого класса веществ, содержащих, в частности, такие важные продукты питания, как обычный сахар (Сюняон) и крахмал, обусловлено тем, что их водород и кислород характерны и находятся в том же соотношении, Цсвнюо), что и в воде (то есть число атомов кислорода больше в 2 раза). RTC-F-MH 2 0 (то есть как бы вода и соединения углерода). Организм животного содержит относительно мало углеводов.
Напротив, в растениях они образуют большую часть ткани. Последний состоит в основном из волокон, которые имеют тот же состав, что и крахмал, но имеют еще большую молекулярную массу. Крахмал(.P. It является одним из основных продуктов питания человека (в виде муки, крупы, картофеля и др.), и волокно делает его одеждой (с хлопком. Д. Кон и древесина, получаемые при обработке различных растений Воло УЦ, не считая количества творческих культурных потребностей (бумага), другие профессиональные удовлетворяют топливу (древесина), давая исходный материал для (древесина).
Наиболее важными ляються белковые вещества для жизни органических соединений ЯВ.»Везде, где мы идем, мы находим жизнь, она ассоциируется с какой-либо белковое тело»(Ф. Энгельс).Кроме углерода (50-55%), водорода (6.5〜7.5), Китти состав белков loroda (19-24) и азота (15-19), как правило, включает серу (2,5%), а иногда и некоторые другие элементы (c, Fe, Си и др.).Структурная формула природных белковых веществ известна только отдельным представителям. Изучение продуктов его разложения показало, что фундаментальную роль в образовании белковых молекул называют основанием-содержащее органическое соединение NH2 играет в его структуре, называемой CUOH, аминокислота амино.
Эти соединения характеризуются либо временем (это связано с наличием этих основных функций в группе NH2) и способны соединяться друг с другом, образуя кислотные композитные частицы (по COOH), но по своим свойствам приближаются к молекулам даже простейших белков. Поэтому искусственный синтез важнейшего природного белка еще не осуществлен, но уже сделано несколько важных шагов в этом направлении.10 ° −10 секунд Как видно на примере углеводов и белков, частица Кула (которая обычно седативно несколько изменяет свои свойства), которая в то же время вся моль замечает, что не только 2 и более специфических групп могут содержать органические соединения.
Очень это на самом деле приводит к разнообразию органических веществ в чае. В еще более широком диапазоне, это разнообразие связано с возможностью различного расположения атомов в органических молекулах. Не говоря уже о веществах с более или менее сложным составом, Бутан (СНю), 1 из простейших углеводородов, возможны 2 различных строения CH3-CH g-CH 2-CH 3 и HC(CH 3 )3 Нормальный бутан изобутан Кроме того, на практике известны 2 углеводороды, соответствующие формуле C4H10, но они отличаются по свойствам. Например, обыкновенный Бутан кипит при 0°С, а изобутай кипит при −10 ° С.
такие соединения характеризуются одинаковым составом и молекулярной массой, но называются изомерами, существует различное расположение атомов в молекуле, а сущее явление-изотропия-изомер соединения (изомер).104-107 Число возможных изомеров для устья заданного вещественного состава, основанное здесь на установленной во времени Бутлеровой А. М. (1861) ли теоретической химической структуре, согласно которой » сложные химические свойства частиц определяются типом основных компонентов и величиной их химического строения.«следующее домашнее химическое соединение, которому каж должен соответствовать определенный состав-формула температуры.108. 1. одним из важнейших положений теории химического строения является принцип взаимного влияния атомов.
Суть этой теории состоит в том, что свойства каждого из них зависят не только от его ГСССТВЕННОЙ природы, которая входит в состав химических соединений атомов, рассматриваемых соединениями UO, но и от свойств других атомов, которые стремятся образоваться. Не только непосредственно связанные с данными непосредственно атомными, но и затронутые им и в то же время правительством irrelevant. So, в CH3COOH кислым свойством обладает только водород, связанный с кислородом. Ного влияния явного хорошего примера нение SNzSOON (2-10 -: 5) = CH 2 S1SOON (YU-3-CHC1) 2 COOH (6.10-2) — CC1 3-COOH (210 — 1), где непосредственно связанный атом может выступать в качестве measure.
As как видно из приведенных выше данных, в М Е хлорированном воддроде замещение тнльного радикала уксусной кислотой кнсловоты сопровождается быстрым ростом ее кислотного карбоксильного водорода. Теория химического строения является ведущим теоретическим БА Зоэ органической химии. Она утверждает, что, особенно для веще ства предписанного состава, могут существовать как изомеры, так и различные структурные формулы, это возможная теория для ретического построения. Выводы структурной теории полностью подтверждаются experience. In во всех проверенных случаях удалось получить все предсказанные изомеры. Число последних быстро увеличивается с увеличением числа атомов в молекуле.
Например, если углеводородная композиция C7H| B, C может быть 9 для 0h 22 75, C ^ NGV-для 355, для рукава^ — для более чем 366 миллионов и OoNi-для более чем триллионного изомера 62.109. Исходя из вышесказанного, огромное значение структурной формулы органической химии имеет obvious. In дело в том, что они жают после карты, в то время как четко определенная простая формула дает лишь представление о несколько более крупных веществах, сходных по групповому составу веществ, но отличающихся по свойствам.
Однако связывание между атомами правительства, указывающее на Расположение карты в молекуле, вызывает проблемы свойств соединений, которые позволяют сделать важные выводы о структурной formula. As сокращенно для этой принцессы, это, следовательно, номические свойства хорошо поняты опытными химиками. Сто десять Необычное разнообразие органических соединений можно обнаружить среди них с помощью разнообразных веществ, с самого начала обладающих противоположными друг другу свойствами. С другой стороны, он также реализует свойства вариации перехода, которые хочет установить урар.
Благодаря обоим этим свойствам органические соединения находят широкое применение на каждом этапе жизнедеятельности человека и постоянно используют для приобретения новых ИС. 111-3 Добавь 1) теперь правильнее было бы рассматривать органическую химию как химию углеводородов и их соединений. derivatives. It считалось, что в то время (более 150 лет назад) сохранилось название «органического» химического рода, е-неральное и органическое (Н жнвотный флора), которое можно резко разделить на два отдельных друг от друга»царства«.
В соответствии с общим духом господствовавшего в то время метафизического идеализма, разделительная линия между 2 «царствами» воспринималась как абсолютная и абсолютная. non-transitive. It казалось невозможным в принципе, потому что искусственно приобретенные временем личностные методы приписывались им как биогенные вещества, или продукты распада, но Ваня их вовлекал в»жизненную силу«.
Сторонники этого взгляда назывались тогда Виталистами (от латинского Vita-жизнь). Примат витализма привел к тому, что первый период развития органической химии был посвящен изучению различных веществ растительного и животного происхождения. Это исследование проводится с помощью естественных продуктов разложения fellow (..Анализ может относиться к развитию органической химии (т. е. переходу от сложного компонента к более простому-просто), а следовательно, и к рассматриваемому этапу анализа.
Попытки идти по пути синтеза (то есть перехода от простого к сложному) вообще не имели места, поскольку с точки зрения витализма она была заранее обречена на провал. Первое нарушение Виталистического мировоззрения было нарушено открытием Веллера(1828).Испаряется раствор цианата аммония (NH «NCO»), вещества, называемого»цианид«.Тот «органический» материал, который верлея получила неожиданно-моча вины, перспектива внталнзма, сформированная из учения должна [со (N112) 2), обновить в себе» жизненную силу».»
Солнечный свет от циановокислого аммиака до мочевины повторно прост и группирует атомы. Однако в эпоху Велера его творчество имело огромную линейку, в основном основывая опыт на его важности, так как впервые сложилось мнение о виталистическом понятии правильности. Логово Виталистов в новом положении облегчается тем, что моча вина является»мусором«животного (частью мочи).Просто так, как вы утверждали виталисты, она могла искусственно напоить Чена.
В отличие от этого, живой организм (например, жиры или углеводы) из веществ, содержащихся в композиции, образуется только при поддержке «жизненной силы», и поэтому искусственно вырабатываться может УП. Такое «описание» опыта Велера сохранялось в науке около 30 лет, но в этот период оно было постепенно подорвано открытием новых возможностей перехода от»минерального»вещества к»органическому».Последним ударом по витализму стали жиры (Бертло, 1854) и углеводы(А. М. Бутлеров.1861), который был вызван антропогенным производством, веществом, которое больше не могло быть классифицировано как»мертвый мусор».«
Биологический.«Пы могут чаться, за возможность получить каждое из синтетических органических веществ», в 1864 г.- Писал А. М. Бутлеров виталистическая идея была очень сильна и хороша и оказала влияние на развитие органической химии Ноя. Примерно с половины последних ста лет эта наука требовала роста промышленности, чтобы продолжалось блестящее цветение, чтобы в результате синтетической искусственно свободной ликвидности, стало возможным получение сортов, которые по виду углеродных соединений значительно крупнее, чем их формы, направление естественного процесса кипения.
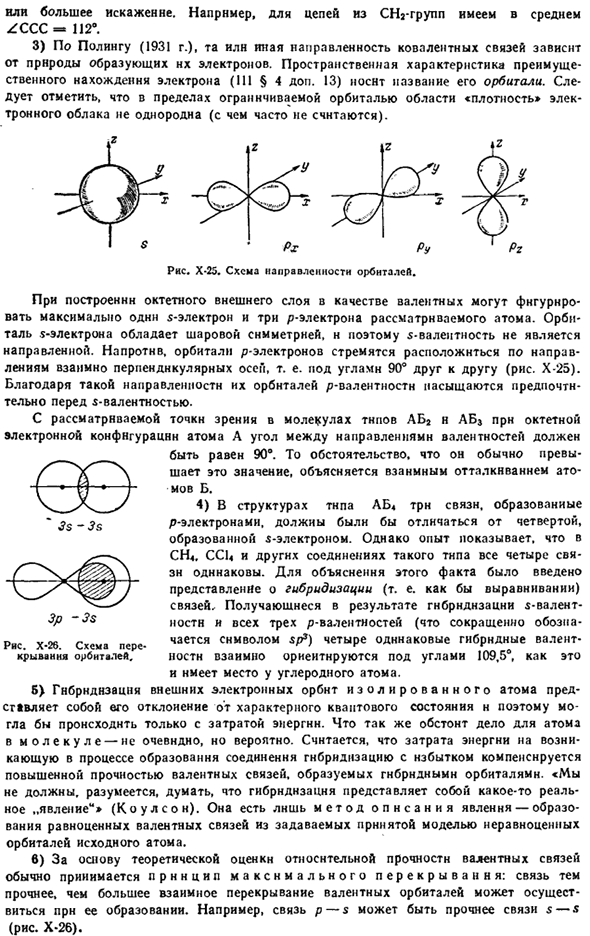
2) углеродная цепь х-24, показанная на диаграмме, соответствует точному положению тетраэдрического углеродного числа на структурной диаграмме, практически только тогда, когда встречаются все 4 атома, связанные с подобием (например, алмазы).Если эти атомы не совпадают, то тетраэдр подвергается меньшему или большему искажению. Например, средняя длина цепи из 2 СН групп составляет ZCCC-112°. 3 секунды-3 секунды Sp-3 секунды Рисунок Х-26.Схема повторного кривания орбнталей. 3) согласно Полингу(1931), противоположное направление ковалентных связей зависит от природы образующих их электронов.
Преимущества пространственных свойств электронного местоположения (111§ 4 Далее.13) ее называют орбитой. Далее следует в пределах орбитальной области»плотность» Элек и отметить, что трон (что не часто считается) облако не является однородным. ВЧ икс)\ Икс Px P» Рисунок X-2S. диаграмма направленности орбеналя. Самые крупные из них π-электроны и 3 p-электрона считаются атомами. поскольку орбита электрона s сферически симметрична, 5-валентность не имеет направленности. Скорее всего, электроны в орбитали Р стремятся оставаться в направлении оси лений перпендикулярно друг другу, то есть Е.
Рыскать друг к другу под углом 90°(рис.25-х).Благодаря такому фокусу его орбнталей район валентностн предпочитает насыщенные акции перед S-валентностью. С рассматриваемой точки зрения, в молекулах типа АВ 2 и АВ 5, имеющих октетное электронное расположение атома а, угол между направлениями валентности должен быть равен 90°.Дело в том, что он используется для предварительного просмотра, складки, эта величина обусловлена взаимным отталкиванием атомов мов В.
4)в структуре типа AB связь, образованная электроном p, должна отличаться от связи, образованной электроном S. Однако в опыте показано, что CH. CC1-4 и другие соединения этого типа имеют все 4 связи свя same. To объясняя этот факт, было введено понятие гибридизации связей (то есть как бы выравнивания).Гибридизация получена S-valent-nostv и (сокращенно обозначается 3 p-valentiostey символом SP) 4 идентичных гибридных валентных Носта, ориентированных под углом 109,5°, как это происходит с атомами углерода, друг к другу.
Б) гибридизация внешней электронной орбиты, изолированной атомом пре-с», прецессия его спина является отклонением от свойств квантового состояния, и поэтому МО ГЛА будет происходить только при потреблении энергии. То же самое не ясно и в отношении атомов в молекуле, но вероятность этого высока. При образовании гибридизационных соединений образуется гибридный орбиталямн, чем компенсируется валентная связь повышенной прочности, что считается трудоемким и энергоемким процессом.»Мы должны, конечно, не думать, что гибридизация представляет собой какой-то реальный»феномен»(совместно со мной и Л.
Метод описывает явление-от определения принятой модели начальных атомов неравной орбнталей, а затем способа бани равной валентной связи. В) принцип максимального перекрытия основан на теоретической оценке относительной прочности общепринятой валентной связи: взаимное перекрытие связи валентных орбнталей осущест вляет сильные, более крупные завитки при ее образовании. Например, связь p-s может быть сильнее, чем связь s — 5 (рисунок X-26). Следует подчеркнуть, что сами по себе орбнталь не имеют тенденции к взаимному перекрытию, так как они одинаково заряжены.
Их перекрытие является не причиной, а результатом развития химических bonds. To то, в какой мере это на самом деле произойдет, зависит от индивидуальных особенностей взаимодействия существующих атомов. Таким образом, оценка перекрытия базируется исключительно на типе orbit. It это по своей сути принятие возможности как реальности. Это схема, которая может описать некоторые экспериментальные данные несколько хорошо, но она также имеет предсказательную силу. Например, 2 перекрывающихся незначительных s-орбнталей на основе взаимных.
Низкая интенсивность HH в молекуле 11 ожидается 2-м правительством, тогда как на самом деле это соотношение составляет 1 большую часть NZ и т. д. В соответствии со своей максимальной способностью охватывать благотворные принципы, НИА такова: «человек силен, он есть.»»Статистически это может быть верно, но очень часто неверно оценивать силу человека только через рост. 7) Если гибридизация все же происходит, то NLN не может быть установлен непосредственно в определенных случаях, n Ba определяется на Ванье главным образом на основе NZ и косвенно обсуждается структура пространственной молекулы.
Простейший пример возможной неоднозначности такого решения дает МО молекулы воды. Если предполагается, что использование 2 атомов кислорода P-orbntaln (за исключением гибридизации) в нем для связывания с атомами водорода и P N S-orbntalya. mn против свободных электронов), то ожидание VALO ZHOH будет меньше равного 90°.С другой стороны, суммарную плотность всех внешних орбит атома кислорода Жох должны быть 109.5°(как в CH»).Экспериментально установлено Жох = 104.5°. Существует 3 основных подхода к отслеживанию в научной литературе величины аратации: гибридизация (в атомах кислорода) отсутствует, а разность углов от 90°обусловлена взаимным отталкиванием атомов водорода (приложение 3).б) в атоме кислорода происходит полная гибридизация внешних орбиталей(см. рис. IV-15).
А другой угол от 109,5°обусловлен поляризацией атомов кислорода протонами (или сильным взаимным отталкиванием орбиталей неразделенных пар по сравнению со связующим).В) S-орбитальные атомы кислорода сопровождаются промежуточной угловой буквенной частью NYM-briddation. Рисунок Х-27.Кузроджи-метрологическая бомба. Чаще всего используют последнее. Это самое простое в теории (чтобы отвлечь внимание от рассмотрения межатомных взаимодействий) и, следовательно, наиболее удобное для описательных целей.
- Например, объясните разницу в угле центрального атома.112°in (CH.) и O. 110°in C1 2 0. 104,5°в час 2 0. 103°Ки 2 с. 99°с (Ч) 2 с. 92 в IBS 3-перекрутить ее, только если степень участия разная-orbntaln. Однако такой подход практически дает только одно объяснение. Скорость этой степени основана не на параметрах взаимодействия атомов, что указывает, а фактически определяет ранговый угол (т. е. Его»свой«.«Потому что мы не можем сказать, что теория NZ-направленная (J. K. валентность следует точно за одной геометрической конфигурацией».
8) исходные данные нения эксперимента Hx нашли выход теплоты сгорания для расчета значения прочности связей в КПД organic. (Скакательная сталь-изготавливается полностью в спе нормальном металле).1. одна из конструкций таких бомб показана в RNS. X-27.In вннте отпустите, тогда точно! Из баллона с кислородом (баллон NZ), впрыснутого под давлением 25 / в баллон через канал B, в чашку помещалось взвешенное испытуемое вещество.
In теплосчетчик «бомба — теплосчетчик» для определения того, что это такое, как правило, изготавливают и самосожигают НЗ Людмила Фирмаль
Например, тонкая проволока L, помещенная в бомбу, будет выгорать и воспламенять испытуемое вещество, а количество тепла будет передаваться в воду калориметра, которая может быть измерена таким образом. 18 БВ Некрасова「 иавески вместо газообразного (т. е. газообразного вещества в баллоне, куда можно ввести объем газа расширения газа до заданного давления), происходит горение Вэ, а также вышеописанное.
Калориметрия широко применяется в технике определения теплотворной способности различных видов топлива (то есть теплотворной способности весовых или объемных единиц). 9) зная по опыту теплоту сгорания метана (192 ккал / моль), можно рассчитать так называемую теплоту образования атомов, то есть теплоту образования газообразных молекул СН4 грамм из газообразных атомов углерода и водорода*.Най, чтобы найти это значение разбивает сжигание метана на другой: шаг 1) (CH») ©-F 4 (H) — X образование ккал (атомная желаемая теплота); 2) © » {C} + 171 ккал (теплота атомов углерода); 3) 4 (H)= 2 (H 2) 4-208 ккал (теплота диссоциации водорода); 4) [Q + (0 2) =(C0 2) + 94 ккал (теплотворная способность углерода); 5) 2 (H a) — f (Oj) — » 2 (HjO) — f 116 ккал (теплота сгорания водорода) Общее NLN(4 в CH) + 2 (0)=(C0 2) 2 +(H、0)+(171 + 208 + 94 + 116) ккал х ккал. Закон Гесса 171+ 208 + 94 116 ккал — ккал-192 ккал, х=«(171 + 208 + 94 + 116 ) ккал-192 ккал-397 ккал.
Однако образование 1 моля метана из атомов углерода и водорода kuls приводит к образованию 4 C-H bonds. So, доля каждого составляет 397: 4 = 99 ккал. Когда атомная теплота образования различных гомологов метана вычитает отношение bonds-bonds связей, остаток становится отношением bonds-С связей. Средняя энергия такой связи обычно равна 83 ккал. Расчеты проводились и в других случаях: сначала находили атомную теплоту образования данного вещества, а затем значение всех связей, которые вы читали и уже изучали. Остальное (или соответствующая часть) дает желаемую теплоту образования связи.
Значения, найденные в этом методе, несколько сильно колеблются, даже если они рассчитываются и рассчитываются из различных соединений одного и того же типа. Выво Сары НЗ средние значения этих индивидуальных результатов (каковымн и водившиеся в организме) можно считать только грубой направленностью и потому тировочными. Вибрация отдельных величин вполне естественна, поскольку некоторая прочность связи зависит не только от природы ее атомов, но и от окружающей среды последних, т. е. от общего химического состава и молекулярной структуры входящих в нее атомов. to.
At в то же время влияние окружающей среды обычно не особенно выражено, поэтому полученные усредненные значения тем не менее дают почти правильное представление об общем характере этой связи с точки зрения прочности(поскольку работа разрыва численно равна энергии образования). 10) для сред, ищущих свою отправную точку, является е (СН), как видно из обычного способа на основе приведенного выше НЗ, где энергия связи основана на принципе аддитивности (III§ 6 доп 13) -.99 ккал / моль метана.
С другой стороны, отдельный расчет насыщенных углеводородов(см. Приложение 2 к книге) проводится с этаном E (CH)= 100 и E (CC)= «74,5 ккал / моль», с цепью из 2 групп, E(CH) — 101 и E(SS)= » 78 ккал / моль. По-видимому, последнее значение матери принять за точное среднее. 11) большинство органических реакций представляют собой реакции замещения с почти углеродными атомами. По основным признакам механизма его возникновения (аббревиатура нуклеофные обозначения Р С), электрические м и С Е (5х), Н, О, Ф радикал (с).Цифры справа обычно указывают на молекулярную природу реакции (добавлен IV§ 2.3).
Например, маркировка S * R2 реакцией нуклеофильного замещения Би-совместимых молекул. Активными участниками таких замен отрицательно поляризованными атомами (nlnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnn ннннн ННН НН nnnnnnnnnnnnnnnnnnnn nnnnnnnnn nnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnnn. Для электродинамического замещения верно обратное. НАКО Хефф, радикальный механизм, включает реакцию некоторых свободных радикалов.
Такая реакция, как правило, цепная (VII§ 2). в насыщенном атоме углерода есть обзорная статья о механизмах реакций замещения.[1]. 12) является простейшей органической группой метила (CH) и метилена (CH 2).Первый может быть получен, например, пиролизом тетраметилсвинца, который протекает по схеме Pb (CH3) = Pb-f 4CH3.По отношению к свободным элементам ОИ является сильным эндотермическим (теплота образования составляет 35 ккал / моль).
Несмотря на наличие свободных электронов, метильные радикалы имеют плоскую структуру (с другой стороны, радикалы CC1 имеют пирамидальную форму С d (CCl)= 1.74 A и ZC1CCI » 109.5°].Его потенциал ионизации составляет 9,8 в, время независимого существования 1000 минут 1 секунда. Затем, при отсутствии других возможностей, происходит полимеризация с образованием этана. В частности, метилен радона (также известный как карбонат) образуется при пиролизе диазометана (§ 1 add. 137). Что касается свободного элемента, то он прочен и эндотермичен (получаемая теплота-92 ккал/моль), но может существовать гораздо дольше бромида.
Его потенциал ионизации составляет 10,4 вольт.2 свободные электроны метилена в основном состоянии не спарены, но в ближнем (0,6 эВ) возбужденном состоянии они спарены. Для первого NZ задается линейный угол Nye-структуры I (CH) 1.03 A), для второго (D (CH)= » 1.12 A. ЖЧ = 103°J. Путем замещения водорода на хлор, уровень стойкого дихлоркарбена (CC1-2) в перевернутом положении к большему бо, хотя это по существу свободный радикал и обычно углерод tetralin. In частные, могут быть приготовлены STI, действие CC1 заключается в 4 ° C 1300 активированного угля и газообразных веществ (т. к. П1.-114, T.
In воздух (KBP-20°C), ген окисляется до PHOS. Для молекул CClj, мы нашли ионизационный потенциал ZC1CCI 113°с. ш. 9.8 В. Известно много других производных карбена. Например, при пиролизе PFjfCFsb (Мп-102, Мп +20°С) в соответствии с генеральной схемой pfv-максимальное прямое напряжение (МВ.)= пф $ — ф 3CF а Oifluorcarbene 1 <(СР)= 1, 30 а, ZFCF = » 105°, а = −0.46].Его положительный элемент NZ генерирует тепло CClj (39 ккал / моль) от сеет эндотермнчного до отретлей. Потенциал ионизации молекулы составляет 11,9 вольт. Существует специальная монография о карбене*.
13) большинство органических веществ растворяются при температуре менее 300°C и кипятятся. Если аппроксимация этой фигуры имеет место, то она обычно обусловлена не полярностью рассматриваемого соединения, а увеличением дисперсионной силы вследствие увеличения атомарности молекулы (111§ 7 доп. 3).Этот фактор влияния UA может быть визуально кнпення о температуре плавления, а текстовая таблица в основном соответствует гомологичной серии выводов часов methane.
As вы можете видеть от нее. Влияние увеличения атомарности молекулы влияет на обе константы, кроме того, при температуре кипения она становится намного острее, чем при температуре плавления. 14) причины разложения большинства полимерных органических соединений вится понимает исходя из следующих соображений, при нагревании до точки Стано Точка кипения достигает своей точки плавления reduced.
Tel ных 2 различных молекул, которые грубо выражают энергию валентной связи между 2 атомами конкретной молекулы, эквивалентную в 2 раза энергии молекулярного взаимодействия атома. Если число атомов в молекуле невелико, то работа разделения молекул значительно меньше работы разрушения валентных связей, и вещество»нормально» работает при нагревании. То есть растворитель кипит без decomposition. As атомарность увеличивается, а межмолекулярная СНЛ увеличивается, работа разделения молекул увеличивается все больше и больше.
Для частицы, состоящей из десятков атомов, она обычно соизмерима с задачей перерезания валентной связи, и в будущем она станет еще более важной. Поэтому нагревание таких веществ требует、 18 ′ За счет разделения молекул, за счет разрушения отдельных валентных связей в молекуле, то есть за счет термического разложения исходного соединения. 15) интересным углеводородом является адамантайский запах лагерного мозга (C, 0 Hie), в котором алмазоподобная структура его молекулы показана в РНС. X-28 [d (CC)= » 1.54 A, ZCCC = 109.5°].
В отличие от большинства других углеводов, он только плавится при 269°С и испаряется без разрушения (дух дальнейшего нагрева в отсутствие тележки).с точки зрения различных химических воздействий, адамантай очень стабилен. 16) расстояние (СС) d является простым, двойным, тройным свя зях соответственно в молекулах этана, этилена, ацетилена (ственной) 1,54, 1,34 и 1,21 А. расстояние D (СН) также несколько изменяется 1.10.1.09 и 1.06 А. молекула ацетилена является linear.
In в графстве все атомные ядра расположены в одной плоскости и ЖЧ-1 117°. 17) наличие двойной связи su в молекулах углеводородов * рисунок х-28.Структура вещества не влияет на свойства соседних С-bonds связей. о молекуле «дамантая«.Поляризация водорода соседствует с сильной положительной для тройной связи. Таким образом, ацетил-водород может быть использован вместо некоторых металлов, таких как натрий, чрезвычайно легко (§ 1, расширение 187).
18) Если атом из нативной тетраэдрической модели, в которой расположение атомной валентности углерода в интерпретационном пространстве продвигает классическую стереохимию(т. е. Кливер.. Ридизации СП 3) с 2 тетраэдрами валентности симметричным простым соединением угла отклика и двойными связями-2 тетраэдра с общим ребром, и тройными-2 тетраэдра с общей плоскостью. Таким образом, индивидуальная валентность множественных связей приобретает криволинейную форму («банановая» связь).То есть, ничто не идет по линии кратчайшего расстояния между ядрами обоих атомов.
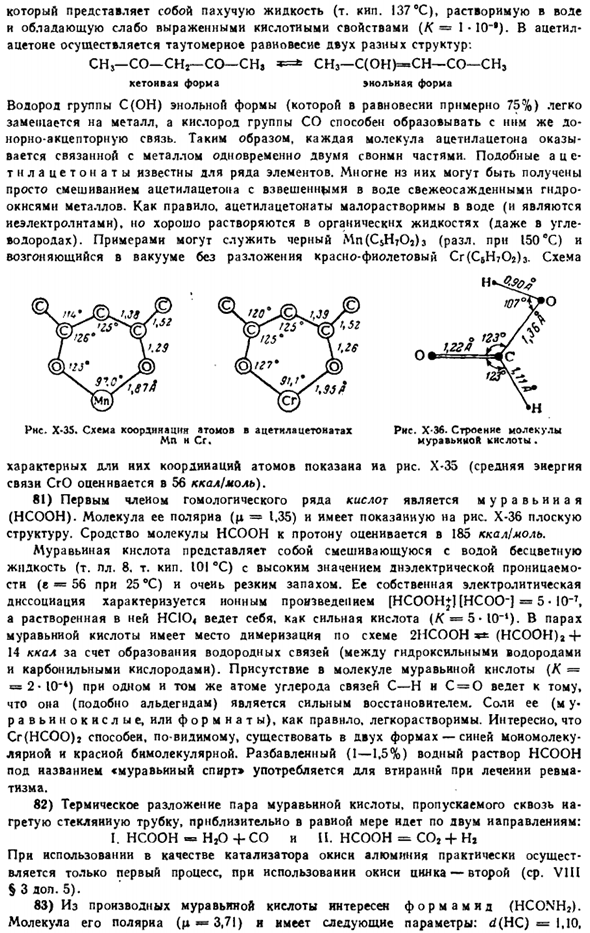
Другая точка зрения (введенная в более позднюю науку) исходит из того, что это валентная связь, соединяющая ядро атома по линиям кратчайшего расстояния между атомами[V и т. O (Sigma) — связь), следовательно, должна быть особенно цепкой обра зуется во всех случаях. Принцип несовместимости (VI§ 3 перм.3) поскольку UE может пространственно перекрывать более 2 валентностей, stey перпендикулярен направлению электронного облака, а другие участвующие B-обращенные массы множественных связей каждого атома и соединения.
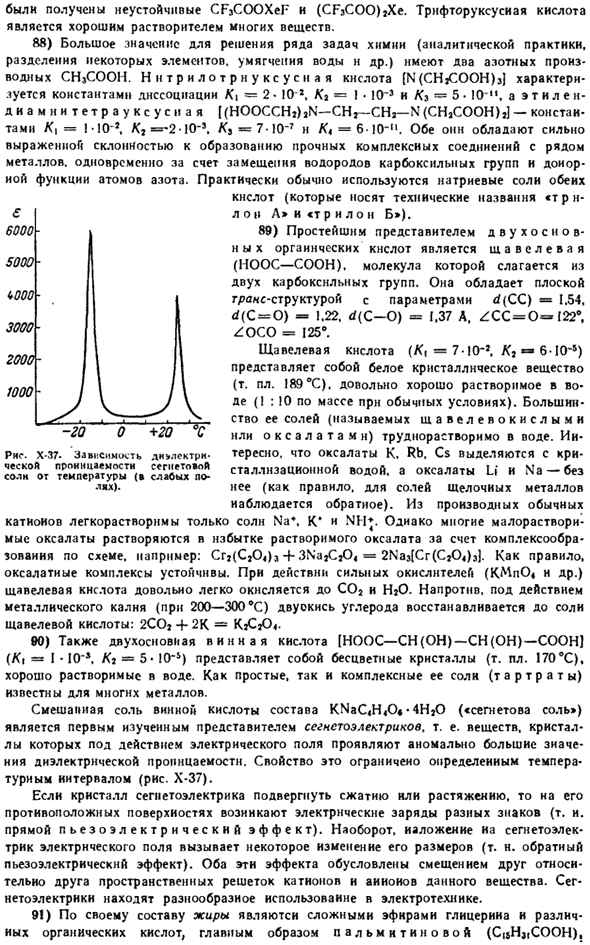
И друг к другу. Такая конфигурация неудобна из-за взаимного перекрытия электронного облака, поэтому валентная связь Nick{T. и т. д. L (pi) связь] относительно weak. As как видно из рисунка Х-29, оба атома углерода соединены 1 o связью и 1 L связью (ol связью) в этилене и 1 2 l связью (all bond) в ацетилене.Σ связь с этиленом представляет собой гибрид HA rakter SP 3, — ацетилен SP. Энергетически рассматривая оба равноцена лечения, мы ( — ..Три «банана», то есть все-ввязь, что соответствует привязке всех к 2).
Поэтому с таким же правом вы можете воспользоваться любым из них. Общим для современной теоретической химии является 2-я интерпретация. 19) химические свойства комплексных соединений в общей закономерности постоянно проявляются следующим образом: центральное увеличение числа координационных атомов с Тре на железной дороге и на фоне ослабления ее силового поля (каждой из соответствующих частиц).Наиболее ярко это проявляется в увеличении ядерной дистанции.
Примером могут служить ионы (PC1] *и (PC1])〜ядерные расстояния P — C1, которые равны 1,98 и 2,07 а соответственно. * S base Г н н » 61 > Н Рисунок Х-29.Валентными элементами схемы С являются ЭФТ, этилен и ацетилен. Естественно ожидать, что уменьшение координационного числа атомов сопровождается уменьшением типичного для него ядерного расстояния. По-видимому Это объясняет изменение длин связей между атомами углерода и их постоянную кратность(ср.§Дополнительные 185).
II I С-СС-С-С-С-С-С-Я Я Я файлы jp2-jp2 и $ Р2 — $ п СП 4 3 2 1.34 1.3!1.28 Эти значения хорошо покрываются уравнениями d (A)= 1.30 + 0.04 L (для связей C — C) и d (A)= 1.22 + 0.03 L (для связей C = C).Аналогичные соотношения наблюдаются и для других углеродных связей. Например, средняя длина соединения Я —С-С1,= когда С1 и = СК-С1 1.77,1.72 и 1,64 соответственно. Это то же самое. В целом Применяется к другим свойствам. Например, изменяется мощность Con, а также постоянный Этан C-I(4.8).Этилен (5.1) n-ацетилен(5.9). 20) атомное расстояние C-C связей и ваться о C = C. углеродный Ридный (отдельно для одинарной связи и двойной связи) состояние различных кливерных углеродных Ридных от общего радиуса связи в сумме:
Гибридное государство…. т р ’» р 2 сп и СП J в СП Corelechia радиусе. А.。0.77 0.73 0.69 | 0.67 0.64 Используя эти и другие ковалснтнтнимн радиусы (III § 6) можно приближенно выражать, но оценивать углеродные связи разной длины. Например, для спая C получены CI 1.77, 1.73 и 1.69 значительное расхождение количества последнего, заданного правительственными экспериментами (см. выше), наглядно показывает сильную поляризацию атома хлора, возможную ненадежность расчетов сложения.
21) углеродное электричество в различных штатах (£s)тридцать два) / Я \ ’(\ \ —С-равно 1.19.1.451.68 (=С =и-С3).Прямо над тобой. Длина углерод-углеродных связей в пределах±0,01 а покрывается унифицированной формулой: niemid (SS) (A) = I. 637 / P»* (£CI • £ Cj) — кратность связи (1 или 2) P. длина этих связей определялась в первую очередь не теми samnm (как принято считать), а величиной углеродного электросродства 22) потенциал ионизации молекулы этана составляет 11,7, а эффективный радиус метнлюй группы-1,77 А. потенциал барьерного свободного вращения метильной группы на С-С связи равен 3 (IV§ 5 add 7) ккал/моль(тогда С1 as 5 SSS1 3 равен 17,5 ккал/моль).
Молекулы этана неполярны. А в следующем гомо лог-пропане (D (CC)= 1.53 A, ZCCC-II2°\ — iy обнаружен малый дипольный момент (P = 0.08) и даже некоторая полярность (P = 0.13) триметнл-метана-молекулы. (CH 3) E CH. Второй болезнь Связь-С-СС-С—С-С—С-С—С-С— —С-С- III I Гибридизация Углерод…. spJ-sp * sp 3-sp 1 sp * — sp sp 7-sp 2 sp * — sp sp Общее количество периферийных устройств Атом Н…. 6 5 4 4 3 2 Посредственный. Длина связи.,.. 1.54 1.50 1.46 1.46 1.42 1.38 23) этилен образуется по схеме: ©+ 2н 2 + 13 ккал= С2Н » при прохождении в пухлом угле, нагретом от 1400 до 1800°C.
At при еще более высокой температуре водород отсекается и переносится в acetylene. In на практике этилен обычно получают дегидратацией этилового спирта (VIII§ 3 add.5).Потенциал ионизации молекулы этилена составляет 10,5 В, А протонное сродство-156 ккал / моль. Кроме того, для постоянной силы двойной связи задано значение k(CC)= 8,6.Этилен-бесцветный газ (Мп.-169, Мп.-104 ° С), очень растворим в воде (1: 8 по объему).Гидратированный C-2 H » — 6H 2 0 Ch long TSE образование напитка NZ group Ch 2. этилен полимернзуется (в присутствии или триметнлалюмния) под высоким давлением. Полученный твердый полимер («полиэтилен») нашел разнообразное практическое применение.
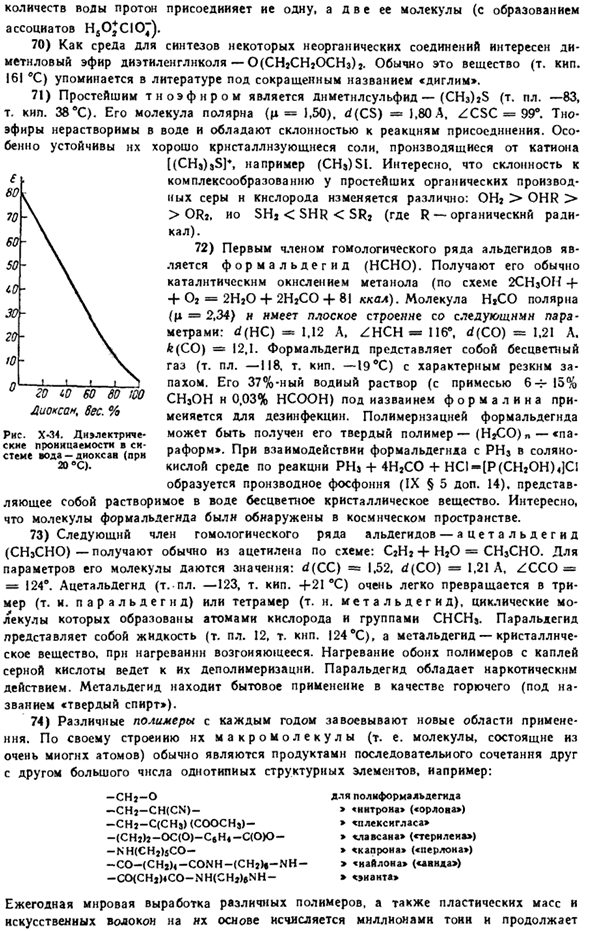
24) этилен обеспечивает исходный материал, в частности, при приготовлении «горчицы» (C1-SNz-CHJ).Последний представляет собой бесцветную жидкость со слегка характерным запахом (0,8 г / л), плохо растворимую в воде. В мировой войне 1914-1918 годов ОИ применялось как химическое оружие, относящееся к классу «устойчивых«.Это означает, что область была заражена в течение длительного времени. Иприт вызывает воспаление кожи и образование язв, которые трудно заживают.
Интересным является применение этилена в пищевой промышленности: сколько ни испытывай его в воздухе, связывание уже небольших примесей значительно ускоряет старение особей. Это дает возможность транспортировать в прошлом лом с целью не совсем формообразования и мытарств (значительно снижаются потери при транспортировке и хранении), их быстрого созревания на складе за счет потребления уже УА месте государственного управления. Часто, наряду с этиленом для той же цели, его действие UA некото ацетилен, хотя используется ржаной плод (например, апельсин) становится сильнее.
25) сравнение растворимости воды в этане, этилене и ацетилене (до§ 1) связывание сильно повлияло на углеродную связь большого количества этого свойства с UA. Хм… о’.оев 0.098-0.84 Как видно из приведенных выше данных, накопление собственной облигаций способствует быстрое увеличение растворимости. Возможно, это связано с взаимодействием молекул воды с протонами. Рисунок 2c) представляет собой мелкодисперсный порошок, образованный комбинацией 2 молекул этилена D YL (CH 2 = «* = » = CH-CH CHJ) бесцветного газа(T. PL.-109, T. завеса.-4°С).Его плоская молекула имеет форму лотка (ZC » C-C = 123°).
Ядерное расстояние центральной связи C-C равно 1,46 A, но длина связи C * = » C(1,34 A) существенно не изменяется. Ситуация здесь такова, что dnacetylene (§ 1 add.185) и голубой (§ 1 add.120) аналогична ситуации, наблюдаемой в. Уменьшение ядерного расстояния C-C происходит не из-за увеличения порядка этой связи, а из-за уменьшения числа других атомов, которые связываются с ней (add.19). Разумеется, порядок С-С связей может увеличиваться, когда собственной электроэнергии в несколько смежных облигаций несколько делокализованную(§ I добавление.188), но тогда порядок самой множественной привязки уменьшается.
Ограниченные случаи этого До II в. Тип-полный массив смежных связей-C» C — (d = I, 34A) и » C-C — =(d = 1.46 A) встречается в молекуле бензола (add 29). 27)делокализации некоторых собственн-электронов характерна для всех поляронов — молекулы Н-типа (- СН = СН-ч-ч-ч-ч) с сопряженными двойными и простыми связями. В таких системах, возможность непрерывной одностороннее перемещение собственной электронов создается под влиянием изменения электрического состояния атомов углерода в результате замещения атома водорода и других атомов или радикалов, связанных с ним.
Эффект этого замещения может поэтому быть повторно-и вся система данной сопряженной связи, т. Е. Е. ного участка ее атомов углерода для обнаружения и удаления из данной. Напротив, если сопряжения нет (например, в цепи насыщенных углеводородов), то эффект замещения затрагивает лишь небольшое число ближайших атомов.
То есть клетка быстро разрушается. 28) в качестве структурного аналога углекислого газа представляют интерес для нормальных условий эксплуатации углеводороды, L E N — CH = C = CH (температура плавления −14632 ° C)…… В его молекулах d(CC) 1.31 и d (CH) −1.08 A, а для силовой постоянной связи приведены значения k(CC)-9.4 и£(CH)= 4.6. Пять Десять Пятнадцать Двадцать Двадцать пять Этаи.。。。 о’.ОВО 0.036 0.055 0.047 0.041 Эчиерек.。。 。0.226. 0.19! 0.162 0.139 0.122 0.108 Как я должен использовать это лекарство? 。1.73 1.49 1.3! 1.15 1.03 О.
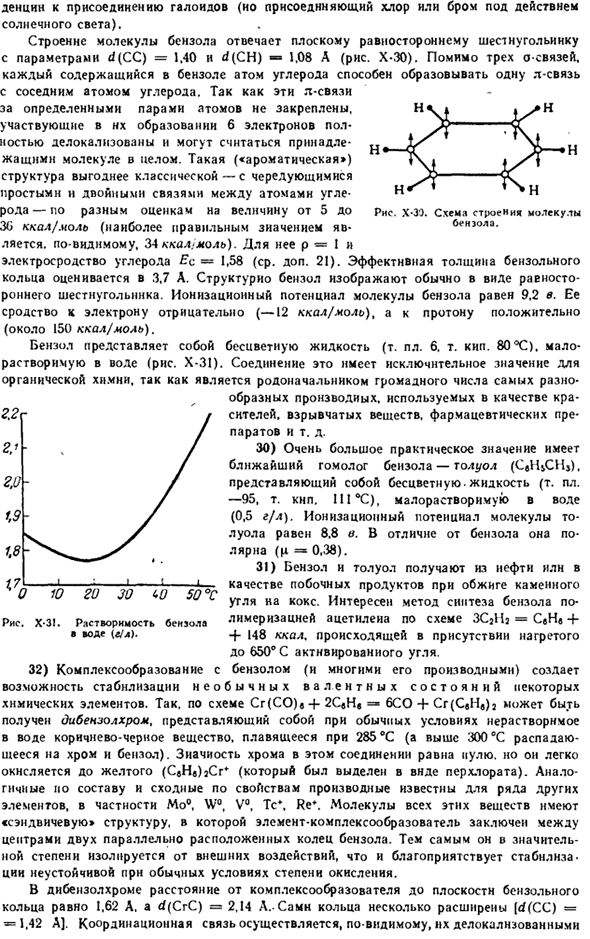
Температура.»»С Растворимость. Я объем / С и код, Том I 29) если между атомами углерода имеется несколько различных связей, накопление таких связей может ослабить тенденцию реакции присоединения в органической молекуле. Типичным примером СКВ может быть живой циклический углеводород, бензол (s в C ’ H), который при нормальных условиях связывает дентсин (но при хлоре или Броме) для соединения галогенидов с тензором Солнечный свет.) Структура молекулы бензола соответствует плоскому правильному шестиугольнику с параметрами d(CC)= 1,40 и d(CH) — 1,08 а«(рис. х-30). кроме связей 3 О, каждый атом углерода, содержащийся в бензоле, может образовывать связь 1 л с соседними атомами углерода.
Для определенных пар атомов эти L-связи не являются фиксированными, поэтому их образование можно считать-Носта делокалнзованы и прниадле вовлечены в электронный пол с использованием молекул МГО жащнмн в целом. Такая («ароматическая») «классическая» структура-чередующиеся двойные связи с одинарной связью между углеродом, оцененным в разных для рода — на количествах от 5-Р и S. X-ZE. Структура молекулы составляет 30 ккал / моль (наиболее правильным значением является бензол, который, по-видимому, равен 34 ккал / моль).
Его электрический углерод составляет 1,58 (см. дополнительный 21).3.7 A. In структура бензола расчетная эффективная толщина бензольного кольца обычно указывается в виде уравнения роннего шестиугольника. Потенциал ионизации молекулы бензола составляет 9,2 вольта. Его сродство к электронам отрицательное(-12 ккал / моль), а к протонам положительное (около 150 ккал / моль). Бензол-это почти бесцветная жидкость(т. к. P1 6T. It было жарко.80°C) и растворимой водой(рис. Х-31).
Производные ЦИТЕЛА используются в качестве ребра формы соединения, которое является прародителем огромного количества различных наиболее важных для органической химии веществ. Взрывчатые вещества, фармацевтические препараты пре-Паратов и т. д. 30) ближайшие бензольные конгенеры, толуол (CeH * CHj) — это бесцветная жидкость (mp 95, mp 1P°C), которая плохо растворима в воде (0,5 г / л) и имеет большое практическое значение. Потенциал ионизации молекулы (Луола) равен 8,8.В отличие от бензола, он имеет полярность (q = * 0.38).
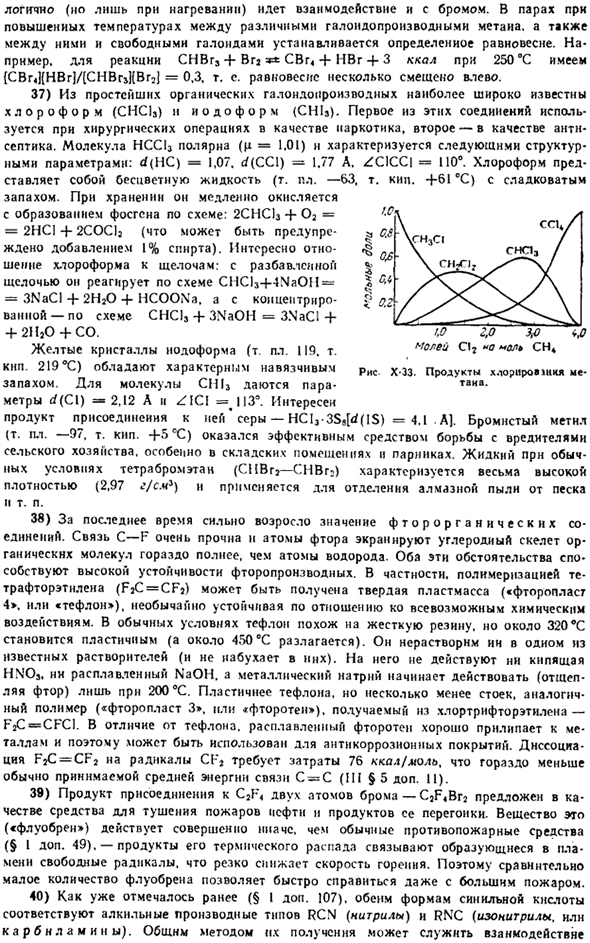
31) получают из бензола, толуола и нефти. Качество побочного продукта в каменной обжарке v 2 30 ^и 50 С(по коксу). интересным методом синтеза бензола является Рисунок Х-31.Растворимость бензола заключается в полимеризации ацетилена по схеме X 2 H 2 = C в H + в воде (ejA).- f 148 ккал происходит в нагретом состоянии Активированный уголь до 650°C. 32) при комплексообразовании с бензолом (и многими его производными) аномальное валентное состояние некоторых химических элементов может быть stabilized. So в схеме CR (CO) можно получить n»=■6SO+ CR (C»H A) 2 в + 2C и oibenzolhrom (на 285 ° C выше нормального состояния водонерастворимого коричневато-черного твердого вещества, плавящегося под действием®C 300, разделенного щееся UA хрома и бензола).
Это соединение Токсичность хрома для вещества равна нулю, но он легко окисляется до желтого (от C до H) 2 Cr *(выделен в виде перхлората).Аналогичные технологические аналоги по составу и свойствам производных известны в ряде других элементов, в определенной степени МО. W°, V 0, Tc *.Re.молекулы всех этих веществ имеют «сэндвич» структуру, которая окружена комплексообразующим элементом между центрами 2 параллельных бензольных колец. Соляная кислота стабилизируется в значительной степени, благодаря чему выгодно изолируется от внешних воздействий, неустойчива при нормальных условиях окисления. 2.2 2.1 2.0 1.9 1.8 в
В дибензенхроме расстояние от комплексообразователя до плоскости бензольного кольца составляет 1,62 A. ad (CrC)= 2,14 A. само кольцо слегка растягивается (d(CC)= 1,42 A).Координатные связи, очевидно, выполняются путем делокализации. gs-electronamn (точка показана на рисунке X-32), а кольцо сохраняет свободу вращения. dnbenzenechrome и Cr (CO)» n C 4 H » Cr (CO) 5 (mp.163 °C) для сравнения, бензольное кольцо занимает место фокальной конфигурации в пределах хрома TPH.(
Взаимодействие с dnbenzolhroma fosfortrnftorndom при 350 барометрическом и 200 ° C) собирается в формацию CR (PF S) $ (§ 1 ext 83). 33) среди других углеводородных производных бензола, соизмеримых в симбиозе с металлами, стоит упомянуть гексаметилбензол-Sv (CH3) in или C jj H m (mp 164, mp 264°C).Примерами его производных являются Re (C t3 Hie) 3 и lRe (C rt H hb). 34) ненасыщенный углеводородный циклопентадиен, близкий по составу к бензолу, C5h$, стал очень важным для обобщения.
Красящая жидкость (т. to. It было жарко.40 °с), очень склонен к нерастворимому в воде N-димеризацину. Плоская молекула C $ H $связывается с 2 двойными 4-SR группами NAI и 5 членными кольцами группы CHJ (D (CH, — CH))= 1.51.РФ (Ч — Ч) » 1.34.D (CH-CH) равно 1 = 47 A).1 водород метиленовой группы может быть заменен металлом(его кислотность выражена очень слабо-K = 10«, s). Если металл смог заменить 2 периодических атома водорода 2, то в самом iCal Van Leishi C $ H & short. подобный к dnbenzenechrome, приводя к «песочной ночи» structure.
It способствует стабилизации валентного состояния этого металла. Первым из соединений этого типа было производное железа — (C5h5) jFe («fer erce»).Очень стабильное оранжевое вещество (M. P1. 173®S), СПО собное сублимации, нерастворимо в воде без decomposition. In молекула ферроцена газа, d (FeC)= 2.06 и<2= 1.43 A (средний результат, так как кольцо вращается), a 4 (NS)= 1.12 A. In кроме того, атом водорода отклоняется на 5°от плоскости кольца к центральному атому.
Для эффективного заряда атома Fe предложено значение 0,68.Азотная кислота окисляется до катионов ферроцена (CsHs) SFE, после утверждения индивидуальных (синих) солей. Известно много других металлических производных циклопидонена («цена«).Например, коричневый (C $ H5) 2 Mp, красный (CsHs) jCr N фиолетовый (CjH$) jV, Зеленая соль (C 5 H5) sCg *и красная соль( CsHsbV *.Интересно то, что 2 циклопентадиенильных кольца образуют «сэндвич», а другие 2 являются синими (C & Hs) Проф-СНиП + «07 +33 +19 —я ккал резус + г» * рублей + НГ+: 03 + Ж3 +6-ю ккал РКС. Х-32.
Схема структуры dnbenzolhro ма ма. Эти данные показывают, что йод следует реакции АБС даже с тепловым щением. 36) реакция хлора и метана осуществляется при 400-500°С (или под прямыми солнечными лучами) и приводит к образованию смеси хлорированных продуктов, состав которой зависит от исходного соотношения концентрации метана и хлора (рис.. Аналогом (только ректификационным нагревом) является взаимодействие и bromine.
At при высокой температуре паров устанавливается определенное равновесие между различными метановыми галоногенными соединениями, а также между ними и свободными галогенами. Приведенный выше пример. Начало при 250°С 3 + Br 2 * * в реакции CBr + HBr + 3 ккал, (STg » KNVg] /(начало rjK YO = 0.3.Таким образом, равновесие немного смещается влево. 37) из простейших органических галлоновых производных наиболее широко известны хлороформ (CHC1e) и йодоформ (CHI).
Первое из этих соединений используется в качестве антисептицемического средства в хирургии, как лекарственное средство, второе. Молекула NSS1 3 polar (P = 1.01) n имеет следующие структурные параметры управления: D(HC)= 1.07.< / (CC1)= 1.77 A. ^ ClCCl = 110°.Перед хлороформом появляется бесцветная жидкость с негодующим сладковатым запахом (т. to. P1.63.T. It при хранении медленно окисляется с образованием фосгена по схеме 2SNS1 3 + 0 2 = + — 2HCl 2SOS1 3 (Это можно определить добавлением 1% спирта).
Интересно отно шение щелочи хлороформом: в разбавленной щелочи это chcl 3 + 4NaOH = = 3NaCl + 2HjO + HCOONa, а в концентрированной-схема CHC1 3 + 3NaOH = 3NaCl + + 21IjO + CO. Желтые кристаллы в виде йод(mp119.Мп.219°С)имеет характерный навязчивый запах. Для CH1 молекула 3 представляет собой пару метров RF (CL) −2.12 A N ^ ICI = | | * 3.- Интересно, что это аддукт серы HCI 3-3S E [D (IS)= 4.1 A.].Бромид метнл(T. PI.-97.T. It было жарко.5 В) оказался эффективным средством борьбы с сельскохозяйственными вредителями, особенно на складах и в теплицах.
Жидкий рекомбинантный тетра бромэтан (SNVgz-ADHD) характеризуется очень высокой плотностью (2,97 г/ см) и используется для отделения песка от алмазной пыли II и др… 38)в последние годы значительно возросло значение органического фтора и единства. Общение С- F очень прочен и имеет атом фтора, но углеродный экран OP намного лучше подходит для органических молекул, чем для атомов водорода. Обе эти ситуации СПО свойство фторопронзводных высоко stability.
In в частности, полимеризация ts-трифторэтена (FjC = CF 2) позволяет получать твердые пластики («фторопласт 4», nln»тефлон»), которые чрезвычайно устойчивы ко всем видам химических воздействий. В нормальных условиях похожая на тефлон жесткая резина, но при температуре около 320 С (около 450°С по мере разложения) становится plastic. It нерастворим в 1 из известных растворителей(также не набухает в растворителе).
Ни кипяченой разработка плана ст, ни расплавленный NaOH и будет действовать. Металлический натрий начинает работать (чешуйчатый Laa fluoro) тефлоном пластичным при REC 200°, но несколько устойчивым подобным NY полимером («Teflon ® 3″или»ftoroten«).Полученный NC chlortrnfloroethenlen является FjC = CFC1.В отличие от PTFE, расплавленный фторотен хорошо прилипает к таллию IU и поэтому может использоваться для антикоррозионных покрытий. может.
Диссоциация FJC = CF 2 в группе SK} 76 ккал / моль значительно меньше, чем средняя энергия, получаемая обычно C =C (III§ 5 EXT.11). 39) продукт прилипает к C 2 F «два атома брома-C 2 F 4 Br», как показано на рисунке 2.Это вещество («флуоблен») действует совершенно иначе, чем обычные огнетушащие вещества (§ 1 add.49).- Продукты пиролиза образуются за счет связывания их ПЛА Мени свободными радикалами, которые значительно снижают скорость горения.
Поэтому, используя относительно небольшое количество полноценных кирпичей, можно быстро справиться даже с большим пожаром. Рис X-ZZ. Хлорированные продукты* 40) как указывалось ранее (§ 1 дополнение.107).Оба типа синильной кислоты соответствуют алкильным производным типов RCN (нитрил) и RNC (изонитрил или карбиламин).Общим способом их получения может быть взаимодействие соответствующего Галогенида алкила с цианистым калием или серебром cyanide. In в первом случае основным продуктом реакции является нитрил, во втором-карбиламин.
Простейшими представителями являются ацетонитрил (CH CN) и метилкарбиламин (CH3 NC). 4!) Молекула ацетонила полярна (q = 3,97).Связь C-C характеризует длину лета 1,46 А. константа мощности комбинационной частоты 919 см и 5,2, а длина связи C «N-1, 16A, частота комбинационной частоты 2267 CJT» и константа мощности 18,0.Диэлектрическая постоянная ацетонитрнл (Э»= 39), бесцветная жидкость(T. P1.45.T. It был подогрет до.82°с) растворяемые скважины имеют относительно большое значение с неприятным запахом воды и смешиваются во всех пропорциях проводящими специфическими солями (бромид лития, КНКС, AgN0 3 и др.).
Известных продуктов, солей и комплексов, содержащих atsetonitrnl во внутренней области его примыкания рядом, например коричневый CHjCNTa (НКС)$ или желтый (СН 3 СN)3 9 (со)^ требования е-СГ, молибден, В. Atsetonitrnl хорошо растворяется xef * — и KRF и xef по 4(без химического взаимодействия с nnmi).Интересно, что решение состоит в том, что PCU, по-видимому, почти полностью диссоциирует Ван несольватнрованные ионы PC1″и PC1″, hasbci при низких концентрациях sbcl диссоциирует на»И С» с другой стороны при высоких! SBCL * и SBCI IA«.Ацетонитрил может быть использован в качестве горючего реактивного топлива (303 секунды кислорода и удельное воздействие при температурах пламени, близких к 4400°с).
42) молекулы метилкарбиламина Jd и (CN) 1,43, D (NC)=1,17 а) изучены намного хуже, чем молекулы ацетоннтрила, Ио известна как постоянная частота связывания комбинационного рассеяния света и мощность любого Трилло в C H в C меньше, чем в карбиламинах для связывания N = & C. Это хорошо совпадает с тем, что при нагревании достаточно SRI карбиламины (более 200 ° C) изомера 8 нитрилов. Перед Метилкарбиламином возмущалась бесцветная жидкость с отвратительным гнилостным запахом (т. к. П1.-45, Т. Он был с подогревом.60 ° C). он нерастворим в воде и гораздо более токсичен, чем ацетонитрил.
43) соединения с сильной и выраженной склонностью к реакции с Карбнламинами. Например, он легко сочетает кислород (или серу) в соответствии с RNC + O RNCO scheme. In внутренняя сфера известного производного комплексного ряда представляет собой редкое окисление этих металлов, билизирует часто комплексообразующий металл, в том числе карбнламины. Примеры включают [Mn «(CNCHa) JI (Белый, M. точка плавления 264), (MN» » (CNCH 3) E ] I, (синий, M. точка плавления 152 градуса Цельсия) и цветные кристаллические производные нулевой степени (3 (CNC, Hs)). 44) необходимо обратить внимание еще на 2 производных цианида нейтрального типа. Голубая форма-HC (CN) 3-представляет собой бесцветный кристалл (mp 214°Cdecomp. it это не так.
Четвертая водородная ногенность, которую ниж цианоформ приводит к возрасту замещенных CN в 3 водорода метановых радикалов, — это сильные кислоты (их аналоги непохожи на галогениды).Свободная электронная пара Иона (C (CN) SJ’) центрального атома углерода, содержащегося в его соли Тип K (3 (CO) sC (CN) 3), где E-Cr, Mo, W со значением 0. Хлорирование K(C (CN)]дает CIC (CN) 3 пирамидальной структуры, а для константы прочности связи углерод-углерод C (CN) 4 приведено значение k (CC)= 4,86. 45) цепь и N и T и L-NCC * CCN также называют нитридами углерода (ChNj). это бесцветное вещество(mp.21, Мп.77°C)и может быть разобран при взрыве.
Горение в атмосфере кислорода приводит к удельному импульсу 310 секунд и температуре пламени до 5000°C 46) только продукт замещения аммиака водородными алкильными радикалами называется первичным Амином (RNH*).Самым простым представителем является метил m — — CH3NHt. Его молекулы характеризуются следующими параметрами: d (CN)= 1.47,</(NH)= 1.01 A, ZHNH = 106°.Дальнейшие замены Образуется вторичный (RjNH) и третичный (NR3) аммиак. Оба свойства в основном аналогичны свойствам первосортных Аминов.
Их гидроксиды. Как и NH OH OH, в свободном состоянии неустойчива и слаба основа. Ниже сравниваются характерные константы простейших Аминов (и аммоний). NH3 CHjNH, (CH3) jNH NHjR> NHR *> NRj-способность образовывать комплексы обычно ослабляется. (CH3) 3N барьера инверсии дают значение 8 ккал / моль. Только немного больше, чем аммиак(IX§ I добавление.18). интересная производная от dnethylamne и четыре-валентного Хрома-это летучие зеленый компаунд КТ [Н(Хсг») » В. 47) В дополнение к кислоте третичная Амилия может связывать галогенированный алкил путем образования солеподобного комплексного производного, аналогичного аммониевым солям по схеме: N ’ R3 + Rr = [NR] R. простейшим примером является хлорид тетраметиламмония-(N (CHj)) Cl.
Разлагается на газообразные N (CH h и CHCC1 (mp.-98.т. температура кипения-24 ° С) только если она превышает 230°C. IN (CH3))) дан Ион#d (NC)= 1.49 A и » (NC)■ = 5.5.Соответствующее свободное основание выделяется из водного раствора в виде кристаллогидрата[N (CH3) α) OH * 5НаО (MP 63 ° С), что делает его более близким к NaOH по прочности (то есть он относительно стабилен и более мощный, чем Nha) OH).Среди других продуктов в дополнение к триметиламин, необходимо отметить кристаллический (СН3) 3Н * pfv-максимальное прямое напряжение. (СН3) 3Н * так и (СН3) 3n в-ва. В последней молекулы, группы N11 является линейной на расстоянии D(Н)= 2,27 и 4(11)= А. 2.
83 Большое количество катионного [NRJ] способствует стабильности взаимодействующего с ними Анона. Это позволяет получить несколько типов солей, которые не существуют с элементарными катионами. Примеры пока известны только террокванид — [NfCsHshJTeCN. In в этом контексте желтое твердое тело[N (C <Ht) 4) Cl CC CCU, очевидно, содержит анион CC15, что интересно. 48) (CH3) 3N [4 (CN)= 1.47 A. ZCNC = 109°]путем воздействия на перекись водорода получают оксид триметиламина.
Это твердое вещество (mp 96°C), растворимое в воде. Щелочная реакция. Из 2 возможных формул этого соединения классическая [(CH3) 3N-O)и донорно-акцепторная I (CH3)3N- » — O:] — с высокой полярностью (z-4,87 в бензоле) и длиной связи N-O равна 1. 39 а) более соответствует 2-му(который отличается от f3no-3 добавлением 63). Из водного раствора оксид триметиламина выделяется в виде кристаллогидрата (CH) jNO•2HjO (mp 208°С).в сильных кислотах получают соли, примерами которых являются(CH3) 3NO-HCl (mp 218bC).Для этой соли были определены следующие структурные параметры. РФ (CN) −1.48. d (NO) α= 1.43, d (O—CI) α= 2.95 A. ZCNC * = * = 112°,ZNO * — * CI =■110°.
Следует отметить, что длина донорно-акцепторной связи N-O практически совпадает с длиной обычной ковалентной связи N-O(например, 1,41 а в HNO). 49) наиболее важным представителем Аминов является анилин (CeHjNHj), чья неплоская молекула (ZCNH = 39°) характеризуется следующими параметрами: d (CC) α= 1,39, cf(CN)= 1,43 A. ZHNH= 114°.он бесцветен, но постепенно превращается в жидкость на воздухе с характерным запахом(mp.-6.Т. Кипячение.184°с).Растворимость в воде относительно невелика (3: 100 Вес).Основные свойства анилина выражены лишь очень слабо (/C = 4-10°). Н. Н.
По мнению Зиииим, открытие возможности получения анилина восстановлением нитробензола (1842) заложило основу для развития промышленности органических красителей. — Если бы Джинни не только превратила нитробензол в анилин, его имя осталось бы золотыми буквами в истории химии.- Писал один из его современников. 50) среди других первичных Аминов особое внимание следует уделить молекуле (d (CC) 1.55) этилендиамина (NHj—СНу-СНу-NHI). rf (NC)= 1.47 A. ZCCN = = 110 e.
It представляет собой бесцветную жидкость (Мп.9. mp.116°C) и характеризуется четкой базовой характеристикой(/С «= 9•10-5,Kt = 2» 10-7).Диэлектрическая проницаемость этилового эфира составляет всего 12,9(25°С) и хорошо растворяет некоторые неорганические соли. Например, растворяют при 25°(г и 100 г растворителя): LlBr NaBr КБР Нальчик ки KN03 NaN03 устройство xcs продается 2.4 54.4 0.78 34.6 74.9 33.5 0.37 83.0 Растворенные соли диссоциируют умеренно (например, константа диссоциации Nal. Agl, NaNOj и AgN03-это 7-U ’4, 2-U’ 5, I•10-4 и 4-I0 ″ 4, respectively.
It очень характерно, что этилен-na-min (сокращенно En) попадает на внутреннюю территорию комплексных соединений. В качестве антиобледенительной композиции была предложена смесь с КНКС (масса 2: J).Этилен-na-min также может быть использован в качестве реактивного топлива(теплотворная способность 453 ккал / моль). 51) когда 1 CH группа бензола заменена атомом азота, молекула пиридина (C3H $ N) является obtained.
It является полярием (q * = 2.15) и характеризуется следующими структурными параметрами: d (NC)= I. 34A, ZCNC = 117e. пиридин представляет собой бесцветную жидкость с характерным резким запахом (mp.-42.Mp.116°C). по химическим свойствам он во многом схож с бензолом, но из-за наличия аминных функций имеет некоторые существенные отличия appear. So пиридин смешивается с водой во всех точках и проявляет очень плохие основные свойства в растворе (В / С™2 «10»), а также более склонен к попаданию во внутреннюю область комплексных соединений.
Вивалентные производные рения-красный является примером таких комплексов[Re02Py«] Cl и оранжевый желтый [Re0jPy4) Cl04(Py-аббревиатура пиридина).Когда эти пентаголиды ниобия и тантала вступают в реакцию с пиридином, эти элементы восстанавливаются до четырехвалентного состояния, и туба|например,<RU4. Пиридин хорошо растворяет многие неорганические галогениды (кроме фтора) и нитраты. Его диэлектрическая проницаемость относительно мала (при 20 ° C e = 12,5), а растворенное вещество диссоциирует лишь умеренно.
Например, константа диссоциации nsj равна «8-10». 4.HN03-5-10″*. Растворение йода в ПИРИДИНЕ HI-b-Yu » *и Nal-I * 104 сопровождается частичной диссоциацией C $ HsNl * при C 5 H 3 NI n 1 ’(константа диссоциации 4-10 ″ c).Из других продуктов присоединения пиридина мишенями являются C H HsN-Cr03 и Cr (CO) 3Pu3.Они оба являются нестабильными кристаллическими веществами, соответственно оранжевого или красного цвета. 52) из пиридиновых аналогов наиболее интересным для обобщения является A. a-ойпиридил (CioHgN).Его молекула содержит довольно близко расположенный атом азота, что позволяет одновременно связывать комплексообразователи (занимая 2 координационных участка Внутренней Сферы).
Дипнидил (сокращенно ДИПИ) — бесцветный кристалл(Мп.70. mp.273eC). Комплексы типа (3Dipy3)известны своими элементами и различными состояниями окисления. Например, СГ (желтый), также CR1 (черный), пр (СНН). Cr «(Красный), V (зеленый). V *(Красный), V0 (фиолетовый), V «(Красный).Последние 2 состояния окисления являются аномальными в хроме и 3 в ванадии. 3N)-2.09 A и^ N3N-74e. все это легко Он окисляется на воздухе. Катионные комплексы в основном выделяли в виде перхлоратов. 53) CijH $ N4 (сокращенно Phen) также является бесцветным Кристаллом с несколько более низким значением в общей химии, сходным по свойствам с ортофиллием и тритлунгом. 100, ВР.> 300°с). примером комплекса, в котором он участвует, является производное хромита. Красный (Cr (Phenh) Ij. Зеленый (Cr (Phen) 3) I2 и черный(Cr (Phen) 3) I.
54) из-за общей амфотерной природы спирта nx функция кислоты более выражена, чем его основная функция. Это уже видно из того, что раствор NHj в метиловом спирте проводит ток гораздо лучше, чем раствор SNECU в нем. Величина соответствующей кислотной диссоциации ионного продукта (RON] (или) «CH3OH 1•10-17, C2H» OH 8-10-2.Обе молекулы обладают значительным протонным сродством-по 180 НК ккал каждая!
в то же время из распределения кротона между спиртом и водой в жидкой фазе видно, что сродство спирта к протонам ниже сродства воды (169 ккал} моль пар): ROH * +HjOH30 равновесие системы* -f ROM равно 139 (R = CH3) или 250 (R = Hh3).Я обнаружил, что для балансировки схемы OH-f CgH * OH * * C2HsO » + HjO постоянное значение равно 0,7. в сом (и твердом) состоянии спирт образует тип межмолекулярной водородной связи.•* * HO®-HO ® — длина такой связи оценивается в 2,66 а (-110°С), энергия которой составляет 5 ккал] моль. 55) продукт замещения водорода в спирте металла (спирт) известен многим elements.
As как правило, это бесцветные твердые или жидкие вещества. Например. Nb (OCH3b плавится при+60°C, тогда как Nb (OC2Hj)$является жидким в нормальных условиях. Интересно, что ниже (Р — СН3, линии С3 Н$) получится при взаимодействии алкоголята ТП (или) более волатилен, чем аналогичные соединения ниобия( в CH3ONa кристаллы, натрия и кислорода четыре-скоординированы друг с другом(РФ (нет)= 2.32,Д(со)= 1.41 а, ZNaOC =ий)). 56) Метнохлорит (CH3OC1) можно рассматривать как продукт, который заменил Галон спиртовым водородом. В нормальных условиях нестабильное вещество (т. Кип. Молекула этого газа при 12 ° С) характеризуется параметром: d (CO)= 1,39. rf (OCI)= 1.67 A, ZHCH = 109 e. ZCOCI =113®.
57) большинство солей в спирте практически нерастворимы, но, как видно из приведенных ниже данных (1 ммоль / л на 1 моль растворителя при нормальных условиях), некоторые из них даже более растворимы, чем вода: L1CI LilKH «с1кн» br NHINOA caclj 0a (No3), bacl, ba(noj), PB (noj) J h7o ….. 350225130 <40430120150 30 7 30 Чжо,… 320820 20 40 70 85370 3 0.6 1.3 Чодзе. 。 。 265860 5 15 15 1017 175 0.1 0.0! 0,05 Эти данные указывают на то, что растворимость зависит как от катиона, так и от соли Анкона, и иногда изменяется очень конкретно.
Интересно, что процесс, посредством которого многие соли растворяются в CH3OH, более экзотермичен, чем вода. 58) первым членом родственного насыщенного спирта является метиловый спирт (метанол), получаемый в очень больших количествах сухой перегонкой древесины N синтетически(реакция СО-F-2Н? 33ОН-F на 26 ккал). Молекула SNeOH полярна (q = 1,70) и характеризуется следующими структурными параметрами: rf (HC)= 1,09. ТФ (со)= 1.43. д(О)= 0.95 в, ЖЧ = 109°. ZCOH = 108°C — O энергия связи составляет 80 ккал! Мол, его постоянная мощности равна k = 5.8.Метанол представляет собой бесцветную жидкость, которая смешивается с водой во всех точках (Мп.-98, депутат.+ 65°С). в парах она частично связана (с преимущественным образованием тетрамеров), а в твердом состоянии в какой-то мере характерна. Образование цикла из 3 молекул.
Метиловый спирт оказывает сильное токсическое действие на организм человека (нервно-сосудистые яды). Диэлектрическая проницаемость метанола (е = 31) значительно ниже диэлектрической проницаемости воды, а растворенные в ней электролиты умеренно диссоциированы(напр.: Постоянная dnssotsatsnnn НС1. CsCI и AgNOj составляют 6-10*, I * 10 — «2» и 10 г соответственно. Но энергия сольватации ионов ими очень важна(ккал / г-Ион): Ч * у * Н * К * РБ * СГ * с г Бр » г 265127104 С7 81 71 60 54 48 В случае H и Li они приблизительно равны энергии гидратации (V§ 8 add.20), немного больше для других катионов и гораздо меньше для анионов. 59) этанол (C2H5OH) является наиболее important.
It также называется вино. Самый старый рецепт, который был передан нам, содержится в копии книги XII века » ключи к живописи «(I§ I add 9),» смешивая чистое и очень крепкое вино, содержащее 3 минуты соли и 1 тепла в подходящем сосуде: горючая вода, которая горит без воспламенения предметов » (mp.-117, Мп.4-78 СС) смешивается с водой во всех отношениях. Интересным является тот факт, что растворимость кислорода в смеси воды и спирта ниже, чем соответствующая растворимость в добавке. Как уже упоминалось(II§ 6 дополнение.8).Спирт образует азеотропную смесь с водой. Последний кипит только на 0,1°С больше, чем чистый спирт.
Тройная азеотропная смесь состава (%по массе) имеет значительно более низкую температуру кипения: 18,5 CaH4OH,7,4 HjO, 74,1 C, H -, которая никогда не использовалась для обезвоживания спирта. Этиловый спирт (этанол) производится в очень больших количествах. Он.1. в частности, это один из важных видов синтетического каучука, часто используемого в качестве топливно-реактивного топливного сырья.
Для пищевых целей его обычно получают сбраживанием натуральных продуктов, в том числе крахмала или сахара, а в промышленных-химической и биохимической обработкой древесины (гидратацией этилена по схеме Chсн= CHJ +Н20** cjhsoh + 5 ккал). 60) важным репрезентативным примером класса спиртов является глицерин [SEN *(OH. Около 0°C (mp.20. т. кипение с частичным разложением (290 ° с) представляет собой бесцветную вязкую жидкость, которая только затвердевает и смешивается с водой во всех точках.
Глицерин, в частности, выступает в качестве исходного материала для изготовления взрывчатых веществ (нитроглицерин, динамит), а его депронгард CH2SCH2OH («анти-Рой укус») используется для обработки мышьяка и ртутных соединений в коже. 61) фенол (CeHsOH) имеет важное значение applications. It представляет собой бесцветную кристаллическую массу с характерным запахом (mp 43, mp 182°C) с характерным бесцветным (но постепенно краснеющим на воздухе) оттенком. odor. In в отличие от большинства других спиртов, фенолы имеют ярко выраженный кислотный характер (K = \ 10 -’°).С этим связан «углевод», название, которое используется время от времени.
82) серным аналогом спирта является меркаптан. Они имеют отвратительный запах и довольно прозрачную кислоту nature. In вода, меркаптан почти нерастворим. CH3SH (mp.-123, депутат. Для + 6°С) были определены следующие структурные параметры: rf (CH)= 1.09,d(CS)= 1.82, rf( SH) «= 1.34 A, ZHCH-110°,zXSH = » 97 *.Сульфгидрильная группа (- SH), которая характерна для меркаптана, является частью некоторых важных ферментов в организме человека.
83) наиболее интересной реакцией эфира является его взаимодействие с Галоидным алкилом. По схеме приводит к образованию сложных гидроксидных соединений: ROR + RT(ORjjr. Кислород играет роль, аналогичную роли азота в аналогичных реакциях с алкилгалогенидами и третичными аминами: NRj + RT = [NR4) r. только координационное число обоих комплексообразующих агентов различно.4-азот, 3-кислород.
Полученное комплексное соединение можно считать продуктом замещения водорода алкильными радикалами ионов аммония и окисления он*. как и в случае самого исходного Иона, стабильность производного аммония значительно выше, чем у производного оксония. Однако, некоторые представители Последний также очень стабилен. Например, (SNE) 30) SBC、 137 С. 64) простейшим представителем класса эфиров является диметиловый эфир, представляющий собой газ при нормальных условиях-(CH) jO (mp).-138, Мп.-24°С).
Его молекулы полярны (u = 1.31),</(СО)* = 1.41 a, zcoc = 112*.Атомы кислорода могут действовать как donors. An примером может служить равновесие по схеме (CH3) 20 + PF $ * * CHjOPFs. In нормальные условия, 90% смешиваются справа. 65) этил ef и p — (C2H5) 20 обычно получают действием этилового спирта против серной кислоты (водозаборного агента) при высоких температурах, и на самом деле это гораздо больше common.
In в связи с этим способом получения этилового эфира его можно ошибочно назвать «серной кислотой«.Этиловый (TSI, диэтил) эфир представляет собой бесцветную летучую жидкость (mp.-116.Т. Кипячение.+ 35 °С).Его пары легко воспламеняются в воздухе, а при вдыхании вызывают отравление, которое впоследствии приводит к обезболиванию. Этиловый эфир заметно растворим в воде (v§ 2 add.20).
Этиловый эфир обычно называют просто «эфиром». И. Ил LiC10″.AgCIO») только хорошо растворяется. Раствор эфира LiBr (25 ° C, растворимость до 1,2 м) содержит тетрамер (LiBr). он растворяет многие бромиды, которые нерастворимы в эфире для комплексообразования по схеме: например: 2LiBr + MnBr2 = «= Li2MnBr».Подобно воде, эфир может образовывать ассоциацию с протонами. Примерами соединений этого типа являются красные кристаллы ((CjHj) jOHO (CjHj) 2] (ReOCls). 66) заметим, что при длительном хранении эфира (особенно на свету) этилпероксид-(С2Н5) 202 накапливается постепенно.
Перегонка такого эфира часто заканчивается сильным взрывом. Вы можете проверить наличие перекиси с помощью KI. И уничтожить его перед перегонкой с подкисленным раствором FeS04(он никогда не должен быть завершен) 67) структура 2-х СН2-групп и 3-членных колец атомов кислорода (d (CC) — = 1.56,<(CO) −1.45 A]представляет собой молекулу этиленоксида полярности (q = 1.88) [(CH ^ aO].Это стабильно. Газообразное вещество (mp −112, mp + 11°C), которое хорошо растворяется в воде при нормальных условиях, является важным промежуточным продуктом во многих органических отраслях промышленности.
Интересно, что небольшое количество добавок оксида этилена значительно улучшает текучесть имидных аналогов оксида этилена-этилена и mn(CH2)2NH (IE).56°с) оказался сильнейшим мутагеном(то есть веществом, резко изменяющим признаки наследственности Твена). 68) в качестве удобной среды для проведения специфической реакции необходимо реверсировать Тетраг и D рофуран-(СН2) 0.Его молекула полярна (q-1.63) и имеет структуру 4 метиленовых групп и 5-членное кольцо атома кислорода (ISN)= 1.11,</(CC)= 1.54, rf (CO)= 1.43 A. Тетрагидрофуран (сокращенно ТГФ) представляет собой бесцветную жидкость (mp.- 108, Мп.66°с).
Немножко солубле внутри water. An интересным примером протекшей в нем реакции является изомеризация эндогенного комплекса в изолятор: E (CO) 3 \ CH E (CO) sMS— » −3(C0bCN — + 3(CO) sCNH (здесь E-Cr, W).Интересны также некоторые полученные им соединения, например кристаллический комплекс типа Li [3 [Dipy] 3l 4THF, известный в ванадии (черном), ниобии (черном) и марганце (чайном фиолетовом).Эфир (добавлено 66).
Хранение ТГФ может привести к накоплению взрывоопасных производных пероксида. 69) интересна бесцветная жидкость(Мп.12. mp. Температура кипения 101°с) представляет собой циклический эфир 0 (- СН2-СН2 -) zO (Доно-Кан).Для его молекулы заданы следующие структурные параметры: tf(CC)= 1,52, J (CO)= 1,42 A. ZCCO = 109°,ZCOC = 113°.
Диоксай имеет очень низкую диэлектрическую постоянную (е » 2) и смешивается с водой во всех отношениях. Это позволяет приготовить смесь, характеризующуюся диэлектрической проницаемостью 80-2(рисунок х-34).Это очень важно в некоторых научных исследованиях. При хранении доноксана может накапливаться взрывоопасная перекись(рекомендуется хранить ее в FeSO).
В растворе HCIO dioxa, даже незначительно Большое количество воды, Протон, связывает 1 из 2 его молекул(с образованием HjOJCIOJ-связанных) 70) в качестве синтетической среды для конкретного неорганического соединения интересен диметиловый эфир диэтиленгликоля-0 (СН22020СН3) 2.Обычно это вещество (т. Кип.161°C) упоминается в литературе с аббревиатурой «diglyme». 71) самым простым toephnr является диметилсульфид — (CHj) aS (mp 83, mp 38°C).
Его молекулы полярны (q = 1.50), d (CS)= 1.80 A, ZCSC = 99°. Тно-эфиры нерастворимы в воде и склонны к реакциям присоединения. Особенно стабильны хорошо кристаллизованные соли, которые получают из катионов. [(CHj) 5S] \например (CHj) Sl. Интересна различная склонность к комплексообразованию простейших органических производных серы и кислорода. О* > ор >> ORj. Однако SHJ «Нитрон» («Орлов») «оргстекло » ««Ловесана» («терилен»)»капрон» («паррон»)») >»Нейлон» («Анида») » ei AITA」 Мировое годовое производство различных полимеров, а также пластмасс и искусственных волокон на их основе продолжается, достигая нескольких миллионов тонн Он растет быстрее.
Объем производства СССР в 1972 году составил 2781 тыс. тонн. Имеются специальные монографии * о достижениях в области химии полимеров. 75) особое значение для химии имеет т. н. Ионообменная смола («ион и вы«).она характеризуется замечательной адсорбционной способностью к катионам (таким как катализатор (формальдегидная или фенольная смола) или анионы), например, формальдегидная и карбамидная смолы).
Такие смолы во многих случаях позволяют селективно извлекать определенные элементы из растворов. Есть отзывы об ионообменнике и его использовании. 76) простейшим представителем класса кетонов является ацетон (CHECCOCH$), который широко используется в качестве растворителя для многих веществ. Например, его получают реакцией, протекающей при 400 ° С: (CHjCOO) jCa = CaCOj + +(CHj) jCO.
Его молекула полярна (c = 2,90) и характеризуется следующими параметрами: rf (CC)= 1,52, rf(CO)= 1,21 A. ZCCC =116®.Ацетон-бесцветная жидкость с характерным запахом (Мп.-94.Т. кипятить при+57°С) и смешать с водой в любых пропорциях. Диэлектрическая проницаемость ацетона очень высока (e = 22), некоторые соли (Nal, Ca (N03))?FeClj, AgC!0, KMnO< и др.) Kl (910 «s).
Как видно из значений констант диссоциации HC104 (2-I0» s) и HCI (5-10″), электролитическая диссоциация в растворах ацетона невелика. 77) при 700°с пары ацетона разлагаются по схеме СН3СОСН3 = СН » + hjcco, образуются метан и Кетен. Молекула HjC = C = 0 является полярной(q = 1.41) и характеризуется следующими параметрами: rf (CC)= 1.31 A, k(CC)= 9.8. РФ (Колорадо)= 1,16 а, к(СО)= 15.5.Если в Центральном атоме углерода имеются кумулированные (2 одновременно) двойные связи, то Кетен(Мп.-135, Мп.
Реактивность (-41°C) очень высока. 78) сернистые аналоги ацетона-диметилсульфид и д (т. пл. 6®С) — один из самых универсальных растворителей. Молекула (CHj) 2SO является полярной(| d-α= 4,0), которая имеет пирамидальную структуру и характеризуется параметром RF (CS) = 1,81 A. ZCSC= 97°. D (SO) 1.47 A. ZOSC-107e. при нагревании выше 90°C диметилсульфоксид начинает разлагаться(но не разлагается при пониженном давлении). он смешивается с водой и обычными органическими растворителями(за исключением насыщенных углеводородов) и часто используется в качестве хорошего растворителя, особенно при определении молекулярной массы полимеров.
В отличие от воды, которая гидратирует как катионы, так и анионы, диметилсульфоксид (ДМСО) только сольватирует катионы. Анион реакции обмена(Тип A * + Х〜+ У А * +(три датчика)〜а * + г «+ ВХ、 При участии «голых» анионов они прогрессируют быстрее, чем обычные растворители. ДМФ проникает в кожу и быстро распространяется по всему телу, обеспечивая обезболивающее. Это является основой использования для введения в организм некоторых препаратов без лекарств (например, инсулина).
Очень важно, что ДМСО предотвращает образование кристаллов льда во время замораживания биологических препаратов (см. IV§ 3 дополнительно 26).Достаточно высокий процент смеси с водой кристаллизуется даже при температуре жидкого азота. 79) (CHj) окисление jSO, диметилсульфоксид — (CHj) jSO? Вы также можете использовать это приложение, чтобы помочь вам найти идеальный подарок для вашего любимого человека.
Структурные аналоги серной кислоты l (H0)} S02].Параметр rf (HC)= 1,08. РФ (КС)= У7. d (SO)= 1.43 A. ^ HCH = Il0e, ZCSC 103 ′. ^ ОСО =127. Oi-бесцветное кристаллическое вещество (Мп.109. mp. At 238 ° C), он легко растворим в воде и обладает высокой устойчивостью к восстановителям. 80) важным для общей химии кетои является ацетилирование-CsHe02. * Корш тов. Прогресс химии полимеров. М..»Нлум.»1%5. 415 С. ** R i 6 h и о A. D. I. .. Terei Tysi E. A. и достижения в области химии. 1950, Сент-2.220.
Это пахучая жидкость (кипящая при 137°С), легко растворимая в воде и обладающая слабокислыми свойствами (к = 1-10-1). в ацетилацетоне выполняются таутомерные равновесия 2 различных структур. СН, — СО-ЧГ-СО-СН, че-с (О)= » Ч-со — че Кетоформ>единственная форма Водород группы енольного типа C (OH) (около 75% в равновесии) можно легко увидеть на металле, а кислород группы CO может образовывать донорно-акцепторную связь с it. So, каждая молекула ацетил-ацетона связывается с металлом одновременно в 2 части.
Подобные ацетоновые ацетонаты известны многими элементами. Многие из них получают только путем смешивания ацетилированных и свежеосажденных гидроксидов металлов, взвешенных в воде. water. As как правило, ацетилацетонат слабо растворяется в воде(он не является электролитом), но хорошо растворяется в органических жидкостях (даже в углеводородах).Примерами являются черные Mn (cshjoah (разложение, Pr.150°C) и красно-фиолетовый Cr (CjH? ОЖ)3.
Характерная длина атомной координации показана на рисунке. X-35 (средняя энергия связи CrO оценивается в 56 ккал / моль). 81) первым членом гомологичного кислотного ряда является муравьиная кислота (HCOOH).Его молекула полярна (q = > 1.35) и имеет то, что показано на рисунке. Плоская конструкция X-36. Протонное сродство молекулы HCOOH оценивается в 185 ккал / моль. Муравьиная кислота используется для воды(Мп.8. mp. It представляет собой бесцветную жидкость, смешивающуюся с 101°С), обладает высокой диэлектрической проницаемостью (25°С при 56 ° С) и имеет очень резкий запах.
Первоначальная электролитическая диссоциация представляет собой ионный продукт[HCOOH + J [HCOO-} = «5•10’7、и он характеризуется растворенным в нем «НСО». Происходит димеризация по схеме 2 HCOOH **(HCOOH) и образование водородных связей от 4 до 14 ккал(между гидроксильным и карбонильным кислородом).Наличие в молекуле муравьиной кислоты (К = «2-у» 4) приводит к тому, что связь с — Н и атом углерода с = 0 является сильным восстановителем (как в альдегидах).как правило, ее соли(УР и в и С, или формиат) легко растворяются.
Интересно, Cg (NSOO)?Очевидно, что может быть 2 формы синих мышечных молекул и красных бинарных molecules. In для лечения ревматизма применяют разбавленные (1-1, 5%) водные растворы АХК, называемые «ариальколь». 82) пиролиз паров муравьиной кислоты, прошедших через нагретую стеклянную трубку, идет почти одинаково в 2-х направлениях. I. UNSOO-H, 0 + CO и II. при использовании hcooh = CO,+ N оксида алюминия в качестве катализатора фактически выполняется только первый процесс, а второй процесс выполняется при использовании оксида цинка(см. VIII§ 3 из 5). 83) формамид (HCONH?) среди производных муравьиной кислоты интересны).
Его молекула полярна (q 3.71) и имеет следующие параметры: d (HC)= 1.10、 РФ (СN)= 1.38. РФ (Нью-Хэмпшир)= 1.01,< * (со)= 1.I9A, ZHCN = «H13e». ZHNH■= 119′, ZNCO = » 124°.Формамид-бесцветная жидкость (Мп.3, Мп.211 * C). он имеет очень высокую диэлектрическую постоянную (e = 25°C) и соответствующий ионизируя растворитель для много salts. As как правило, они менее растворимы, чем вода(кроме того, многие I-Br-C! С анионами, растворимость уменьшается).
Сравните растворимость некоторых солей калия (г / 100 г) при 25°С ниже. KNCS KHjPO » KNRO K3RO K j (Fc (CN) el K | / Fe (CN)| 88.6 1.2 4.1 4.5 2.7 14.7 2S + 2NaNO из реакции формамида? Следует отметить, что он протекает количественно в соответствии с = N’ajsj03 + NjO (80 ° C за 30 минут).Чистый безводный Na? Вы можете использовать его, чтобы получить Sj03.
84) наиболее близким аналогом formampda является диметилформамид (HCON (CH3b).в качестве растворителя общего назначения он очень похож на диметилсульфоксид (add 78).Oi имеет более широкую область жидкого состояния(t −61.т. БП-это площадь поверхности 153°с), термостабильность выше, но не обладает физиологической активностью, оба-диметилсульфоксид и диметилформамид (сокращенно ДМФ) — иногда называют «Суперрастворителем».
85) на самом деле наиболее часто встречается уксусная кислота (CHjCOOH), Раздел 2 гомологичной цепи кислот, которая представляет собой бесцветное вещество с характерным запахом(mp 17, mp 118 ° С).в парах они частично димеризованы(аналогично UNCS).в жидком состоянии почти нет диссоциации. [cn3soon;] [cn3soo | » 1•10-12.
В качестве растворителя уксусная кислота обычно похожа на воду и растворяет многие неорганические вещества(например, 1 объем растворяет около 300 объемов SO*).Из солей в нем в основном растворимы галогениды (за исключением фторида) и нитраты, а вот сульфаты нерастворимы. Диэлектрическая проницаемость уксусной кислоты мала(α= 6), а растворение соли марадонокосинлоана(например, K в случае LiBr-7—10—7, для NaBr 1 * 10 ’7, для NaCIO 3-10«). «)
CfijCOOH-это скудный протонный рецептор. Таким образом, растворенные в нем неорганические кислоты ведут себя как слабые электролиты и диссоциируют в соответствии с серией IfClO(I-10 -») — HBr(8-10″) — Н, так, (/C,=3,10 -*) — HCl (3 * 10″) — HN03 (4•10″’) уменьшается. Уксусную кислоту смешивают с водой в любой пропорции, слабую кислоту в растворе(к = 2-10’).Большинство его солей (называемых уксусной кислотой или ацетатами) растворимы в воде.
Многие хорошо растворяются в уксусной кислоте. Кальняцстат нашел медицинское применение(как мочегонное средство). Уксусная кислота известна в Европе с 9 века и широко используется в промышленности. При приготовлении уксуса используется 80% раствор CH3COOH, который продается под названием «уксусная эссенция».То есть это разбавленный (5-7%) раствор CH3COOH, который употребляется в качестве ароматизирующего вещества.
86) уксусной кислоты и D и R и D — (CH3CO) АО получаемой в результате действия нескольких влага-рилизинг веществ на ледяной СН3СООН (например, фосген). Oi-бесцветная жидкость(mp.-73.Mp. At 140°C), повторно присоединить воду с замечательной скоростью только при нагревании. 87) трифторуксусная кислота-CF3COOH образуется, когда фтор в метильном радикале CH3COOH замещен фтором.
Бесцветная жидкость с достаточно низкой диэлектрической проницаемостью (е = 8,5) (Мп.-15, Мп.72°C), и является сильной кислотой(K = 1,1).Когда карбоксильная группа удаляется из атома фтора, прочность фторированной органической кислоты постепенно уменьшается, и прочность CF3 (CH) 3COOH (K = 3-10-a) приблизительно равна уксусной кислоте. Многие соли металлов(трифторацетат) известны по CF3COOH. Все они ядовиты. Натриевые соли используются в сельском хозяйстве(как эффективное средство против грызунов). при низких температурах происходит деградация xef2 и обмена
Получены нестабильные CFjCOOXeF и (CFjCOO) jXe. Ацетат Trn fluoro соответствующий растворитель для много веществ. 88) 2 азотные производные CHjCOOH очень важны для решения многих задач химии(аналитической практики, разделения отдельных элементов, умягчения воды и др.).Нитрит и уксусная кислота [N(CHjCOOH) 3]характеризуются константой диссоциации AC, −2 * 10*. / C2 = I•10-3 и / Ce = 5•10-11.И
Тетрауксусная кислота этилена-диаммония [(HOOCCH2) 2N-CHy-CH * —N(CH2COOH) 2] — константа K,= I * 10 «.КДж я = — 2-10 «\ к= 710 «7 и / С4 = 6-10«.Оба имеют ярко выраженную тенденцию к образованию сильных комплексных соединений со многими металлами за счет замещения водорода в карбоксильной группе и диорной функции атома азота. Обычно используются обе натриевые соли. Кислота (даны технические названия «tr-lon L» и «three l he B»). 89) простейшим представителем двухосновной органической кислоты является щавелевая кислота (HOOC-COOH), молекула которой состоит из 2 карбоксильных groups.
It имеет плоскую структуру grax с параметрами d (CC)= 1.54, d(C = 0)= 1.22,d(C-O)= 1.37 a, ZCC = 0-122°,ZOCO =125е. Щавелевая кислота (K,= 7-U «/ C2 6-10») представляет собой белое кристаллическое вещество(mp. At 189°C), очень растворим в воде (при нормальных условиях по массе 1: 10).Большинство его солей (называемых оксалатами или оксалатами) плохо растворимы в воде. water. It это смешно. Оксалат К. Р. Cs выделяется с кристаллической водой, а оксалаты Li и Na-без нее (как правило, наблюдается противоположность солей щелочных металлов).
Из производных обычных катионов легко растворяется только соль Na . K и NH *.Однако многие плохо растворимые оксалаты растворяются в избытке растворимых оксалатов путем комплексообразования по схеме. Например, Cr2 (C204) 3 + 3NajCjO <= 2Naa (Cr (Cj04) 3).как правило, оксалатный комплекс стабилен. Благодаря действию сильных окислителей (таких как KMn04 n) щавелевая кислота очень легко окисляется до CO2 и H2O. напротив, под воздействием металлического калия (pr 200-300°C) углекислый газ восстанавливается до соли щавелевой кислоты:2C02-f-2K-CrCrO.
90) двухосновная винная кислота (Noos-CH (OH) — CH (OH) — COOH) (Ki = I * I0 «/ /(2 = 5 ′ I0 » J) представляет собой бесцветный кристалл (mp 170° C), простую соль, которая хорошо растворяется в воде, и ее составная соль (винный камень) известна для многих металлов. KNaC ^ HiO, смешанная соль винной кислоты в составе 4H20 («соль Рошели»), является первым научным представителем сегмента электричества. То есть вещество, кристалл которого проявляет необычно большое значение диэлектрической проницаемости под действием электрического поля.
Это свойство ограничено определенным диапазоном температур (рис. Х-37). Когда Сегио-электрический Кристалл подвергается сжатию или растяжению, на противоположной поверхности появляется заряд различных знаков (так называемый прямой пьезоэффект).Напротив, применение сегнетоэлектрического поля вызывает определенное изменение его размеров (то есть обратный пьезоэффект).Оба этих эффекта обусловлены смещением катионов этого вещества и пространственной решетки ионов друг от друга.
Сег-netoelectrics имеет множество применений в электротехнике. 91) в своем составе жиры представляют собой сложные эфиры глицерина и различных органических кислот, главным образом пальмитиновой кислоты(C / jH3lCOOH)、 Рисунок Х-37.Температурная зависимость диэлектрической проницаемости сегнетоэлектрической соли («слабое поле»). Стеариновая кислота(c |?NmCOOH) и олеиновой кислоты (CfNmCOOH).Первые 2 кислоты ограничены, а последняя содержит 1 двойную связь в молекуле.
Их относительное количество определяет физические свойства жировых веществ: твердый жир (например, баранина) содержит больше стеариновой кислоты и сложных эфиров пальмитиновой кислоты. Жидкость (например, подсолнечное масло) — олеиновая кислота. Коровье масло также содержит значительное количество масляной кислоты глицерина эфира (CjHjCOOH).Этилацетатный эфир-CHjCOOCjHs (например) часто используется в качестве растворителя. Это бесцветная жидкость, которая слабо растворима в воде (mp.-83.mp.77°C).
92) среди сложных эфиров неорганических кислот особенно следует выделить трибун «tn l фосфат[OP (OS» N)) s1 careful. It представляет собой бесцветную жидкость (mp 80, mp 289°C, разложение).Практически нерастворим в воде. Атрибут фосфат (CC1 ″ при q = 3,01«) часто используется для отделения некоторых элементов из смеси путем распределения между 2 растворителями (VII§ 4 add.13). 93) другим важным представителем сложного эфира неорганической кислоты 1 является нитратный эфир глицерина. Нитроглицерин[C3Hs(0N02) j1.
It представляет собой тяжелую маслянистую жидкость (mp14°C). характеризуется крайней взрывоопасностью. Триполи, пропитанный нитроглицерином, называют динамитом и используют в качестве explosive. In смесь пироксилина с некоторыми другими добавками, нитроглицерином дает студенистую массу и помогает сделать бездымный порошок. 94) большинство других взрывчатых веществ имеют нитрогруппу (- нет?) скрепленный к атому углерода через скрепление К-Н в molecule.
It относится к классу органических нитросоединений, который характеризуется наличием а). примером такого типа соединения является нитробензол (Cehsn’OJ). это жидкость, которая практически нерастворима в воде(mp.6. Т. КНП.(211°C), с характерным ароматом горького миндаля. Даже если в молекуле нитробензола присутствует 1 Митрогруппа, характеристики взрывчатых веществ пока неизвестны. Дальнейшее накопление такой группы приводит к ее появлению: производное бензола или толуола с 3 и 4 Нитрогруппами в молекуле становится взрывчатым веществом с взрывным действием(техническое название-мерилит, тротил, тетрил и др.).
95) простейшим органическим соединением intro является нитрометай-CH3NO}(mp 17, mp 101°C).Его полярные молекулы (q = 2,71) и структурные параметры характеризуются rf (CN)= 1,49. d (NO)= 1.22 A. ZONO-127°.Для константы связи C-N приведено значение k = 4,7. Добавление группы ntro к атому C значительно усиливает поляризацию связи C-H. Нитрометай в водном растворе ведет себя как слабая кислота (/C| = 1•10 «、|)。Кислотные функции диннесрометана уже четко выражены (/Ct-3-U » 4), HC(нет? с (МП 25°С).c= 2.7) является сильной кислотой (/C-7,0-1), и многие соли известны.
Нитрометан 3 (в противном случае ntroform)бесцветен и hoii (C (NOj) j] » желт. Нитрометола Тетра представляет собой бесцветную жидкость (mp 14, температура кипения 126°C). ее можно разобрать взрывом. Только 70%C (нет? «) 4 и 30%N ’ 20 » могут быть использованы в качестве окислителя для реактивного топлива. 98) интересно смешанного nitrocyanide производные метана-водного раствора ФК(с n02), соли-как НАК (с помощью параметра n02) СN N, которая получается при действии фтора на CN.
Последнее соединение » Е » представляет собой бесцветную жидкость (Мп.-13, депутат.74°с). 97) обычное мыло состоит в основном из смеси натриевых солей стеариновой кислоты и пальмитиновой acid. In в производстве жидкого мыла («зеленого мыла») преобладает каруниевая олеиновая кислота, так как она не происходит из различных растительных масел или KOH. In кроме этих солей, в состав композиции обычно вводят много различных примесей, особенно красителей и пахучих веществ. soap.
An важным побочным продуктом производства мыла является глицерин. Моющее действие мыла обусловлено частичным гидролизом свободных щелочей и жирных кислот. Гидролизованный продукт удаляет пот-жировые вещества, которые удерживают грязь в руках, нижнем белье и т. д. Мыло было произведено и потреблено в Месопотамии еще 2200 лет назад. h. (я добавляю 1.2). 98) в настоящее время обычное мыло все чаще заменяется различными синтетическими detergents.
As как правило, в их основе лежит общее число атомов С от 12 до 20, а также углеводороды с различной структурой, в которых часть атомов водорода замещена атомами или радикалами, придающими молекуле достаточную растворимость в воде. Различают анионные (и обычные мыльные), катионные, амфотерные и круговые ионные чистящие вещества. Первые обычно присутствуют в его составе: первая группа-SOjNa (не-натрий), вторая-группа-NRjCl (Ион-хлор), третья-обе группы обоих типов, а общая формула R-R представляет собой 4-й (неионный) углеводород, CHjCHjO-Chjjo-Chjchoh, где R — радикал, а R-атомарный двухвалентный (O. S) или радикал (- CH * — NH -, — CO-NH-и др.).
Почти все синтетические моющие средства лучше, чем обычные мыла, которые прекрасно работают в жесткой воде. 99) большинство стиральных порошков основано на общей формуле Ргэх «SOjNa» додецилбисолсульфонат («сульфонол»).Где R-углеводородная цепь, обычно содержащая 12 атомов углерода. Интересно, что почвенные бактерии разлагают сульфонолы, переносимые сточными водами, причем чем меньше разветвлена углеводородная цепь, тем легче это происходит. 100) простейшей аминокислотой является аминокислота (глиций, или гликоль) — Nhjjcooh.
Бесцветное кристаллическое вещество, легко растворяется в воде. Кислотные свойства глицина выражены лишь очень слабо (к = 2•10-11).Наличие его основных свойств проявляется при взаимодействии с водой: OH,+ Nhjjcooh * * OH ’ + * HNH? Ч, КУ. Эти свойства еще слабее, чем кислотные (/(= 3-10-u).Изоэлектрическая точка глицина находится при рН = 6,2. Помимо обычной электролитической диссоциации в растворе глицина, существует равновесие между его 2 формами-нейтральными молекулами и др. Биполярная львица: NHjCH2COOH * * ♦Hnhjchjcooo».
Реакция последних с кислотами и основаниями протекает по схеме.♦HNH2CHjCOO» — fH * * * ’ HNHjCHiCOOH и ОН + + ♦ hnhjchjcoo * н, 0 + nhjchjcoo. Получается тот же конечный продукт, что и нейтральная молекула. Судя по высокой температуре плавления глицина(233 ° С), его кристаллы формируются именно биполярными ионами. NHjCH, COO».Среди простых производных глицина интересна голубая соль меди с хорошей кристалличностью.
101) связывает большое количество молекул глицина друг с другом, удаляя при этом воду по схеме «**H] ONSN «С0 / 0Н+HlNHCH» cojoif-• Он служит упрощенной моделью процесса, ведущего к образованию белковых частиц. Glction является самой простой из 20 аминокислот, которые составляют белок человеческого организма. Все они относятся к T. o-аминокислотам, то есть содержат одни и те же атомы углерода-NHj и группу-COOH. Их общая формула, как правило, имеет вид H2NC (H) ® COOH, который имеет различные радикалы R. некоторые из этих аминокислот(11)могут синтезироваться самим организмом человека, а остальные (9) должны быть включены, то есть незаменимы в составе пищи.
Имеется обзорная статья об использовании аминокислотных смесей в питании человека. * В. М.. B a b 1 i и T. L. B c i y o o, успех в химии. 1971, м. 5.828. 102) среди отдельных аминокислот глутамин (R-CH2CH2COOH) является наиболее распространенным concern. It не требуется, но входит в состав таких жизненно важных органов, как сердечная мышца и мозг (последний содержит 0,15% по массе).Основная физиологическая роль глутамата, по-видимому, заключается в связывании (последующем выводе из организма) аммиака, который, в свою очередь, интоксикирует нервную ткань, которая частично образуется при распаде proteins.
An удивительной особенностью этой кислоты (или ее натриевых солей) является ее способность улучшать вкус даже самых разнообразных предложений, даже в очень малых количествах quantities. It считается, что это связано со стимуляцией вкусового нерва. Мировое годовое производство глутаминовой кислоты и глутамата натрия составляет десятки тысяч тонн. 103) растительные организмы, особенно животные, как правило, содержат гораздо больше химических элементов, чем отдельные белки.
Средний химический состав человека (В. И. Вернадский) в качестве примера элементы сгруппированы в группы с целью уменьшения их весового процента: 1. Более 10 Часов (63.04). С (18.25). Н(Ю.05)| Второй. 1 Н(2.65).Се (1.4) III. > 0,1 P (0,8). К (0,27). Н «(0.26). С1 (0.23). С(0.21) IV. » 0,01 мг. Фэй В.«0.001 ЗН.» СИ Ви. 0.0001 Аль. Br. Cu. Ф. И. МО VII. » 0.00001 As. В. ПБ. Ти Интересно, что отдельные элементы, характеризующиеся очень малым общим содержанием, концентрируются в основном на определенных частях тела.
Поэтому относительно большое количество С содержится в печени. АГ-это мозг. Си-лун. МП-это сердце. ЗП-это язык. ЗН-зубы, как ногти и т. д. 104) существование противоположного пола. Для Ломоносова это было obvious. In в очерке «элементы математической химии» (1741) он писал: частицы неоднородны, когда элементы соединены по-разному или в разных количествах. От этого зависит бесконечное разнообразие тела.«Под элементами» М. В. Ломоносов понимал атом, под»микрочастицами»-молекулы.
Изомеризация была экспериментально открыта Liebnh (1824), и общая формула для гидроксида серебра (AgCNO), которую он изучал, оказалась такой же, как и общая формула для циано AG (AgNCO), полученная ранее Vlsrom, но свойства обоих веществ отличаются. результаты этноса поначалу казались непостижимыми большинству химиков, но после этого были открыты и другие подобные случаи, позволившие признать возможность такого единства различий.
Общая трактовка феномена РГ гетеросексуальности впервые Дана А. М. схема стереоизомеров была дана Бутлеро-Райсом. вым (1861). 105) следует отметить только то, что, не касаясь отдельных разновидностей изомеров органических соединений (которые подробно рассматриваются в курсе органической химии).Что это может быть вызвано не только изменением порядка распределения связей, но и различными пространственными распределениями различных атомов или радикалов в молекуле.1 в случае такого типа гетеросексуальности, называется стереосексизм. Схематично показано на рисунке. Х-38.
Представьте себе, что 4 заместителя (атомы или радикалы) вблизи атома различны, это будут оба вышеприведенных рисунка. Тетраэдр X-38 является зеркальным отражением друг друга (например, левая и правая руки) и не может быть соединен вместе. Поэтому обе структуры должны соответствовать 2 различным веществам, которые могут быть получены на практике. Сцреонзомерня была открыта Пастером в 1848 году. 106) при нормальных условиях изомеры превращаются друг в друга, но их относительная стабильность все же различна.
Таким образом, тепловое воздействие обычного бутана на горение будет на 2 ккал / моль выше, чем у нзобутана. Поэтому последнее является so. It соединено больше stable. In в целом, изомеры насыщенных углеводородов достаточно стабильны, чтобы цепь была разветвленной. Используя катализатор, иногда удается перевести изомеры в определенное равновесие друг с другом, расположение которых зависит от temperature. So в присутствии A1C13 равновесие I-изобутана характеризуется следующими данными: Температура°C…………… 70110130150 IH0
Соотношение: стадия рыбного поля/ к-Бутан……. 2.76 2.62 2.04 1.73 1.41 107) таутомерное учение (§ 1 add.108) в 1877 г. М. Его разработал Бутлеров. Тем не менее, необходимо учитывать, что обычные изомеры по своей сути тавтологичны. Однако коэффициент конверсии незначителен. Противоположный пол является тавтологически особенным (хотя до сих пор он был изучен), поскольку покой-это особый случай движения. 108) «если можно выразить химическую структуру вещества химической формулой, то эти химические формулы будут в некоторой степени не неполными, а действительными химическими formulas.
In в этом смысле рациональная формула, выражающая все свойства вещества, возможна для каждого тела только 1». «Это большое дело», — сказал Бутлеров said. At в то же время он признал, что структура молекулы не является полностью жесткой.- Мы не считаем химические вещества мертвыми и неподвижными, — сказал он. Отношения постоянно меняются. Суммируйте некоторый постоянный средний результат.」
109) молекулярная масса частиц белкового вещества*очень велика, поэтому число возможных изомеров должно быть очень большим. large. It был рассчитан. В молекуле, построенной из 20 аминокислот, число изомеров определяется значительными числами с 27 нулями. То есть, он представляет собой размер астрономического порядка. Интересна гипотеза о том, что в свете таких цифр индивидуальность каждого организма связывается с различием в структуре его характерных белков.
Общую формулу вещества (ПО) легко найти на основе его химического анализа и определения его молекулярной массы(в большинстве случаев это трудно), но для установления структурной формулы часто требуется кропотливая работа work. In в этом случае необходимо основываться на способе получения рассматриваемого соединения, его химических и физических свойствах и т. д. В качестве простого примера рассмотрим процесс вывода при исследовании изомерных модификаций веществ состава С2Н60.
Структурная теория дает 2 изомера со следующими структурными формулами: CH3-O-CH3 и CH3-CHj-OH A B 2 вещества состава CjMeO также известны о реальности.1 из них kipnt в −24. 1 не реагирует с металлическим натрием, а другой 1 не взаимодействует с металлическим натрием, он испускает водород, и кроме того, он испускает только 1 атом каждой молекулы C2H * 0.Эта последняя ситуация является ключом к решению проблемы.
Такой водород присутствует только в структуре В, причем последняя обусловлена изомером CrHeO, который реагирует с Na, поэтому водород должен каким-то образом связываться с молекулой с другими молекулами. Он называется этил alcohol. To другие изомеры (I и метиловые эфиры), на которые натрий не действует, необходимо выделить структурой А.
111) относительно недавно единственным источником исходного сырья для производства органических соединений является природный продукт (в виде животных или растительных организмов и их остатков), т. е. само вещество имеет более или менее сложный состав и structure. In в частности, взаимодействие с водородом позволяет получать (и уже технически доступно) действительно важные вещества, такие как высоконасыщенные и ненасыщенные углеводороды, СНаОН и другие спирты. 。
112) помимо чисто химических методов получения органических соединений все большее распространение получают биохимические методы, основанные на техническом использовании различных микроорганизмов. Последний может быть более активным, чем химическое вещество. Например, известны бактерии, которые могут питаться углеводородами. То есть он разрушает свойства, на которые не влияют кислоты, щелочи или обычные окислители(керосин, парафин и др.).С другой стороны, в большинстве случаев действие микроорганизмов очень специфично.
С их помощью часто можно регулировать и доводить процесс в нужном направлении гораздо тоньше, чем с обычными катализаторами. 113) 1) одним из перспективных направлений биохимического синтеза является получение белковых веществ из нефти. Эксперименты показали, что такой препарат возможен, если бактериям дать соединение N, R, K, Mg и другие микроэлементы (Fc, Zn, Cu, Mn).что касается аминокислотного состава, то дрожжи, выращенные в нефтяных углеводородах, сходны с животным белком и значительно лучше растительного белка. Их производство уже начало осуществляться в промышленных масштабах.
Смотрите также:
| Подгруппа ванадия | Круговорот углерода |
| Углерод | Кремний |
