Оглавление:









































Углерод
- Углерод этот элемент не самый распространенный в природе-на его долю приходится всего 0,14% от общего числа атомов в земной коре. Тем не менее, значение углерода очень велико, так как его соединения являются основой всех живых организмов. Формы углерода в природе являются diverse. In добавление к тканям живых организмов и продуктов их разрушения (угля, нефти и др.), он входит в состав многих минералов.
- Большинство из них имеют общую формулу MCO3.Здесь M-металл 2 валентности. Наиболее распространенным из этих минералов является кальцит (CaCO3). Атмосфера содержит углерод в виде углекислого газа (CO2), который при растворении также содержится во всех природных водах. Свободный углерод можно найти в виде 2 простых веществ: Алмаза и графита. Вы можете увеличить или уменьшить растяжение (из-за наличия примесей) и добавить 3-й так называемый аморфный углерод (самый простой представитель-древесный уголь) к этим 2 forms.
Иногда они образуют огромные скопления на отдельных участках земной поверхности. Людмила Фирмаль
In по внешним характеристикам алмазы существенно отличаются от других модификаций. Плотность составляет 3,5 г / см3, самый твердый из всех минералов. Самые чистые алмазы бесцветны и прозрачны. Графит серый, металлический блестящий и липкий на ощупь с плотностью 2,2 г / cm3.In в отличие от бриллиантов, они очень мягкие, легко царапаются ногтями и оставляют серые полосы на бумаге при трении. «Аморфный» углерод, по своим характеристикам очень близок к графиту.
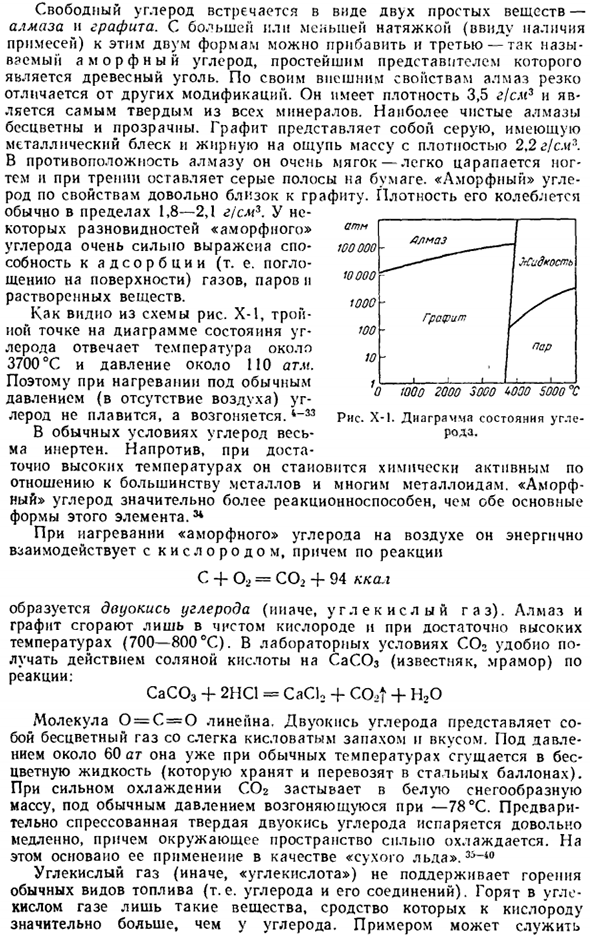
Его плотность обычно колеблется в пределах 1,8-2,1 г / см3. В некоторых видах»аморфного» углерода способность адсорбировать (то есть поглощать на поверхности) газы, пары и растворенные вещества весьма примечательна. Как видно из рисунка х-1, тройная точка диаграммы состояния углерода соответствует температуре около 3700°С и давлению около 110 атм. Именно поэтому при нагревании под нормальным давлением (в отсутствие воздуха) углерод не плавится, а возгоняется 4_m при нормальных условиях, углерод очень инертен.
Напротив, при достаточно высоких температурах он становится химически активным для большинства металлов и многих полуметаллов. Аморфный углерод значительно более реакционноспособен, чем обе основные формы этого элемента 34. Когда» аморфный » углерод нагревается в воздухе, он бурно взаимодействует с кислородом и, в зависимости от реакции С+ 0.2 =СО » » 94 kkcli Образуется углекислый газ(иначе углекислый газ).
Алмаз и графит горят только при чистом кислороде и достаточно высокой температуре (700-800°С). в лабораторных условиях CO2 получают действием соляной кислоты на CaCO3 (известняк, мрамор) по следующей реакции: СаСО3-Ф 2HC1 = Касу-Ф-ко, / + Н20 Числитель 0 = C = 0 является линейным. Углекислый газ-это бесцветный газ со слегка кисловатым запахом и taste. At при давлении около 60 атмосфер он уже конденсируется при комнатной температуре в бесцветную жидкость (ее хранят и транспортируют в стальном цилиндре).
При сильном охлаждении С02 затвердевает в белую снежную массу и сублимируется при нормальном давлении −78°С. Предварительно сжатый твердый углекислый газ испаряется довольно медленно, а окружающая территория очень сильно загрязнена. cool. It основано на его использовании в качестве «сухого льда». 3> 4° Углекислый газ(или «углекислый газ») не поддерживает сжигание обычных видов топлива (углерода и его соединений).Только их вещество горит углекислым газом, его сродство к кислороду гораздо больше, чем у углерода.
Примерами являются банкомат Вулдридж 10 1 / злмаз Жидкость Графит Пункт 1 Около 1000 2000 3000 WOO 5000 X Рисунок Х-1.Углеродный рисунок Металлический магний, около 600°C, воспламеняется углекислым газом и горит по формуле: СО, 4-2mg = 2mgo + с + 194 ккал Атмосфера содержит в среднем 0,03% CO2 по объему. В воде углекислый газ очень растворим(примерно 1: 1 по объему).При растворении он частично взаимодействует с водой и образует угольную кислоту.
H2O + CO2 H2CO3 Равновесие этой реакции сильно смещено влево, но углекислый газ следует рассматривать как безводную угольную кислоту. Последний очень слаб и слабо разлагается на ионы H-И NSCC. Дальнейшая диссоциация с образованием ионов СО не происходит сама по себе.
Равновесие: H20 + COo HOCOS ^ H ’+ HCOS ^ 2H’4-CO; При нагревании CO2 испаряется, и равновесие смещается влево. Напротив, при добавлении щелочи ионы водорода будут связываться, и равновесие сдвинется вправо. Сорок семь Будучи двухосновной кислотой, II2COj дает 2 ряда солей. Он является умеренным (в том числе и потому, что анионы»») и кислотной(в том числе HCOf анионов).Первая называется углекислотой (иначе-углекислотой), а вторая-углекислотой (бикарбонатами).
Подобно аниону самой угольной кислоты, большинство ее солей бесцветны. Из наиболее распространенных катионных карбонатов только соли Na+, K +и Nl-tf являются soluble. As в результате значительного гидролиза их раствор проявляет щелочную реакцию. Первые 2 соли могут плавиться без разложения, а большая часть оставшихся карбонатов при нагревании разлагается на соответствующий металл и со *оксид.
Под воздействием сильных кислот все карбонаты легко разлагаются, образуя соли сильных кислот, воду и углекислый газ. Наиболее важными из них являются a2C03 (сода), K2C03 (поташ) и CaCO3 (известняк, мел). В отличие от большинства карбонатов, все бикарбонаты в воде растворимы. Наиболее важными кислотными солями угольной кислоты являются K’anco3 («бикарбонатная»или» питьевая » сода).
В нормальных условиях его гидролиз незначителен(реакция раствора на лакмус практически нейтральна).При нагревании он значительно увеличивается, и примерно при 60°с углекислый газ начинает частично выделяться из раствора. Бикарбонат разлагается в сильной кислоте, такой как карбонат 48-52 монооксид углерода (CO) также является характеристикой C-oxides. It образуется при недостатке кислорода и происходит сгорание углерода или его соединений.
Чаще всего он получается в результате взаимодействия углекислого газа и горячих углей: COa + C + 41 ккал = 2CO Эта реакция обратима, равновесие ниже 400°с почти полностью перемешивается слева, а справа-выше 1000 см3 (рис. х-2).Однако при ярко выраженной скорости она устанавливается только при высокой temperatures. So, в нормальных условиях, ко очень стабилизировано 43 * 54 При разложении муравьиной кислоты удобно получать небольшое количество монооксида углерода.
nsoon = Н20 + со Эта реакция UNCT и горячая Сильная серная кислота 55 Окись углерода представляет собой бесцветный газ без запаха, слабо растворимый в очаге и химически с ним не взаимодействующий. Со также не вступает в реакцию со щелочами и кислотами. Угарный газ очень токсичен. С химической стороны монооксид углерода в основном характеризуется тенденцией реакции присоединения и его восстановительными свойствами. Однако обе эти тенденции обычно проявляются только при высоких температурах.
В этих условиях CO соединяется с кислородом, хлором, серой, некоторыми металлами, etc. At в то же время окись углерода при нагревании превращает многие оксиды в металлы. Это очень важно для металлургии. Помимо нагрева, увеличение химической активности монооксида углерода часто обусловлено его растворением.
Поэтому в растворе можно уменьшить содержание Li-соли. Другие элементы, Pt n, высвобождают металл при комнатной температуре. В воздухе СО горит примерно при 700 ° С, а 燃02 горит синим пламенем: Сто 60. 2Г. 1 в Рисунок Х-2. Равновесие CO. + С; ЗР 2ПК. 2CO + 02 = 2C02 4-135 ккал Из-за значительного нагрева, связанного с этой реакцией, монооксид углерода становится ценным газообразным топливом. Однако он имеет самое широкое применение в качестве исходного сырья для синтеза различных органических веществ. Исходя из вышеизложенного, сжигание толстого слоя угля в топке будет протекать по существу в 3 фазы, как схематично показано на фиг. 3. Х-3.
Если труба будет преждевременно закрыта, то в печи возникнет нехватка кислорода, и со распространится в отапливаемом помещении, что может привести к отравлению(горению). Следует отметить, что запах»угарного газа» обусловлен не самим угарным газом, а некоторыми примесями органических веществ. Взаимодействие хлора и хлора по уравнению Коку + 27 ккал В присутствии катализатора (активированного угля) он быстро прогрессирует уже при комнатной температуре.
Полученный фосген представляет собой бесцветный и очень токсичный газ, он имеет характерный запах и почти не растворяется в воде, но в схеме он постепенно разлагается: SOSG> + 2Н, 0 =Н2С03+2НС1 2ПК * Ој-2ПК、 В. В….. Рисунок Х-3.Образование углей горения в печи. Со + ЦБС Следовательно, это карбонатное соединение. Благодаря своей высокой реакционной способности фосген широко используется в органическом синтезе (74-79 Окись углерода может прилипать непосредственно к некоторым металлам (обычно только при высоких температурах и под давлением).
В результате образуется карбонил металла] Fe( CO) 5. Ni (CO) 4. МО (СО) в соавт.), Это следует рассматривать как сложное соединение. Карбонил металла-летучая жидкость или твердое вещество, нерастворимое в воде, но растворимое во многих органических растворителях. Все они очень токсичны и при нагревании легко разлагаются до соответствующего металла и окиси углерода 8 ^ 89 В отличие от сильных экзотермических процессов выделения CO2 из элементов, реакция соединений углерода и серы является эндотермической реакцией.
C-f 2S + 21 ккал = CS2 В данной области техники дисульфид углерода (CS2)образуется путем пропускания паров серы к слою горячего угля. Чистый дисульфид углерода — это очень летучая бесцветная жидкость, которая имеет довольно приятный запах, но обычно содержит следы примесей продукта частичного разложения, что придает ей желтый и неприятный запах. Дисульфид углерода практически не растворяется в воде и не взаимодействует с водой в нормальных условиях.
Его пары токсичны и легко воспламеняются. Их сжигание происходит по формуле CS2 + 302 = CO2 + 2S02-f 264 ккал Сероуглерод является прекрасным растворителем жиров, масел, смол и т. д. Это является основанием для их использования для извлечения (извлечения) таких веществ из различных природных materials. It очень важно для индустрии искусственного волокна и также использовано для того чтобы контролировать аграрных бичов. nst90-105 Реакция соединений углерода с азотом очень эндотермична и протекает лишь частично при очень высоких температурах.
Среди простейших азотсодержащих производных углерода наиболее важным является цианистый водород(HCN).Реакция может быть получена из Co и аммиака CO + NH3 + 11 ккал = H20 + HCN В присутствии Th02 (в качестве катализатора), при температуре около 500°С он уже прогрессирует достаточно быстро. Цианистый водород (синильная кислота) — очень летучая бесцветная жидкость со слабым специфическим запахом и вкусом (горький миндаль). HCN смешивается с водой в любой пропорции, образуя цианистый водород (hydrogen cyanide) acid. Его кислотная природа очень слабо выражена, поэтому под действием более сильных кислот он легко выделяется из своих солей (например, цианид).
Синильная кислота используется в основном для синтеза органических веществ, ее соли (NaCN, KCN)-для извлечения золота. И кислота, и ее соли очень токсичны. Как и сам Ион CN, большая часть цианида бесцветна. Производные наиболее активных металлов легко растворимы в воде, а производные с низкой активностью, как правило, плохо растворимы.10 * » 115 Для ионов CN очень характерно попадание комплексных соединений во внутреннюю область. Распространенным способом получения сложного цианида является воздействие избытка KCN на соли соответствующих металлов. Первый осажденный простой цианидный осадок растворяется в избыточном осадке за счет образования растворимого сложного цианида.
Реакции, например, следуют по схеме: CrC13 + 3 цианистого калия = СГ(ЧНУ + ZKS1 и CR (КН) 3-Ф 3 цианистого калия = К3 [СГ (Ц\’) 6] Наиболее сложные цианиды успешно кристаллизуются из раствора. Их стабильность сильно зависит от свойств комплексообразователя и, как правило, велик. При нагревании цианида серебра до 350°С в зависимости от реакции 2AgCN-(CNb-f 2Ag ЦИАН выпущен(N = sC-CaN). это бесцветный ядовитый газ с слабым специфическим smell. In с точки зрения многих химических свойств, цианид очень похож на галогены и является одновалентным радикалом CN.119_l4e играет роль атома галогена.
Раствор цианистого калия кипятят с серой(или с примесью обоих веществ), а соль родановой кислоты (H — N = C = S) формируют по схеме. KCN-f S = KNCS-f 22 ккал Свободные HNCS бесцветны и стабильны только при очень низких температурах или в разбавленных водных растворах (менее 5%).Она совершенно изолирована. Большинство его солей (называемых тиоцианатами, роданидами или рудниками) бесцветны, хорошо растворимы в воде и стабильны в нормальных условиях.
Наиболее распространенными являются соли аммония и калия.147 ″ 161 Простейший галогенированный углерод соответствует общей формуле SG. За счет взаимодействия элементов получают только фторидные производные, остальные получают опосредованно. Наиболее важным из них является тетрахлорметан (SSC) — тяжелая бесцветная жидкость со слабой характеристикой odor. In вода, SCC почти неразрешима. С химической стороны он характеризуется главным образом своей инертностью.
Именно поэтому в нормальных условиях ККУ не взаимодействует с кислотами и щелочами. Четыреххлористый углерод прекрасно растворяет воду, масло, смолу, многие краски и др., а потому служит хорошим средством для удаления грязи. Так как он негорюч, то риск возгорания при работе исключается, а ССК значительно выгоднее, чем более дешевый растворитель вышеуказанного вещества-сероуглерод.1″ 1 ″ 9 В нормальных условиях происходит образование метана (СН4) путем реакции и прямого взаимодействия углерода (аморфного) и водорода С-f2H2CH44-18 ккал
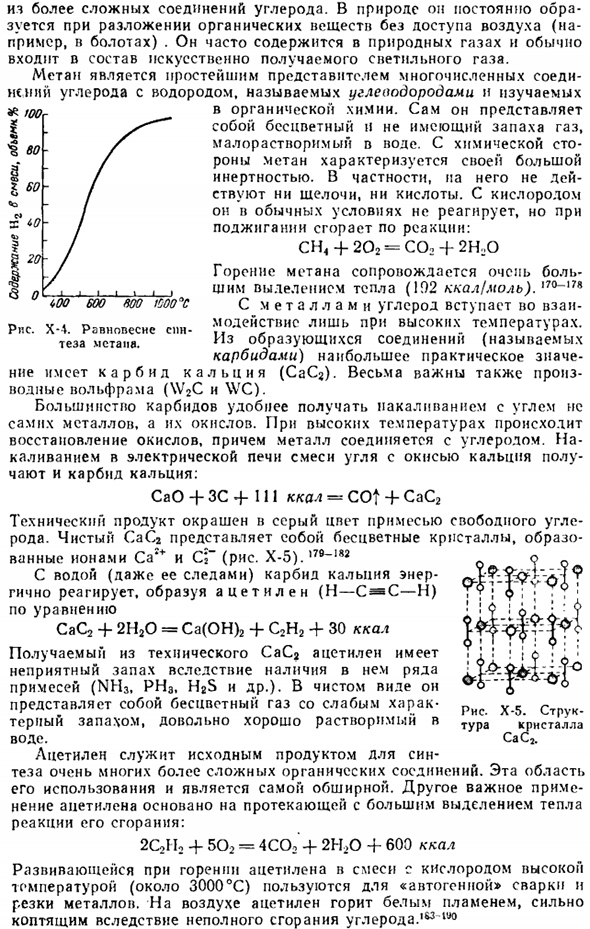
На самом деле этого не происходит. При нагревании равновесие устанавливается в присутствии катализатора (мелкодисперсного Ni), расположение которого сильно зависит от температуры(рис. х-4). Помимо этого синтетического пути метан может быть получен и многими другими способами. Из более сложного углерода compounds. In в природе он образуется постоянно при разложении органических веществ без контакта с воздухом (например, в болотах), часто входит в состав природного газа и обычно входит в состав искусственно генерируемого лампового газа.
Метан, называемый углеводородом, является простейшим представителем большого количества углеродных соединений, содержащих водород, и был изучен В органическом chemistry. In сам по себе он представляет собой бесцветный газ без запаха, почти нерастворимый в воде. На химической стороне, метан охарактеризован своим большим inertness. In в частности, не действуют ни щелочи, ни кислоты.
В нормальных условиях он не реагирует с кислородом, но когда он горит, он горит: CH <+202 = CO2 + 2H20 Сгорание метана сопровождается очень большим выделением тепла (!).92 ккал / моль).170-17 * углерод взаимодействует с металлами только при высоких температурах. Из полученных соединений (называемых карбидами) наибольшее практическое значение имеет карбид кальция (CaC2).Производные вольфрама (\ V2C и WC) также очень важны. Большинство карбидов удобнее получать раскаленным углем, но не из самого металла, а из его oxides. At при высоких температурах оксид уменьшается, и металл соединяется с углеродом.
Если вы нагреете смесь угля и оксида кальция в электрической печи, вы также получите карбид кальция. САО + 3С 4-111 ккал = коф-Ф Сас2 Технические изделия окрашены в серый цвет и смешаны со свободным углеродом. Чистый CaC2 представляет собой бесцветный кристалл, образованный не-Cag +и C \ — (рисунок X-5) M-1 * 2 Карбид кальция бурно реагирует с водой (даже в небольших количествах) и образует ацетилен (Н— Cs = C —Н) по формуле. CaSg-f 2H20 = Ca (OH) 2 + C2H2 + 30 ккал Ацетилен, полученный из технического Сас2, имеет неприятный запах из-за наличия многих примесей (NH3, PH3, H2S и т. д.).
В чистом виде это бесцветный газ со слабым характерным запахом, очень хорошо растворимый в воде. Ацетилен является исходным материалом для синтеза более сложных органических соединений. Эта область использования является наиболее обширной. Еще одно важное применение ацетилена основано на реакции горения, которая происходит с выделением большого количества тепла. 2C2I2 + 502 = 4COe ’+ 2H> 0 + 600 ккал Ацетилен образуется при сгорании в смеси с высокотемпературным кислородом (около 3000°С) и используется для»Автогенной» сварки и резки металла. metals.
In воздух, ацетилен горит белым пламенем, и из-за неполного сгорания углерода, он испускает тяжелый дым.183 ltf0 Рисунок Х-4.Равновесие синтеза метана. Остроумие! Рисунок Х-5. Структура кристалла CaCj. Из рассмотренного выше материала видно, что во всех его более или менее стабильных соединениях углерод является четырехвалентным. 1 исключение составляет окись углерода, но yes.
As уже упоминалось, что легко вызвать дополнительную реакцию с переходом углерода в квадрантное состояние. Кроме со, мало известны производные углерода с валентностью, отличной от 4(то есть 2 и 3), но такие соединения нестабильны при нормальных условиях conditions. So, характерная валентность углерода равна 4. Добавь 1) в виде древесного угля углерод был известен человечеству с незапамятных времен, но в 1787 году этому элементу было дано современное название.
2) природный углерод состоит из 2 изотопов: «с (08.802%)»и» с (1.108%)».Начальная масса в настоящее время считается единицей атомной и молекулярной массы(i§ 4).Следует отметить, что в различных природных объектах соотношение обоих изотопов может несколько отличаться (см. Рисунки, приведенные в известняке COj).Следовательно, практический атомный вес Углерод дается с точностью±0.00005. —— л / 0 3) структура внешней электронной оболочки углерода — ^ ^ ’ / Ov * g и ее валентное состояние были ранее рассмотрены (VI§ 3 add.11).Последовательная энергия ионизации атомов углерода составляет 11,26. 24.38; 47.87 и 64.48 эВ.
Сродство к 1 электрону составляет от −4 до 26.И до 4 электронов-710 ккал / г-расчетный атом. 4) рисунок х-1 показывает, что графит является наиболее стабильной формой углерода в нормальных условиях. Теплота сгорания (до СО) составляет 04 ккал / г atoms. In алмазы, он равен 04.5.Число атомов углерода в аморфном PMS-X составляет 96-08 ккал / г. Переход-менее Стабильная форма графита в нормальных условиях не возникает, но если она превысит 1500°С(при отсутствии воздуха), то будет очень быстрой.
5) теплота плавления графита (47000 атмосфер)составляет 25 ккал / г атомов. Его относительно небольшое значение указывает на то, что при плавлении разрушается только часть кристаллической решетки связи. 6) даже при 2500°C давление паров графита все еще незначительно (около 5-10 * атм).Температура сублимации составляет около 3700°С. пары углерода состоят не только из отдельных атомов, но и из более сложного образования общей формулы Cn.
При температуре 3100°C пар в основном состоит из молекул CC (</(CC) 1.31 A. K = 9.3.Энергия диссоциации 144 ккал} моль].Когда температура повышается еще больше, она явно обогащается молекулами С. = C = C, C = C = «C = = C и т. д. Теплота сублимации углерода при 25°С (точнее, атомизацина) составляет 170,9 ккал / г атомов. Это значение очень важно, потому что оно включается в расчет. Энергия всех углеродных связей 7) образование природных алмазов, по-видимому, было вызвано кристаллизацией углерода в глубоких слоях Земли (200-300 км от поверхности), при температуре около 3000°С и давлении около 20 миллионов атмосфер.
Их моренные отложения связаны с очень редким обнажением на поверхности особой породы, называемой кимберлитом. Аллювиальные породы располагаются в аллювиальных образованиях. Промышленное освоение включает только 1 Алмаз со средним содержанием 0,5 г на тонну rock. In в Якутской Автономной Советской Социалистической Республике (1055) обнаружены богатые залежи алмазов. Они уже интенсивно развиваются. 8) Как видно из рисунка х-6.
Каждый атом углерода алмаза соединен с другими 4 атомами, и расстояние от его центра до центра соседних атомов одинаково (1,54 а).Для каждого атома C в углу есть 4 соседних атома Заключающий его тетраэдр[SS электронная плотность в середине связи равна 0,25 e / A *].Алмазная решетка обладает атомарными свойствами (111§ 8). Несмотря на свою твердость, Алмаз хрупок и относительно легко ломается от удара. Тепло передается хорошо, но на самом деле ток не течет.
Многие алмазы не бесцветны, но имеют различные цвета, от слегка кажущегося до темного. Что касается рентгеновских лучей, то алмазы прозрачны (в отличие от подделок), а в случае ультрафиолета одни кристаллы прозрачны, а другие непрозрачны. Алмазы очень инертны: они не щелочны и не подвержены воздействию acids. In в воздухе Алмаз горит примерно при 900 ° С, а в кислороде-около 700 ° С после сгорания остается небольшое количество золы (N 0,02 мас.% ), Что свидетельствует о наличии примесей в природных алмазах (в основном AI, Si, Ca, Mg).
При нагревании до более чем 1200°C без воздуха начинается Алмазная липкость. 9) алмазы существуют в 2 формах, 1 является родовым, а еще 1 является относительно редким(2% изученных образцов).Эта 2-я форма характеризуется низкой однородностью внутренней кристаллической структуры и быстрым увеличением проводимости под влиянием light. In внешне обе формы неразличимы. В кристаллах алмаза обычного типа небольшая часть атома углерода (около 1: 1000) явно замещена атомом азота.
Среди редких видов особый интерес представляют светло-голубые алмазы, проводимость которых значительно выше, чем у других образцов. При нагревании на рисунке х-7.Они обладают полупроводниковым свойством Р-типа(от алмазной царапины. До 1100 * C с последующим 5,5 запрещенной зоны в атмосфере водорода. 10) Самые красивые бриллианты полируются и используются в качестве украшений по названию бриллианта (рисунок х-7).По цене единица массы, приложенная к драгоценному камню, равна ka r a t (0,2 г).
Самый крупный добытый алмаз (Куллинан)составлял 3026 карат, или 600 г. Необычайная твердость алмаза определяет ценность технологии. Последний использует все камни (большинство), которые имеют дефекты (ли, цвет, трещины и т. д.). он неуместен в качестве украшения. Поскольку такие бракованные камни имеют относительно низкую цену, их можно непосредственно использовать в виде алмазных сплавов для заточки и шлифования твердосплавных режущих инструментов, правки шлифовальных кругов, буровых работ при добыче полезных ископаемых («алмазное бурение»), резки стекла и твердых камней, сверления отверстий в стали, токарной обработки металлических валов, нанесения тонких линий и т. д.
Использование алмазов резко повышает скорость и качество обработки различных материалов. Его значение для технологии хорошо выражено в следующих словах: «если бы эта страна (говоря о Соединенных Штатах) была отрезана от источников современных алмазов, то промышленный потенциал упал бы вдвое за очень короткое время.«(разработка) мировое годовое производство природных алмазов составляет около 5 тонн (без учета Советского Союза).
Существует специальная монография о бриллиантах*. 11) существует предположение, что исходным материалом природного синтеза алмаза является углерод, полученный в результате (высокотемпературного и высоконапорного) восстановления карбонатных пород двухвалентным железом, по приближенной суммарной схеме: CaCO3-f 5FeO = Ca (FeOa) j-FejO » — CF. При длине, необходимой для кристаллизации углерода в виде алмаза, создавалось очень высокое давление (рисунок х-1) для случайного локального увеличения.
12) попытки искусственно изготовить алмазы предпринимались неоднократно, но в 1953 году это удалось впервые. В настоящее время этот процесс уже технически освоен в производственных масштабах. * Шахрановская И. И. Алмазы. Л. М.. «Наука», 1964. 174 С. Преобразование графита в алмаз может быть осуществлено только при очень высоких давлениях (рис. X-1).
С другой стороны, при высокой температуре она достаточно быстро прогрессирует только в присутствии катализатора, но среди них мы обнаружили, что некоторые элементы триады являются оптимальными (рисунок х-8).Эмбриональные кристаллы алмаза возникают на границе раздела графита и расплавленного металла катализаторов. Они остаются покрытыми мембраной из жидких углеродсодержащих металлов, через которую они диффундируют от графита к Алмазу по мере роста углерода.
Новейшая технология позволяет разместить более 20 граммов алмазов в 1 камере за считанные минуты. Интересен и другой метод их синтеза-воздействие ударных волн на графит (смешанный с катализатором).Созданный взрывом. Импульс этого действия компенсируется очень высокими значениями давления и температуры, которые возникают во время explosion.
So в одном из экспериментов с ударной волной 30 1 млн атмосфер почти весь собранный графит превратился в очень мелкие кристаллы алмаза (до 40 джвк). 13) искусственный алмаз-это небольшой кристалл, основная форма которого обычно варьируется от куба (относительно низкая синтетическая температура) до октаэдра(высокая).Цвета тоже разные. От низкотемпературного черного, зеленого, желтого, белого-до высокотемпературного.
Например, в одном из опытов 1, при нагревании графита до 5000°с разрядом, мгновенно при давлении 20 тысячелетий (в течение 1000 минут 1 секунды) был получен йод, бесцветный чистый водный Алмаз. Цвет искусственного алмаза также в значительной степени зависит от природы примесей, содержащихся в Кристалле(а следовательно, и от состава первой графитовой смеси).Например, смесь Ni дает зеленый тон, а Ni n B дает синий тон.
Интересным является полупроводниковый Алмаз (р-типа), синтезированный при Р00°С и 7 млн атмосфер в присутствии небольших добавок B, Be или A. основанный на хорошей теплопроводности и сильной температурной зависимости удельного электрического сопротивления Малый и чувствительный термометр (термистор Диаманта) был конструирован с рядом от −200 до+650.
Как правило, синтетические бриллианты небольшого размера и обычно имеют хороший цвет, поэтому они редко используются в качестве украшений. Наоборот, по техническим качествам он лучше, чем по природным качествам. Мировое ежегодное производство искусственных алмазов уже соизмеримо с добычей природных алмазов. 14) выращивая затравочный кристалл, алмаз может быть синтезирован вне стабильной области.
Например, путем медленной подачи метана под давлением 0,001 АТМ в кристалл зародыша, нагретый до температуры Ts00°C, была достигнута скорость роста до 1 0,5% в час. Процесс продолжается со структурой нанесенной на поверхность СН Crystal. In аналогичным способом, в частности, был получен алмазный ус («ус»), длина которого составляет до 2 мм (несколько десятков микрон в диаметре).
Имеется обзорная статья по низкотемпературному синтезу алмазов. Тысяча утра Да. СУ IJ ^ Pd 80, 70, 60, 50. ОВ Новый В. yoooo tboo МО 2soot Рисунок X*.Синтетические районе алмаза о Рисунок X-9.An массив атомов С в графите. * Дерья Г. И. Б. В. Ф Е Д. В. успешный химии, 1870, м 9, 1661、 15) кристаллы графита расположены в 1 плоской ячейке атомов углерода по одному вверх и вниз. То есть, типы чередуются с формой графита, а 2 сети чередуются через равные промежутки времени. То есть в зависимости от типа A на B…(Рисунок Х-9).
Также известен очень редкий (менее стабильный) АБВАБВ… Каждый атом углерода («паркет») в плоскости сетки связан еще тремя ковалентными связями. Эти связи намного короче, чем алмаз (4 (SS)= 1.42 A).Это указывает на их высокую прочность. Расстояние между отдельными слоями велико(3.35 AJ. Внешне это выражается в легком разложении графита линиями PS, показанными на рисунке X-9, и плоскостности кристаллов, раскрывающихся по отдельным пластинкам («хлопьям»).
16) графит обладает хорошей теплопроводностью (в 3 раза выше, чем ртуть) и проводимостью, близкой к металлической (0,1 проводимости ртути).Как электрическая, так и теплопроводность параллельны слою, чем перпендикулярны слою. Максимальная теплопроводность графита наблюдается примерно при 0°С, а электропроводность-примерно при 600°с.
Механическая прочность графита при переходе от нормальной температуры к 2500 ° с почти в 2 раза выше. Его степень сжатия примерно в 20 раз превышает степень сжатия алмазов. Значительное окисление графита при нагревании на воздухе происходит только при температуре выше 700°С. 17) Что касается электронной структуры графита, то существует 2 основные точки зрения.
По словам одного из них.4-е валентные электроны каждого атома углерода участвуют в образовании связей в сети(увеличиваются на порядок до 1,33).Связь между слоями осуществляется только межмолекулярными силами. Согласно другой точке зрения, 4-я валентность атома углерода образует слабую металлическую связь между слоями (это связано с подобием графита и металла).
Возможно, сочетание обеих интерпретаций и примат первой из них будут самыми correct. So экспериментально установлено, что в графите имеются свободные электроны, эффективное число которых относительно невелико-около 1 **на b-10(то есть на такие электроны приходится около 18 000 атомов углерода).Графит составляет 4,6 эВ (близко к нормальному значению металла).
18) интересной особенностью графита является его способность поглощать большие количества определенных веществ, благодаря чему они поглощаются в пространство между молекулярными слоями. Новая система совмещена с именами которые включают смеси графита. Особенности их придатков (V§ 2 доб.4) более или менее сильно накладывает черты истинно химического соединения. Как и другие придатки.
Графитовые соединения обычно характеризуются переменным составом, который ограничен некоторыми ограничениями composition. As как правило, последнее не соответствует соотношению величин, характерных для углерода и соответствующих элементов. Образование всех интерстициальных продуктов сопровождается значительным увеличением расстояния между углеродными сетями, но при помощи правильного воздействия поглощенный материал может быть восстановлен с почти полным восстановлением исходной графитовой структуры хозяина.
Рекомендуется разделить все графитовые соединения на 2 группы. Первый из них. Те, к которым относятся только производные фтора и кислорода, характеризуются появлением ковалентных связей между атомами углерода и вставленными элементами. Это вызовет некоторое искажение в структуре «паркета».Вещества, ограничивающие ассоциированный состав, здесь близки по своей природе к истинным соединениям. 2-я группа охватывает все многочисленные другие продукты, введенные в графит.
Они близки к типичным аддуктам, от которых отличаются главным образом внешним видом различной поляризации внедренных частиц и графитовым»паркетом».Однако в последнем нет существенных искажений. 19) наиболее ярко выраженным свойством истинного соединения является фторидное производное графита. Взаимодействие последнего с фтором при 450°С замедляет образование продукта инкорпорации композиции CF. Где I <1.
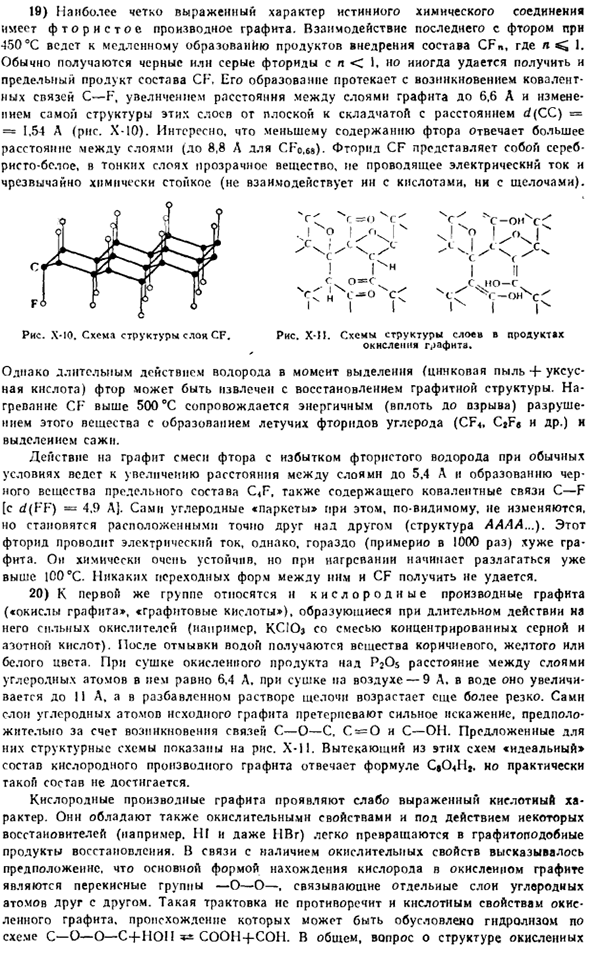
Обычно, я <1 получаются черные или серые фториды. Его образование происходит от появления C-F ковалентных связей, увеличения расстояния между графитовыми слоями до 6,6 а, а расстояние от изменения структуры этих слоев — от плоской до складчатой при d (CC)= 1,54 а(рисунок х-10).Интересно, что чем короче расстояние между слоями, тем ниже содержание фтора(SGo. до 8,8 а в М).
Фторид CF представляет собой тонкослойное серебристо-белое прозрачное вещество, которое не проводит электрический ток и очень химически устойчиво (не взаимодействует с кислотами и щелочами). Рисунок Х-10. Структурная схема рождественской елки CF. Рисунок XI. Схема структуры слоя продуктов окисления графита. Однако пролонгированное действие водорода в момент выделения (цинковый конец+уксусная кислота) может быть экстрагировано с восстановлением структуры графита.
Когда CF нагревается до 500°C или более, летучий фторид углерода (CF4.Если это так, он будет генерировать «CtF«и т. д. и так будет испускаться. Действие смеси фтора и избытка фтористого водорода в нормальных условиях на графит увеличивает расстояние между слоями до 5,4 å, что приводит к образованию черного вещества с предельным составом C F F. C-F ковалентные связи также включают[d (FF) −4,9 A]. в этом случае углеродный «паркет» сам по себе не будет изменяться четко, но будет располагаться точно вверх и вниз(AAAA structure… it это не так.
Этот фторид проводит ток, но гораздо хуже (примерно в 1000 раз), чем graphite. It очень устойчив химически, но при нагревании начинает разлагаться уже при 100°С и выше. Переходная форма между ним и CF не может быть получена. 20) в первую группу также входят кислородсодержащие производные графита («оксид графита», «графитовая кислота»), которые образуются при длительном действии сильного окислителя (например, КСУ*со смесью концентрированной серной кислоты и азотной кислоты).
После промывки водой получают коричневое, желтое или белое вещество. При сушке продукта окисления с помощью PjOs расстояние между слоями атомов углерода в нем составляет 6,4 А. При сушке с воздуха оно равно 9 A. In вода, она увеличивается до 11 A. In редкий щелочной раствор, он увеличивается еще более резко. Сам слой атомов углерода исходного графита подвергается страшным искажениям, вероятно, из — за образования связей C — O-C. C * = 0 и C-OH.
Предложенная структурная схема для них приведена на схеме. X-II.«идеальный» состав кислородных производных графита, полученный по этим схемам, соответствует формуле CtOiH}.Однако на практике такой состав не был достигнут. Кислородные производные графита проявляют слабо выраженные кислотные свойства. Они также обладают окислительными свойствами и легко превращаются в восстановительные продукты, такие как графит, под действием определенных восстановителей(например, HI и даже HBr).
В связи с наличием окислительных свойств было высказано предположение, что основной формой кислорода в оксиде графита является перекисная группа, которая объединяет между собой отдельные слои атомов углерода. Такая интерпретация не противоречит кислотным свойствам окисленного графита. Его происхождение, С—О—О—С+НОН**схема СОО+СОН в результате гидролиза может быть связано.
В общем, проблема структуры окисления Форма графита не считается окончательно утвержденной. Когда эти формы нагреваются медленно, они возвращаются в графитовую структуру (они удаляют CO2), а при нагревании на высоких скоростях они разрушаются с образованием CO. CO *и сажа. 21) для представителей 2-й группы изделий характерно введение графита. Возможно существование левого смешанного равновесия по схеме С «- f XI \ — *С—f X или Cn-f X iZT ^С — f X».
Простейшим примером такой системы являются производные калия и брома, состав которых соответствует формуле С » К и С®®. 22) аддукт композиции С * К экзотермически образуется при контакте графита с избытком жидкого или пароподобного калия (8 ккал! моль). он имеет вид бронзы и имеет гораздо более высокую проводимость, чем исходный графит. Введение атомов калия не искажает»паркет«, но они перемешиваются в точно таком же положении(ААА structure… it это не так.
Расстояние от одного из них до другого будет равно 5,4 а, и каждый атом калия будет расположен между центрами 2 шестиугольников. 12 атомов углерода соседствуют (J (KC)= 3,07 AJ. Схема конфигурации C$ K показана на рисунке X-12.Аналогично калий работает против графита рубидия и цезия (расстояние между «паркетом» составляет 5,6 с (5,95 а) при C * Rb, и далее увеличивает поглощение тепла до K (87)-Rb (116)-Cs серии (159 кал / г графита).Жидкий сплав Rb-Cs (при 220°C) графит в основном поглощается.
Натрий гораздо труднее проникнуть, а литий еще больше difficult. In в последнем случае продуктом предельного состава является желтый C (Li [d (Li Li)= 3,70 A]). Ряса. х-12.Схема координации-на химической стороне, C * K-это В ЦКИ. Настоящая реакция. Самовозгорание В воздухе и до взрыва-до взрыва-он взаимодействует с водой и одновременно реагирует со свободными щелочными металлами (без образования углеводородов).
Металлическая ртуть извлекает калий при восстановлении структуры графита, а при нанесении жидкого аммиака на C $ K происходит частичное замещение атомов калия молекулой Nib по следующей схеме: ЗС? K 4-4NH3 = 2C: JK(NHjh 4-K. производные графита с расстоянием около 6,6 а между «паркетами» получают прямым взаимодействием с раствором щелочных и щелочноземельных металлов в жидком аммиаке.
Эти вещества очень чувствительны к влаге, но в воздухе они не самовоспламеняются. Обзорная статья.* 23) за счет взаимодействия графита с избытком жидкого брома или его паров образуется аддукт предельного состава C * Br(в последнем случае теплота образования составляет около 8 ккал / моль). он стабилен только при наличии такого избытка, а при его отсутствии постепенно теряет почти весь свой бром.
Проводимость этого аддукта значительно выше, чем у исходного графита. Расстояние между плоскостями «паркета» увеличивается до 7,05 а с его formation. In кроме того, промежуточный слой брома образован цепочкой молекул VGA(ядерные расстояния 2.13 и 2.24 а).Возможно, рассматриваемый аддукт наиболее точно описывается равновесием C, e 4-Br2. * C * e4-BrJ (была также предложена формула C * $ Br—3Br2).Гораздо более сложным, чем бром, является введение свободного хлора в графит, в то время как йод не вводится вообще. all. At в то же время, 1CI работает для графита, а также брома.
24) графит также действует как частичный донор электронов. — Графитовая соль.»Обычным способом формирования последнего является воздействие на графит концентрированных кислот в присутствии (или при анодировании) сильного окислителя agent. An примером такого типа вещества является серная кислота водородного синего цвета. И Ю. Н..
Интернет телефонию и М. Е. В Химии 1971,, С. 9.> 568 В. Моя формула-C ^ HSO J * 2H, S04. Известны подобные синие «золи» графита с анионами типа NO, CIO, HFJ. Все они характеризуются межслойным расстоянием около 8 атомов углерода. При обработке соответствующей концентрированной кислотой каждая из этих солей изменяется обратимо. Все они могут быть возвращены в графит под действием воды или восстановителя (SnClj и др.).
По-видимому, в эту группу также входят многие продукты входного типа, возникающие при нагревании графита безводными хлоридами многих металлов (во многих случаях синтез лучше в присутствии свободного хлора). примером такого продукта введения является голубое вещество приблизительного состава с®-AlClj. As в результате внедрения структура» паркета » не меняется, но расстояние между ними увеличивается примерно до 9,5 A.
In вода, некоторые из рассматриваемых веществ (например, Cn-AlClj) легко разлагаются, а другие (например, Cn-FeCl) очень стабильны. Из десятков уже изученных хлоридов (другие галогениды почти не изучены) около половины встроены в графит, а остальные-нет. Общая зависимость тенденции введения от состава четко не определена, но во многих случаях она совпадает с наличием электронососущей функции в соответствующей молекуле.
Например. AsCI3 не формирует продукт реализации, но a1c1l does. At в то же время, несколько других факторов, несомненно, играют свою роль. Например, почему y, SM хлорид — непонятно. ЕС. Gd, Dy, и Yb врезаны в графите, пока хлорид Sc. La, Че, пр. N’D и eg не укоренены. Выше, только основные особенности наиболее типичного графитового»соединения» были affected. By и вообще, эта интересная часть химии углерода еще до конца не изучена. Есть специальная монография*.
25) во многих случаях мощность месторождений графита оценивается в несколько миллионов тонн. Обычным исходным материалом для его образования служили остатки растений очень древней эпохи. Есть месторождения только в редких случаях cases. It возникает в результате выделения углерода из расплавленной магмы. Из-за происхождения таких»минералов» графит практически не оставляет золы при сгорании, но его зольность обычно высока(от 1,5 до 15, а в некоторых случаях-до 35%).
Ежегодное мировое производство графита составляет около 30 миллионов тонн (без учета Советского Союза). 26) основным потребителем графита является керамическая промышленность, которая производит тигель («графитовый тигель») для выплавки металлов из смеси графита и глины. Сжатый графит используется для получения ракетного газа rudders. In металлургия, она использована для покрытия прессформ.
Благодаря отличной проводимости графита, электроды изготавливаются из графита для электрохимических и электрометаллургических процессов. Значительное количество графита используется для изготовления карандаша (смешанного с глиной) с минералом paint. An интересным применением графита является использование его порошка (отдельно или вместе с моторным маслом) в качестве смазки для фрикционной части механизма.
27) как недавно стало ясно, под вакуумом смазывающие свойства графита исчезают. Это говорит о том, что их присутствие в нормальных условиях обусловлено адсорбцией молекул газового воздуха между слоями. 28) графит является основным (по объему) конструкционным материалом большинства ядерных реакторов. Для этого она должна быть очень чистой.
Такой графит получают искусственно, например, путем нагрева сжатой смеси нефтяного кокса и каменноугольной смолы в течение длительного времени (до 1500°С, затем до 2800°с) с последующим медленным охлаждением продукта. С превосходным искусственным графитом, содержание золы не превышает 1000 процентов 1 минуты. 29) интересным и практически значимым видом искусственного графита является пирография.
Получают термическим разложением углеводородов и поверхностей, нагретых до 1000 −2500 см3.Сброс безопасности для того чтобы повторить бескислородный слой * Bibles A. R. Luke F. A. графит и его кристаллические соединения. Пер на английском языке.. Эд. л. С. Giloyne А. И О. А. уй jhoboA. М..«Мир» 1Uo5. 256 секунд Осажденная поверхность характеризуется существенными различиями в свойствах параллельно и перпендикулярно поверхности осаждения (например, параллельная теплопроводность очень высока, а перпендикулярная очень мала).
При температурах выше 2500°C механическая прочность ннрографита выше, чем у всех других известных материалов. Он начал находить много важных применений в очень высокотемпературных технологиях (таких как sonnet rocket).Ядерная и химическая промышленность. Есть обзорная статья о пирографите. 30) при нагревании органических соединений до 500 — ^ 800°С в отсутствие воздуха происходит большое количество излучения(то есть атомы углерода связываются со структурой графита), и форма частиц исходного материала не изменяется.
Этот процесс в основном используется в производстве текстильных материалов на основе графита, а затем во многих технических областях. ^ 31) по-видимому, (—СеС-Салас -) (так называемый полнометражный) или (=c = ci = C=) » (то есть кумулеев).Начиная с ацетилена, мы получили продукт, который содержал углерод и углерод до 99,9°C и представлял собой трехфазную систему, в которой кристаллы фурункана и Кумулюса были объединены с аморфным углеродом.
Цвет черный, плотность около 2,0 г / см, не растворяется, имеет характеристики полупроводника n-типа, n переходит в графит при температуре более 2000°С. Интересно, что теплотворная способность карбена-85,2 ккал / г-атом-значительно меньше, чем у других форм углерода (add 4).Причина этого не ясна.
32) основными видами «аморфного» углерода являются древесный уголь, животный уголь и сажа. Самый чистый» аморфный » углерод получается при карбонизации сахара. Древесный уголь получают путем нагрева древесины без воздуха. Сыпучие черные продукты, возникающие из этого сохраняют исходную древесину structure.
In металлургия, она используется, когда нужен уголь особой чистоты, например, медь рафинируется (рафинируется).Благодаря высокой адсорбционной способности древесного угля, он используется для очистки различных веществ от примесей или для защиты gases. In кроме того, древесный уголь потребляется не только в домашних условиях, но и при изготовлении черного порошка. Животный уголь получают путем обугливания останков животных-костей (костяной уголь), крови (кровяной уголь) и др.
Все виды животных углей характеризуются высокой адсорбционной способностью. Главным образом использованный в медицине(заглатывании отравлений). Сажа образуется при неполном сгорании многих органических соединений. Частицы ПЭ имеют сферическую форму со средним диаметром 10 300 ММК. Обычно сажу получают путем направления пламени вещества на горение с высоким выделением сажи на поверхность металлического хладагента.
Это связано с тем, что он является частью смеси для производства шин. Такие как galoshes. It также используется в производстве красок (полиграфия, покраска, краска для кожи) и туши для ресниц. Оказалось, что кристаллическая структура этих типов»аморфного» углерода во всех случаях исследования идентична структуре графита. Поэтому можно подумать, что обычный»аморфный» углерод состоит в основном из очень мелких случайно расположенных кристаллов графита.
Тем не менее, есть признаки этого. Схема КСУ-Ф 2С1″= Зю! В результате реакции, которая проводилась при 1000°С в соответствии с+ С, образуется углерод, который не проявляет признаков кристаллической структуры. То есть она на самом деле аморфна. 33) в дополнение к термическому разложению некоторых углеродных материалов (таких как синтетическая смола) также может быть получен стекловидный углерод, который также не имеет четкой кристаллической структуры.
Предполагается, что он составлен * Фиалка А. А. С. Баннер Я!.. Сидоров И. М.. Б * Л К U и M. Я!.. |> ж с н и»• И h SM ..Достижения в области химии. Я% 5,.В ijl в И.’. Из графитоподобного микрослоя, который случайно связан друг с другом атомом углерода, координированным на трехграннике. Стекловидный углерод обладает многими ценными свойствами, такими как высокая устойчивость к температурным, механическим и химическим воздействиям. Есть обзорная статья*.
34) для перехода COa-CO-C-CIL приведены следующие значения для следующих потенциалов экранирования—восстановления. −0,12; +0,51; +0,13 дюйма (кислотная среда) и −1,01; −0,52; −0,70 дюйма(щелочная среда). 35) углекислый газ был впервые описан Ван гельмонтом (i§i дополнение.17).Именно в таком количестве Баннику образуются побочные продукты при прокаливании известняка и других процессах (сжигание кокса, спиртовое брожение и др.).
Иногда в качестве источников COj используют обычные дымовые газы и пропускают их через концентрированный раствор K’COJ (после освобождения и охлаждения от твердых частиц дыма), который хорошо поглощает углекислый газ на холоде, а при нагревании высвобождает его. 36) ядерное расстояние молекулы диоксида углерода л^:$ Рисунок X-1E. An массив молекул в Кристалле углекислого газа. Константа (16.0).Всё. Рига Х-14. ТВ.- министерство обороны разработало схему получения углекислого газа. 40) интересно использовать твердый COj для устранения облаков над airfield. As как правило, облако состоит из мельчайших капель переохлажденной воды (IV§ 3 доп.
25).Нарушения состояния распада при дожде и снеге (в зависимости от погоды) хорошо достигаются за счет рассеивания твердого CO2, который измельчается до определенного размера над облаками. Когда каждая частица с температурой около-80°с падает через облако, это вызывает кристаллизацию соседних капель, тем самым производя огромное количество эмбрионального снега. давление водяного пара над nymn ниже, чем у переохлажденной воды, поэтому эти снежинки растут за счет капель воды и оседают.
Облачный покров снимается примерно за 30 минут, и единственное, что необходимо для осаждения 1 кубического километра облаков (до 1000 тонн воды) — это около 200 г сухого вещества ice. As как правило, такую же технику можно использовать и для искусственного опрыскивания посевов. 41) около 97%С02 состоит из атмосферы Вежры. Наличие атмосферы этой планеты называется M. V. It был открыт Ломоносовым (I7GI).
Наблюдая прохождение через диск солнца, он подтвердил, что Венера «окружена такой благородной атмосферой, что она разлита вокруг Земли».»Атмосферное давление на поверхности Венеры (нагретой до 475°C) составляет около 90 атмосфер. Очень разреженная атмосфера Марса также состоит в основном из CO. 42) CO2 не поддерживает активность бактерий и плесени, поэтому срок хранения продуктов питания в этой газовой атмосфере больше. С другой стороны, повышенное содержание CO2 в воздухе теплицы способствует росту растений («углекислотное удобрение«).
На практике это достигается путем помещения сухого льда в теплицу. greenhouse. It оказывается, для большинства овощных культур содержание COj в 0,2〜0,3% является наиболее благоприятным. 43) даже если концентрация углекислого газа в воздухе составляет до 3%, никакого вредного воздействия на организм человека не происходит. Только учащенное дыхание наблюдается в результате стимулирующего действия СО2, растворенного в крови соответствующего Центрального отдела нервной системы.
Вдыхание высококонцентрированного COj может нанести серьезный вред организму. При концентрации 10% остановка дыхания приводит к немедленной потере сознания и смерти, а при концентрации 20% в течение нескольких секунд наступает значительный центральный паралич. Смесь кислорода и 5%COg («Карбоген») имеет медицинское применение для остановки дыхания и отравления. 44) растворимость CO2 в воде( но не по объему): 0°C при 1,71; 20°C при 0,88; 60°C при 0,36. V-3.
It следует отметить, что установление равновесной реакции между углекислым газом и водой в организме происходит медленно. Вода, находящаяся в равновесии с воздухом, содержит около 0,0005 г / л углекислого газа. рН » = 5.7.In кроме того, водный раствор, насыщенный в нормальных условиях, составляет около 0,04-L1 для CO2, а рН = 3,7. Кристаллогидрат C02-6H20 может быть отделен от насыщенного раствора при низкой температуре.(V§ 2 add.3). в то же время, как и для угольной кислоты, только стабильное aeterato (C2Hj) при 5°С 20-1I? C0j известен(Мп.- 47CC).
45) хорошая растворимость диоксида углерода связана с использованием диоксида углерода в производстве искусственного минерального сырья. Из них обычная газированная вода представляет собой просто насыщенный водный раствор CO2.It также содержит примеси от некоторых солей. «Безалкогольные напитки»(например, лимонад) также готовятся таким же образом, за исключением того, что вместо соли добавляется небольшое количество сахара и различные»эссенции».
46) обычная форма угольной кислоты (Н2С04) называется скорее мета-угольной кислотой. Соответствующий Орто-тип (H CO CO <или C (OI)) неизвестен как в свободном состоянии, так и в виде соли, но фактически может быть диссоциирован в водном растворе(IX§ 3 dsp.56).Некоторые органические производные, соответствующие ему, хорошо изучены. 47) Х2сое—4-10 −7 я не уверен. К, 5-10 -)), концентрация Н, присутствующая в растворе, связана с общим количеством растворенного COj (предполагая, что все находится в форме НзСОз).С другой стороны, на практике она должна исходить из концентрации молекул Н3СО3, фактически присутствующих в растворе.
Последнего почти нет, поэтому углекислота должна быть гораздо сильнее, чем нам кажется. Если попытаться оценить истинную константу диссоциации, то значение ACj = 2 IO » 4, то есть в 500 раз больше значения, определяемого непосредственно. Аналогичные соображения применимы и к другим кислотам и основаниям(H? SOj. It это также верно для других языков (таких как» NH » OH). Во всех этих случаях истинная константа диссоциации должна быть выше, чем определенная непосредственно. Молекулы H} CO]также могут образовываться в газовой фазе. На это указывает несравненно сильное увеличение растворимости водяного пара по сравнению с увеличением давления углекислого газа.
Например, используйте азот. 48) со’ — ионы, содержащиеся в карбонате, имеют структуру равностороннего треугольника с атомом С в центре (, и когда последний испаряется, горящее вещество CoJ одновременно охлаждается (за счет испарения COj). оно изолировано от кислорода в воздухе слоем углекислого газа. Основными преимуществами этого типа огнетушителя являются: COj испаряется без следа, а объект вокруг места горения ухудшается.
50) соединения диоксида углерода получают из неизвестного состояния акне и угревой сыпи и Моновой кислоты Онго, соответствующей следующей структурной формуле: <4 г / о / о 5С-о-о-С <Ф О = с < Он-Хен Для Na, K и Rb известны Cam и угольная кислота (и dasjour, или Перкарбонат).Они образуются в результате анодирования концентрированных растворов углекислоты при низких температурах(по схеме: 2CO «-2e CfO»), бесцветного (или бледно-голубоватого) кристаллического вещества, очень гигроскопичного, но стабильного в сухом состоянии. При нагревании эти соли мигрируют в карбонаты, где выделяются углекислый газ и кислород、 Рисунок X. I5.
Разработана схема получения твердого углекислого газа. Они растворяются при гидролизе (по схеме KgC20 $ + 2H20 ″ 2KHCO $ + H2Og).Подверганный действию кислот, выпущенный Хджка быстро сломает вниз в Х2О2 и СО2. Что касается подкисления, то это не только средняя кислота(в отношении прикалывания).Но также и кислотная соль. Эти и другие могут быть получены взаимодействием с гидропероксидами пероксида углекислого газа или щелочного металла по схеме. — 4-COj = E * CO » или UNO + COj = ENSO<. по своей природе они похожи на соли супер-яблочной кислоты.
- Известны также, например, продукты с добавлением перекиси водорода к этому типу карбонатов. Na2COj-L. SHaOj H20 («Persol»). часто трудно определить, является ли не-лексическое производное углерода аналогичным аддуктом или истинной солью угольной кислоты. Карбонат калия (к? С? Os) может быть использован в качестве окислителя в химическом анализе. Из нейтрального раствора ки он немедленно выделяет свободный йод. 61) помимо добавления воды к углекислому газу (что приводит к образованию углекислоты), уже при нормальных условиях карбоновая кислота аммиачная аммиачная CO * + 2NH — = CO (N! З)характерна также реакция добавления аммиака с образованием Онг|.
Неизвестный в свободном состоянии, этот нестабильный карбонат, при нагревании до 200°C под давлением около 190 атмосфер, отделяет молекулы воды и переносит в urea. CO (NH2)ONH «f-7 ккал — =» = » HjO + CO (NIIj)|. . X-10.In водные растворы, кажется. Частичная изомеризация ОС (Х2) 2 ** ** происходит по схеме HOC (NH) NH3. Мочевина (в противном случае, мочевина) представляет собой бесцветный кристалл (mp. 133°C). он хорошо растворяется в воде (RI1e * Ku-1Y карбамид 0 близок к 1: 1 по массе при нормальных условиях). в расплавленном состоянии он сам по себе является хорошим растворителем многих неорганических веществ и может образовывать комплексные соединения солями многих металлов. metals.
Молекула OS (MI2) 2 плоская и имеет структуру, показанную на рисунке Людмила Фирмаль
Is взаимодействие мочевины с иросульфокислотой, но реакция является CO (NH2) j-f-H2S20? = «COjf + 2H2NS03H является удобным методом получения сульфаммонийной кислоты (добавлено IX§ I. 60). Основные свойства мочевины очень слабые (/C 2 10 n).Но с кислотой получается соль. Примерами являются C0 (NM2) allN03 и CO (NH?2 HsPO<.Первая из них показала, что основную роль во всей структуре играет короткая (2,60 а) о — н — о водородная связь между обеими молекулами. Известен также ряд продуктов с нейтральными солями и мочевиной. Интересно, что связь с SnCl4 происходит через кислород, а связь с SnBr4-через азот.
Мочевина всегда присутствует в моче животных (следовательно, ака). Oi является отличным азотным удобрением и отличной частичной заменой для анти-муравьев животного растительного белкового корма(хотя он токсичен для других).Поэтому его синтетическое производство развивается в очень больших масштабах. Есть признаки этого. Мочевина может быть заменена бикарбонатом аммония (NH «HCOj»), который является более дешевым продуктом.
В водных растворах(особенно в почвах, пораженных бактериями) мочевина медленно присоединяет 2 молекулы воды и переходит в карбонат аммония(CO(NH2) j + 2HjO =(NH4) 2COj). именно эта реакция определяет запах недостаточно поддерживаемого туалета (за счет последующего (NH4) гидролиза jCOj) odor. In в моче взрослого человека выделяется около 1 г мочевины в сутки. 25. 52) относительно состава более сложных соединений известно много близкородственных мочевин-OS (NH2) NH2, (bnuret). OC (NHNHCONH2) j (trnust).
NH3CONHHCONH, (дикарбамид). РЯ(НЬЮ-ХЭМПШИР? H2) 2 (Карбо-гидразин)n OC(NHNH*) NHNHCONH2.Все они представляют собой бесцветные кристаллические вещества, которые обычно разлагаются и растворяются, и плохо растворимы в воде (за исключением высокорастворимого карбогидрадина).
53) молекула со характеризуется ядерным расстоянием 1,13 а, силовой связью * 18,6, дипольным моментом с 0,11 (направление СО) и непотенциалом 14,0 вольт. Энергия этого сообщества-256 ккал / моль-больше, чем у всех других двухатомных молекул. Электронная структура молекул монооксида углерода может быть представлена двумя формулами. Согласно одному из них (1: С»аО), оба атома соединены нормальной двойной связью. 2 ($2). 2-я формула лучше согласуется со свойствами окиси углерода, чем первая(классическая). 54) окись углерода (Мп.-205°С, МП.-191°С) является частью атмосферы (0.00001 об.%).
В среднем 0,5% со содержит табачный дым, а 3% — выхлопные газы двигателей внутреннего сгорания. Образование монооксида углерода из элемента следует следующему уравнению: 2C 4-02■ » 2CO-f 53 ккал. Критическая температура CO −140 eC, а критическое давление-35 атм. Растворимость монооксида углерода в воде составляет 1: 40 по объему. 55) получение монооксида углерода из муравьиной кислоты фактически осуществляется путем воздействия концентрированной H2S04 на жидкость HCOOH (при нагревании) или путем пропускания последней через PrO.
Взаимодействие HCOOH и хлорсульфоновой кислоты по схеме HCOOH + ClSOjH = H3SO4 + HCI + CO происходит уже при нормальной температуре. Еще одним удобным методом лабораторного получения со является нагревание с концентрированной HjSO » щавелевой кислотой или железом синергетическим effect. In в первом случае разложение протекает по схеме H2C204 =СО + COJ-f H0. Вместе с CO также выделяются углекислые газы.
Газовую смесь можно задержать, пропустив ее через раствор гидроксида бария. Во 2-м случае единственным газообразным продуктом является монооксид углерода: K l lFe(CN))+ 6H2S04 + 6H20 2 2K S S04 + FeS04 + + 3 (NH4), S04 + 6C0. 56) первыми признаками острого отравления угарным газом являются головные боли и головокружение. Тогда сосуществование будет потеряно. На рисунке х-17 показано, что физиологические эффекты со зависят от соотношения воздуха и времени вдоха.
Предельно допустимой концентрацией СО в атмосфере промышленных предприятий считается 0,02 мг / л. Основным антидотом при отравлении угарным газом является свежий воздух. Кратковременное вдыхание паров аммиака также полезно. 57) эксперименты на молодых крысах показали, что содержание 0,02%СО в воздухе замедляет рост и снижает активность по сравнению с контрольными образцами. Следующее наблюдение оказалось особенно интересным.
Животным в обеих группах давали воду и растворы глюкозы и пили спиртовые растворы, в то время как те, кто жил в нормальном воздухе, предпочитали воду, а те, кто жил в атмосфере с добавлением спиртовых растворов. 58) этот газ особенно опасен из-за крайней токсичности угарного газа, отсутствия цвета и запаха, а также очень слабого поглощения активированного газа из обычного противогаза. Проблема защиты от него была решена изготовлением специального противогаза. Маска была заполнена смесью различных оксидов (в основном MnO2 и CuO).
Действие этой смеси («гопкалита») сводится к каталитическому ускорению реакции со На СО *с атмосферным oxygen. In дело в том, что протеолитический газ, как и хмель, очень неприятен, поскольку позволяет дышать нагретым воздухом(в результате окислительных реакций). | И. Призраки ’ 2/3 Время * bdhonim、 Рисунок X-17.Действие окиси углерода м » человек*. 59) Как уже упоминалось в тексте, окись углерода не взаимодействует с водой или шелком в нормальных условиях.
Напротив, при высоких температурах и высоких давлениях происходит такое взаимодействие. Свободная муравьиная кислота (HCOOH) получается из CO и H2O, а натриевая муравьиная кислота (HCCOON) — из CO и NaO1l. последняя реакция, которая уже протекала при 120°C n 5 от давления, имеет техническое применение. 60) общая схема PdCli-fH20-f CO = C02-f 2HCI-F Pd является реакцией, наиболее часто используемой для обнаружения монооксида углерода в газовых смесях.
Уже очень небольшое количество со легко обнаруживается при плотном окрашивании раствора, так как оно выделяется мелко Измельченный металлический палладий. Количественный Измерение окиси углерода основано на реакции: 5CO + l2Oi = 5CO, — f U. 61) окисление СО в растворе часто сопровождается чем-то примечательным Только в присутствии катализатора скорость. Когда выбирать Последние играют важную роль в характере oxidizer.
So … КМПО » в присутствии мелкодисперсного окислителя со наиболее быстро Раздробленный серебр. K2Sg20; — в присутствии соли В присутствии ртути, KClOj-0s04.In генерал、 Восстановительные свойства монооксида углерода Молекулярный водород и его нормальная активность Условие выше, чем latter. It это весело. Бактерии, которые могут окислять Co semi — / W R500 ZYuYS. <. Чтобы получить энергию, необходимую для жизни. Рисунок x-18.62) сравнительная активность восстановленных CO и H2 2со + ОА Н-2ПК |.
Вы можете оценить это, посмотрев на обратимую реакцию. NaO + CO * * CO2 + H2 + 10 ккал. Равновесное состояние при высоких температурах устанавливается очень быстро (особенно в присутствии Fe2Oj).Для константы равновесия этой реакции были получены следующие значения: ^ W20) / с / температура,°С…. 700600830 2000 1200 1400 <H2J / С02 / С…………. 0 0.90 1.0 1.7 2.6 3.45 Из представленных данных видно, что при температуре 830°с в равновесной смеси содержатся равные количества CO и H2.
То есть, сродство обоих газов к кислороду одинаково. Ниже 830 SS, CO является более мощным восстановителем, выше-H2.Рассматриваемая реакция частично протекает при образовании водного газа. 63) 1. Связывание продукта реакции-единственного, который рассматривается по закону массового действия, сдвигает его equilibrium. So, пропуская смесь монооксида углерода и водяного пара через оксид кальция, можно получить водород по следующей схеме: Н20+СО-fcao-cacoj-fн2-F 52 ккал.
Эта реакция составляет уже 500 ° C. 64) температура пламени монооксида углерода достигает 2100°С. Для них представляет интерес реакция горения СО. При нагревании до 700-1000°С он протекает с замечательной скоростью только в присутствии следовых количеств водяного пара, а других водородсодержащих газов (NHj, H2S и др.).Это обусловлено цепным характером рассматриваемой реакции, в которой протекает промежуточное образование радикалов он по схеме: H + Oa = HO + O, O + CO = » CO.«Хо + со СО2 + Инт. д.
65)при очень высоких температурах реакция горения СО является удивительно обратимой. На рис. Х-18 показано, что содержание СО2 в равновесной смеси выше 4000°С (при давлении 1 agm) незначительно. Поскольку молекула CO сама по себе очень термически стабильна, она разлагается до 0000°С. — Молекулы были обнаружены в межзвездной среде.
66) неполное сгорание угля в специальной печи — газогенераторе позволяет получить большое количество окиси углерода. Обычный («воздушный») генераторный газ имеет среднюю (об.(% ) Включено. Со25, nj −70, С02—4 Небольшие примеси других газов. При сжигании дают 1 800-1000 ккал на кубический метр. Если заменить нормальный воздух кислородом, то содержание окиси углерода значительно возрастет(и теплотворная способность газа возрастет).
67) Еще со содержит т. (идеальный случай) водный газ, состоящий из смеси равных количеств СО и Н2, дающий 2800 ккал / м3 при сгорании. Этот газ получают путем вдувания водяного пара в слой горячих углей, взаимодействующих по уравнению около 1000°С. HgO+ C-f 31 ккал = CO + H2.Поскольку водогазообразующая реакция протекает с поглощением тепла, уголь постепенно охлаждают, и для того, чтобы уголь оставался в горячем состоянии, необходимо чередовать проникновение водяного пара и прохождение воздуха( или кислорода) в газ generator.
In в связи с этим газообразная вода содержит приблизительно СО—44. 2-45, СОа-5 и NJ-6%.It широко используется в синтезе различных органических соединений. Есть обзорная статья по этому вопросу 68) часто получает т. к. смешанный газ. Процесс его получения сочетает в себе оба вышеперечисленных способа, а именно одновременное вдувание воздуха и водяного пара в слой горячей воды. coals. So, состав смешанного газа является промежуточным между генератором и водой.
В среднем она включает в себя: СО-30.2-15. COj-5 и Nj-50%.Кубометр дает его при ожоге около 1300 ккал. 69) указанные газы используются в качестве топлива и медленно движущегося сырья в химической промышленности. Они важны как один из источников получения, например, азотно-водородной смеси для синтеза аммиака. Проходя вместе с водяным паром и катализатором, нагретым до 500°C (в основном Регое), реакция протекает через обратимую реакцию Н20+СО3 * С02Н2 + 10 ккал.
Его равновесие сильно смещается вправо. Затем, промыв смесь водой(под давлением), удаляют образовавшийся углекислый газ и удаляют оставшийся CO аммиачным раствором меди salt. As в результате остаются почти чистые азот и водород. Поэтому, регулируя относительное количество генератора и водного газа, N2 и I *могут быть получены при желаемом объемном соотношении. Перед подачей в колонну синтеза осушают газовую смесь и удаляют примеси, загрязняющие катализатор.
70) при 80°С, когда монооксид углерода действует на металл калия, образуется бесцветное, кристаллическое, очень взрывчатое соединение в составе K * C6Ov. Это вещество, при исключении из него калия, легко переходит в монооксид углерода с составом QO*(«т и Х и но»), который считается продуктом полимеризации со. Его структура соответствует шести кольцам, образованным атомами углерода, каждое из которых соединено двойной связью с атомом кислорода. 71) другой монооксид углерода (и оксид) состава C502 получают путем отбора воды из малоновой кислоты[CH2 (COOH) 2]с использованием P2Oj.
Теплота образования от элемента составляет 23 ккал / моль. Углекислый газ-бесцветный газ с резким запахом (Мп.- *107 < > с; МП.- Ф7°С).Структура его молекулы соответствует линейной структуре O_C-C = C = 0 (</(CC)= 1.29, d (CO) 1.16 A).Для силовых констант соединения задаются значения: 9.8 (C = C) и 16.5 (C-O).Потенциал ионизации молекулы-10,8 О. при нагревании углекислый газ легко полимеризуется с образованием красного полимера (С302) n, который почти так же легко разлагается на СО2 и С2(с дальнейшим переходом от молекул углерода к графиту).в воздухе он горит синим пламенем с выделением сажи, а при взаимодействии с водой дает немного новой кислоты.
Есть обзорная статья про углекислый газ•**. 72) взаимодействие CO и серы с реакцией CO-f S = COS + 7 ккал происходит быстро только при высоких температурах. Полученный углекислый газ (0 = C = S) представляет собой бесцветный газ без запаха (mp.-139, mp. −50°C). в воде он очень растворим(по объему: 1:2) и постепенно гидролизуется по схеме: COS + H20 = COj + H2S. молекула OCS линейна и является изолирующей(q-0,71). * Нефедов Г. К.. Eidus Дж. Т.. Достижения в области химии. 1965.Мистер. 4.$ 30. Дашкевич Б.. Будьте ф л и В. Г.. Успехи химии, 1967.В » 6. Девятьсот сорок семь、 17 стр. м. В. Некрасова Длины связей C°O и C-S составляют соответственно 1,16 и 1,56 а, а константы силы-16,1 и 7,1.
73) аналогичное соединение Селена (Коза) представляет собой бесцветный газ (Мп.-122, Мп.-22°С). Числитель OCSe является линейным [<(СО) » = «1.16, D (CSE)» и 1.71 A] и полярным (Q = » 0.75).Для связи сил задается значение k (CO). 4 и авг.(ЕГЭ)= 5.4.Нестабильная остеология также известна, но ее свойства изучены очень мало. 74) молекула ОССЬ полярна (Q 1.17), имеет плоскую структуру и характеризуется следующими структурными параметрами: D (co) −1.17, D (CCL) = 1.75 a, zcicc1 ″ ■ »
111.в качестве растворителя используется фосген(MP.-128.Т. Кипячение.+ 8°С) инертен — растворяет ковалентное неорганическое вещество незначительно(1 г. 1С!»A) CI|, AsClj, SbCJj, SbC)$, хлорид серы).Раствор хлорида алюминия в нем хорошо пропускает электричество и обладает высокой реакционной способностью. Причиной этого, вероятно, является существование равновесия по схеме: COCJj-f AJClj СОС1 * + А1С17.
75) крайняя токсичность фосгена вместе с его высокой плотностью, дешевизной и простотой приготовления, связанной с воздухом, привели к использованию этого газа в качестве химического оружия в Первой мировой войне War. In в случае отравления, необходимо обеспечить пострадавшего полной peace. It также полезно вдыхать чистый кислород. Предельно допустимой концентрацией фосгена в воздухе промышленных предприятий считается 0,0005 мг / л. Контейнер с ним должен иметь защитный цвет с красными полосками.
76) фосген, а также фторид-COF (mp 114,mp-83°С) — образуется из CO и Fi с высоким тепловыделением(115 ккал / моль).Его молекулы характеризуются полярностью (q 0.95), параметром<(СО)» = 1.17, D (CF)= 1.31 a, zfcf » — 108°. Формирование SOVg«(Т. ККП.65°C с катушкой.) Тепловой эффект очень мал(1 ккал / моль).Оба эти соединения ведут себя как фосген в отношении воды, но COFf гидролизуется гораздо быстрее, чем это, в то время как COBrt намного медленнее. Соответствующий йодид не был получен. Карбилазиад также известен-СО (NJ). это летучее и взрывоопасное кристаллическое вещество.
77) этот тип смешанного галоида COFC1 (c-1.23, mp −138.Tp. — 42eC), COFBr(tp-120.Tp.-21°C), CoFI (mp.- «-90. Т. Кипятить.-23°С при декомпрессии).Другие смешанные производные включают HCOF fd(OH) 1.08, J(CO)= 1.19,d(CF)= 1.35 A, ZHCO-llO0,ZFCO = −122°]и F, NCOF (т. е. тюк).-52°С). 78) интересными аналогами фосгена (CIjCO) являются фосген и CloxCNOH. Oi-бесцветный кристалл (mp 40, mp. At 129°C), растворим в воде и многих органических жидкостях. Фосгеноксим является высокотоксичным веществом.
79) при взаимодействии F с CO и избытком 09 было получено пероксидное производное композиции(FCO) * Oa(наряду с COF *и CO).Это бесцветное вещество(Мп.-42.Т. Кипячение.+ 16°C) имеет характерный запах (похожий на запах озона) в кислой среде, реагирует с йодидом калия по формуле (FCO) jOa-f 2K1» 2KF-f-4-I» + 2COfc и разлагается при взрыве (COF, COj, О) При нагревании до 200°C и более.
80) карбонильные производные известны для многих металлов, которые являются элементами середины больших циклов. То есть она характеризуется завершением d-подгруппы. Их обычно получают под высоким давлением со, при нагревании, из соединения соответствующего элемента, которое восстанавливают до металла непосредственно из мелкодисперсного металла или в процессе синтеза. Существует специальная монография по карбоксильным металлам * N обзорная статья
81) из уже исследованных элементов наиболее известны карбоксилы хрома и их аналоги. Они соответствуют Формуле Е (СО) 4 и являются бесцветными. * Blokrs * * ФЛ углерода на металл. М. Металдургудат. 1968.372 секунд * * Абель Е. В. успехи Хмыцкого, ИМС, м. 6. 1127. Возвышенные кристаллы (то есть 147, 156 и 175 ° С соответственно).При пониженном давлении он воспламеняется без разложения, а при нормальном давлении около 120°C медленно разлагается на металл и угарный газ.
Монокарбоилы W доступны в прямом синтезе, но во многих случаях они поступают из MoCls и WCU, а Cr (CO) e обычно поступает из CrC1$.Величина теплоты получения карбонила по схеме E + 6CO = E (CO) уменьшается при переходе от Cr (99) к Mo (76) и W (68 ккал / моль). Теплота сублимации металлов по энергии связи E-CO (VIII§ 5 add.9) и принимая во внимание сам карбонил (17 ккал / моль), получаем значение 35 (Cr). 42 (Mo), 48 ккал / моль (W), то есть немного меньше того, что обычно соответствует обычной углеродной связи кобалита. 3 соединения все молекулы являются положительными октаэдрами на расстоянии d (CrC)= 1,92,</(MoC)» d (WC) » = 2,06 A. Для расстояния d(CO) значение равно 1,10 (Cr). 1.15 (Mo) и 1.15 (W). Для Cr (CO) определяется определены, и постоянная силы связана: K (CR-c) = = 2.5 и K (co) = 15.6.
Потенциал ионизации молекул E (CO) в серии Cr (8.2)-Mo (8.3)-W (8.5 V) несколько повышен. С точки зрения химической стойкости рассматриваемые карбоилы превосходят все остальные соединения этого типа. type. At нормальная температура, как концентрированный HCI, так и HaSO «не действуют на них».Без щелочи (если нет кислорода).Однако дымящаяся азотная кислота легко разрушается. Под действием хлора, когда образуется хлорид соответствующего металла, со вполне.
82) известны различные продукты частичного замещения монооксида углерода в карбониле е (СО) (в основном для различных аминов, кроме того, обычно замещается менее 3 молекул со).Например, взаимодействие суспензии CR (CO) с металлическим натрием в жидком аммиаке протекает по реакции: Cr (CO) » + 21CH’a = NaJCrfCO)»] + ко. Полученный продукт имеет твердый желтый цвет, стабильный в атмосфере азота и быстро окисляющийся на воздухе.
Аналогичные производные были также получены для Mo и W. также описаны желтые соединения[Ez (CO)| o]и черные соединения типа N’aj3j (CO) (E-Cr или Mo) элементов типа Hr. На? Жидкий аммиак раствор (СГ(со) з]является стабильным, но реакция NaJCr (со) й-ф-2NH» х = » 2NaX + Н2-Ф NHj-ч-Ф СГ (со) jhhe протекает под действием аммониевых солей 3 Нью-Хэмпшир Нью-Хэмпшир (со) при нагревании взаимодействие с карбонильной е (СО) и комплексов всех Нью-Хэмпшир Нью-Хэмпшир Нью-Хэмпшир (3 NHJ) формируется.
Твердый желтый Cr (CO) NH NH NH легко растворяется во многих органических растворителях и только медленно разлагается на воздухе. Cr (CO) 3 (NHj) * соль желтых анионов| E (CO)$ P » известна из продукта, который заменил монооксид углерода галогеном(E является Cr. Mo. W. И G — это CI, Br. Я есть).Желтый (СО )gg2 (здесь — — mo. W и G-CI, B)и синий карбонил норид Cr (CO)$ 1.
Последний устойчив ниже −40°С, но при комнатной температуре медленно разлагается. То же самое относится к стабильным лишайникам ниже −25°C, Cr (CO)$ SH. Зеленый энергонезависимой КР(с бортовым номером 03) 3 получают путем NjOj(СС1″), и сплошной зеленый chloroutrosyl3 (Ноа) clj-это синтезированный путем взаимодействия МО (co) или Ж (со) 4 и Чино (CH2C1). Cr (CO) » не реагирует с CINO при тех же условиях.
83) в Cr(CO)® свойства нуклеохромных комплексов хрома и трифилфосфина-Cr(PFj) аналогичны. Это бесцветное кристаллическое вещество (Мп.193°С) является крайне неустойчивым и сублимирует в вакууме даже при комнатной температуре. Он устойчив в сухом воздухе, но медленно растворяется во влажном воздухе(вследствие гидролиза п-ф облигации).
В воде, СГ (pfv-максимальное прямое напряжение) е не растворяется в воде и растворяется более или менее хорошо. Смешайте с органическими растворителями. Разбавленные кислоты не действуют, но они разлагаются в концентрированной HNOj или щелочи. Подобные свойства являются собственностью МО (pfv-максимальное прямое напряжение) α (Мп 196°С) до W (ПФ3) е (Мп 214°С).
Смешанные производные типа CR (ПФ)) м(со) N(где М-ф л = 6), особенно бесцветный кристаллический КР (ПФ|) с (со) J (в СНГ структура) была получена. Существование напоминает комплекс, и в своей двойной функции (свободными электронными парами атомов фосфора) PF, как показано, подобен окиси углерода. 84) карбоннол Mn, Tc n Re может быть получен на основе двухвалентного марганца или более оксидов Tc n Re salts.
In последняя структура, каждый центральный атом е соединен с другим атомом Е 5 молекулами CO (</(ReC)= 2.01 A]и длинной связью E-E (2.93). МН-МН Н 3.04 a по ТК-ТС и ре-ре.Таким образом, атом Е находится примерно в центре 8-стороннего тела(примерно 45°поворота относительно друг друга).Также получают желтый смешанный карбонил (CO) sMnRe (CO). MN-Re bond (2.96 A).
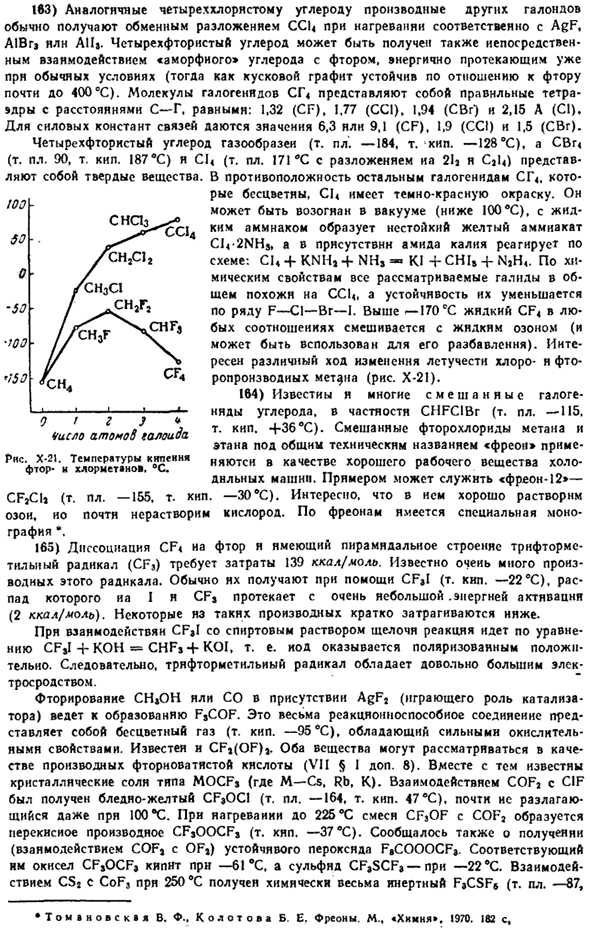
Комбинированный диссоциативные энергии(и постоянной силы) увеличивается на порядок[ккал / моль]: 21(англ), 51 (параметров), 62 (МПР). Установлено, что для молекул Mn3 (CO) ω и Re2 (CO) I0 дипольный момент равен 0,98 и 1,18 (в бензоле) соответственно. В отличие от своего бесцветного аналога, Mpc (CO) ω имеет золотистый цвет.Его потенциал ионизации составляет 8,1 а, энергия связи mn-Mn оценивается в 21 ккал (моль).
Температура плавления карбоквола (в трубке) составляет 155 (. Mn), 160 (Tc) и 177°C (Re), а также сублимация и тепло. -15 (Mn) n 19 19 ккал / моль (Re).Все 3 карбонила очень устойчивы в воздухе, он не растворяется в воде, но во многих органических жидкостях.Есть обзорная статья о карбониле марганца. 85) известны многие производные карбонила марганца и рения.Если каким-то образом нарушить связь e-E карбонила E2 (CO) ω, то появится соединение типа X3 (CO) s.Где X-E.
Это одновалентный атом или радикал, занимающий 1 из углов октаэдра около атома. за счет взаимодействия амальгамы натрия с γ (со) ω получается желтоватая соль Na3 (со), которая интенсивно окисляется на воздухе, а из них путем легкого гидролиза-g и другие карбонаты (СО) 5. Последний представляет собой бесцветную жидкость Мп. -25 (Mp) или-f 13 ° С (Re), слабо растворим в воде, но смешивается со многими органическими растворителями.
Их разложение в нормальных условиях (E2 (CO) ω и H2]очень медленно, а кислотные свойства очень слабы(для производных марганца константа диссоциации составляет 8-10″).Дипольный момент молекулы равен z = 0.70). Константы связи H-Mn и I-Re составляют 1,9 и 2,0 соответственно, а длина связи I-Mn равна 1,43 А. замещение водорода метильной группой значительно повышает стабильность соединения.CHjI и Na3 (CO) SNe (CO) 5 бесцветный кристалл который стабилизирован в воздухе и имеет точку плавления 95 (Mn).
Или 120°C (Re).Дипольный момент CH $ Mn (CO) s равен 0,79 (в бензоле). Под действием карбонила E2 (CO) галогена образуются дуги и лиганды HE(CO)$(G-CI.Vg.1).они представляют собой достаточно стабильное, бесцветное или желтоватое кристаллическое вещество, не растворимое в воде.Испаряющий и растворимость в органических жидкостях увеличивают с CI-Br-series.In в BrMp (CO)$и 1Mp(CO)$ был обнаружен большой дипольный момент-3,19 и 3,25 (в бензоле).
При нагревании галогениды GE отсекают часть CO и переходят в димерный галокарбонил (GE (CO)]] 2.Его структура четко соответствует 2 октаэдрам с общим краем атома галогена.Этому переходу способствует Бр-1.Полученное бесцветное или желтое вещество практически нерастворимо в органических жидкостях. Из других производных этого типа наиболее интересным является образование бледно-желтого NOjMn (CO) j, который образуется под действием N20 ‘ на карбонил марганца.
Порошок этого вещества устойчив на воздухе, растворим в воде, раствор изначально неэлектролитный, и его электропроводность быстро растет со временем. Интересны и некоторые другие производные рассматриваемого карбонила.Например, обработка IMn (CO) оксидом азота при температуре около 100°C дает зеленые кристаллы Mn (NO) jCO (mp 27 ° C).Также был получен темно-красный цвет * Л М м в. И М и К. Н .. О Г и А около 11.Коробов 11. Достижения в области химии. СИ 3. 330.
Мельница (СО) N N0 (MP.- 1°С) и Mna (CO) 7 (no), (разлагается примерно при 40°С). Все 3 вещества легко окисляются на воздухе. (Ре (со) з (OHjhCl |.Обработка ClRe (COb избытком жидкого аммиака приводит к образованию iRo (CO) 4 (NH>) G) C1.Эта соль, как вещество представляет собой бесцветный кристалл, легко растворим в очаге. Растворимый в воде и С1Э (СО) $ и А1С! Йод, содержащий высокое давление СО, полученный из типа [Э (со) А) A1 color бесцветной рениево-марганцевой соли.
На их основе было получено аналогичное производное нескольких других анионов (особенно CIOJ) — такого же типа соль (Re (СО) e) [re (со) 5), которая легко разлагается на LRE (Co) 5j2 NCO. 86) аналогичная карбоинла. производные м-трин-фторфосфина известны для рения. Бесцветный Кристалл Re2 (Pl?3) описывает iD (mp 182°С), HRe(PF3) s(mp 43°С). KRe (PF.)$(т. е. разложение 210°С), ClRc (PF) s (т. е. разложение 153 ° С).Очевидно, бесцветный Сипз(pfv-максимальное прямое напряжение)
87) Cg как углеродистая глина. контур \ o и W, Зеленый, Зеленый V (CO) при нормальных условиях имеет октаэдрическую структуру с атомом ванадия в центре. Для энергии связи V-CO приведено значение 28 ккал / моль. Это вещество самовоспламеняется в воздухе, сублимируется в вакууме около 50°C и разлагается в атмосфере NJ 70°C. образуется очень сильное охлаждение, которое, очевидно, вызывает димеризацию VJ (CO) ij. Раствор в органической жидкости\ ’ (CO) b желтовато-оранжевый и очень неустойчив.
При действии на них йода реакция протекает количественно по схеме: 2V (CO) » + 31 *» * 2VU + 12CO. С другой стороны. В (Со) Е легко сводится к apiois (в (Со) Е).В частности, желтые соли типа М (В (со) Колорадо) известен. Где M = Na. К. Нибс. Их подкисление получают явно нестабильным углеводородом HV (CO). установлено, что он обладает четкими кислотными свойствами. 88) карбонил ниобия и тантала неизвестен.
Однако из-за взаимодействия NbClj или TaClj с избытком металлического натрия в присутствии дигитрима (диметилового эфира диэтиленгликоля) при высоком давлении CO, [Ma (Inglnm?) [E (CO) e]был получен тип желтой соли. Где E-Nb или Ta. Они плавятся при температуре около 175°C и медленно разлагаются на воздухе (и на свету).Известны некоторые из более сложных карбонильных производных обоих элементов.
89) окись углерода образует комплексные соединения с определенными солями. Некоторые из них (OsCl — * ЗСО. Вы можете получить его в твердом состоянии, но другие (например, PtClj•СО) (agjsorco. It стабилен только в растворе. Образование последнего вещества связано с поглощением монооксида углерода сильным раствором is1 CuCl. Подобные соединения, по-видимому, образуются в аммиачном растворе CuCl, который часто используется для поглощения CO в газовом анализе.
90) числитель S = C = S является линейным. Его потенциал ионизации составляет 10,1 А. связь C = S характеризуется ядерным расстоянием 1,56 а, энергией 128 ккал / моль, постоянной силы k = 7,6. Растворимость дисульфида углерода в воде (Мп −112.T. температура кипения 46°C) только 0,15 wt. It гидролиз isIts по схеме CSj + 2H-0 = CO + 2HjS-f 12 ккал протекает только при 150°С и выше. Электрическая печь, которая используется в промышленном производстве CS2, схематично показана в RNS. Х-19.
Ежегодное производство сероуглерода в мире составляет около 100 млн. г. 91) вдыхание воздуха выше 0,3% С может быстро привести к серьезным заболеваниям. При хроническом отравлении небольшим количеством паров сероуглерода постепенно развиваются желудочные заболевания (Ахиллес, гастрит) и различные расстройства нервной системы. Предельно допустимой концентрацией CS2 в атмосфере промышленных предприятий считается 0,01 мг / л. смесь паров сероуглерода и воздуха является взрывчатым веществом мощностью от 1 до 50.%ЦЕЗИЙ.*
Рисунок Х-19. Электрическая печь SCHML для того чтобы получить CS2. 92) под давлением 45000 атмосфер дисульфид углерода при 200°С превращается в черную твердую массу с плотностью 1,9 г / см*.Очевидно, что полимеризация протекает с образованием цепи [- C (S) — S -] n и сопровождается выделением тепла(5,6 ккал / моль CS2).Полимер имеет низкую диэлектрическую постоянную (4,0), обладает полупроводниковыми свойствами и нерастворим в органических растворителях.
В нормальных условиях он стабилен, но размягчается при 70°C и разлагается на элементы при 170 ° C. 93) в дополнение к сероуглерода, серы аналогов других углерод-кислород, как известно-thioxides (CS) и thioxides (с»С2).Первый образуется в виде очень неустойчивого твердого бесцветного вещества под действием искрящегося разряда в пар CS2 при очень низкой температуре. temperature. By нагрев пара CSj с пламенем электрической дуги, 2-ой метод получен, который немного более стабилизирован.
Окись углерода (S = C» -C = C = S) представляет собой красную жидкость с резким запахом, которая затвердевает при −1°C. Как CS, так и CjSj очень легко становятся естественно темными твердыми продуктами полимеризации. 94) Серный углерод (CSe>), подобный сероуглероду, не образуется непосредственно из элемента, но может быть получен действием CH2C12 на селен при 600°C.
It представляет собой желтую жидкость (Мп.44, Мп. Разложите на 125°C), легкий для того чтобы полимеризировать даже в нормальных условиях(как CS2).По ряду свойств он похож на сероуглерод, но не горюч (не смачивает стекло). SE = C = Se молекула линейна, а связь C = Se характеризуется длиной 1,70 а, энергией 112 ккал/ моль, постоянной силы 5.8.Tel locor carbon (STe2) не приобретается.
95) смешанные производные серы и ее аналогов тоже известна-желтый ГКЧП(Мп.-85.Мп.4-84SS) и красный для сетей catv(Мп.-54°с).Последнее соединение очень неустойчиво. Молекула SCTe имеет низкую полярность (q = 0,17), а связь C = Te характеризуется длиной 1,90 а и постоянной силы 4,6. 96) подобно углекислому газу, CS2 представляет собой кислотный ангидрид, который вместе с некоторыми сульфидами может образовывать соли Тиокарбоновой кислоты (H, CS3).
Например, при взаимодействии КС с мощным раствором Na2S образуются Na2CS.)Тио-карбонат наиболее активного металла (и NH » j) стабилен, но остальные производные несколько легче расщепляются. В частности, производные Na, K, NH».Карбонат калия используется для борьбы с сельскохозяйственными вредителями (в основном фнлоксерой). Бесплатные Тио угольную кислоту получают действием сильных кислот на раствор солей.
Во-первых, цвет меняется с красного на желтый. И в виде маслянистой жидкости молекула HtCSs SC(SH) частично высвобождается, что приводит к полярности (u = 2,13).в кристалле плоская группа CS[ZSCS = 120°, d (CS) 1,6 = 1,69-g-1,77 A) связана друг с другом водородной связью S-H-S (® ) Также гораздо более выражен. 97) кислотные свойства угольной кислоты — HjCSej (AC | = 7-10 «J, / C2 = 710″*) выражены еще сильнее strongly.In сам он очень нестабилен и известен только в растворе, но некоторые его фиолетовые соли (Ba, K и др.) были isolated.
In воздух, он быстро окисляется. 98) в дополнение к MjCSj.Это более точно называется трихоевой кислотой, продуктом неполного замещения серы атомом кислорода I2CO-mono-1.c>вы можете изучить общую угольную кислоту (H2CO3S и H, COS2).Некоторые органические производные тканей очень важны для 1 технологии искусственного типа:) шелк- «вязкий».
Известны также органические производные Орто-типа Тио-угольной кислоты, например C (SCH8) 4 (mp 66°C). 99) вследствие действия CSj некоторых металлических производных бисульфита (Na2S2 и др.), образуется желтая соль сукцината тиомонада- Компонентов HTC.»Обработанный с сильной кислотой, свободный H> CS4 можно также отделить. Это красная маслянистая жидкость(Мп.36°C) и гораздо более нестабильны, чем HjCS.
Последний хорошо растворяет серу, но тиомиоагалиновая кислота не образуется. Для диссоциации цистита значение HaCS4/ C | = 4 \ K,= 6-ICM *. 100) взаимодействие между сероуглеродом и PCI в герметичной трубке при 100°C позволяет проводить реакцию CSa + PCI * w * CSClt + PSC1>с получением тиофосфата (CSClt).Отделенная от Пскла фракционной перегонкой, красноватая жидкость (т.76°с).
Тиозоген имеет неприятный запах, ядовит и медленно разлагается водой(с образованием CO * HjS и HC! это не. Бесцветный CSF2 растворяется быстрее в воде (кипячение.- 63°С). В солнечном свете тиофосфен превращается в твердый циклический димер (с 2 связями C-S-C) в нормальных условиях. Он плавится при 116°C, но обратимо (до равновесия) переходит в Мономер только при 180°C.
101) взаимодействие Тонофосфогена с Na2CS или Na2S дает желтый полимер приблизительного состава (CtoSigClt).при 165°С разлагается на CSCl2l CS2 и черный (CS2). 102) в дополнение к фнофосгее. Известен состав тиохлорированного углерода С $ С14, образующийся при взаимодействии хлора с охлажденным дисульфидом углерода в присутствии следовых количеств йода (он играет роль катализатора).
Реакция протекает по следующему уравнению: 2CS2 + 5CI2 = = 2CSCU + StClj. CSCI4 отделен от хлорида серы паром distillation. In в чистом виде это вещество представляет собой жидкость с неприятным запахом (то есть оно кипит).149°с).Структура рассматриваемых хлоридов Тио четко соответствует формуле ClfCSCI. При действии восстановителя он легко переходит в тиофосфен. 103) схема CSClt + 2NH3 = * 2НС! По тонофосгену на основе+ CS(NHa) t получают с тиомочевиной (или тиокарбамидом), которая является сернистым аналогом мочевины.
Это вещество представляет собой бесцветный кристалл (mp172°C), легко растворимый в воде (при нормальных условиях по массе около 1:10). Молекула SC (NH.) 2 плоская, параметр D (CS)= 1.72, d (CN) 1,3 1.34 A, близкий к углу 120°.Кристаллы имеют водородные связи N-Н-S, с 2 различными J (NS) −3.54 и 3.24 A. свойства тиомочевины аналогичны свойствам, обнаруженным в случае SC(NHt) NHNH2 (mp 181CC).Моча и селен-CSe(NH2) t (mp.200°де разложение. Даже известно).
104) хлорид аммония-сернистый аналог карбамата аммония-хлорид аммония может быть получен взаимодействием аммиака (в присутствии органических растворителей) с сероуглеродом, согласно формуле: 2NHS + CST = CS (NH2) SNH. Oi-нестабильное желтое кристаллическое вещество(mp. It используется в органическом синтезе (включая 99°decomp разложения).Соответствующая свободная кислота, CS (NH2) SH(K = 1-10-3), стабильна только при низких температурах.
105) взаимодействие сероуглерода с азотной кислотой происходит по формуле: CSa + HN | HSC (S) N |.Полученная азидо-дитиоколовая кислота представляет собой бесцветное кристаллическое вещество, которое в нормальных условиях медленно разлагается и легко взрывается при нагревании или воздействии impact. In водные растворы, он ведет себя как сильная кислота, которая гораздо более стабильна и многие соли известны(большинство из них очень взрывоопасны).
Как и XSC (S) N, его заменяющий продукт также нестабилен. Где X-CI, Br или 1.Взаимодействие йода с NaSC(S) Ni позволяет получать нестабильные и очень взрывоопасные свободные углеводы в нормальных условиях(в виде белого кристаллического порошка) и s и g-[SC (S) Nj) 2.Его затухание протекает в основном по схеме: [SC(S) N3] 2 2N2-f 2S + +(SCN) j. Это вещество реагирует с щелочным раствором, но формула: ISC (S) N3} 2 + + 2NaOH = NaSC (S) Nj + NaOSC ( $ ) N§+ HjO, то есть аналогично реакции свободного галогена. 。
106) цианистый водород можно смешать с газовой смесью по формуле 2CH, 4-4-2NHj + 30 * =6НаО + 2hcn + 230 ккал Контактное устройство с платиновой сеткой.Для получения в лаборатории чистого безводного HCN (mp 13, mp +26°C) оптимально использовать нагрев порошковой смеси сухого KCN и KHS.В межзвездной среде была обнаружена молекула цианистого водорода. 107) нормальная синильная кислота содержит смесь молекул I-Cu1 (стандартная форма) и H_NC (изоформа).
Обе формы могут быть легко переданы друг другу (путем прыжка Протона). таким образом,они находятся в состоянии динамического равновесия, их расположение зависит от температуры.В нормальных условиях синильная кислота почти исключительно (около 99,5%) присутствует в обычной форме, и при нагревании равновесие несколько смешивается в пользу изоформы.Последние не разделялись, но могли образовываться при специфической реакции (например, при взаимодействии сухого AgCN и HCI).
Органические производные-нитрил (RCN) и изонитрил (RNC)-известны для обоих типов синильной кислоты. 108) говоря о тугоплавкости данного вещества, отмечается существование 2 (или более) форм веществ с различными атомными структурами,находящихся в динамическом равновесии друг с другом, а сами их различные модификации называются Т-размерностями.В настоящее время установлено, что Таутомерия является гораздо более распространенным явлением, чем считалось ранее.Это особенно верно для соединений, перенос протонов которых таутомерен, то есть лежит в основе внутримолекулярного перемещения ядер водорода от одного атома к другому.
Такое движение обычно сопровождается изменением электронной структуры молекулы. 109) молекула HCN полярна a (q = 2.96) и имеет линейную структуру с параметрами d(NS)= 1.07 и rf(CN)= 1.15 A. Для энергии и силовых констант обеих связей приведено 114 ккал. / моль, к = 5.7(ч-с связи) или 207 ккал / моль, к = 17.7(CesN облигаций). Потенциал ионизации молекул HCN составляет приблизительно 13,9. Для молекул HNC d (HN)= 1.01 и rf (. Северная Каролина)= 1.17 предполагая линейную структуру, следующих значений постоянной силы приводятся:к(ХН)= 7.0 и K(НК)= 16.5.
110)в твердом и жидком состоянии цианистый водород связан образованием водородных связей по схеме-HCN-HCN.Частично такие ассоциации сохраняются в парах.Если вы подожжете в воздухе, они будут гореть фиолетовым пламенем и образуют H20. CO2 и N2 (предел горючести G-10%HCN). при сжигании цианистого водорода со смесью кислорода и фтора (уравнение 2HCN-f-Oz + F2 = 2HF-f 2CO-f Nj + 244 ккал) может быть достигнута температура пламени приблизительно 3700°C.
111) токсическое действие синильной кислоты (и цианида), по-видимому, вызванное ее изоформой (Hi \ C), в основном сводится к дыхательному paralysis.In в организме синильная кислота очень легко разрушается с образованием безвредных продуктов.Поэтому в несмертельных дозах после периода острого отравления сразу же наступает полное выздоровление. Первая помощь при отравлении желудка HCN и его солями заключается в резком возбуждении рвоты (щекотание неба или рвота, например, в мыльной воде) и приеме внутрь 1%Na2S20y solution.
In случай отравления парами HCN, вдыхание аммиака является useful.In в случае обморока пострадавшего используется искусственное дыхание.Предельно допустимой концентрацией HCN в атмосфере промышленных предприятий принято считать 0,0003 мг / л. хорошим показателем наличия цианистого водорода в воздухе является табачный дым.Это будет очень горько в присутствии HCN.Отравление синильной кислотой также возможно через кожу (даже неповрежденную).Существует монография о синильной кислоте*.
112) синильная кислота не является хорошим растворителем для большинства солей, но в то же время сильно ионизирует растворенную часть.Последнее значение * Б О 0-о С. С.. Смирнов С. К., синильная кислота*. М, «химия», 1970,176 С. Иметь очень высокую диэлектрическую постоянную (0 ° C при 158,25°C при 107). Присущая электролитической диссоциации HCN очень мала:(H’CMN -) = 2-10 -, C. NSU растворяется в ней.»H, S04 и HNO ведут себя как слабые электролиты. Это указывает на то, что тенденция присоединения Протонов не характерна для молекул HCN.
Но она все еще может выступать в качестве донора. Именно поэтому в VCI образуется»черный твердый комплекс (HCN), VCI», который начинает разлагаться только при 40°С и выше. Кислотные свойства HCN в водных растворах характеризуются значением х = 610-10.Как в безводном состоянии, так и в водном растворе синильная кислота является стабильной только в том случае, если она одновременно содержит небольшое количество минеральных кислот (или других веществ, таких как кокосовое масло).
Взрыв синильной кислоты. В водных растворах гидролиз также происходит по схеме HCN-f 2H * 0 = HCOONH. Напротив, цианистый водород можно получить, нагревая эту соль с PjOj. При хранении водного раствора цианида цианид медленно разлагается по следующему уравнению: KCN-f-CO * — f-H, 0 = HCN + KHCOj и KCN-f 2H20 = NHj + HCOOK. С гипохлоритом реакция протекает по формуле. 2NaCN + SNaOCl-f H2O = 5NaCl + 2NaHCO 3 + N. 114) в индивидуальном состоянии полимера HCN, белый кристаллический (HCN) j(mp).86) и (HC. N) т (Мп.184°С) известно.
Трнмер (симметричный триазун) имеет структуру 6-членного плоского кольца, чередующего атомы N и радикалы CH(rf(CH)= 1.09, rf(CN)= 1.32 A. ZNCN= / 27°.ZCNC= 1/3°].И легко гидролизуется до HCOONH.»Тетрамеры являются структурными NH, (CN) C = C (CN) NH> 115) соединение фосфора, подобное цианистому водороду, NDS частично образуется, когда PH3 проходит через дугу с графитовым электродом. Н—С*Р в случае молекул, значение 4(НС)= 1.07,к(НС)=■= 5.7,д (СР)1,54 В и к(СР)-8.9 НК =»0.39 была определена.
Это вещество является стабильным бесцветным газом только при температуре ниже тройной точки (-124°C) и самовоспламеняется на воздухе. Взаимодействие с хлористым водородом основано на Формуле: НСР-F2HC1 = CHJPCL2.Уже при −78°C из NDS немедленно образуется черный полимер. Длина одной связи C_P составляет 1,85 А. 118) основным техническим способом получения цианида является цианид кальция (IX§ 1 add.13) и уголь и сода (или хлорид натрия). Реакция Pr 800°С протекает по уравнениям CaCN2 +С-F-Na2C03 + 20 ккал = » CaCOj-f-2NaCN.
Поскольку CaCOj практически нерастворим, цианид натрия можно экстрагировать водой из сплава. Чистый д. nacn представляет собой бесцветное кристаллическое вещество, которое растворяется без разложения. в PR 564°С, легко растворяется в воде, если нет воздуха. При 1000°C пара AcIinda содержит примерно одинаковое количество молекул NaCN и (NaCN). При сжигании смеси калия и угля с потоком аммиака образуется цианистый калий: K, COj +С-f 2 NHS-f = 66 ккал = 2 KCN-fЗН, 0.In при отсутствии воздуха эта соль плавится при температуре 635 ° С, а при высоких температурах она испаряется без decomposition. It легко растворим в воде.
117) не-CN, содержащийся в цианиде, имеет эффективный радиус 1,92 а (при свободном вращении).Среди слаборастворимых цианидов наиболее важным является белый AgCN (PR 7-10 16).Подгруппа Mn для металлов. Cr n V простой цианид не является characteristic. In напротив, сложного цианида этих металлов очень много. Характерной чертой при не-CN-поступлении во внутреннюю сферу является резкое повышение устойчивости низшего окислительного состояния, что не характерно для комплексообразующих элементов организма (обычных соединений).
Итак, желтый MelRc (СN) » л, Зеленый мне [СГ (см) е] (м одновалентного катиона) и розовый К $ [В (кн) 8]соответствует степень окисления ноль, а бесцветный (мл) или зеленый (ту, Рэ) тип МС [3 (СП)»] комплексы и Н К«(КР(СN) 4]представляют собой 1 степень окисления. В состоянии окисления 2 известны как синие (МН, СГ) или желтый (повторной, в). К (комплекс (3 (СN) Эль-3×20, в случае степень окисления, 3 являются комплексы Московский джазовый оркестр (КН) тип Эдж красный (марганца, ванадия), желтый (кг) или зеленый (Ре).
Состояние окисления 4-Красный K3 [Tc (CN) e]и K «[Mn (CN)$], или желтый M4 (3 (CN)», где 3-МО. Степень окисления 5 Коричневый с Kerrc (CN) 8]и M5 [E (желтый с. Где: E-Mo, W. Наконец, фиолетовый Kj [Re (CN) * j описывается для состояния окисления 6.Когда окисляется, кДж / (Ре (спицы)* о] явно сформирована. Степень окисления рения составляет 7. 118)Как вы уже можете видеть из приведенного выше краткого списка, сложный цианид рассматриваемого элемента весьма разнообразен.
Их разнообразие дополнительно усиливается наличием различных смешанных производных, в которых некоторые из групп CN смешиваются с другими радикалами или молекулами (O, OH, CO, NO, Nib, H20 и т. д.). Примером такого производного является оранжевый Kslrcosfcn’BJ. ЦИАН K4 (Cr (CN)5N0] −2H20, фиолетовый K4 [Mo (CN) 5NO], бесцветный Kz [Mn (COb(C \ b) и K *(Cr (CO) 4 (CN) a).в случае ниобия сложный цианид тантала не получается.
119) это удобный способ произвести бирюзовый заключается в использовании реакции НД (СN) 2-ф-HgCU = » = NdgC12-Ф(КН’х. Оно основано на).Уравнение: 4NaCN + 2CuS04 — » 2Na: S04 + 2CuCN | +(CN) 2.Сигаретный дым всегда содержит следовые количества цианогенов (Мп −28, Мп −21°С).он частично возникает при горении электрической дуги в атмосфере азота с поглощением тепла (74 ккал / моль). 120) молекула ЦИАНа линейна (</(CC) −1.39, d(CbT)= 1.16 A).Связь C-C характеризуется энергией 132 ккал / моль и постоянной силы 6,9.
Его длина будет намного больше shorter. It приближается к простой связи между атомами углерода (1.54), В 2 раза длиннее обычной (1.34 а).Однако увеличение порядка C-C связи Cyan является уменьшением порядка соседних C-N связей(111§ 5, 8 дополнительно).С другой стороны, их длина и константы силы (k-17.4″) такие же, как и у других общих цианидов(HCN, топливо, смазочные материалы), и при переходе от последнего к NC — CN порядок связей C»» N не изменяется.
121) в жидком состоянии цианид связан и является плохим растворителем для большинства веществ. При помещении на огонь в воздухе он горит фиолетовым пламенем, выделяя большое количество COt и N2(260 ккал / моль).при сжигании цианида в кислороде можно получить пламя с температурой до 4500, а в озоновой атмосфере даже до 5000 куб. см можно получить пламя.
122) ЦИАН легко растворим в воде (примерно 4: 1 по объему), в основном разлагается образованием оксалата аммония в соответствии со схемой (CN) 2-f4H»0 =(NH4) aCj04. Нагревание последнего в присутствии PjO может служить способом получения голубого цвета. 123) если цианид хранится длительное время, подвергается воздействию ультрафиолетовых лучей или нагревается до 500°С и более, он превращается в твердый темный полимер («испарение»).
Это также постоянный побочный продукт производства цианида за счет пиролиза цианида. ParaCiai нерастворим в воде, спирте или жидком цианиде, но растворим в холодной концентрированной H2S04, и при разбавлении такого раствора водой он осаждает paraínia. При нагревании до 860°С в потоке азота образуется величина, а при нагревании в потоке водорода образуются HCN, NH и свободный углерод.
124) другой цианидный полимер, гексанин, как известно, представляет собой бесцветный кристалл(Мп 119. mp.262°с).Структура этого вещества соответствует плоскому шестиугольнику, в котором чередуются N атомов и CCN групп. В присутствии сильно нагретой платины гексахиакки разлагаются и образуют нормальный голубой цвет. 125) при нагревании цианида выше 1000°С он диссоциирует по схеме: CjNj * * 2CN. Радикал CN характеризуется ядерным расстоянием 1,17 а, диссоциированной энергией 195 ккал моль и постоянной силы 15,9″.
Его потенциал составляет 14,6 э, а сродство к электронам оценивается в 88 ккал / mol. In большинство свойств, подобных галогену, OV находится между бромом и йодом. Термическая стабильность этого радикала настолько велика, что его можно увидеть даже в атмосфере Солнца. 126) при взаимодействии с сильной соляной кислотой цианид связывает 2 молекулы воды и переходит в оксиам и d — (CONH2) j. последний представляет собой белый кристаллический порошок, не растворимый в воде.
При нагревании oi частично разлагается и сублимируется. 127) галогенидные кристаллы (C1CN, BrCN, ICN) могут быть получены действием соответствующих свободных галогенов на водный раствор HCN(в случае йода реакция по схеме G2 + HCN = * TCN + NG замечательно обратима).Цианид хлорид представляет собой бесцветный газ (mp 7-7°C,+ 13 ° C), BrCN (mp 51 ° C 61 ° C) и 1CN(mp 140 ° C, mp 146 ° C под давлением) — летучее кристаллическое вещество.
Они характеризуются потенциалом ионизации 12,5 (CI). 12,0 (Vg), 11,0 дюйма (I).Линейная структура[d (CN) 1.16. РФ (ЗАО) 1.63. < * (ВГС) 1.79. d (lC)= 2.00 A]и постоянной силы G-C муфты. 5.0 (C1), равный 4.1 (Br)’. 2.9(я). Дипольный момент BrCN и 1CN (в бисоле) равен 2,9 и 3,7.Соединения галогенов очень токсичны. Пар в них, даже в очень низких концентрациях, вызывает сильное слезотечение. Растворимость в воде серии CI-Br-I значительно снижается.
Хуже, чем любой другой галогенный цикл, который исследовал FCN. Это бесцветный газ (Мп.- Да. Т. Кипятить.-46°С).Его молекула q = 1.68 и содержит очень короткую связь F-C(1.26 A), но длина связи C * N обычно составляет (d 1.16 A). 128) основным продуктом фторирования ciaia AgF3 (110 ° C) является бесцветное вещество состава CjF4Nj (bp-36°C).
Судя по спектральным данным, структура его молекулы линейна (FjCNNCFa) и может представлять собой 4-членное кольцо(простая связь между атомами углерода и двойная связь между атомами азота). 129) во время хранения галогенид цианид полимеризуется по схеме 3rCN» =»(rCN) j, причем N атомов и SG групп чередуются, образуя 6-членные кольца(FCN особенно легко измерить).Тример называется Галогенидным ананулятором и представляет собой летучее кристаллическое вещество.
Например, хлорид цианида плавит 146 и кипит при 190 градусах Цельсия. При взаимодействии с SbFj получается фторид Шиа-Уру (mp.-38.Mp.4-74°C), его пиролиз является лучшим способом получения FCN. (FCN) в то же время как j, CjN3F2Cl(mp 4-23.Mp.114°C) и C3NsFCI2(mp 4-2, mp. Образуется смесь 155°с). tsniazid (Н » СН, МП 40°C) и его тример, C и A и U и Z и D ((NjCN), (Мп 94°С)), также известный. Пиролиз цианазида привел к образованию цианида азота, NC, N, N и CN.
An интересный желтовато-белый взрывчатый комплекс (C (Ns) siffble] (mp 145 * C с decomp. it это не так. Обзорная статья на хлорид циануровой и его реакция* 130) взаимодействие между AgCN и раствором сероуглерода SCI2 получено с цианидом серы-S(CN) j. его молекула полярна(q-3,04) и характеризуется следующими параметрами:<f (SC) » = 1,70. РФ (СП) » 1.16 А. ^ ДКО = КМТ. Ciaiistai серы представляет собой бесцветное кристаллическое вещество, легко возгоняется(Мп. При 61°С), растворяется в воде и многих органических жидкостей.
Его руды цветной полимер с (СП) т и * Мур В. и химия успеха. 1000 л, 2, 110. Житель земли. Последний получают путем обменного разложения по реакции(в бензоле).TeBr,+ 3AgCN = 3AgBr + BrCN + Te (CN)* 131) цианид фосфор-P (CN) может быть взят из AgCN и PCIj*его молекула имеет пирамидальный тип и характеризуется следующими структурными параметрами: d(PC) -= 1.78, rf(CN)= 1.15 A. ZCPC 98°. ZPCN = 172°.
Цианид фосфора представляет собой бесцветное кристаллическое вещество, которое может быть сублимировано в отсутствие воздуха (его используют для отделения его от одновременно образующегося Агкл).он почти не растворяется в органических жидкостях, разлагается с водой. Смешанный флуороцин nanide FjPCN является нестабильным и постепенно изменяется на PF203 и P (CN) 3 даже при 20°С.
Цианид мышьяка-As (CN) 3 также имеет пирамидальную структуру. Р21″(ІХ§ 5 добавить.57) и взаимодействие с AgCN в дихлорэтане дало белый кристаллический дифосфентрифосфид-Pj (CN)». 132) цианидными аналогами фосгена являются Карбо и lts, а также a и d-CO (CN) 2.It бесцветен, но желтоватый свет в свете (Мп.-38.Т. Кипячение.+66°с).Его молекула-норария (q = 1,35) и имеет довольно большое сродство к электронам (около 20 ккал / моль).Карбопиринид бурно реагирует с водой. Обеспечивает CO и HCN.
Известны и стабильны только ниже −100°C ионы il-cyan и d-SO (CN). 133) в соответствии со схемой 2NH3 + CICN ’ NH4CI взаимодействие хлорида цианида с эфирным раствором аммиака| + NHjCN может быть получено с Цианамидом(H, N-CeN).Его молекула имеет плоскую структуру [^UNH = 120°, rf (HN) −0.94. д (Н — С) −1.35. I /(CbN) −1.16 A) и полярность (fi = 4.24). Константы силы для связей N-C и Cs = N равны соответственно 7,5 и 16,0.Цианамид представляет собой бесцветный кристалл(Мп.46 СС).
Легкий для того чтобы растворить в воде, спирте и ether. In нейтральный органический растворитель, равновесие таутомерного типа HjN-C » N HN = C-NH, вероятно, будет для него и сдвинется вправо, поскольку решение diluted. In водные растворы, он стабилен при рН = 5.С другой стороны, в сильно кислых или сильно щелочных средах молекулы воды легко прикрепляются за счет образования мочевины.
134) сплавленный цианамид является отличным растворителем для многих неорганических соединений. При нагревании до 150°С он полимеризуется по схеме: 3nhacna=(NHjCN) J. полученный полимер (Мел) обладает свойствами прочного основания. Его молекула представляет собой плоский шестиугольник, образованный чередующимися атомами N и группой CNH.1. один из исходных продуктов некоторых синтетических смол.
135) цианамид характеризуется очень мягкими кислотными свойствами. Из его солей цианамид кальция получают сухим методом (IX§ 1 постскриптум 13).в чистом состоянии он представляет собой бесцветный кристалл, образованный ионами CAG * и линейным Nomen[NCNJ «*(то же-1.28 a-расстояние ядра C-N).
Над 1000°C, цианамид кальцина разлагает в 2 параллельных реакциях:2CaCN?= CaC2 + Ca + 2N2 и 2CaCN2 = » 2Ca (CN) 2 + Ca + N2.Калиевая соль, Формула 2?CN2 = = 2KK + 2K + N2 уже более 400°C. При взаимодействии с водой кальцинцианамид гидролизуется по схеме 2CaCN2 +2НгО = ca( hcn2) 2+ca (Oh) 2.Цианамид получают под действием разбавленной серной кислоты. Цианамид тяжелых металлов нерастворим в воде и легко разлагается при нагревании (воздух, обычный, азот, цианид, если нет свободного металла).
Наиболее характерной является соль желтого серебра (PR = 7-J » 11). Известными продуктами замещения цианистого водорода и галогенидов являются бесцветные FjNCN(mp.-62°С). В присутствии CsF, в нормальных условиях, он быстро изомеризуется в донохурус диазирин (add. См. 138).
136)в слабощелочной среде, Цианамида склонен к лихорадке-как diumerenzine. Полученный cnanoguanidine (dnciandiamide) представляет собой бесцветный кристаллический (mp.209°с).Молекула этого вещества имеет структуру (HjN) aC = N-ChN, но потенциал таутомерного потенциала по схеме(HjNbCNCN H2CN(NM) NHCN исключен. Представлены основные свойства дикнамбата.
Очень четко (K 3-U ’ 5), кислый-очень слабо (K = b-10-15). существует обзорная статья*о дициан-днамиде и его реакции. 137) структурные изомеры инанамида (и аналоги закиси азота и азотной кислоты) представляют собой диазомеган-HjC = N™N и получены по следующей формуле: CHCI,+ NaH » +ЗКОН = * 3KCI +ЗН20 + знcn2. Молекула H2CNN полярна (q = 1.50) и имеет следующие структурные параметры: d(HC)= 1.0 V. d(CN)= 1.30, rf(NN)= 1.14 A. ZHCH = 126°.
Риазометан является высокотоксичным желтым газом (т. е. кипит при 0°C), который взрывается и разлагается при нагревании выше 200°C. It применяется в органическом синтезе (обычно в виде свежеприготовленных эфирных растворов). 138) диазометан является структурным изомером для диазиана. Его Полярная молекула (ji™1.59) содержит 2 атома азота и 3-членное кольцо Ch2 (d(N = N)= 1.23,d (C-N)= 1.48 A).
Структура Диазолина ранее была отнесена к диазометану. 139) Na2NCN-f BrCN = NaBr-f Na. При реакции N (CN) 2, когда цианиды действуют на водный раствор цианида натрия, в течение нескольких дней образуется натриевая соль и образуется n-имид IHN (CN).1.Последний раствор получают обработкой водной суспензии его малорастворимых солей меди сероводородом. Свободные дипианимиды известны только в растворе и характеризуются очень выраженными кислотными свойствами.
При попытке его разделения продукты различного состава осаждаются и происходит полимеризация. 140) по схеме NH $ -f NH2CN (NH2) 2CNH гуанидин может быть получен из Цианамида. Структурно это соединение сходно с мочевиной, в которой атом кислорода связан с имидной группой. Гуанидин-бесцветное, сильно гигроскопичное кристаллическое вещество (Мп.50°C, декабрь).
Согласно своей химической функции, это сильное одиночное основание, формируя типичную кислоту и стабилизированную соль. Катион (C (NH2) 3) представляет собой плоскую структуру С d(CN)= 1,32 А. соответствующие нитраты(mp.217°C) используется в качестве взрывчатых веществ. В присутствии щелочей, гуанидинов гидролизуется до мочевины и аммиака. В случае гуанидина продуктом замещения 1 или 2 атомов водорода металла является known.
In в частности, соли серебра могут быть получены путем добавления AgNO к высокощелочному раствору. Гуанидоний очень характерен для попадания на внутреннюю территорию комплексных соединений. 141) взаимодействие цианида и щелочи протекает так же, как и при аналогичной реакции свободной галоген-водородной цианидной кислоты и одновременном образовании соли цианидной кислоты (HNCO): (CN) a + 2KOH = KCN + KNCO-f H20.
C и a и ts также получают путем тщательного окисления цианида, особенно путем слияния с оксидом свинца. Цианат калия также образуется при нагревании KCN в воздухе. Эта соль легко растворима в воде и постепенно разлагается по следующей схеме: KNCO + 2H20 = NHa-f KHCOe. Пиролиз дуаната калия главным образом. Уравнение: 4KNCO = 2KCN + K2C03 + CO + Na. Серебряная соль бесцветна, почти нерастворима в воде (PR = 2-U-7).Для комплексных анионов[3(NCO) 4] 2 «(Э — элемент ряда Mn h-Zn) группа 3NCO линейна.
142) циановая кислота (Мп.- 87.Mp.+25°С), существует высокая вероятность того, что наступит следующее равновесие таутомеров: Н— N = C = 0 * * NsC—О—Н. При нормальных условиях он смещается влево (между тем, во время охлаждения он, кажется, слегка перемешивается вправо). Взаимодействие NS / −80°C нитрата натрия, в результате чего 97%HNCO и 3%HOCN, при взаимодействии серебряной кислоты серебра с SiCl4 в бензоле, 98% Si (NCO) ((MP 2G, mp. mp.18GeC) и 2% Si (OCN) 4(mp 35, mp 247°C).
Органические производные известны только в HNCO. В противоположность этому, по данным инфракрасной спектроскопии, ianic комплексов МО * \ Ре4 *и re имеют структуру[3(Сайт OCN) Ин. «Молекула HNCO(т. е. изоцианат) полярна(q = 1.58), а параметр D(HN)= 0 99, d (NC)».2l. D (CO)= 1.17 A. ZHNC = I28°. * Kpcloi A. E. достижения в области химии. 1954. НЗ. 105.
Для констант силы его сцепления приведены значения: 6.9 (HN), 14.0 (NC) и 15.0 (CO). 143) в разбавленном водном растворе циановая кислота (/C = 3-10-4) быстро гидролизуется по схеме HNCO + HGO * * COj + NHj, после чего образуется мочевина: NH3 + HN’Co = CO (NH2) 2.Полимеризация происходит в растворах с образованием трехосновной циануровой кислоты (HNCO).ее также получают гидролизом мочевины или цианурового хлорида, бесцветного кристаллического вещества, плохо растворимого в воде(1: 400). HN и CO [d (N C)= » 1.37 AJ.
Нагревание лимонной кислоты (/(,=■!* 10-7, / C2-5-10 ″ 11, / C3 = 3-10-5) вызывает его depolymerization. It используется для получения свободного цианата. 144) в дополнение к металлу (и кремнию) были получены цианаты фосфора и серы. Такую вещь можно назвать «П (НКО)» (Мп.-2, Мп.169°с). Па (НКО), РГ рода производными финансовыми инструментами (к: COB и Pr2NCO (Г является F или CI), PCl2 (НКО) С. По(НКО), ПС(НКО), так *(НКО) J в(Т −4.t. bp 139 eC), SjOs (NCO) 2 (mp 27°C).Также известен нестабильный галогенид, который легко тускнеет по схеме: 2rNCO T2NC(0) NCO. д (Кин) 1.69 а,^ ГК ВМФ» = * 124°. 145) n тот же элементный состав, что и циано, имеет летучую кислоту.
Исходя из»невозможности» присутствия Пятикнижного азота (добавлено VI $ 3,12), молекула H — O — N =£C долгое время приписывалась именно этой молекуле, но по классической формуле H-C » N = * 0 параметр rf (HC) −1,03, d(CN)= 1,16,d(NO)=1,21 A, q = 3,06. Структура CHjCNO(и-4.49) аналогична:< / (CC)= 1.44,< / (CN) — = 1.17,</(NO)■= 1.22 A. Обе кислоты-как цианогенные, так и взрывчатые (их соли называются фламингитами) — очень неустойчивы в свободном состоянии. Из этих солей наиболее интересными являются нитрат аммония (NH NCO), аргентоксанат (AgNCO), аргиет флумнеат (AgCNO) и ртуть (Hg (CNO) 2J. (мочевина).
Синтез обеих солей серебра дал первое свидетельство существования противоположного пола в истории кимчи (1824).Взрывчатая ртуть взрывается при ударе и используется в качестве детонатора. Его разложение протекает по схеме. F N2 + 118 ккал. Винтовочные патрульные поршни, содержащие смесь ртутной кислоты (50%) с хлорсодержащими солями (25%) и антимонтристорфидом (25%). 146) взаимодействие AGNCO и CC1 с 12 < свободным оксо — (NCO) I является obtained.
It устойчив только при низких температурах и представляет собой бесцветное кристаллическое вещество (Мп.- 12Х). 14 обычно получают взаимодействием сероуглерода с сильным раствором аммиака в присутствии гидратированной извести по реакции (при 110°С при давлении в слое): 2NHj-f CS2-fCa (он) 2 * NH » NCS-f CaSj + 2HtO. In в отличие от цианида, соли родано-серной кислоты не токсичны.
Ничтожное количество содержится в человеческой слюне. 148) при вакуумном взаимодействии сухих КНКС и ХС04 и охлаждении выделяющегося пара жидким воздухом можно получить тиоцианат водорода. Полученная белая кристаллическая масса будет плавиться при-U0°C. уже выше −90°C начинается полимеризация, сначала получаются белые, затем окрашенные твердые продукты. Полимер разлагается примерно на 4 * 3 «С.
В парообразном состоянии тиоцианат водорода представляет собой мышечную молекулу, структура которой определяется формулой H-NeC » s с параметрами </(HN)= 0.99, rf (NC) 1.22, d(CS)» = 1.56 A,^ HNC −135®.Константа прочности связи составляет 7,0 (HN). 13.2 (NC) и 7.3(CS).Молекула Полярная (u 1,72), потенциал ионизации 10,6 в、 Кроме того, энергия связи H-NCS оценивается в Ккал / моль. Основная возможность таутомерного равновесия, обусловленного схемой H-N = C = S * * N «C-S-H, возникает из наличия органических производных обеих форм. 149) за счет взаимодействия сероводорода с HNCS образуются CSj и NHj.
При нагревании HNCS с серной кислотой, которая не очень сильна, реакция протекает в основном по следующей схеме: HNCS +Н* 0 + H / S04 «■NH4HSO » + COS. Этот процесс может быть использован для получения окиси углерода. Сильный окислитель (Na02.Например, KMnO преобразует HNCS в I1CN и HtS04.Кислотные свойства родановой кислоты характеризуются величиной к 0,5 0,5 (то есть она намного сильнее циановой кислоты).Эта кислота содержится в луковом соке. 150) интересно проследить эволюцию представлений о строении родановой кислоты.
С древних времен, а то и 60 лет назад, основываясь на методе образования тиоцианата по схеме MCN + S, считалось, что MCNS соответствует формуле H-CeN ^ S. около 40 лет назад, когда стало модно отрицать возможность 5-валентного азота (см. VI§ 3 доп. 12).Также установлено, что эта кислота сильна. Его формула Н-S-Си»м. Прямое определение структуры тиоцианата водорода, приводящее к текущей формуле H_N = C = S, было сделано уже 20 лет назад, но в предыдущей литературе даже 40 лет назад (HSCN) и 60 лет назад (HCNS) были открыты уравнения.
151)по данным рентгеновской дифракции солеподобных кристаллов тиоцианата. Ион NCS является линейным и характеризуется параметрами tf (NC)= 1.24 и (CS) = 1.58 D. Это соответствует структуре N-C = = S. At в то же время при смешивании комбинационного спектра соли (III§ 6 добавление 12) КНКС и воды (3: 2 в массе) температура полученного раствора снижается примерно на 30 градусов, что иногда используется для антифриза.
Существует выраженная тенденция к некоторому Родию (особенно Li).О формировании пересыщенного раствора. При нагревании, в отсутствие ki KN’SS (mp 177°C) примерно до 400°C, частичная термическая диссоциация тиоцианата при KCN и S вызывает синеву расплава с последующим образованием коллоидного раствора серы (образующегося с молекулами S4) за пределами KNCS. (VII§ 4 add.39). 152) интересен тиоцианат марганца, образующийся при растворении MnCO в HNCS. In контраст к розово-красному цвету почти всего другого производства Mn * безводный Mn (NCS)*желтый, и его кристаллический гидрат MnfN’SS); −1 Bright ярко-зеленый.
При растворении в воле сначала образуется зеленый раствор, и только после достаточного разведения он становится розовым. Константа диссоциации Ионов MnNCS *составляет 6-10. при обменном разложении ниобия и тантала с NH4NCS (ацетонитрильная среда) пентохроматических (Nb (NCS); b и (Ta (NCS) sb). NBO (NCS) 3 и NbOjNCS. In форма кристаллического сольвата с ацетоном (2 молекулы), черный Mo (NCS) и W (NCS) разделены. Оба эти соединения разлагаются. AgSCN(пр = МО’»).
Кристаллы этой соли делятся на параметры d (AgS) » −2.43,d (AgN)= 2.22.РФ (СN)= 1.19.D (CS)=состоит из цепочек типа AgSCNAgSCN. 1.64 A. остаток атомов Iepn Izogn S и Agf равен AgSC = 104°.ZNAgS =165е], поэтому он становится зигзагообразной формой. Нестабильный SO; (SCN) 2 был получен взаимодействием AgSCN и SOjCI. 153) проникновение комплексных соединений ионов NCS во внутреннюю область «менее характерно, чем CN», но существует также довольно много сложных тиоцианатов.
Ионы NCS могут связываться с центральным атомом через азот или серу во время их образования. Основные типы координации с различными комплексными соединениями показаны на рисунке х-20.Его присутствие является связью E-NCS, и низкая валентность комплексообразующих агентов выгодна для связей, опосредованных серой, и для высоких связей, опосредованных азотом. Иногда характер координации зависит от характера других заместителей, существующих во Внутренней Сфере.
Например, в случае кобальта комплексы с конфигурациями co_ncs (normal) и co_scn являются known. An пример одновременного сочетания обоих типов координации дает Co / Hg (SCN) 4] — Кристалл этого комплекса содержит кобальт в тетраэдрической среде с атомом N [tf(CoN) = 1,92 A], а Ртуть-Атом s [tf (HgS)= 2,56 A), то есть состояние рассматриваемого соединения можно сформулировать как Co (N) H (Hg) Hg.
Однако с точки зрения своей химической функции этот комплекс представляет собой соль анионных ионов кобальта и ртути. То есть Co и Hg-это одно и то же. Имеется обзорная статья по кристаллохимии тиоцианата. Наличие того или иного типа неинвазивной регулировки может быть установлено не только рентгеноструктурным и структурным анализом, но и инфракрасной спектроскопией. (III§ 6 постскриптум 10), поскольку растягивающая вибрация муфты M-SCN находится в диапазоне частот 690-720 см-1, а муфта M-NCS — в диапазоне частот 780-860 cm-1.
It было также показано, что частота растягивающих колебаний связи CN роданида также служит индикатором. Широкий диапазон меньше, чем 2100 см свидетельствует о Е-Н связи. Острый диапазон над 2100 sp-1-и E-S binding. So до сих пор регулировка TNP роданонона была установлена экспериментально только для относительно небольшого числа соединений. Поэтому в неясных случаях дополнительно используется запись родинида по типу МНК(из структуры самой канифоли соляной кислоты, как следует).
154) примеры сложных rodanides металлов уже рассмотрены м2 [3(по NCS) 6]тип соли(и т. д. мо мо м одновалентных катионов), МС {3 (НПШ))) (3-СГ, МО или W), М Л МН(НК)], с $ {Ре (СКС)]].Из них темно-красное производное хрома сразу после растворения в воде не вступает в реакцию с Cr -. NCS тоже нет’.Однако с появлением ионов Cr раствор становится постепенно зеленым, когда они стоят\темно-синий kinb (NCS) e]и оранжевый K / Ta (NCS) J также были получены.
Известны также смешанные комплексы с участием группы родандо. желтый Mn (CO)$ SCN. Есть обзорная статья о металлокомплексах Родана 155) реакция 2AgSCN + Br2 = 2AgBr-f (SCN) 2 при действии брома на AgSCN (раствор сероуглерода) можно получить свободный Родин (SCN)его молекулярная структура соответствует формуле NCS-SCN. Бесцветные кристаллы, низкая температура(mp. It только стабилизировано на −2°С). в воде, Родан растворяет легко, но быстро разложенный формулой 3 (SCN) 2 + 4-4HjO = 5HNCS + H3SO4 + HCN. Как и свободные галогены.
Родан связывается непосредственно с определенными металлами, образуя соли HNCS. Электронное сродство радикалов NCS оценивается в 50 ккал / моль. Окислительная функция менее выражена у Родена, чем у брома, но она сильнее, чем у йода. В процессе хранения он легко переносится в красный полимер (SCN) N. Для Родана известны дополнительные продукты типа (SCN) 3-2Hr (здесь Г-С1, Вг) n (SCN) rhj3 (здесь Э—о, s). 156) ближайшим аналогом родия (и цианида серы) является общая формула Sn (CN) c, а n-сульфан (n) в структуре, известной при значении n = 3-8, аналогичен галогенсульфану (VIII§ 1 add.47).
Распространенным методом получения является взаимодействие SnCl2 (n = I×6) с Hg (SCN) 2(в сероуглероде).Высокосортный цианосульфон является нестабильным, бесцветным (n = 3,4) или желтоватым веществом, из которого S3 (CN)*(разлагается при температуре 93 ° C) и S *(CN) 2 (т. е. для S9 (CN) j длина соединения составляла d (SS)= 2,12,d(SC)= 1,69, d(CN)= 1,21 A. Cg Mp Tc Co Ni Si Zn Ga Mo Tc Ru Резус-Др Ай Компакт-Диск ст В Вновь ОС ИК-Пт Ау Он Т1 ПБ Гонка X — ’ J0.Основная область регулировки-роданий. * Жданов Г. С.. 3 В и 3.В..
Успехи в химии. 1953, нет. I. 3. ••Я есть A. K. It речь идет о прогрессе в химии. I0SA, M. 7. 872. 157) соединения селена-аналогичные приведенным выше (SeCN) j также были получены. СК (СN) 2 (Мп 134°с). Se(SCN) j. Sc(SeCN) Jf и многие соли и комплексные производные, известные только в растворе, очень нестабильны HNCSe (K = 5).Из них KNCSe гигроскопичен и слабо растворим. AgScCN практически нерастворим(PR = 410 «16). при 158°С стрептоконат калия подвергается обратимому разложению по схеме: KNCSe * * KCN 4-Sc. In в случае не-NCSe -, приведены следующие значения ядерного расстояния и силовой постоянной: d-1.17 (по другим источникам, 1.12) A, k 15.1 (NC) и d sas | .83 A. Lg = 3,9 (CSe) может быть соединен через азот (с Fe, например), как в случае азалии.
Существует обзорная статья о селенозиатах металлов, которые используют селен (Ni), или селен (Pd, Pt и т. д 158) Родин хлорид (NCSC1) и Родин хлорид (NCSCI3) могут быть получены взаимодействием Родина и хлора. Первое из этих веществ-бесцветные кристаллы, второе-оранжевая жидкость(т. Кип.153°с).Структура трихлорида Родана, по-видимому, соответствует формуле CISC (CI) NCI. Оба производных хлора Родена медленно разлагаются при хранении и под воздействием воды. 159) известно много родинидных производных фосфора. Из них P (NCS) 3. PO (NCS) 3. PS (NCS) s. смешанные галолоданиды PT2NCS (где Г-F или CI) и POCljNCS являются нормальными жидкостями, [NP (NCS) 2] 3 и [NP(NCS) 2J4 являются легкоплавкими твердыми телами (mp 41 n 90 °C)).Последние 2 соединения.
Галогенид фосфоязы (IX§ 5 Add.83), при температуре 150°С и выше они полностью замерзают и превращаются в резиновую массу. Благодаря взаимодействию AsCI3 с kncs жидкости S02, стабильный as (NCS) 3 мышьяк-родинид был получен только при низких температурах. 160) уравнение IIIIg(SCN) 2 = 2ilgs 4-C-CSj 4-C-1 продукта термического разложения Родиновой ртути, которое протекает в соответствии с C3N4, представляет собой обычный нитрид углерода (CjN).в индивидуальных условиях его удобнее приобретать путем термического разложения цианида серы.2S (CN) 2 = CS2 f-f C3N4.Нитрид углерода представляет собой очень большое количество желтой аморфной массы, которая очень сильно поглощает влагу, но нерастворима в воде или других растворителях.
При нагревании до раскаленной температуры он распадается на цианид и свободный азот. 161)с точки зрения элементного состава род соляной кислоты в природе близок к т. Новый водород образуется по уравнению (C2S2N2H4): 2HCN 4-211 ^- C2S2N2H4 + Н2.Это соединение, по-видимому, существует в двух таутомерных типах: H2NC (S) C (s) NH2 и HN = C (SH) C (SH)= NH. Рубиновый водород представляет собой красно-оранжевое кристаллическое вещество, которое разлагается при 170°с относительно легко растворимым в воде (0,02 моль / л) и постепенно разлагается при производстве щавелевой кислоты. NH3 и H2S. очень слабы и обладают ярко выраженными кислотными свойствами (/С (=3-10″!0).
Водород Рубина дает много катионов металлов и характерных красящих соединений, которые трудно обнаружить. dissolve. In в частности, oi является очень чувствительным реагентом против меди. 162) теплота образования газообразных СГ4 галогенидов из элемента в значительной степени зависит от свойств галогена (ккал / моль): 223 (f). 32 (С1), −20(Бр). −73 (I).
Как видно из этих данных, последние 2 соединения являются термическими. Карботетрахлорид (mp 23, mp 77°C) обычно получают действием хлора на CS2.При нагревании до 60°С в присутствии катализатора (ФЭС и др.), реакция протекает по следующей формуле: CSj 4 * 2Cb = CCI4 + 2S +54 ккал. Несмотря на химическую инертность тетрахлорметана, некоторые металлы (АИ, например. Fe) значительно разъедается им.
Если они присутствуют, то CCI4 постепенно разлагается водой по следующей схеме даже при нормальной температуре: CCI4 4-2H20 = CO2 4-4HCl. Присущая им растворимость в воде очень мала (порядка 5 * 10 «* моль / л.).Использование в некоторых системах огнетушителей основано на негорючести и тяжести паров четыреххлористого углерода. 0,02 мг / л. ежегодное мировое производство SS14 составляет около 20 млн тонн (без учета СССР). * Голуб Л. М.. Об а т и О В У. в. успехах в химии. «965, 0.4» 12 2098. 163) производные других галонов, аналогичных тетрахлорметану, обычно получают путем обменного разложения CC14 при нагревании с AgF, AlBrj или AN соответственно.
Тетрафторэтилен также может быть получен прямым взаимодействием «аморфного» углерода с фтором, который при нормальных условиях протекает бурно (однако твердый графит стабилен почти до 400°с относительно фтора). Молекула галогенида представляет собой тетраэдр с расстоянием с—г, равным 1,32 (СГ), 1,77 (CC1), 1,94 (CBG) и 2,15 a (С1).Для констант силы соединения указаны значения 6.3 или 9.1 (CF), 1.9 (CCI) и 1.5 (CBg). Четыре-фторуглеродного газа(Мп.- 184 депутата.-128°С), и ЦБ РФ«(Мп 90, Мп.187°C) разложение I C14 (mp 171°C) ia 21 «n C» 14) является solid.
In в отличие от других бесцветных галогенидов СГ4, С14 имеет темно-красный цвет. Он был ’Run может сублимироваться в вакууме (ниже 100°C) с жидкостью.’ Аммиак реагирует в присутствии Амида калия, образуя нестабильный желтый аммиак » Ci4-2NHS Схема: CI4-f KNH «+ NH, — KI + SNC + N2H«.Из-за их химических свойств все рассматриваемые железы в целом похожи на CC14, что приводит к снижению стабильности вдоль серии F-CI-Br-I.
Выше-170 куб. см, жидкий CF4 в любом соотношении смешивается с жидким озоном(можно использовать для разбавления).Интересным является различное поведение Летучей вариации хлор-фтор-индуцированного метана (рисунок х-21). 164) также известно много смешанного галогенированного углерода, особенно CHFCIBr(mp 115, mp + 36°C).
Смешанный фторид метана и этана под общим техническим названием «фреон» используется в качестве превосходного рабочего вещества refrigerator. An примером может служить фреон-12-CFjCI«(mp.-155, Мп.-30°С).интересно, что озон очень растворим, а кислород почти нерастворим. Есть специальная монография по фреону. 165) диссоциация на фтор с пирамидальной структурой CF4 с трифторметильным радикалом (CFS) требует затрат 139 ккал / моль.
Известно много производных этого радикала. Обычно они сделаны из CF l l(bp. It получается при −22°С), его распад равен 1, а ХФУ происходит с очень малой энергией активации(2 ккал / моль).Некоторые из этих производных кратко описаны ниже. Когда CF «l взаимодействует со спирто-щелочным раствором, реакция протекает по уравнению CF» I + KOH CHFs-koi. То есть йод положительно поляризован.
Таким образом, трифторметильный радикал, сродство кабеля Els довольно велико. За счет фторирования CH»OH или CO в присутствии AgF2 (играет роль катализатора) образуются F, COF. Это высокофункциональное соединение представляет собой бесцветный газ (Мп.-95°с).Известен и кф » (оф)«.Оба вещества можно считать производными плавиковой кислоты (VII§ I, 8). в то же время известны кристаллические соли типа MOCF (M-Cs, Rb, K). По реакции COF и C1F был получен OCI светло-желтого CF(mp 164, mp.47°с).Даже при 100°с почти не разлагается.
Когда смесь CF3OF и COF2 нагревается до 225°C, она образует OOCF, боковое производное CF (mp.-37°С). Сообщалось также о получении стабильного перекисного окисления F «COOOCF» (за счет взаимодействия COF с OF).Соответствующая яма оксид CF, OCF, кипит при-61°С, сульфид CF, SCF кипит при −22°С.
При взаимодействии CS2 и CoFj при 250°C был получен химически очень инертный F » CSF®(mp.- 87.、 Да. ’50-J00 450 о г р Дж * I / изоатомный галоген Рисунок Х-21.Температура кипения * фтор и хлорметан. * Том 1 В. Ф. новский.. Колотое » Б. Е. М..«Химия.» 1970.182 секунд т. −20°C). CF, SF3 также известен. Интересно, что CF3SSeCN гораздо более стабилен. От sescn изомера БФ. 166) фторирование AgCN (не смесь с Ag20) образует много производных фтора, включая как углерод, так и азот. Самое интересное-это FjCNO.
Представляет собой голубой газ(Мп.■ 197. Т. Кипятить.-87°с).Стабилен в нормальных условиях и химически очень инертен. Молекулы этого вещества слабо полярны (q-0,31). CF3N02(ВР. Наиболее близким аналогом к −31°С) является бессбет, и существуют следующие структурные параметры: d (CF)=«\, 33. д (СN)= 1.56. d (NO)- = 1,21 A. среди других простых азотсодержащих производных ZFCF-110°,^Ono 132 трифторметил, N(CF3) 3(bp-70°C), CF3NFj(bp-122. bp-77 «C) и CF3N =» NCFj (t (133 bp-32°C).Первое из этих веществ[d(NC)= 1.43, d (CF) = 1.33 A. ^ CNC = 114rj. As с NFj, в отличие от аммиака, последнее соединение, полученное взаимодействием CICN с AgF2 (80°C), является стабильным до 500°C фтора.
Интересные (FjQjNOH, слабокислые свойства (K = 2-10®).Первое окисление(через AgO) дало довольно стабильный (F3C) 2NO со свободнорадикальной природой. 16 33. Т. типун.190°С). При пиролизе (CFj) jPH или (CFa) jP-P (CF3) j может быть получено то же самое соединение(наряду с более высоким полимером).Когда кардиостимуляторы нагреваются до 250°C, в большинстве случаев тетрамер FD (PP) 2.21,d (PC) 1.87 и стабилен до 300°C. d (CF) 1. 1.32 а).Влияние кислорода на последний достигается полимером (CF3POj) N. Фосфонитолилхолин также известен как аналогичный полимер{NP (CF3) 2) n. простейшим представителем рассматриваемого соединения является CF3PH2.Задается следующий параметр:< / (SR)= 1.90. д (РН) 1,4 1.43 А. ^ ФКИ-108°. ЖПХ = 97e, я = » 1.92. 168) наличие трифторметильных групп в молекуле вызывает резкое увеличение прочности кислоты.
Поэтому, кислота CHjCOOH слаба, и CF3COOH очень сильно. Очень сильная кислота также CF, PO (OH)}. CF3P(OH) 2, (CF3) 2PO (OH). CF3AsO (ах) 2, (ЛК.) аасо (ой) и CF3S02(0ч).Трифторметилсульфоновая кислота может быть самой сильной из всех известных кислот. Соли серебра, такие как HCL4, растворимы в бензоле. 169) CC1 взаимодействуя с AgClO *(в присутствии следовых количеств HCl), можно получить соединение состава CUCC104.Представляет собой бесцветную жидкость(Мп.-55°С).
Это взрывчатое и химически активное вещество можно перегонять в вакууме, но оно разлагается при температуре 40 ° С и выше. CC13N02 («хлорпикрин») — бесцветная жидкость(Мп.- 64.Mp (112°C). если концентрация паров в воздухе составляет порядка 0,01 мг / л, происходит сильное слезотечение. Структурные параметры молекулы имеют следующие значения: d (CCI) » 1.73. д (СП) «1.59,» д » (нет)» 1.19 А. zTClCCl » = 112э, ZONO-132e. Свободное вращение барьер облигаций CN составляет 3 ккал / моль.
170) в лабораторных условиях путем нагревания смеси ацетата натрия и метана каустической соды (Мп.- 184 депутата.-161°C) удобно готовится. Реакция протекает по следующему уравнению: CH3COONa-f NaOH-Na ^ Oj + CH <+ 15 kcal. To чтобы уменьшить коррозию стеклотары, необходимо заменить каустическую соду содовой известью. Баллон » содержащий СН «должен иметь красный цвет и белую надпись»метан».
Растворимость этого газа в воде составляет 4: 100 в объеме при нормальном conditions. By охлаждая насыщенный раствор, можно получить кристаллогидрат CH-6H20. 171) связь C-I в метане имеет длину d (CH) * 1.0-1.094 A, со средней энергией 99 ккал / моль (III $ 5 add.12), есть особенность, что постоянная силы k равна 5,5. для c (HC) предлагается значение 0,3 D.
Потенциал ионизации молекулы СН4 составляет 13,0 вольт. Интересно, что он имеет большое сродство к протонам (124 ккал / моль). Это позволяет ожидать возможности получения соли метония (CH*) из достаточно сильной кислоты, известной только в газовой фазе. 172) метан является основой атмосферы тяжелых планет (Юпитера, Сатурна).
Его следы(0.00014 об.%) Всегда находится в атмосфере Земли. Интересно, что высокое содержание метана в воздухе, по-видимому, привлекает комаров. 173) большое количество метана(часто более 90%) содержит большое количество природного газа, накопленного в подземных пустотах. Такой газ-очень хорошее топливо. 1 м * дает 8-9 000 ккал в течение combustion. At в то же время они выступают в качестве основного сырья для промышленного производства водорода.
Обычно используемый в этом случае метод основан на неполном окислении метана по формуле 2CH < + Oj = 2CO + — f 17 ккал. Затем полученный газ вторично обрабатывают паром(69). В СССР известны многие месторождения богатого метаном природного газа (Саратов, Ставрополь, Бухара и др.).Благодаря высокой теплотворной способности и удобству транспортировки(по трубопроводам) такой газ ежегодно занимает все более важное место в топливном балансе страны в целом. В 1972 году в СССР было добыто 22,1 млрд мг газа(в 1940 году-34 млрд, в 1913-0.017 млрд м3).
174) сгорание смеси метана (и других горючих газов) и воздуха происходит только тогда, когда процентное содержание СМСК не превышает определенного определенного значения boundary. So, предел горючести (процент горючих газов по объему) составляет 5-15 в СН, 12-74 в СО и 4-75 В Н*.Эти данные относятся к нормальному давлению и носят ориентировочный характер, поскольку помимо давления пределы горючести зависят и от других условий.
Локальное нагревание смеси, которая имеет подходящий состав для воспламенения, позволяет горению распространяться почти мгновенно по всему телу, в результате чего образуется explosion. As горючим веществом такой взрывчатой смеси с воздухом могут оказаться не только пары, но и пыль различных горючих веществ (уголь, мука, сахар и др.).Это может быть связано с случайные взрывы на элеваторах, сахарных заводах и т. д.
175) зависимость скорости горения газовых смесей от внешних условий обычно имеет достаточно сложное внутреннее давление ratio. As на примере рисунка X-22 показана кривая такой зависимости системы 2H2 + Oa. Общая природа такой кривой обусловлена цепным характером общего процесса взрыва и, в частности, реакцией задачи (см. VII§ 2, доп. 19).Есть обзорная статья * по этому вопросу. 176) для воспламенения газовой смеси необходимо нагреть смесь не менее чем в 1 месте до определенной минимальной температуры (называемой температурой воспламенения).
Последнее зависит не только от характера реагирующих газов, соотношения и давления смеси, но и от способа воспламенения и др. conditions. So он меняется не в константе, а в пределах определенного limits. So, смесь метана и воздуха обычно воспламеняется при давлении 650-750, окиси углерода 610-660, водорода и 510-590°С. 177) само существование определенной температуры воспламенения тесно связано с энергией активации соответствующей реакции (IV§ 2, 10).
В общем случае компоненты газовой смеси, которые химически реагируют при определенной температуре, реагируют друг с другом при низкой температуре, что соответствует появлению пламени. То есть быстро прогрессирующая реакция с выделением тепла и света. Однако взаимодействие в подобных условиях происходит только между индивидами Семеновн. Успехи химии, 1967, I » 1.3. U50500550600°С Рисунок Х-22.
Влияние внешних условий и доля редких 2Hj + 02-2H30. После полудня. см, о. Сто- Она является достаточно активной молекулой и поэтому отдает лишь относительно небольшое количество тепла и быстро рассеивается за счет теплопроводности, излучения и т. д При повышении температуры в месте нагрева количество активных молекул вблизи него увеличивается, и соответственно увеличивается тепловыделение в результате их взаимодействия.
При определенных температурных режимах (соответствующих температуре воспламенения) вблизи места нагрева возникает ситуация, когда выделяется больше тепла, чем рассеивается за единицу времени. Это нагревает до температуры воспламенения соседней части системы, от которой массовая активация молекулы распространяется на другие части в виде well.
As в результате скорость процесса резко возрастает по всему реакционному пространству. 178) характер горения в конкретной системе определяется ее внутренней структурой. Если компоненты системы достаточно перемешать друг с другом, пламя быстро распространится по всему объему, что приведет к взрыву.
Если же, наоборот, реакционные газы смешиваются только в момент реакции (как в обычной горелке), то горение протекает только в точке соприкосновения, в результате чего образуется нежное пламя. Горение жидкостей и твердых тел обычно протекает мягко, так как они могут происходить только на плоскости соприкосновения с air. In помимо температуры воспламенения (определяемой началом горения всей поверхности), воспламеняемость жидкостей часто характеризуется точками воспламенения.
Последнее относится к минимальной температуре жидкости, при которой пламя вызывает взрыв ее паров (но не загорается).Например, согласно стандарту, температура вспышки коммерческих сортов керосина не должна быть ниже 28°С. воспламенение керосина происходит примерно при 300°С. 179) графически проиллюстрированный электрод печи Х-23 для производства Сас представляет собой толстый графитовый слой (а), заполняющий ее дно, и большое количество угольного блока (5), падающего сверху.
Корочка из исходной смеси хранится у стенок рабочей печи и кипит при выпуске расплавленного карбида в скважину В. производство каждой тонны Сас2 требует затрат 3000 кВт * ч. Ежегодное производство в мире составляет около 500 млн. г. 180) карбид представляет собой твердое вещество, в чистом виде, является хорошим кристаллическим материалом. Они являются нелетучими и нерастворимыми в любом из известных solvents.
In в связи с этим истинная молекулярная масса карбидов неизвестна и должна удовлетворяться простейшей формулой. Последние, в одних случаях, соответствуют обычной валентности углерода и металлов, которые с ним связываются, а в других, сами по себе указывают на сложность молекулярной структуры углерода. carbides. In это обстоятельство, а также ряд свойств (по большей части устойчивость при нагревании и др.), карбиды очень похожи на нитриды. Существует монография по карбиду*.
181) по отношению к воде и разбавленным кислотам карбиды подразделяются на 2 большие группы. Эти вещества как разлагаются, так и не разлагаются. Карбиды первой группы можно далее подразделить на а) ацетилен, б) метан, в) смеси различных продуктов в зависимости от химических свойств летучих продуктов их разложения. Первый тип карбида следует считать продуктом замещения ацетилена водородом.
Они образованы в основном наиболее активными металлами. Общая формула карбидов этой группы йода представляет собой одновалентный металл, МК- Рига Х-23. Иллюстрация электрической печи для производства Кака. * Косолапова Т. Я. Карбиды. Москва, металлургия, 1968.299 С. В случае двухвалентногом2св-трехвалентного. Ядерное расстояние карбида кальция rf (CC) (рисунок X-5) составляет 1.20 A.
Аналогично, карбиды 2-го типа должны рассматриваться как продукт, в котором металл замещен метановым водородом. Они известны только о бериллиевом n-алюминии, и в обоих случаях простейшие формулы (Be2C и AI4C3) соответствуют нормальной валентности элемента. Под действием горячей воды или разбавленной кислоты оба карбида разлагаются с выделением чистого метана, например, по схеме: ACS * + + 12HaO » 4A1 (OH + ZCH4. Примером 3-го типа карбидов, образующих при разложении смесь различных продуктов, является MnCC, который в основном реагирует с водой по следующей формуле: MncC-f 6HjO 3Mn (OH) 2 + CH + + H2 в то же время образуются и другие газообразные углеводороды.
182) карбиды, которые не могут быть разложены разбавленными кислотами, обычно очень устойчивы по отношению к другим химическим воздействиям и нагреванию. Однако все они могут быть разрушены слиянием со щелочью при воздействии воздуха(например, реакцией; 2WC-f 8NaOH + 50 * = 2Na2W04 + 2NajC0j + 4H20).Некоторые карбиды этой группы хорошо проводят электрический ток. Среди производных металлов, которые уже были рассмотрены, Mn ^ C *включен. МП » С MP7S3. ТКС, CrzC2. SG7C3, Cr2jCe, MoC, MOfC, WC, WgC, VC, NbC, NbaC, TaC, Ta2C. многие соединения этого типа являются наиболее тугоплавкими из всех известных substances. As пример, WC (mp 2600°C с decomp.
Существуют: (2700), W2C (2800), VC (2800), NbC (3500) и TaC (3900°C).Сплавы на основе карбида хрома обладают высокой устойчивостью к коррозии и износу. Цементированные карбиды никеля, называемые ламентами, используются в качестве цементированных карбидов, а карбиды Nb и Ta используются в ракетах. 183) как и в случае синильной кислоты, в случае ацетилена(mp.-84.Mp.-81°C, под давлением) таутомерность возможна за счет образования 2 форм: Н—С»С-Н(ацетилен) nHrC» c (Изоацетилен).в нормальном состоянии равновесие смещается почти полностью в сторону стандартной формы, а при нагревании оно явно находится в равновесии. Критическая температура ацетилена составляет+35 * С.
1J4) связь C-H молекулы ацетилена имеет длину d (CH)* 1,06 а и постоянную силу k = 6,0, а связь C * C-длину d (CC)= 1,21 а, энергию 194 ккал / моль, постоянную 15,7. для ацетилена (NS) рекомендуется значение 0,6 D. Потенциал ионизации молекулы ацетилена составляет 11,4 вольт. 185) образование ацетиленовых ns-элементов происходит только при температуре более 2000°С и сопровождается поглощением тепла (54 ккал / моль).Ацетилен сильно эндотермическая смесь, поэтому он может разложить когда он explodes.
In в газообразном состоянии такое разложение не происходит при нормальных условиях, но при высоком давлении, особенно в твердом состоянии жидкости, оно возникает от самых незначительных воздействий(вибрация и др.).Растворимость ацетилена в воде(1: 1 по объему при нормальных условиях) значительно ниже, чем в различных органических растворителях. При охлаждении насыщенного водного раствора получают кристаллогидраты C2H2•6HA.
186) ацетиленовый водород обладает очень слабокислым свойством (X,= 10 «14).Обычно известны взрывчатые металлы (ацетилнды).Относительно стабильная бесцветная натриевая соль-среда (NajC2) и кислота (NaHCi) — путем воздействия ацетиленом на раствор NaNHj в жидком аммиаке, [CfCH! Сложные соединения, которые не содержат ]также являются known. In внутренняя сфера. Примерами являются розовый K2 (Mn (C2H) 41 и оранжевый Kz (Cr (C2H) c).
Оба очень нестабильны. Интересно, что ближайший ацетиленовый гомолог-метилацетилен (CH»C» CH) — заменяет все 4 атома водорода литием. 187) в молекулах d и a цепь a-HC»C-C ^ CH-длина связи C-C в середине равна 1,38 а, а длина связи CgC остается неизменной по сравнению с ацетиленом. Ситуация здесь точно такая же, как и в случае с cyiaia (дополнительные 120).Дассетилен Это бесцветный газ(Мп.-35, Мп.- f-10 ^ 0).Легко полимеризуется.
Триацетилены также известны-NS » C-C * C-HSS. 188) при дальнейшей полимеризации ацетилена можно получить полиацетилен (Paul Inn), молекула которого состоит из цепи олова H (- CbC-C «C -)» H. правильно чередующееся наличие множества простых связей между атомами называется системой с сопряженными связями-образованием такого рода валентностей. Собственн-электронов, попадая в них всегда более или менее делокализован. То есть в большем диапазоне вы не можете переключиться на простые смежные соединения.
Поскольку углеводородные цепи, образующие твердый полиацетилен, находятся в контакте на всем протяжении, можно не только переносить π-электроны вдоль них, но и обмениваться этими электронами между цепями. Такой обмен связан с преодолением энергетического барьера, величина которого относительно невелика (и характерна для органических полимеров).Это связано с полупроводниковыми свойствами полиацетилия, который можно считать простейшим представителем органических полупроводников.
Ширина запрещенной зоны составляет 0,4 эВ. 189) для самостоятельной сварки и резки металла используют специальные горелки с 3 трубками, вставленными друг в друга. Ацетилен поступает из центральной трубки, а кислород поступает с обоих концов. Кислород возникает из баллонов, содержащих его, ацетилен nln получают при работе, iln отделяют от раствора в ацетоне. При давлении от 1 до 12 объем ацетона растворяется в 300 с} НГ объема, при нормальном давлении-только в 25.
Поэтому, когда вы открываете клапан с цилиндром с раствором, ток QHj высвобождается. Контейнер с ним белый, с надписью «ацетилен», надпись Красная. 190) твердые частицы углерода, образующиеся при неполном сгорании CjH2, очень горячие, поэтому они вызывают яркое свечение пламени, что дает возможность использовать ацетилен для освещения. Используя специальные горелки с усиленным воздушным потоком, можно одновременно добиться яркого свечения и отсутствия такового.
Частицы углерода которые светят очень много во внутренней области пламени сгорят полностью во внешней area. In в отличие от ацетилена, газы (такие как H2), которые не образуются при сгорании твердых частиц, почти не производят flame. In в пламени обычно используемых горючих веществ (соединений от С и Н до некоторых о) твердые частицы могут образовываться из-за неполного сгорания только углерода, поэтому чем больше дыма газового пламени к парам жидкости, тем выше относительное содержание молекулы, тем меньше кислорода и водорода.
Например, спирт (CjHjOH) горит бездымным пламенем, а скипидар (CioHte) сильно коптится. Яркость пламени также зависит от степени накаливания этих твердых частиц, то есть от температуры, которая возникает при горении.
Смотрите также:
| Подгруппа мышьяка | Органические соединения |
| Подгруппа ванадия | Круговорот углерода |
