Оглавление:




















Кремний
- Кремний самый близкий аналог углерода, кремний является 3-м элементом по обилию(за ним следуют кислород и водород).на его долю приходится 16,7% от общего числа атомов в земной коре. Если углерод можно считать главным элементом всей органической жизни, то основную часть его массы составляют силикатные породы, поэтому кремний играет аналогичную роль по отношению к твердому телу crust.
- It обычно представляет собой смесь различных соединений кремния и кислорода и многих других элементов. Свободный кремнезем (5Syr) также очень распространен, в основном в виде обычного песка. Природный SiO2 является сырьем для всех других кремний compounds. In элементарное состояние, оно получен путем уменьшение SiC 2 в условиях высоких температур С магнием. Для удаления MGO и избытка SiO2 продукты реакции непрерывно обрабатывают соляной кислотой и плавиковой кислотой.
Реакция начинается при воспламенении смеси тонкоизмельченных веществ и протекает по схеме. Si02 + 2Mg = 2MgO-f Si-f 70 ккал Людмила Фирмаль
Свойства кремния сильно зависят от размера его частиц. Аморфный кремний, который получают восстановлением SiO2 магнием, имеет коричневый цвет powder. By повторно устанавливая из какого-нибудь расплавленного металла(например, Zn), можно получить кремний в виде серого, твердого, довольно хрупкого кристалла с плотностью 2,3 г / sr3.Кремний плавится при температуре 1410 и кипит при температуре 2620 ° C. Кристаллический кремний является химически достаточно инертным веществом, но аморфным является гораздо больше reactive.
It реагирует с кислородом, хлором, бромом, серой и уже с фтором при нормальных условиях-около 500°С при очень высоких температурах кремний может сочетаться с азотом и углеродом. Растворим во многих расплавленных металлах, некоторые из них (Zn, A1, Sn, Pb, Au, Ag и др.) не взаимодействуют химически и образуют другие металлы (Mg, Ca, Cu, Fe, Pt, Bi и др.), соединения, называемые силицидами (например, Mg2Si) −12%. В нормальных условиях кислота не действует на кремний (за исключением смеси HF-f-HNO).Щелочь с развитием водорода превращает его в соль кремниевой кислоты (H2SiOa). Si + 2NaOH +Н20 = Na2Si03 +2Н2
Такая реакция протекает даже со слабыми щелочами.13 ″ 15 Наиболее характерным и стабильным соединением кремния является его диоксид (oi02), причем образование из элемента происходит с очень большим тепловыделением. Si 4-02 = Si02-f 218 ккал Диоксид кремния представляет собой бесцветное, высоко тугоплавкое слоистое вещество. Свободный диоксид кремния (кремнезем, кремнезем) встречается в основном в виде кварцевых минералов.
Кварц, загрязненный примесями-обычным песком-является 1 из основных продуктов разрушения горных пород, и в то же время-1 из важнейших строительных материалов, а годовой расход в мире достигает нескольких сотен миллионов тонн. Свободный кремнезем составляет около 12%*от массы всего crust. In различные породы, значительно большее количество SiO2 (около 43% массы земной коры) химически связаны.
Поэтому, в целом, земная кора более чем наполовину состоит из диоксида кремния. Si02 практически нерастворим в воде. Кислота на него не действует, за исключением HF, который реагирует по схеме Si02 + 4HF = SiF» — f 2H20 При следующей реакции щелочи постепенно переносят SiO2 в раствор, образуя соответствующие силикаты (называемые силикатами или силикатами). Si02 + 2NaOH = Na2Si03 +Н20 Очень мелкодисперсный диоксид кремния растворяется, как только его кипятят в щелочном растворе, но обычно реакцию, в результате которой образуется силикат, проводят бюх и щелочь или щелочь.
CO2 выделяется при высоких температурах по соответствующей карбонатной, например, схеме: Si02 + Na2C03 NaSiOj H-CO2 В результате реакция будет уменьшаться вплоть до выделения угольной кислоты кремниевой кислотой. Как правило, силикаты бесцветны, тугоплавки и практически нерастворимы в воде. Среди немногих растворимых — Кагбюз. Эту соль часто называют «растворимым стеклом», а ее водный раствор — «жидким стеклом».3 * 40 Кремниевая кислота настолько слаба, что»жидкое стекло» в результате гидролиза реагирует резко щелочно, а силикаты слабых оснований почти полностью гидролизуются в растворе.
По этой же причине кремниевая кислота выделяется из раствора своих солей многими другими кислотами, в том числе и угольной. Если в растворе углекислота выделяет кремниевую кислоту из своих солей, то при ее сиянии/как уже было сказано выше, происходит обратное высвобождение. 1-е направление связано с низкой прочностью (степенью диссоциации) кремниевой кислоты, а 2-е-с низкой летучестью при нагревании.
Поскольку многие кислоты со сравнительной летучестью могут отличаться от многих кислот с одинаковой прочностью, направление реакции осаждения в растворе, с одной стороны, и направление реакции осаждения в лампе накаливания, с другой, также может быть различным, что видно, по крайней мере, из схемных примеров.: Разделение в растворе НС1 H2S04 H3P04 H2Si03- Сияющий разряд Свободная кремниевая кислота практически нерастворима в воде (в виде истинного раствора).
Однако из-за легкого образования коллоидных растворов он обычно осаждается лишь частично. Осадок имеет вид бесцветного студня, состав которого не соответствует простой формуле Ng3Su3 или H4SiO*, но более распространенные-nSi02-mH20 n и m, значения которых зависят от условий осаждения. величина N Z> 1 соответствует множеству поликремниевых кислот, производными которых можно считать многие минералы с точки зрения химического состава. Силикат известен как гидрат с различными значениями ямы.
Продукт, который полностью или частично заменил их водород на 1 или другой металл, является так называемым простым silicate. An примером может служить минеральный асбест(Mg3H Si6Ol6 или K20•A1203 * 6S 02 неполный Na2Al2Si60J6 «Na20•A1203•6Si02 ашитовый камень Caalysi208» CaO * Л1203 * 2Si02 Их можно назвать главными представителями. В основном под комбинированным действием воды и углекислого газа, природных силикатов, алюмосиликатов и других различных природных факторов Водорастворимые продукты транспортируются водой в море, а нерастворимые продукты частично осаждаются на месте, частично погружаются в русло реки и транспортируются в море.
Основными нерастворимыми продуктами разложения алюмосиликатов, которые наиболее распространены в природе, являются кварц (Si02), который осаждается в виде песка, и каолин (H4ali2oe или Al203-2Si02-2H20), являющийся основой обыкновенной глины (окрашенной в коричневый цвет с примесями оксида железа).Иногда залежи белой глины образуются в чистом виде.
Процесс выветривания алюмосиликата может быть представлен следующей принципиальной схемой. К2А!2Si60. 6 + 2H20 + CO2 = K2C03 + H о-од * О, мм рисунок х-48.Схема почвообразования. Из химических свойств Галогенида кремния наиболее характерным является интенсивное взаимодействие с водой по схеме. Sir4 + 2H20 Si02 + 4NG Для C1, Br и I равновесие смещается почти полностью вправо, тогда как для F реакция является удивительно обратимой. Из-за образования твердых частиц Si02 при гидролизе(точнее, rtSi02-mH20) пара галогенированного кремния дымится влажным воздухом 71 — * 7
При взаимодействии плавиковой кислоты с SiFi образуется композитная плавиковая кислота (иначе плавиковая кислота). 2HF + SiF4 = H2 [SiF6] Безводный H2SiFe не делает exist. In напротив, в водном растворе это стабильная и сильная двухосновная кислота. Большинство его солей (силициды или фторсиликаты) бесцветны и очень хорошо растворимы в воде. Из производных обычных металлов наиболее плохо растворимы соли калия и особенно бария 8 * −92
Водородное соединение кремния (кремний, или Силан) получают в смеси серы и водорода, под действием разбавленного HCl до силицида магния (MgsSi).Кремний водородный (SiH*, Si2He и др., вплоть до SieHie, последний известный термин) сходен по составу и структурной формуле с серией метановых углеводородов. Наблюдается большое сходство в плане физических свойств. Как и углеводороды, силаны бесцветны, и первый член конгениальной цепи является газом при нормальных условиях, а следующий-жидкостью.
Напротив, общими химическими свойствами соединений обоих классов являются different. In в отличие от инертных углеводородов, силаны высокоэффективны. reactive. In в частности, он легко воспламеняется на воздухе, сгорает до SiO2 и воды, а горение сопровождается очень большим выделением тепла(341 ккал / моль SiHO..93 ″ 1 * Добавь 1)в 1823, свободный кремний был сперва obtained. It состоит из 3 природных элементов. Изотопы — » Si (92,2%).«, Si (4.7) и 0Si (3.1).
Его практический атомный вес задается с точностью±0,001. 2) в основном состоянии атом кремния имеет структуру внешней электронной оболочки 3s23p *и является двухвалентным. Ближайшее состояние квадранта(3 ^ 3 /?Возбуждение до ( * ) требует затрат 95 ккал / г атомов. То есть он требует примерно такой же энергии, как и в случае с углеродом(VI§ 3 add. ВТОРОЙ.)Энергия непрерывной ионизации этого атома составляет 8.15. 16.34; 33.46 и 45.13 эВ. Его сродство к 1 электрону оценивается в 34 ккал / г атомов.
3) небольшое количество кремния присутствует почти во всех полостях человеческого тела, а легкие являются самыми богатыми (0,65 мг / г сухих тканей) * относительно много кремния содержится в волосах и ногтях. Имеются признаки избыточного * точного накопления за счет раковых опухолей(при этом их содержание в моче уменьшается). * Шварц Р.. Достижения в области химии. 1957, м. 8.923. * * Маву Ялов, Л. А.. К ыйкосск и фт Г. И. Физическая химия и химия кремния. М..«Пока» делится школа.«1966 год. 311 s * K подсчитывает » G, B, химия ставит нагрузку на физический вес людей. М.、 Шакира, 1966.463 секунд*
4) для получения большого количества элементарного кремния обычно используют реакцию, которую проводят в электропечи по формуле: SiOj + 2C = 2CO + Si(продукт получается выше 99% чистоты).Такой кремний может быть использован для отделения свободных металлов от оксидов(то есть s и l и cotermi).Взаимодействие тетрахлорида кремния и паров цинка при температуре около 1000 ° С (реакция: SiCl4 + 2Zn-2ZnClj + Si), а далее чистый S1 получают термическим разложением на элементы SiH4 при температурах выше 780 ° С. 5) кремний часто получают в виде сплава (ферросилиция) с железом, смесь SiOj сильно блестит. Железная руда и уголь.
Поэтому сплавы, содержащие до 20% Si, могут производиться как в доменных печах, так и в электропечах с более высокой скоростью. Ферросилиций, даже с содержанием 15% Si, используется непосредственно в производстве кислотоупорных изделий, так как все обычные кислоты, кроме соляной кислоты, не действуют на металл, а 50% Si-HCI перестает действовать.
Наиболее важным применением ферросилиция является металлургия, которая используется для введения кремния в различные марки специальной стали и чугуна. в) в кристаллическом состоянии кремний хорошо передает тепло. Его электропроводность составляет от 0,007 (обычно) до 0,000001 (очень чистая) от электропроводности ртути и уменьшается при нагревании (характерно для металлов), но increases. At в то же время давление возросло до 12 миллионов. Кремний, в свою очередь, приобретает свойства металла. Теплота плавления кремния равна II, а теплота распыления-108 ккал / г атомов. Плавление сопровождается увеличением плотности (около 9%).
Кремний в этом отношении подобен льду. Проводимость кремния резко возрастает(в 20 раз) при плавлении. 7) кремний кристаллизуется как алмаз[tf (SiSi)= 2.35 A. электронная плотность в середине связи равна 0.25 e / A1].Его Монокристалл получают путем выращивания в вакууме из расплава (путем медленного вытягивания семян в контакте с поверхностью жидкости). таким образом, удалось вырастить Монокристалл диаметром 2,5 см и длиной 24 см. Очень чистый Монокристалл кремния, содержащий правильно подобранную добавку (III§ 8 postscript
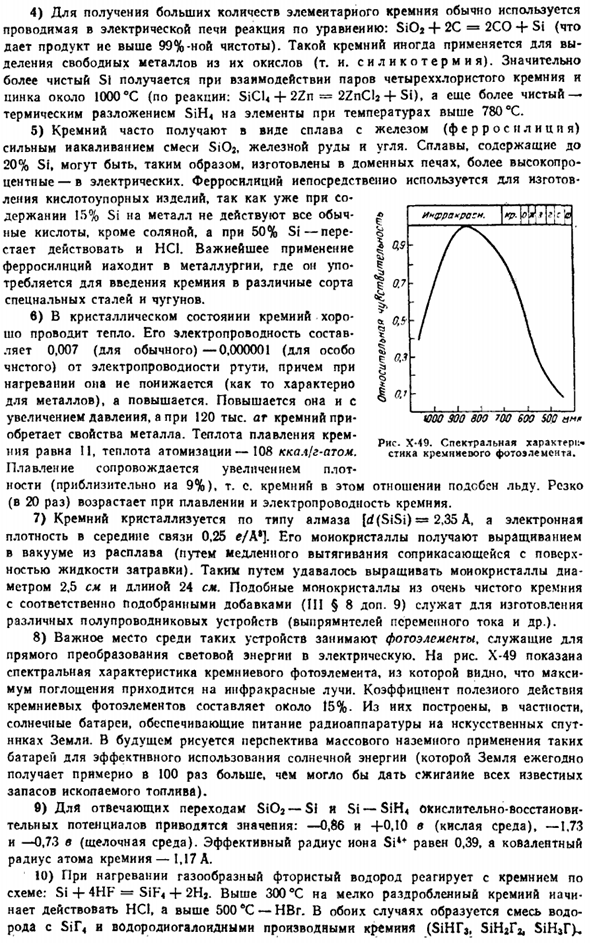
9), помогает в производстве различных полупроводниковых приборов(таких как выпрямители переменного тока). 8) важное место среди таких устройств занимают фотоэлементы, которые служат для непосредственного преобразования световой энергии в электрическую. На рисунке X-49 показаны спектральные характеристики кремниевого фотоэлемента, и мы видим, что максимальное поглощение происходит за счет инфракрасного излучения.
Эффективность кремниевых фотоэлементов составляет около 15%.Из них, в частности, построены солнечные батареи, обеспечивающие энергией радиооборудование и искусственную Землю satellites. In в будущем для эффективного использования солнечной энергии существует перспектива использования такой батареи в больших количествах на Земле (Земля получает примерно в 100 раз больше в год, чем сжигает все известные запасы ископаемого топлива). 9) значения окислительно-восстановительных потенциалов, соответствующих переходам SiOa — SI и Si— SiH4, составляют −0,86 и+0,10 в (кислотная среда), −1,75 и −0,73 в (щелочная среда).
Эффективный радиус Иона Si4 *равен 0,39.Радиус ко-рецептора атома крем составляет 1,17 А. 10) при нагревании газообразный фтористый водород реагирует с кремнием по следующей схеме: Si 4-4HF = SiF <-f2Ha. Когда он превышает 300°C, HCl начинает действовать на мелкодисперсный крем, а когда он превышает 500°C, HBr. In в обоих случаях смесь водорода и Sir и производное Галогенида водорода крема (SiHIj. SiHaf * SiHar>образуется. UOO 900600 ′ 00600 $ 00 Рисунок X-49.
Спектральные свойства кремнистых фотоэлементов. 11) как и в случае карбида, для силицида известны только самые простые формулы. Иногда они образуют нормальные валентности металлов и кремния (Mg * Si, Mn3Si, MnSi. In в большинстве случаев валентная связь остается неясной(Mn3Si, Mn $ Si$, MnSi3, Re3Si, ReSi3, Cr и др.).MoSij, WsSi,.W3Si3,WSi3, В, Си. V3Si, VSi3, Nb3Si, NbsSi * NbSi2.Та3си, Та3си3.TaSi3). 12) как правило, силициды характеризуются высокой твердостью и термостойкостью(например, Mg2Si плавится при 1285).(MnSi-1270, TaSij-2200°C).
Многие наночастицы очень устойчивы к окислению при высоких температурах (например, ReSi3-до 1600.MoSij-до 1800°С).Молибденовый яд используется в качестве защитного покрытия для молибденовых изделий. Некоторые силициды (ReSi3, CrSi3 и др.) могут быть использованы в качестве высокотемпературных полупроводников. Только силициды наиболее активных металлов(в частности, Li3S>, CaSi, CaSi3,MgjSi) расщепляются водой и разбавленной кислотой, а большинство других очень устойчивы к реагентам этн.
Напротив, многие силициды являются щелочными (Особенно если содержание Си высоко) очень облегченно ’1 w разложение. есть что-то особенное в snlncidami — Ст-О-си-о — си-о-Иограф• 000 возможность взаимодействия с кремнием 1 I I I ООО даже вода, содержащая только следовые количества щелочи、 * Меня привлекло стекло. Полученная соль очень Рисунок X-так. Структурная схема слабой кремниевой кислоты в разбавленном растворе кремнезема. Почти полностью гидролизованный, концентрированный, Ионы OH не уменьшаются, даже если реакция прогрессирует Такое случается.
Таким образом, рассматриваемый процесс фактически ограничивается разложением воды кремнием, а щелочь, присутствующая в следовых количествах, играет роль catalyst. To чтобы получить 1 * 3 водорода таким способом, нужно всего 0,63 кг кремния. Например, вам нужно 2,5 кг железа(кроме того, еще большее количество кислоты необходимо для реакции). 14) высоко химически активный элемент кремний получают, воздействуя на суспензии casi3 в CC1 при 30°C (не избыточном) хлоре. Такой кремний бурно реагирует не только с водой, но и с CH3OH. 15) как и в случае с кремнием, многие силициды, особенно силициды железа, вступают в реакцию со щелочью.
Высокая концентрация порошка ферросилиция и сухой смеси Ca (OH) 3 и NaOH особенно подходит для быстрого производства водорода в полевых условиях. При воспламенении H3 начинает сильно выделяться и тлеть в соответствии со следующим scheme. Si+ Ca (OH) 3 4-2NaOH = Na3Si03 + CaO 4-2H3.Эта смесь технически называется гидрогеин. 16) каждый атом кремния в Кристалле SiOa является тетраэдром, окруженным 4 атомами кислорода [</(SiO)= 1,61 A], и каждый атом кислорода является неотъемлемой частью 2 тетраэдров одновременно. На фиг. 1 показан вид в плане такой полимерной структуры. Х-50.
17) основной природной формой диоксида кремния является минеральный кварц (плотность 2,65 г! См*, показатель преломления 1,55).Минеральные переходные процессы и кристобалит, которые имеют несколько иную кристаллическую структуру и более низкую плотность (2.3), встречаются реже. Когда кварц сначала нагревается медленно (573 ° C), происходит постоянное изменение его собственной кристаллической структуры(кварц — * — p кварц).После этого ОИ последовательно переходит в другие 2 формы, и только после этого тает. 867 1470 1723 кварц — * — тринидимит-кристобалит-жидкость Si03 Самсонов Г. С. силицид для использования в технике. СВУ-в Академии наук в Киеве, Украинская ССР. 1050.204 секунд
Быстрый нагрев позволяет кварцу плавиться при температуре 1610 ° C. И в тридиминтовом крнстобалите 1680°C происходят изменения при низких температурах (менее 272°C), а в трндимите также 8 таких изменений(все менее 475°C). Что касается температуры кипения Si02, то приведено значение 2590°C(но в глубоком вакууме кремнезем испаряется уже за пределами 1200 ° C).Пары диоксида кремния сильно диссоциируют по схеме: SiOa SiO +O. энергия такой диссоциации оценивается в 112 ккал / моль.
18) при высоком давлении происходит дальнейшее кристаллическое превращение 2 SIOS -косита(плотность 2,9 г / см3, показатель преломления 1,60) и стишовита(плотность 4,3 г / см3.Показатель преломления 1,80).Благодаря внутренней структуре кристаллов, косит отличается от кварца взаимным расположением сопряженных друг с другом тетраэдров СИОА. То есть сохраняется тетраэдрическая конфигурация атомов кислорода, характерная для кремния.
Наоборот, в стншовнт Октаэдрическая координация его атомов довольно необычна для соединения оксигената кремния, но это происходит(рисунок X-5I).В зависимости от твердости рассматриваемая форма Si () 2 расположена в порядке стишовита>xhite>кварца. Зона стабильности основного участка составляет более 20 атмосфер, стншовнта-более 100 атмосфер. При нормальном давлении стишовит поступает в кварц при 400 Тл, а при 1200°С-в косит.
19) кристаллы кварца иногда встречаются в огромных размерах(самый большой вес-около 70 г, обнаружен в Казахстане в 1958 году).Они вращают плоскость поляризации света, могут быть правосторонние и левосторонние образцы. Оба имеют различную форму как зеркальных изображений, так и объектов (рис. X-52).Такая кристаллическая метаморфоза называется р р ф Н И М и о е и А и т и о м. Частота, Гц Рисунок JC-53. Звунопач Бо -: иипим \ л’иибо: РБ люди.
20) некоторые минералогические типы кварца имеют особое название. Например, его крупные прозрачные кристаллы часто называют горными кристаллами, а фиолетовый вариант-аметистом. Микрокристаллическая модификация кремнезема (включая примеси других веществ) включает мену и яшму. 21) кварц используется в различных технических областях, и его крупные кристаллы часто выращиваются artificially.
In в частности, он является общим исходным материалом в конструкции устройства для получения ультразвука. Применимость кварца в этой области основана на пьезоэлектрических свойствах (add 2 90)-особой связи между пластинами, вырезанными из кристалла, и высокоскоростным электрическим полем: под его действием пластины начинают периодически сжиматься и расширяться с частотой, равной частоте прикладываемого электрического поля.
По этой причине волны, подобные обычным звуковым волнам, но характеризующиеся различными частотами, возбуждаются в среде, окружающей пластину. 22) человеческое ухо воспринимает звуковые волны с частотой от 16 до 2 миллионов Герц (1 частота) в секунду. Низкие частоты (то есть инфразвук) и высокие (то есть ультразвуковые) звуки недоступны для нашего непосредственного восприятия. от rns. X-53 показывает самый слабый звук п 、、. Ф 7; в Я ПСБ В \ » О Рисунок. >- 5! Шмц граф?- D HH.1УХИИ кромнля Н стихонги. Рисунок Х-5.В левый и правый Кристалл. Он распознается в области около 3000 Гц. Звук выше известной силы воспринимается как таковой, но он вызывает боль.
Нормальный звуковой интервал человеческой речи составляет от 120 Гц до 400 Гц и используется в музыке — от 50 Гц до 8000 Гц. Самая низкая частота пения составляет 80 Гц, а самая высокая-1300 Гц. Акустическая мощность обычно оценивается по шкале децибел (дБ).На шкале децибел нулевая отметка соответствует самому слабому звуку, который обычно воспринимается ухом.
Следующая средняя оценка (дБ) показывает концепцию этой шкалы (с логарифмическими свойствами).Нормальное дыхание(10).Шепот (25), разговорная речь (60), среднее уличное движение (70), поезд метро (95), реактивный самолет на высоте 150 м(115), порог болевой чувствительности человека(125).Шум городского дома оценивается в 30 г 55 дБ. Считается, что постоянный шум на уровнях выше 85 дБ может привести к частичной потере слуха.
23) некоторые животные только кажутся «смехотворными», потому что интервалы частоты звуков, которые они используют, находятся за пределами человеческого слуха. Например, установлено, что рыбы энергично говорят друг с другом, а отдельным индейцам соответствуют разные диалекты. Эти «рыбьи разговоры» могут происходить на больших расстояниях, потому что вода поглощает мало звука, а скорость его распространения в ней высока (около 1500 м / с).
Максимальная интенсивность звука, испускаемого дельфином, составляет 20-60 ГГц, но диапазон восприятия значительно шире(18 Гц-f-280 кГц).Ориентация летучих мышей в полете основана на восприятии ультразвукового излучения и отражений от окружающих объектов. Излучается до 3 звуковых импульсов с самыми сильными частотами в диапазоне от 7 миллионов до 60 Гц в секунду. Помогите ночным бабочкам убежать от летучих мышей, захватив эти звуковые побуждения.
Интересно, что хотя и можно озвучить сигнал, который слышит собака (она воспринимает звук до 10 тыс. Гц), он не слышится человеком. 24) в настоящее время можно возбуждать ультразвук с частотой около десятков миллиардов Герц. Скорость распространения звука в воздухе при нормальных условиях (o = 2QVr м / с, где T-абсолютная температура) составляет около 340 м / ССК, поэтому длина такого ультразвука не совпадает с длиной волны видимого света.
Подобно последнему, вы можете использовать отражатель для сбора ультразвука и направлять его на определенный объект. Энергия звуковых колебаний возрастает пропорционально мощности 2 частоты. Уже есть оборудование, способное создавать ультразвуковую мощность более 100 кВт! ЦМГ. 25) короткий ультразвук обладает многими интересными свойствами. Они разрушают много сложных молекул и убивают маленьких fish.
It стимулирует прорастание семян, получает устойчивую эмульсию, вызывая некоторые химические реакции. Основной причиной всех этих эффектов являются резкие локальные колебания давления и температуры. Это связано с быстрым временным появлением и исчезновением среды, подверженной воздействию пустот («кавитации») и ультразвука. С помощью ультразвука можно легко и удобно контролировать однородность толстых металлических блоков, выполнять различные обработки самых твердых материалов (вплоть до алмазов), припаивать твердые металлы (например, алюминий), мыть шерсть, создавать эхолоты, измерять глубину моря и обнаруживать гидролокаторы. трудно найти область техники, которая не может быть использована.
Свои медицинские применения очень promising. An также был разработан ультразвуковой микроскоп. Это позволяет получить изображение объекта в непрозрачной среде, увеличив его до тысячи раз. Есть интересное сообщение, что частота 19,5 кГц не переносит крыс, а генератор мощностью всего 35 Вт надежно освобождает от крысы область в 225 МК. 26) изучение инфразвуковых звуков, присутствующих во всех шумах (воздуха, моря, леса, городского движения, работающего мотора и т.) еще хуже.
Из-за небольшой задержки звука, вызванной средой, через которую проходит звук, тем ниже его частота, ультразвук (в отличие от ультразвука) распространяется на огромные расстояния. Например, улавливая инфразвуковой звук, возникающий в результате трения воли о воздух на частоте 8-13 Гц, морские животные могут заранее знать о приближающемся шторме. Электронные устройства, работающие по тому же принципу, уже созданы.
Попытки использовать инфразвук для медицинского «зондирования» человеческого организма также предпринимались successful. At в то же время, оказывается, что инфразвук (особенно в области 6-9 Гц), который увеличивает мощность, оказывает пагубное воздействие на организм. Это связано с наложением резонанса на естественные колебания внутренних органов человека. Частота 7 Гц особенно опасна тем, что она совпадает с частотой а-ритма биологического тока мозга. /
Резонансное наложение инфразвука на собственные колебания материальных объектов может привести к их destruction. So, сообщалось, что при включении звукового генератора частотой 3,5 Гц мощностью 100 Вт стены лаборатории сильно сотрясались, потолок покрывался трещинами, и эксперимент пришлось прекратить. 27) на основе SiO готовится важный огнеупорный материал-Динас. Измельченный кварц выпекают при температуре 1300-1400°С и добавляют к нему 2-2. 5% извести.
Нижний кирпич размягчается примерно на 1700 ° С, что помогает выкладывать своды, особенно в открытом очаге. 28) В дополнение к двуокиси, оксид кремния (SiO) является known. It не встречается в природе, но получается реакцией SiOj-f Si = 2SiO. При нормальном давлении сублимация оксида кремния начинается примерно при 1200 * * C(если сам исходный материал еще фактически не испарился).в паре SiO представляет собой индивидуальное соединение, то есть производное двухвалентного кремния(c = 3.1, потенциал ионизации составляет 11.6 дюймов).
Энергия диссоциации на элементы составляет 191 ккал / моль).Перемещение кремниевого окна в твердое состояние может быть осуществлено только путем быстрого охлаждения газовой фазы («закалки»).В противном случае есть время пройти точку по уравнению 2SiO =»SiOj-±Si. Полученная твердая фаза имеет очень мелкий коричневый цвет powder. It медленно окисляется кислородом воздуха, легко растворяется в щелочах за счет образования силикатов и развития водорода.
Его интересным свойством является легкая электрификация за счет трения, а оксид кремния приобретает сильный отрицательный заряд. 29) кремний с нулевым значением известен в виде его производного днипридонила-Sl (Dipy) j. Это черное твердое вещество используется в SiCl4, dnpnridnla(§ 2 add.52) и получены на основе металлического лития. Производные отрицательного одновалентного кремния известны также в виде черных комплексов С ДНЛ и тетрандов состава Na (Si (Dipy) j)•7THF и Na ^ Si (dpy) a]•7THF. 30) непосредственное соединение этого элемента и кремния (Si3N4) с азотом образуется только при 1300°С и выше, но при значительном нагревании (179 ккал / моль).
Нитрид кремния представляет собой легкий белый порошок, который возгоняется примерно до 1900°C. Он известен для 2 кристаллических форм (d (SiN) — 1.72-1.75 A) и обладает высокой устойчивостью к различным химическим веществам influences. So, расплавленная щелочь растворяется медленно(Si3N4-F схема 12NaOH = 3Na4Si04■+ — 4NH3), раствор NaOH не работает даже при кипячении. Нитрид кремния не реагирует с водяным паром до Ot, H *или 1000°C. высокотемпературная концентрированная плавиковая кислота разлагает его (по схеме: Si3N4-±16HF-2 (NH4) aSiFa + SiF4) только очень медленно, а концентрированная соляная кислота вообще не работает.
Под высоким давлением атмосферы азота, Si3N4 хорошо обжато. ется и (1500°С) спекается. Около 1000°С он приобретает полупроводниковые свойства. Сообщается, что еще один нитрид кремния SijNj был получен в довольно сложном непрямом way. It представляет собой белый N-рентгеновский аморфный порошок, и при нагревании до 1200 * C или более Солнце * преобразуется взаимодействием жидкости с SiCI Аммиаком был получен полимер кремния nmide — [Si (NH) a] n.
известны также соединения композиций Ca (SiN) a и CaSiN, аналогичные цианиду и цианамиду кальция. Это достигается нагреванием силицида кальция в атмосфере азота. 31) путем нагревания Si и SiOa в атмосфере 1450 ° С N * было получено 3D Сианао. Его простейшая формула соответствует структуре 0 (SiN). в его кристалле Атом Si является тетраэдрическим, координированным 1 атомом кислорода и 3 атомами азота с параметрами d (NSi)= 1.71, d (SiO)= 1.62 A и ZSiOSi = 147°. 32) желто-коричневый фосфид кремния получают взаимодействием элементов (700°С и более).
Это игольчатый кристалл с красным металлическим блеском, который соответствует формуле SiP. Черный SiP *также был синтезирован из элементов. SiP и Si разлагаются за пределами 600 ° С есть указания на то, что простейшая химическая формула SiaP-синий фосфор также может быть получен (путем нагревания смеси SiH и РН3 до 450°с).Диффузия паров фосфора в кремний используется для создания полупроводникового слоя р-типа в конструкции солнечных элементов (дополнительные 8).
Кремний-арсенид-SiAs и SiAsa также известны(с другой стороны, сочетаются с сурьмой и висмутом).интересным смешанным производным кремния является соединение популярного типа LiSi3j (здесь E — N, P ill As). 33) нагревание смеси SiOa и угля до 2000°C в электрической печи приведет к образованию карбида кремния (SiC), обычно называемого Карборундом. Реакция протекает по общей формуле: SiOa4-ЗС + 126 ккал = 2co + sic (sic требует затрат около 1 8000 кВт * ч на тонну).
Чистый карборунд представляет собой бесцветный кристалл (разлагается на элементы выше 2200 ° С), а технические изделия обычно окрашиваются примесями темного цвета. Мировое годовое производство карборунда составляет около 10 миллионов тонн, ему посвящена специальная монография. 34) из свойств карборунда его твердость является наиболее важной, уступая только твердости diamond. In в связи с этим карборунд широко используется при переработке твердых materials.
In в частности, кольца на шлифовальном станке обычно изготавливаются из него. Карборунд обладает отличной теплопроводностью и полупроводниковыми свойствами (р-типа) и хранится до 1000°С (в элементном кремнии он уже теряется при 250°С и выше).он также используется в производстве электропечей, для этой цели т. Силикат получают сжиганием при 1500°С (в атмосфере CO или Na) массы, образованной из смеси карборунда, кремния и глицерина.
Силикат обладает механической прочностью, химической стойкостью и отличной проводимостью. 35) с химической стороны карборунд характеризуется безразличием ко всем обычным кислотам (за исключением смесей концентрированных HF и HMO3).Напротив, при сплавлении со щелочью в присутствии воздуха ОИ легко разрушается, в результате чего образуются соли кремниевой кислоты и углекислоты. При температуре выше 800 ° С карборунд начинает значительно окисляться кислородом воздуха, а при температуре выше 1300°С он вступает в реакцию с водяным паром по схеме SiC +2НаО= sioa +СН4.
Хлорирование SiC (при температурах выше 600°C) приводит к образованию SiCl и свободного углерода (§ 1 add.32). 36) Найсий Кристалл (mp 1027°C) состоит из цепи типа I-OSi (Oa) -].Интервал не является натриевым. Каждый атом кремния связан с 2 подходящими атомами кислорода (d(SiO)= 1.57 A,^ OSiO = 119°J, 2 общих числа (SiO)= 1.68 A. ^ OSiO = 10°1, то есть центр тетраэдра искаженного атома кислорода. 37) гидролиз метасиликата натрия протекает с образованием ВИМ-силикатов по схеме: 2Na * SiO * +Н * 0 = Na2Si20 $ — f 2NaOH. In кроме того, обычный 8 раствор гидролизовали при 0,1 н. 14. — 28 и 0,01 И. −32%.Гидролиз диметасиликата уже достаточно слаб. Поэтому в обычном растворе гидролизованная часть составляла 2,4 и 0,1. — 6%.
38) кроме Нитсиоа, растворимое стекло также содержит более сложный силикат натрия. Обычный состав примерно представлен формулой: * Добро пожаловать ежи. С. А. и соавт. Карбид кремния Киев, Гостехмлдат СССР, 1963, 315 с、 NaaO * nSiOi. Где n » = 2 ч-4.Если часть Сиоа постепенно расщепляется, то при длительном хранении часто наблюдаются изменения в жидком стекле(помутнение, иногда полностью студенистые комки).Жидкое стекло следует хранить в контейнере с резиновой пробкой (так как стекло и кортикальный клей сильно прилипают к горлышку).
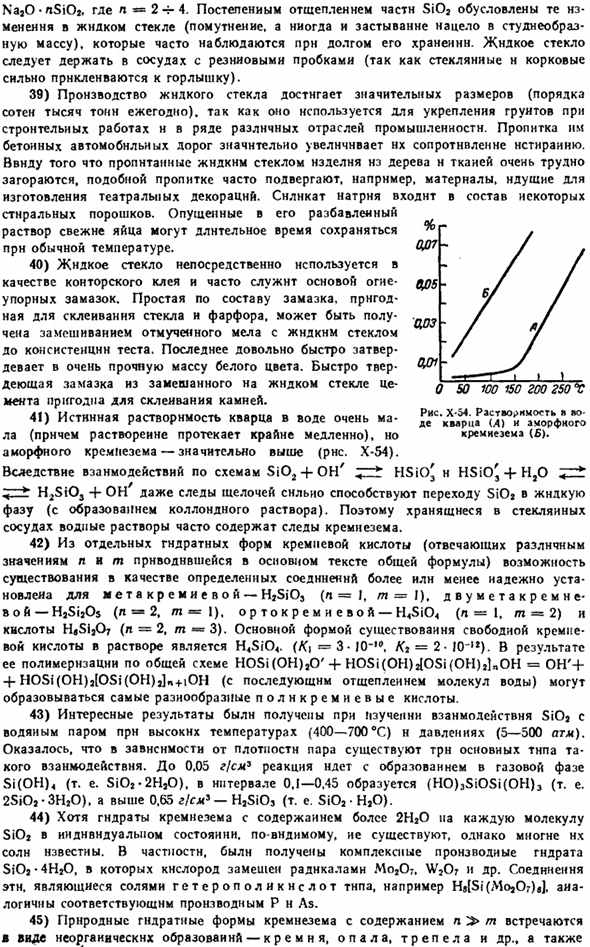
39) производство жидкого стекла достигает значительных размеров (около десятков тысяч тонн в год), так как оно используется для укрепления грунта при строительных работах и во многих различных отраслях промышленности. Пропитка их бетоном дорог значительно повышает их устойчивость к нстиранам. Из-за того, что дерево и ткань, пропитанные жидким стеклом, очень трудно загораются, такой материал часто пропитывают, например, для изготовления театральных декораций. Силикат натрия входит в состав некоторых моющих средств. Свежие яйца, замоченные в разбавленном растворе, можно хранить при комнатной температуре в течение длительного времени.
40) жидкое стекло используется непосредственно в качестве офисного клея и часто служит основой для огнеупорной замазки. Простую замазку, пригодную для склеивания стекла и фарфора, разминают раскрошенным мелом с жидким стеклом, чтобы получилась консистенция теста. Последняя быстро затвердевает и превращается в очень твердую белую массу. Быстросохнущая замазка, изготовленная путем смешивания цемента со стеклом нижнего слоя, подходит для склеивания камня. 4!)
Истинная растворимость кварца в воде очень мала(растворение протекает очень медленно), но аморфный кремнезем значительно выше(рисунок х-54).При взаимодействии по схеме SiOj + OH7, — * HSiOj и HSiO,+ОО < — h2sios + он7, даже следы щелочи сильно способствуют переходу SIO в жидкую фазу (с образованием коллоидных растворов).Поэтому водные растворы, хранящиеся в стеклянной таре, часто содержат следы кремнезема.
42) из отдельных гидратных форм кремниевой кислоты (соответствующих различным значениям ям, которые приведены в тексте общей формулы) возможность их существования в качестве специфического соединения почти наверняка установлена этим методом-HjSiO, (l = I, m = I). 2 кремнистые-hjsijos (л= 2 2, п«ор= 1), ork и REM-это H < Sio < (—I, m = 2) и hjsijoy Acid (=2, T = 3).
Основной формой присутствия свободной кремниевой кислоты в растворе является H4Si04. («/С » = 3-10 -’°.K* = 2-10 -’). в результате полимеризации по общей схеме образуется большое разнообразие общей кремниевой кислоты: HOSi (OH) aO ’+ HOSi (OH) JOSi (ОН).]»он = Oh ’ + hosi (Oh) A [OSI (OH) J] N + Ioh (с последующим расщеплением молекул воды). 43) интересные результаты были получены при исследовании взаимодействия SiOa и водяного пара при высоких температурах (400-700 ° С) и давлении (5-500 атм).
оказывается, существует 3 основных типа такого взаимодействия, зависящих от плотности пара. До 0,05 г / см9 реакция образуется в газовой фазе Si (OH)<(т. е. SiOa•2Н30) и в диапазоне 0,1-0,45 (HO) 3sio (OH) 3(т. е. 2SiO » — 3HsO). Более 0,65 г / см — HaSi03 (то есть SiO2-NaO). 44) для каждой молекулы SiO2 индивидуального состояния, по-видимому, нет гидрата кремнезема более 2H} 0, но многие из его солей являются known.
In в частности, было получено комплексное производное гидрата SiOj-4HjO, в котором кислород смешивался с радикалом Mo207, WjOr и др. Это соль гетерополисного типа, например Hs [Si (Mo » Or)»]. Аналогично соответствующим производным P n As. 45) природные силикаты кремнезема с содержанием l> m встречаются в виде неорганических слоев, таких как кремень, Опал и Триполи. Рисунок X-54.Растворимость йодистым кварцем (А) и аморфным кремнеземом (£).
Остатки оболочки мельчайших морских организмов, которые когда-то жили-диатомовая земля (водорослевая почва).в условиях крайней пористости почв Триполи и Дижона их применение заключается в производстве динамита, нефтепереработке и утеплении. Кремси является одним из 1 самых важных минералов в истории человечества. ОИ является основным материалом для изготовления орудий каменного века, ведь на протяжении многих веков огонь был неразрывно связан с ним.
Аморфный оксид клемия («белый белый»), полученный из кремниевой кислоты, используется в резиновой промышленности, а также в производстве смазочных материалов, красок, лаков. 46) образование пероксидов кремния не характерно, а производными кислот этого элемента являются obtained. At в то же время известны продукты присоединения пероксида водорода к SiO2 и силикату, например Na2hi04-2Hj02.
Это вещество представляет собой белый порошок, легко растворимый в воде. 47) В отличие от широко распространенных кислородных производных кремния, его сернистые соединения встречаются в природе. Теплота образования Элемент SiSj составляет 50 ккал / Молл. Дисульфид кремния получают при реакции 2H, S-Si = SiSa + 2Ha, при 1300°C и выделяют в виде белых шелковистых игл (mp 1090, mp 1130 ° C).
Эти иглы состоят из полимерных цепей, показанных на рисунке. Х-55.Структура кристалла sis2.Тип Х-55, который входит в рисунок. SiOj и H2S разлагаются в воде SiSa, образуя растворимые сульфиды и соли тиокуленовой кислоты (HaSiS3). как и в случае углерода(§ 1 add.46), Эстер thioculamide известен своими ортотропной[напр. SifSQHe)*]. Взаимодействие SiSa с избытком Si (в вакууме при 850°C) может привести к образованию унисилианского кремния (SiS) n.
It представляет собой желтую иглу, которая расщепляет воду, выделяя H2S и водород. Для каждой молекулы SiS (750°С) было найдено q = * 1.74.Желтый сульфид кремния-SiOS также известен. 48) бесцветный SiSea, коричневый Рентгеноаморфный SiSc и красный SijTej описаны из аналогичных сернистых селеновых и теллуровых производных кремния. Все они получены взаимодействием элементов при высоких температурах и неустойчивы к воздействию воды.
Теллурид клемия-полупроводник типа 2.0 с запрещенной зоной 7 звезд. 49) в зависимости от типа исходного гидрата кремнезема простой силикат может быть подразделен на имиаграты (производные H2Si03), ортосиликаты (производные H4Si04) и силикаты различных типов. ratios. An важным простым силикатом является тальк (Mg3H2Si40!iln 3MgO * Н20 * 4SiOt).Из-за очень высокой механической прочности, зеленый ja(SagE5N25i024 или 2CaO-5EO•NaO-8SiOt, e отличаются количеством Mg и Fe) часто использовался в каменном веке для изготовления инструментов.
50) очень распространенные алюмосиликаты включают, в частности, минералы группы слюды, например, мусковит (калиевая слюда) — K2H AleSie024 или KjO•2НаО•за1а03•6sioa. Большое техническое значение имеет глинозем (А1а03), каменный алюмосиликат (Na2AI2Si20 «или Na20•A1203•2SiOa), который используется в комплексном производстве соды и цемента. Драгоценный камень-топаз (Al (F, 0H)] 2Si04, кристаллы которого имеют яркие оттенки разных цветов, а иногда достигают огромных размеров (максимальная масса составляет 117 кг). 5!)
Породы часто представляют собой смесь различных минералов, появление которых уже заметно. Например, гранит состоит из смеси кристаллов кварца, полевого шпата и слюды, с общим содержанием SiOa около 70%. 52) цеолиты образуют интересную особую группу алюмосиликатов, состав которых может быть выражен в Формуле M * Eu02u. nH20, где M-Ca, Na(хотя и не так часто Ba, Sr, K) и e — Si, с переменным соотношением L1.
Они имеют рыхлую кристаллическую структуру, образованную тетраэдрами SIOA и АУ4 с общими атомами кислорода (рис. x-56), в которых М-катионы и молекулы воды расположены в пустотах. Цеолиты могут обмениваться водой и другими жидкостями (такими как спирт и аммиак), а также катионами M с различными другими катионами. в отличие от конттутсвонио ^(то есть некоторых основных компонентов вещества), цеолиты на водной воде, такие как асбест, тальк, москвичи и многие другие минералы, ведут себя как адсорбированные.
При тщательном нагревании цеолита цеолит постепенно удаляется, и даже если он полностью обезвожен, основная структура минерала не будет разрушена. Неорганических ионов агентов(§ 2 Добавить.75) имеет монографию 53) важным типом цеолита является т. Шейла, характер 3 В Г х-56.Схема расчета * cellkol пробираясь сквозь узкие пустоты сетки nx. Структура. Этот тип природного цеолита встречается редко и обычно изготавливается искусственно (из Na2Si03, NaAlOj, NaOH).
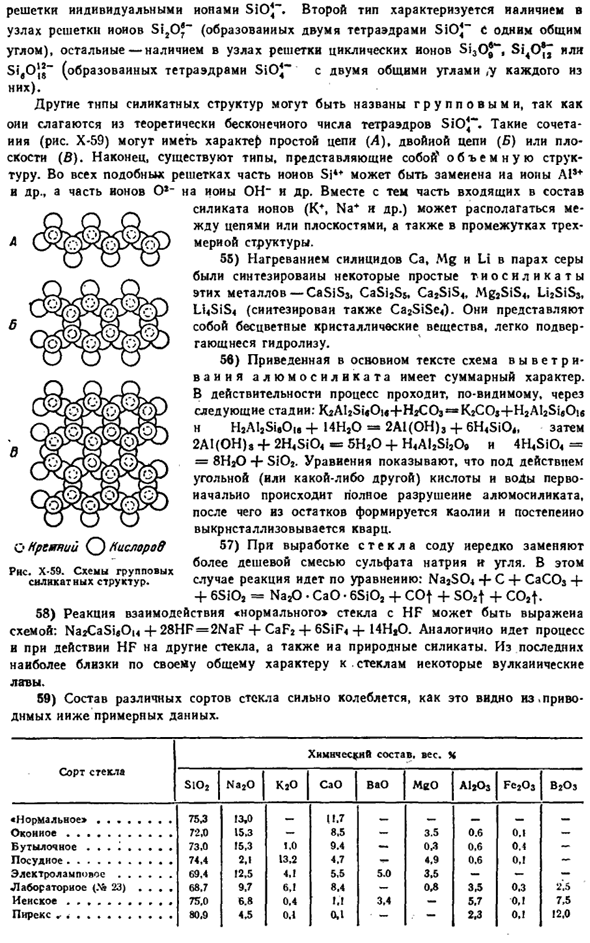
Полученные кристаллы имеют отверстия однородного размера диаметром почти 3-13 А и активно адсорбируют молекулы (особенно полярные), которые могут проникать в эти отверстия. Например, молекулярное сито с диаметром отверстий 3,5 а поглощает H2, O2 и N2, но на самом деле не Ar или CH4(рисунок X-57). Подобные различия, когда размер IJ большой、
Открытие также показано в отношении сложных молекул (Si 0> 8fr 0) s * молекул. Это создает возможность jJ ^ + X ^° Дело в том, что избирательно извлекает некоторые ve — » j Вещества из смесей, выбросы вредных веществ g Рисунок X-57.Критический размер некоторых молекул * рисунок х-5 *.Формирование простых сил и Катианион. Примеси и так далее on. In в частности, молекулярные пучки используются для сушки определенных газов и liquids.
It также использован как несущая non-обменника и катализатора. Есть обзорная статья по молекулярному Ситу 54) многие силикатные пространственные структуры были изучены с использованием X-rays. It оказывается, что все изученные структуры можно классифицировать по относительно небольшому числу типов, свойства комбинации тетраэдрических Ионов SiO}которых отличаются друг от друга.
К этим типам относятся простейшие силикатные анионы (рисунок Х-58).Они включают, во-первых, случай, в котором узел должен быть заполнен пространством * Amflett C. неорганические не-конечные. С английского, Изд. И. В. В. Тананаева. М..«Мир», 1066.188 С. Ждановп. Егорова Е. Н. химия цеолитов. М..«Наука» 1068,158 секунды •* Холима В. Я. Neimarch я, Е. Pioitkovskaya А. М., успехи химии, I960 года Привет 0, 108а、
Решетки индивидуальными ионами SiOj.2-й тип характеризуется наличием Si20 ′ — ионов в узле решетки (образованном 1 тетраэдром sioj с 2 общими углами), а остальная часть характеризуется наличием циклических ионов Si3Ojw в узле решетки. Siojj«(образованный тетраэдром SiOj) каждый имеет 2 общих угла). Другие типы силикатных структур можно назвать групповыми структурами, поскольку они теоретически состоят из бесконечного числа тетраэдров SiOj.
Такая комбинация (рисунок X-5D) может иметь свойства простой цепи (>4), двойной цепи (B) или плоскости (8). Наконец, существует тип, который представляет собой * bulk structure. In все * решетки, некоторые из ионов Si4 * заменены AP и так далее, а некоторые из ионов O1 заменены OH. Состав Ионные силикаты (такие как K, Na*) могут быть размещены между цепями или плоскостями, а также в зазорах в 3D-структурах.
55) при нагревании силицида Cas, Mg и Li в парах серы были синтезированы некоторые простые тиосиликаты, CaSiSj, CaSijSs, Ca2SiS4, Mg2SiS4 и Li2SiS3 этих металлов. Li4SiS4 (синтезированный Ca2SiSe4).Они представляют собой бесцветные кристаллические вещества, которые легко гидролизуются. 56) схема выветривания алюмосиликатов, описанная в тексте, имеет обобщающий характер feature.
In практика, процесс четко проходит через следующую стадию. + 2H4Si04 — = 5H20 + H4A!2Si20e и 4 ^ 550,=8НгО + si02.Формула показывает, что под воздействием угольной (или другой) кислоты и воды алюмосиликаты сначала полностью разлагаются, а затем из остатков образуется каолин, а затем кварц постепенно кристаллизуется. 57) при производстве стекла соду часто заменяют дешевой смесью сульфата натрия и coal.
In в этом случае реакция протекает по следующему уравнению: Na2S04 +С+ CaCOs + + 6Si02 = NajO•CaO * 6S | 02 + COf + S02f + COaf. 58) реакция «нормального» стекла и HF может быть выражена в следующей схеме: Na * CaSi «Oi4-f28HF = 2NaF + CaF2 4-6SiF4 + 14HiO«.Этот процесс аналогичен случаю действия кВ на другие стекла, а также на природные силикаты. Из последних, некоторые вулканические лавы ближе всего к стеклу в целом.
59) Как видите, состав стекла разных марок сильно различается. Ниже приведен пример данных. Виды стекла * химический состав, ЕС. Х S102 Na20 Cao CaO BaO Mao AltOj Fe203 B2O5 «Нормальный.»……. 75.3 13.0 _ 11.7 _ _ _ _ _ _ 72.0 15.3-8.5-3.5 0.6 0.1- 73.0 15.3 1.0 9.4-0.3 0.6 0 я не уверен.」- Посуда……….. 74.4 2.1 13.2 4.7-4.9 0.6 0.1- Лампочка… 69.4 12.5 4.1 5.5 5.0 3.5— Лаборатория (L & 23)…. 68.7 9.7 6.1 8.4-03 ЛП 0.3-2.5 75.0 6.8 0,4 л. Ф 3.4-5.7 0.Ф 7.5 80.9 4.5 0.1 0.1 ′ —23 0.1 12.0 Рисунок Х-59.Схема групповых силикатных структур.
О Нески о нислоро$ При анализе бесцветного и прозрачного древнеегипетского стекла (около 1500 лет назад и э.) были получены следующие результаты(все%). NajO-22,4; K20-0,6; CaO-7,8; MgO-4,2; AljOj-0,6; Fea03-0,7; MnO-trace. In Египет, стекло восходит к 3500 лет назад. е. 60) особенностью стекла и Пирекса является высокая устойчивость к действию воды и кислоты, а также относительно небольшой (особенно Пирекса) коэффициент расширения, в результате чего оно способно выдерживать нагрев.
Обе эти разновидности производят высококачественные химические стеклянные изделия для лаборатории. Стекло типа Pyrex также отличается отличной механической прочностью, поэтому в настоящее время из него изготавливают не только предметы домашнего обихода, но и тару и контейнеры для промышленного осуществления химических процессов. Благодаря небольшому коэффициенту расширения, эти контейнеры можно нагревать на открытом огне.
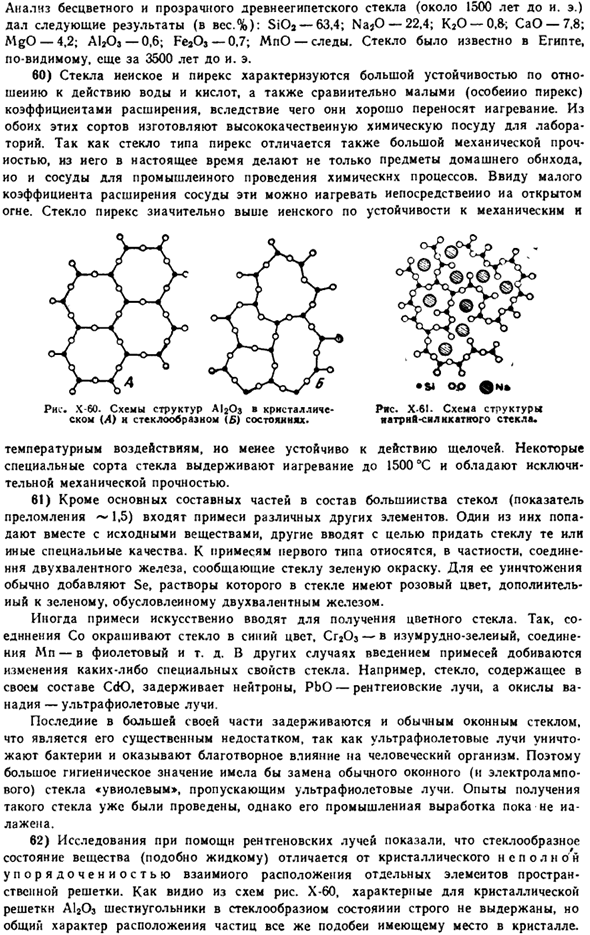
Стекло Pyrex использовано для механически и Ряса. Х-6И. Схема структуры шелковистая стекло. Рисунок Х-60.Схема структуры а / 203 * кристаллическое (А) и стеклянное ( £ ) состояния. * Ш О0 семо * Из-за влияния температуры, сопротивление к алкалиу уменьшено. Некоторые специальные сорта стекла выдерживают нагрев до 1500 * C и обладают исключительной механической прочностью. 61) помимо основного компонента, большинство стекол (показатель преломления〜1,5) также содержит примеси от других различных элементов.
Некоторые из них вводятся вместе с исходным материалом, другие вводятся для придания стеклу того или иного особого качества. К первому типу примесей, в частности, относятся соединения железа, придающие стеклу зеленый цвет. 第1のタイプの不 不純物物には、ガガラスに 緑色色を付 与する 鉄。化合物化合物が含まれるДля уничтожения его обычно добавляют Se. Стеклянный раствор является розовым в дополнение к зеленому для 2-валентного железа.
Известны случаи, когда примеси вводятся искусственно для получения цветного стекла. Таким образом, соединения Co окрашивают стекло в синий цвет. Cr203-изумрудно-зеленый, соединения Mn-такие как Violet. In в других случаях введение примесей изменяет особые свойства стекла. Например, стекло, содержащее C <10, содержит нейтроны, PbO-рентгеновские лучи и оксид ванадия-ультрафиолет.
- Последнее задерживается обычным оконным стеклом, поскольку в большинстве случаев ультрафиолетовые лучи уничтожают бактерии и оказывают благотворное воздействие на организм человека. Это существенный недостаток. Поэтому очень важной для гигиены является замена обычного оконного (и электрического) стекла на «уборай», которое пропускает»ультрафиолет».Эксперименты по получению такого стекла уже проводились, но его промышленное производство еще не налажено.
62) исследования с использованием рентгеновских лучей показали, что стеклянное состояние вещества (например, жидкости) отличается от неполного упорядочения кристаллов в относительном положении отдельных элементов пространственного lattice. As это видно из диаграммы на рисунке х-60.Шестиугольник, характерный для кристаллической решетки А1203 в стеклянном состоянии.
Строго не поддерживается, но общие особенности расположения частиц сходны с теми, что встречаются в Кристалле. Людмила Фирмаль
На рисунке х-61 схема строения силикатного стекла натрия показывает расположение ионов металлов в решетке. Ионы металлов помещаются в пустоты силикатной сети без четкой последовательности. Поскольку в этой сетке нет строгого регулярного повторения структурных элементов, отдельные соединения характеризуются неравномерностью strength. So, стекло, в отличие от Кристалла, не имеет определенной температуры плавления и постепенно размягчается при нагревании.
Неорганическая стеклообразующая система имеет монографию*. 83) большинство стеклянных изделий изготавливается путем выдувания, а исходным материалом является капля расплава 1 или другого размера. Для придания стеклу материала достаточной вязкости, их предварительно охлаждают до 700-800°С. Сам процесс выдувания осуществляется с помощью специальной пены или без специальной смазки. forms. In в последнем случае от практического производства стекла требуется особая технология-стеклодувы.
На рисунке X-62 показана работа стеклодувных ремесленников, описанная в книге Агриколы. Тяжелая работа стеклодувов все чаще заменяется работой специальных machines. In помимо напыления, популярной стала штамповка изделий из стекла. 64) в быстро охлажденном стекле создается сильное внутреннее напряжение, в результате чего оно легко ломается. Именно поэтому готовые изделия из стекла хранятся в специальных печах, где они постепенно охлаждаются. Являясь затвердевшей смесью различных силикатов, стекло при нормальных условиях работы не выделяет их в кристаллическом состоянии, а потому остается transparent.
In в уже охлажденном стекле процесс кристаллизации идет очень медленно, поэтому результат можно наблюдать только в некоторых старых изделиях. Но если стекло нагревают без размягчения и выдерживают при этой температуре достаточно длительное время, то в результате сильного ускорения процесса кристаллизации отдельные кристаллы силиката будут осаждаться и стекло станет opaque. It иногда используется при изготовлении изделий из стекла, но в большинстве случаев это минеральные вещества (Апатит, криолит и др.), которые легко кристаллизуются при охлаждении, специально вводятся в расплавленную массу для получения непрозрачного («молочного») стекла.
В) путем кристаллизации конкретного стекла при определенных условиях можно получить материал, характеризующийся однородной мелкозернистой структурой образующихся кристаллов. Такой металл. Сочетая в себе полезные свойства как хрусталя, так и стекла, вы получаете очень высокую механическую прочность. strength. It интересно, что прочность костей человека обусловлена сходной двухфазной природой структуры, которая состоит из мелких кристаллов апатита, спаянных с органическим веществом (коллагеном). Цемент является ценным материалом для различных строительных работ works.
It очень важно, чтобы металлургический шлак служил исходным сырьем для производства. Рисунок Х-62.Обработка стекла (XV! Век.) Роусон И. неорганическая стеклообразующая система.-Я не собираюсь этого делать, — сказал он. И. В. та-найасва. М., «Мир», 1070, 312 СА cc) стекловата, которая получается путем вдувания под давлением в жидкую стеклянную массу водяного пара, является отличным изоляционным материалом. Существуют»пеностекла» такого же качества, звукоизоляции, высокой механической прочности. OIO образуется, когда смесь стеклянного порошка с веществом, способным выделять газы, постепенно нагревают до 700-800°C, а стеклянную губку с плотностью 0,2-0,5 г / см*, содержащую газы.
С7) ткань изготавливается из очень тонких (до диаметра Микрона единицы) стеклянных нитей, которые получают многими техническими назначениями и специальными машинами, используемыми при изготовлении спецодежды. Стекловолокно обладает высокой удельной прочностью на растяжение и разрыв, и чем оно тоньше, тем оно выше (рисунок х-63).Даже «толстые» волокна диаметром 50 мкм (примерно равные диаметру человеческого волоса) превосходят по прочности как натуральный (хлопок, шерсть), так и искусственный (вискоза, капрон) текстиль materials.
In комбинация с синтетическими полимерами, стеклоткань дает материал («стекло волокна») который легко сформирован дальше receipt. It примерно в 4 раза легче стали, превышает ее прочность и фактически подвергается атмосферной коррозии. 68) Если i-ое стекло покрыто тончайшим слоем другого стекла с соответствующим показателем преломления, то свет, поступающий с одного конца, достигает другого конца без существенного change.
No каким бы изогнутым или скрученным ни был свет, он не может»убежать» от него, потому что постоянно испытывает полное внутреннее отражение. Такие пучки нитей образуют оптические волокна и начинают использоваться в различных областях. Например, освещая объект, который не доступен через кусок гибкого волоконного волокна, можно получить изображение этого объекта через другую часть волокна того же волокна. Основанный на характеристиках стекловолокна(стекла и пластмассы), стекловолокно одно из ключевых достижений современной технологии. 1.
69) оксиды щелочных металлов могут быть очищены кислотной обработкой от обычного типа стекла xNajO * уВ203•zsio кислотная обработка может образовывать пористое стекло, которое сохраняет свою первоначальную форму. Диаметр пор такого стекла (после обработки, например 96% SiOj) будет равен 15-20 A. As с цеолитами он обладает высокой адсорбционной активностью.
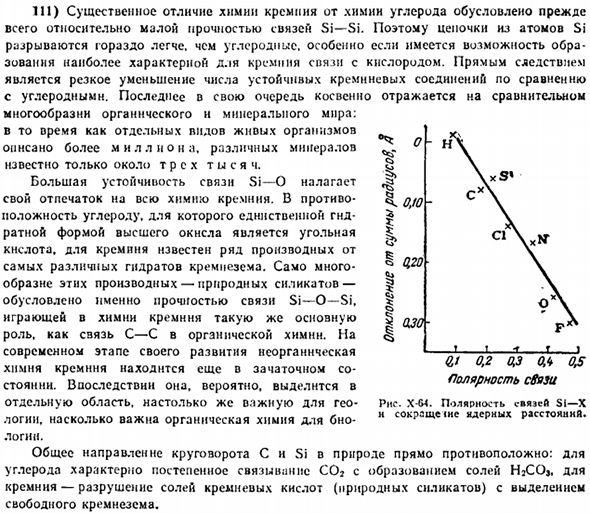
70) в последнее время началось производство кварцевого стекла, химический состав которого в основном состоит из чистого кремнезема (SiOs).Процесс его развития прост, как правило, заключается в растворении кварца (обычно кварца).Однако поддержание требуемой для этого высокой температуры связано со многими техническими трудностями, которые определяют высокую стоимость кварцевых изделий. Плотность кварцевого стекла составляет 2,2 г / см.То есть она ниже плотности всех кристаллических метаморфоз кремнезема.
При температуре более 200°C кварцевое стекло начинает проникать в водород и гелий, а при температуре более 1000°C оно проникает в другие gases. An интересной особенностью кварцевого стекла является то, что оно практически не оказывает эффекта после elasticity. As в результате вяжущие и спирали из этого материала незаменимы при изготовлении многих прецизионных измерительных приборов.
Обычным преимуществом кварцевого стекла является то, что оно примерно в 15 раз меньше, а температурный коэффициент теплового расширения практически не меняется. Благодаря этому кварцевые изделия выдерживают очень резкие перепады температуры без растрескивания. Например, его можно нагреть до красного каления и сразу же поставить в воду. С другой стороны, кварцевое стекло используется в устройствах, потому что оно захватывает очень мало ультрафиолетового света Рисунок Х-Б3.Диаметр стекловолокна (lx) и его прочность на растяжение(кг / мм1).
Вы их получите. Если кварцевое стекло окрашено солями Икера, оно становится черным стеклом, которое задерживает весь видимый свет, но пропускает ультрафиолет. Вода и кислота (за исключением HF и H3PO) практически не действуют на кварцевое стекло, но щелочь очень легко разъедает его. Еще одним недостатком кварцевого стекла является его большая хрупкость по сравнению с обычным. 71) сравните некоторые константы галогенированного кремния со следующими: sif4 SiCI4 Sib4 S1I » Теплота образования, ккал / моль…. …… 386 164 110 48 д (Сид.
Один……………. …… …… 1.55 2.15 2.31 2.43 −68 +5 122 Температура кипения. С….. … +57 153 290 Потенциалы ионизации для SiF4 и SiCl4 составляют 15,4 и 11,6 а соответственно. Константа связи Si-CI задается через/ c(SiCI)= 3.1.Значительное количество SiF4 получают в качестве побочного продукта производства суперфосфата. Фторид кремния является высокотоксичным веществом. 72) хлорид кремния обычно получают путем воздействия хлора на нагревательную смесь SiOj и угля: SiOi + 2C-f 2Cl2 = 2CO-f SiCl«.
Взаимодействие при нагревании некоторых металлов с оксидами протекает аналогично реакции с водой (в некоторых случаях она протекает очень энергично).Например, реакция с А1203 протекает по схеме: 3SiCl «- f 2AbCb = 3SiOa-f 4AlCI3 + 24 ′ ккал. Обмен хлора на кислород также происходит при взаимодействии SiCl4 с некоторыми полуметаллическими оксидами. Например, тетрахлорсилан преобразует P20 $в POC13, а SOa — в S204CI2. Интересно, что SiCI „реагирует с металлическим натрием только при раскаленных температурах (с образованием NaCl и осаждением аморфного кремния), а в случае SiBr4 и Sil подобная реакция протекает гораздо легче“.
Особым свойством Sil4 является воспламеняемость нагретого пара в воздухе. Есть 4 монографии хлора в кремнии (и SiHClj). »» 73) тиоцианат кремния-Si (NCS) 4 получают взаимодействием SiCl4 и Pb (NCS) 2 в бензольном растворе, близком к Sil4.Это вещество представляет собой бесцветный кристалл (mp146, mp.(313°C), легко разлагается под воздействием воды. Интересно, что Si-N =с基 молекулы si (NCS) 4, по-видимому, имеет линейную структуру, в то время как молекула si (NCO) 4 (SEC.1 add.142), ZSiNC = 146°- длина связи< /(SiN)= 1,69, d (NC)= 1,21, f (CO)= 1,16 A. 74) при взаимодействии газа HBr или HI с паром SiCl4 при нагревании удобнее получать бромид и иодид кремния.
Если хлорный обмен брома или йода не осуществляется полностью, образуется смешанная Кремниевая железа-SiCljBr. SiCl2Br2. Вы также можете использовать его в качестве автономного приложения. Вследствие взаимодействия SiCl4 и SbFs при нагревании образуются аналогичные фторхлориды (SiFCl3, SiFjCl2, SiF3Cl). obtained. At при высоких температурах между различными типами молекул устанавливаются определенные равновесные соотношения. Например, при нагревании sif2br2 до 700 ° С смесь содержит одновременно SiBr4 (4%), SiFBr3 (25), SiFjBrj (40), SiF3Br (23) и SiF4 (8%).Свойства смешанных производных обычно являются промежуточными по отношению к свойствам соответствующих простых галогенидов.
75) помимо простейшего Галогенида Sir4, для кремния известны производные галогена Si2r6.Общим методом их образования является взаимодействие SiT4 и аморфного пара Si при высоких температурах путем обратимых реакций.3SiT4+ Si = r± — 2sijiy галогенид Si2r » представляет собой бесцветную жидкость или твердое вещество. Наиболее изученным представителем является Si2cla (MP3, mp147°С), молекула которого характеризуется следующими структурными параметрами:</(SiSi)= 2.34, d(SiCl) −2.02 A. ZClSiCl = 110°.
Аналогичный бромид-Si2bra-плавится при 90, кипит при 265 куб. см, а йодид нестабилен. Для хлора и брома, соединений и * Lapndus И. И. НГС Лотиан, Ланкашир ГСЗ, ГСЗ LanarkshireA. Тетрахлорслан m trichlsrsilai. М.. «Химия», 1970,126 С. Клемий имеет более длинные цепочки атомов. SieCl4 (Мп.318°C) и до Si&Bri. Также перечислены продукты с составом SijoClaa(вязкая жидкость), SizsClsa(пластичная масса) и Si | 0Cl <8.Последние из них, по-видимому, имеют бициклическую структуру (тип 4SiClj-2SiCl-4SiClj) и представляют собой комки, похожие на желтый вазелин.
76) все сложные галлоны кремния легко разлагаются водой, и в конечном итоге образуются соответствующие ореолы угольной кислоты Si (OH) 4n. Во время реакции с холодной водой могут быть отделены нестабильные промежуточные гидролизованные продукты, которые сохраняют связи Si-Si в композиции без избытка water. So SijCle дает t в этих условиях. Щавелевая кислота алкалиа (SiOOH) n выпущена как белый порошок, неразрешимый в воде и не acidic. It разлагается при взрыве при испытании или нагревании, а в щелочи растворяется с выделением водорода.
В результате взаимодействия SiaCU с жидким аммиаком получают амидное производное состава Sia (NH) 3, а в результате его пиролиза при умеренном нагревании (менее 500°С) образуется белый Рентгеноаморфный нитрид состава SiN. 77) при нагревании порошка SI в паре Si4 выше 1000°C происходит обратимая реакция sit4-f Si * t 2sita, при которой Si осаждается на более холодную часть аппарата, т. е. обладает транспортными свойствами(IX§ 1, 43).Он может быть использован для получения очень чистого кремния. 78) значение L в N, выделенном из высокотемпературного равновесного замороженного продукта (SiBrj), составило около 16 (по данным криометрии молекулярной массы QHe).
в отсутствие влаги он стабилизируется на воздухе при комнатной температуре, но сгорает до SiOa при превышении 100°C. При использовании пиридина в бензольном растворе образуется красновато-коричневый осадок (SiBra * CgHtN)*. ) a] n, он слегка загрязнен смесью Si (OH) 4.Аналогичные свойства имеют (SiQa) n и (Sila). 79) в случае газообразных молекул сита дается тепло, полученное из следующих элементов (ккал / моль): 148(F), 38(C1), 10(Br). Н-19(Я).Бифидум Clemium был получен взаимодействием sif4 с кремнием при 1150 ° С и при низком давлении (0,1-0,2 мм рт. ст.).
Среднее время жизни отдельных молекул Сифа[d (SiF) составляет 1,59 A, FS Fif101e, η= 1,23]намного больше, чем молекула галокарбана(§ 2 add.12).При их полимеризации образуется белая или желтоватая резиновая масса (Сифа) n, которая нерастворима в органических растворителях и разлагается водой. В дополнение к SiaF, продукт пиролиза при 300°C. Si3Fe (mp-1, mp.42 ЕС), Si4F | 0 (mp 67, mp. Другие члены серии до 85°C) и SiuFjo отделены и собственн-воспламенены в воздухе. Имеется обзорная статья о производных двухатомного кремния 80) желто-коричневый (SiBr)»может быть получен восстановлением»магния», растворенного в эфире SiBr, аналоги композиции (SiCI)» могут быть получены взаимодействием спекания магния и 101.Их структура четко соответствует 6-членное кольцо Спаркет>.
Также описаны (SiF) i и (Sil) n. Выше 380°c (SiCl) n Летучий хлорид Кремня начинает расщепляться, постепенно становясь красным, а выше 550°C он превращается в темно-зеленую массу с металлическим блеском и почти без хлора, а при х 800°C он становится красным. 81) с молекулами нескольких других веществ железа SiT4 может образовывать дополнительные products. An пример-sif4’N (CH3) s и SIF4’2N (CHj) 3, сублимированные без decomposition. It интересно, что оба эти вещества имеют примерно одинаковое давление паров (то есть 63 см3).
Также были получены SiCl4 * P (CH3) 3 и SiBr4-P (CH9b (давление пара при 25°C, соответственно,<2 и<0,5 мм рт. ст.), но SiF4 * P (CH3) 3 был низким, наиболее важным. * Epell, Х. У. .. Б Е М Е Д и Б. эрг. Р. ..Достижения в области химии. 1070 м. 7.1244. Производные плавиковой кислоты этих аддуктов считаются несколько более низкими. 62) Для кремния известны многие оксо-галлиды(в основном оксо-хлориды).Самая простая конфигурация-это SijOF » (mp.-47, депутат.-23°C) и Сиджоку (mp.(137°с).Первое из этих веществ получают при 750 ° С взаимодействием SIF4 с безводной Наджсией, а второе получают взаимодействием паров SiCU с кислородом при 1000 ° С.
Молекула cljsiosicu характеризуется следующими структурными параметрами: (SiO)= 1.64 A. ^ ClSiCI = 110°, ZSiOSi = 130°. При взаимодействии паров SiCI с кислородом образуются и другие оксокролиды общего типа SinOn-iCUn + s. И тип (SiOCb) * циклические оксо-хлориды(n = 3, 4.5). 83) Sictjsh (ВР 96°с), (SiCbhS (ВР −45, разложение. В БП 187°с), SijSjCU(Т. 80°C)и (SiSCb) я, где N>2.Основной продукт реакции, SiCljSH, представляет собой бесцветную жидкость, которая медленно выделяет серу в воздух и быстро разлагается водой. (РФ (Шицы)= 2.02,д(сис)= 2.14 л).
При нагревании этого вещества до 700°C(в отсутствие воздуха) разложение протекает по схеме:2xSiCI3SH = xh2s2s + xSiCU +(SiSCb)*.Известна также самая простая формула SiSBr3 (mp 93°C) тиобромида кремния. Благодаря его взаимодействию с аммиаком получается Кремниевая тиомочевина sis (NHj) j. 84) взаимодействие SiCU и аммиака протекает по следующей формуле: SiCU + 6NH3 = 4NH4Cl + си (Нью-Хэмпшир) Дж. После переработки продукта реакции с нашатырным спиртом (для удаления хлористым аммонием nh4cl), Белый reasamorphic силикона имида порошок остается.
Это, очевидно, полимерное соединение с предполагаемой структурой типа I_N = * Si (NHj) -] P. диимиды кремния очень гигроскопичны и легко гидролизуются (до SiOj и NH3) и мигрируют в Sijna при пиролизе(промежуточное поколение Si * N3H). путем сплавления этого с KNHj (азотная атмосфера) были получены K * Si (NH) 3 и K Si (NH). 85) за счет действия Тихого разряда на смесь паров SiCU и азота был получен трихлорсиламин-N(SiCl3) 3.Бесцветное кристаллическое вещество(mp. At 78°К), оно растворяет легко в коксобензоле и легко хйдролызед внутри water.
By его конденсацией (с расщеплением SiCU) был получен кристаллический полимер общей формулы (SijNCI). Он состоит из колец, образованных группами = SiCU и= NSiCl3. 86) в дополнение к соединениям галогенов, в дополнение к ранее затронутым Si (NCS) 4 (дополнительный 73) и Si (NCO) 4 (§ I дополнительный 142), известны несколько других производных, соответствующих основным функциям Si(OH) 4.
Бесцветное кристаллическое вещество, Si (CH3COO) 4(mp. П0 ° С) был изучен лучше других, поскольку он разлагается при нагревании выше 160°С, растворим в ацетоне и бензоле и подвергается гидролизу непосредственно под воздействием воды. 。 Белый кристаллический тетрахлорид кремния-Si (N5) 4-очень взрывоопасен. Отдельные состояния Нитрата и перхлората кремния не являются летучими. Ио выделяли в виде взрывчатого бинарного соединения в составе SHNOsh * 2C&HSN и Si (CI04) 4•2CH3CN. 87) из фосфорнокислого кремния наиболее изученными являются производные состава SiOj-PjOs, известные в 2 формах: низкотемпературной (менее 1030°С) и высокотемпературной (Мп 1290°с).
Последний разлагается не только водой, но и плавиковой кислотой. С химической точки зрения веществом этой композиции является либо металлофосфат силикат-SiO (P03) 2, либо пирофосфат кремния-SiPjO. Одно из этих выражений может соответствовать низкотемпературному типу, в то время как другое может соответствовать высокотемпературному типу. Нормальный ортофосфат кремния Sis (P04) 4 также был obtained. It обладает высокой твердостью и не разлагается кислотами (в том числе плавиковой кислотой). 88) K-[SiF4] 1F ’] 2 / [SiF^] 7•10 ~ 7 реакция образования H H H Hysife в разбавленном водном растворе 13,3% раствор перегоняют без разложения и могут быть отделены в виде нестабильного кристаллогидрата путем охлаждения сильного водного раствора.
Кислотные свойства hjsief более выражены, чем у серной кислоты. Его степень диссоциации равна 0,1.Решение в порядке 75°. Подобные Hjsif композитные кислоты других галогенидов не образуются. Особое положение фтора явно связано с гораздо меньшим объемом F〜по сравнению с C1〜 89) ядерное расстояние Si-F Иона SiFj составляет 1,69 а, а эффективный радон этого Иона оценивается в 2,4 А. При нагревании фторсиликат разлагает Sifa и соответствующий фторид металла. — f-SiF4 будет заметен примерно с 450°C. Интересно, что пиролиз kasife явно протекает в промежуточном поколении KjSiFr. Фторсиликат CAS, Sr и Ba разлагаются при 370, 420, 560°C соответственно на SfF4 и MFa.
Разложение Фторсиликата также протекает таким же образом, как и пиролиз Нх в жидком HF. Реакция протекает по схеме, например: Najsify + 2HF = 2NaHFa + SiF4.Фторсиликат аммония, например, разрушается выделением свободной кремниевой кислоты по следующей схеме: Najsif + 4NH » OH = * 2NaF + 4NH4F + Sl (OH) 4.Аналогичный процесс происходит под действием сильной щелочи (NaOH или KOH), но в этом случае при избытке щелочи кремниевая кислота не осаждается, так как образуется силикат соответствующего металла. 90) с образованием H2SiF общая схема гидролиза галогенидов кремния в SIF<приведенная в тексте несколько сложнее и представлена формулой 3SiF4 +2Н20= Si02 4-2H2SiF*. таким образом, обычно получается крем плавиковой кислоты.
Образование HjSiF§всегда происходит даже при взаимодействии раствора HF с SiOj или стеклом. 91) бесплатно HaSiFe используется для обеззараживания воды и пивоварении(как дезинфицирующее средство), а также труднорастворимые Фторосиликат на(0,7 мас.% ) И Ба(0,01%) используются для борьбы с сельскохозяйственными вредителями. Низкая растворимость (0,2%) KxSiFt иногда используется для получения свободной кислоты (такой как HC103) на основе соли калия nx.
Легкорастворимые Фторсиликаты Mg, Zn и A1 под техническим названием «флюаты» используются в строительной промышленности (для придания герметичности поверхности цемента). 92) кислота в составе HSlFft не является свойством кремния, но были получены некоторые его золи, содержащие объемные катионы. Пример{As (CeH5) 4lS » Fs. It стабилен до 245°C и растворим в органических растворителях без разложения.
93) по мере увеличения числа атомов кремния в молекуле повышается стабильность Силана decreases. In в этом же направлении взаимодействие MgjSi с раствором NH4Br в кислоте или жидком аммиаке снижает их относительные количества (значительно увеличивает выход Силана).Из-за сильного охлаждения газовой смеси и ее фракционирования в отсутствие воздуха отдельные кремнеземы отделялись до образования Сишлов.
Вот некоторые константы первых членов ряда: SIH4.SfaHe SljH » SI4H10 Температура плавления,°С…..— 185 —132-17-м Температура кипения. * С. …..— 112 −14 +53 107 Тетрасилан получали с 2 изомерами (аналогичными обычным Бутану и изобутану). Все силаны имеют характерный запах, который очень токсичен. При нагревании верхние ячейки ряда разлагаются с образованием (SiH)» SiH4 и H2.By окислитель, силы превращаются в НПО и Сиои. Oia, как и углеводороды, реагирует со свободными галогенами и непрерывно обменивает галогены на каждый атом водорода.
При использовании Галогенида водорода (например, HCl) в присутствии катализатора (A1C1″) при нагревании происходит аналогичная (но отличная от углехимии) реакция. Силаны (такие как углеводороды) не вступают в реакцию с концентрированной H2S04.Они очень растворимы в органических растворителях, но почти нерастворимы в воде. Последние, например, разлагают их по следующей схеме: SiH4 + 2H20 = 4H2 + SiOj. Однако Полностью очищенная вода в кварцевом сосуде практически незаметна, так как реакция очень интенсивная. slow.
In при наличии следовых количеств кислот, особенно щелочей, она значительно ускоряется, и в нормальных условиях вода разлагается уже примерно на 20% от исходного количества SiH. 94) Snlai-гипертермическое соединение(теплота образования от элемента составляет-8 ккал / моль). Он термически стабилен до 450°С, а при дальнейшем нагревании элементы начинают постепенно разлагаться. Молекула » SiH » представляет собой тетраэдр с кремовым атомом в центре (d (SiH)= 1.48 A).
Его потенциал ионизации составляет 12,2 вольта. 95) дицилан внутримолекулярный< / (SiH) −1.49. d (SiSi) * 2.33 A, а потенциальный барьер внутреннего вращения (через соединение Si-Si) составляет 1.2 ical / mol, то есть намного меньше, чем у этана (§ 2 add.22). Пиролиз Si2H происходит уже при 300°C и выше. интересно, что dislan реагирует с CC14, и реакция с ними interacts. It ясно видно полное экранирование кремния в объеме.
96) ненасыщенные углеводороды формально аналогичны гидриду кремния типа «(SiH2) и»(SiH).Поле — (SiH2) » — образуется при разложении CaSi уксусным ангидридом. OI представляет собой светло-коричневое твердое вещество, нерастворимое в обычных растворителях и самопроизвольно воспламеняющееся на воздухе. При нагревании до 380°С(SiH2) n разлагается с выделением смеси сливок и летучей глины, а также с водой по схеме: SiHj-f2H20= SiO * — fЗН. 97) при пиролизе летучих соединений (SiH) образуется CL-гидрид, близкий по составу к Bcyiee или less.
By свойства, они промежуточны между (sht) n и элементарным кремнием. Синтез (SiH) n получают по схеме 2SiHBr3 + 3 mg = 3MgBr2 + 2SiH(реакцию проводят в абсолютном эфире, полностью исключающем кислород).Полученный (SiH)n представляет собой желтое хрупкое Рентгеноаморфное вещество. 98) продукты частичного замещения водорода SiH4 и галлона характеризуются плавлением (верхнее числовое значение) и кипением (нижнее числовое значение) при следующей температуре (°С единица измерения).
SlHjT SfH, r, SIHrs Ф ки БР и Ф ИЦ БР и Ф ИЦ Бр 1 −118-94 −57 −122 −122 −70-С-131 −126 −73 +8 −88-30 + 2 45 −78 +8 06150 −95 +32 112220 Все эти вещества бесцветны и легко разлагаются водой. молекула nx имеет слегка искаженную тетраэдрическую структуру и имеет кремовый атом в центре n-полярия(n = 0.& −1.5).Взаимодействие металлического натрия с паром sih3i по реакции 2SiH3I-f 2Na = «2NaI Si2H» служит удобным способом получения dn Силанов.
Из последних наиболее стабильным является производное миогалодия Si2H&I(mp 86, mp Kp 103°C). 99) SiH3I-цель характеризуется тенденцией к естественной перестройке в соответствии со схемой 2sihjt = SiH2r2 + sih4 (наименьшее представление в SiHjI). Поскольку пространственная структура молекул sih4 и SiH2r2 является более симметричной, чем молекулы sihjf, то перегруппировку, протекающую без изменения валентности атомов, можно рассматривать как реакцию симметризации по приведенной выше схеме.
Такие процессы очень распространены в неорганической химии(например, IX§ 5 add. См. раздел 60). 100) известны многие клиновые соединения, полученные из одновалентных циловых радикалов-SiHj. Самолет CH3 (§ 2 доб.12) В отличие от него, он сам по себе является пирамидальным типом. Его сродство к электронам оценивается в 39 ккал / моль.
Сравните температуру плавления (°C) и температуру кипения (рисунок) некоторых из простейших силильных производных ниже: SlHjSH SJHjCN SlHjNCS (SlHj) 20 (SlHjbS (SlH3) 2Se (SIH3)2CN2 (SIH3) 3N −134 +32 −52 −144 −70 −68 −75 −106 + 14 +50 +84 −15 +59 +85 +85 +52 (SiHa) структура aCNj является HjSiN-C ^ NSiH*, то есть она не является производным Цианамида (§ I add.133), но карбодиамид-C (NH) a. Все перечисленные вещества бесцветны и легко воспламеняются. Некоторые из них самовоспламеняются даже в воздухе. Это включает в себя SiHaNa (mp 82, mp 26°C), HC (SiH, b (mp 57)), P (SiH, B (mp 114), As (SiH3) 3 (bp 120) и Sb (SiHa) a (bp 255°C).
Трисниридная сурьма быстро разлагается при хранении. 101) некоторые соединения кремния отличаются от аналогичных производных углерода не только низкой стабильностью, но и структурными особенностями. Таким образом, CH3NCS молекула имеет угловое строение (ZCNC»= 142°), SiHjNCS молекулы linearJ (ZS1NC = 180°), в пределах молекулы (ЦДХ) АО, ch3osih3 Н (Сиха) АО, угол атома кислорода сильно варьируется, соответственно (112, 121) 144°), (СН3) молекула имеет пирамидальную тип (выбрано исключительно для удобства визуального = 109°), и (Си3) молекула имеет пирамидальную тип (КЦ =109°). 3N-плоский треугольник (^SINSI = 120е).
в то же время донорная функция атомов O и N значительно слабее, чем у производных метанила. Этнические особенности соединения кремния можно объяснить частичным использованием 3 < / — орбиталей атомов, взаимодействующих со свободными электронными парами атомов O и N. 。Для громоздких центральных атомов S, P и Sb такие трудности больше не возникают: L ^ CSC in (CHs) aS равен 99°, а a-ZSiSSi in (SiH3) * s равен 97°. Молекула(SiH3) aP и (SiH3) aSb представляет собой пирамиду с d(SiP)= 2.25, d (SiSb)= 2.56 A и^ SiPSi = 96°,^ SiSbSi » = 89°]. J02)
Иитерезен представляет собой смешанный гидрид кремния и фосфора, образующийся при температуре 500°С по схеме SiH + PHs = Ha-f-SiHjPH2, бесцветный газ(то есть, kn. It это отличное место для начала. Энергия связи Si-P этого соединения составляет 88 ккал / моль. При гидролизе получается смесь различных продуктов, но преобладают Si (OH) 4 и PHa(как и ожидалось на основе относительного положения Si и P в периодической системе). 103) немного в стороне от вышеизложенного находится металлическое производное силил-Ксиха.
Это вещество получают реакцией[1,2-диметоксетан-(СНаО) Снасна (осна’)), которую проводят в reaction. KH+ Si2He = SiH4 + KSiH * кальций, выделяющийся при испарении растворителя, представляет собой бесцветный кристалл (имеющий структуру) NajCl и др.).При нагревании (в отсутствие воздуха) он разлагается только при температуре выше 200°С и полностью гидролизуется водой. 104) ряд производных кремния, называемых силоксанами, характеризуется наличием групп Si-O-Si в молекуле за счет гидролиза частично галогенированного кремниевого водорода.
Простейшим представителем^является(SiHa) АО, который можно получить по схеме: 2SiH3r + NaO = * 2 HG +(SiHa) jO. Его молекулы характеризуются следующими структурными параметрами: d(HSi) −1.49,</(SiO) −1.63 A, ZHSiH = 109°,ZSiOSi-144°.Силоксан, подобно простому эфиру, представляет собой бесцветное газообразное жидкое вещество, которое быстро разлагается щелочами и медленно (с образованием промежуточного продукта) водой. 105) примером более сложного силоксана является продукт гидролиза силохлоргольма по схеме: 2HSiCI3-f6HaO = 6нс1 + 2hsi (он) 3= 6нс1 + ЗНАО + + hasi203.
Полный силоксан (HaSi2Os)представляет собой белое твердое вещество, структура которого состоит из кольца, связанного связями Si-Si, образованными группами SiH и атомами кислорода. При нагревании до 500°C водород медленно отсекается, в конечном итоге давая оксид кремния простейшей формулы, SiaOa. Известно, что многие галондрондронбоникс-локсаны и их органические радикалы замещены водородом products. In кроме того, некоторые соединения, подобные силоксану (т. е. кремнезем и лентяй) являются obtained.
In это соединение, радикалы NH становятся альтернативой кислороду. 106) из силоксана [(SieHeOj)], полученного взаимодействием CaSia со спиртовым раствором HCl, получают другие кислородно-водородные соединения Si. Широксен белый твердый и сильный С регенеративными свойствами быстро разлагается горячая вода.
Окисление атмосферным кислородом (или KMnO») сопровождается яркой хемилюминесценцией (добавлено IX§b. 23). он имеет циклическую структуру и обладает высокой адсорбционной активностью. Атом водорода силоксана может быть заменен на галоген (и индроксильную или аминогруппу), например, реакцией SitHeOs + HBr = * » H * + SuH503Br.
In в отличие от самого силоксана, такие продукты замещения обычно окрашиваются более или менее интенсивно, но расщепление связей Si-Si (например, под действием свободного хлора) приводит к образованию бесцветных продуктов разложения. 107) для кремния, несколько различных органических соединений кремния known. As простейший представитель, бесцветный газ(Мп.-57°С) можно считать Ил— метил-H3SiCHJt.
В отличие от этана или дисилана, его молекулы полярны (q-0,73).Некоторые кремнийорганические соединения во многом сходны с соответствующими производными углерода. Например, этиловый эфир ортократиката и ортокарбоновой кислоты (Si (OC | Hs) 4 и C (OS * H|) 4]представляет собой бесцветную жидкость, которая кипит при 166 N 158°C соответственно.
Раствор SiOj без электролита. 108) кремнийорганические соединения обычно стабильны в воздухе и нерастворимы в воде. −Si−o-si-o-синтез высокомолекулярного производного, имеющего скелет из группы (т. е. силикон), открыл возможность их широкого практического применения. Свойства, построенные по типу Или Р Р Р Р Р Р Р Р Р Р Р Р Молекулы полимера в основном определяются отношением числа органических радикалов ® к числу атомов кремния: в случае R: Si> 2 получается вязкая жидкость, в случае R: Si и 2 получается эластичная резиновая масса, а в случае R: Si <2 твердое вещество имеет различные степени вязкости. rigidity.
By изменяя природу радикала R, можно внести тонкие изменения в характеристики. R: si> 2 силикон используется, например, в качестве смазки(с небольшим изменением вязкости в широком диапазоне температур).R: Si да 2-Для изготовления специальной резины (особенно устойчивой к жаре и Морозу), R: Si <2-для создания лакокрасочного покрытия и пластика.
Монографин *может быть использован для сжигания органических соединений. 109) сравните промежуточную длину и энергию связи соединения кремния со следующей: Так…….. Сл-Си сл-ч сл-о Си-с Си-н-Си-Си-си-е сл-сл Си-Бр-си-я Дсим, л……. 2.34 1.48 1.64 2.15 1.74 1.87 1.58 2.03 2.17 2.44 Энергия, ккал / моль 53 82108 63 77 75135 98 74 66 Отметим, что литературные данные по энергии рассматриваемых связей могут существенно отличаться. 110) средняя длина связи Si — E выше обычно меньше суммы соответствующих общих радиусов (III§ 6).Это естественно.
Очевидно, по характеру полярности рассматриваемых связей. На рисунке х-64 показана зависимость уменьшения ядерного расстояния от расчетной полярности связей (III§ 5 add.13) очень естественно. * Андрианов К. А. органическое соединение кремния. М., Госхимиедат. 1955.520 С. К. решков А. П. органические соединения кремния в технологии. М.. Промстройиздат. > 956-289 секунд. Андрианов К. А. молекулярный неорганический полимер с основными задачами Академии Наук СССР, M. Id 1962, 327 секунд、
Большая разница между химией кремния и химией углерода в основном обусловлена относительно высокой прочностью связей Si-Si. Таким образом, цепь атомов Si pajpbibaioch намного легче атома углерода, особенно если она может образовывать наиболее характерную Кремниевую связь с кислородом. Прямым результатом является резкое уменьшение количества стабильных соединений кремния по сравнению с соединениями углерода. Последнее косвенно влияет на относительное разнообразие органического и минерального миров.
Существует более 100 миллионов видов живых организмов, но только около 3000 известных минералов. Высокая стабильность связи Si-O оставляет свой отпечаток на всем протяжении кремния chemistry. In в отличие от углерода, где угольная кислота является единственным гидратом оксидов более высокого порядка, о клемине известно много производных от различных гидратов кремнезема.
Само разнообразие этих производных-природных силикатов-обусловлено прочностью связи Si-O-Si. связи Si-O-Si играют важную роль в той же химии кремния, что и связи C-C в органических соединениях chemistry. At на современном этапе своего развития неорганическая химия Клемина находится еще на ранней стадии.
Тогда, как это важно для геологии и в то же время Органическая химия для биологии также важна, она могла бы выделиться в другой области. Общее направление циклов C и Si в природе прямо противоположно: углерод * характеризуется рыхлой связью CO*, а в случае кремния он образует соли HiCOj-разрушение силикатов(природных силикатов) и высвобождение свободного кремнезема. 0 / 0.2 0.3 как полярность соединения Рисунок X-64. Полярность и ядерное расстояние связи SI — X.
Смотрите также:
| Органические соединения | Коллоиды |
| Круговорот углерода | Подгруппа германия |
