Оглавление:






















Подгруппа германия
- Подгруппа Германия. Содержание элементов этой подгруппы в земной коре многих Германий (2-10 4%)-олова (610_4%)〜свинца (L0-4%) изменяется незначительно. Германий относится к высокодисперсным элементам, и образование рудных кластеров не является его особенностью.
- Основными формами природного олова являются минеральное олово (BpOg) и свинцово-галенит (PbS).1 ″ 6 Крупномасштабную добычу в Германии пока не предпринимали place. It главным образом получен как субпродукт в обработке некоторых руд цинка. Галенит переходит в PbO путем накаливания на воздухе, после чего оксид свинца восстанавливается до металла 7 * 8 Что касается физических свойств, то олово и свинец являются типичными металлами, а Германий, скорее всего, напоминает кремний.
Олово выплавляется путем восстановления оловянного камня углем. Людмила Фирмаль
Сравните некоторые из этих констант ниже. Се ЗП РВ Цвет…………Серебристо-голубой Белый-белый Плотность, г / см * …… 5.3×7.3 п Температура Плавления,°C. 。 。 。 937 232 328 Температура компенка,°С. — это хорошая вещь. 。 。 2850 2720 1751 Электропроводность(НД 1). 。 。 0.001 8 5 Твердость и хрупкость рассматриваемых элементов быстро уменьшается Серия Ge-Sn-Pb: Германий очень трудн и хрупок, но руководство можно поцарапать с ногтями и свернуть в тонкие листы. Жесть промежуточная.
Все элементы германиевой подгруппы легко образуют сплавы между собой и со многими другими metals. In в некоторых случаях в результате слияния образуется соединение (например, типа M ^ E)*-14 Все 3 элемента очень важны для современных технологий. Некоторые соединения олова и свинца также имеют важное применение. Производные свинца являются высокотоксичными. Под действием кислорода в атмосфере Германий и олово не изменяются, а свинец окисляется.
Поэтому предмет из свинца всегда покрыт оксидным слоем сине-серого цвета и не имеет блестящего металлического внешнего вида. В нормальных условиях оксидная пленка защищает металл от дальнейшего окисления, но при нагревании она идет дальше, и свинец постепенно полностью окисляется. При нагревании на воздухе олово также начинает окисляться. Германий взаимодействует только с кислородом при температуре более 700°C все 3 элемента могут быть объединены с галогенидами и серой.
Вода не влияет на Германий и олово. Свинец постепенно удаляется из оксидной пленки, что еще больше способствует окислению. Лучшим растворителем для свинца является разбавленный азот*, кислота, Германий, олово-Аква. Взаимодействие с ней. По схеме обоих элементов ZE + 4HN03 + 12HCI = ZES!4 + 4NO +8Н20 В серии напряжений Ge находится между медью и серебром, а Sn и Pb-непосредственно перед водородом.
Поэтому их заменяют соли многих металлов (например, цинка).20-27 Валентная характеристика Германия и его аналогов равна 4 и 2.So, производными 2-х рядов рассматриваемых элементов являются known. In Германия, четырехвалентных соединений гораздо больше common. In олово, производное 4-валентного Sn, более устойчиво в нормальных условиях, но разница менее выражена. Напротив, свинец гораздо более характерен для соединений, которые являются двухвалентными.
В этом отношении производные двухвалентных Ge и Sn являются восстановителями (и, более того, очень сильными), а соединения четырехвалентного Pb являются окислителями и очень сильными. Однако в целом переход от низкой положительной валентности к высокой положительной валентности легче осуществить в щелочной среде, в то время как обратный переход легче осуществить в кислой среде.
Таким образом, восстановительные свойства 2-валентных Ge и Sn в щелочных средах более выражены, чем в кислых и 4-валентных Pb. In в кислой среде это очень сильный окислитель, не щелочной. Оксиды типов EO и E02 известны своими элементами подгруппы Германия. Первое обычно называют оксидом, второе-оксидом. dioxide. In в соответствии с наиболее распространенной валентностью элементов, при раскалении Ge и Sn в воздухе образуются их более высокие оксиды, а при раскалении Pb они становятся более низкими. Остальное можно получить только косвенно.
Все оксиды, о которых идет речь, твердые. Оксид Германия и олова характеризуется черным цветом, PbO-желтоватым классом, Ge02 и Sn02-белым, а Pb02-темным brown. In в воде они практически нерастворимы. Поскольку эти оксиды почти не связываются с водой, соответствующий гидроксид обычно получают реакцией, однако, благодаря действию / сильной щелочи на раствор соответствующей соли SnCl4 + 4NaOH = 4NaCI + Sn (OH) 4 Pb (M03) 2 + 2NaOH = 2NaN03 + Pb (OH) 2 Они выделяются как белые аморфные осадки[за исключением коричневого Pb (OH) J. In вода, Ge (OH> 4 растворяется замечательно, но другая растворимость очень мала.
По химическим свойствам все эти гидроксиды являются амфотерными соединениями. Согласно схеме, диссоциация растворенной части в конечном итоге будет продолжаться (если не учитывать ее рыхлую природу) е «+ 2На е(он) р ^ n2eo2 2Hv + ео? Е » 40х ’е(0н)4 = ч» Е04 Относительная специфичность того или иного направления индивидуальной диссоциации является репрезентативной при следующем приближенном сравнении. Повышенные кислотные свойства<-.— Ге (о) 4 СН (он) 4 Рb (он) 4 Ge (OH) Улучшенные основные свойства
Наиболее отчетливые кислотные свойства обнаруживаются в гидратах диоксида Германия, но это все же очень слабая кислота. Основные свойства наиболее выражены у Pb (OH) r>, который проявляет ярко выраженную щелочную реакцию на воду. Из-за своей амфотерной природы гидроксид, о котором идет речь, может быть растворен в сильных щелочах и кислотах.
Под действием щелочи образуется соль типа кислоты H2EO3 или H2EO2, которая включает в себя Gn. In в составе Анона, а также Sn или Pb под действием кислоты-эти элементы катионные и Е2 * или Е4 * .31-37 соль Из PB (OH) 2 в виде гидрата Pb02 и основания в виде кислоты, до Pb203 (Т. и закись азота) и ярко-красного Pb304(т. 2) получают смешанный оксид свинца. 1-свинцово-метатиновая соль (Н20303), а 2-Орто-свинцовая кислота (н40404).
Таким образом, оба оксида (PbP03 и Pb2Pb04) содержат атомы свинца с различными валентностями одновременно time. In в воде они практически нерастворимы. Кислотные соли типа Н2Э03 названы по их марганцевым, оловянным и свинцовым солям соответственно. Большинство из них бесцветны, слабо растворимы в воде. Растворимые соли в растворе (Na, K и др.) почти не гидролизуются. Кристаллическую окись олова натрия (Na2Sn03-3H20) можно приложить к ткани крася 40 ^ 42
Кислотные соли типа H2E02 называются зародыш, Пито, тинит и тянут m b и t, respectively. By природа, эти вообще подобна к гельмонату, олову и свинцовокислотному, но они имеют гораздо низкее стабилность и более добавочно гидролизованы внутри solution. By под действием окислителей они легко переходят в соответствующие кислотные соли типа H2E03.Особенно это касается немцев и станитов, которые являются очень сильными восстановителями.
Например, трехвалентный гидроксид висмута восстанавливается до металла с помощью станита. 2Bi (OH) 3 + 3Na2Sn02 = 3Na2Sn03 + 2Bi + 3H20 Эта реакция используется в аналитической химии 43-44 Вследствие слабых основных свойств гидратов Ge, Sn и Pb-диоксидов соли с катионами E4 * подвергаются сильному гидролизу в растворах. Среди соединений, которые здесь относятся, наиболее важными являются сплавы типа EG4, известные для всех рассматриваемых элементов и галогенов (за исключением PbBr4 и Pb4).
По физическим свойствам они не являются типичными солями (за исключением SnFi и PbF4), но близки к аналогам SI и C. Например, SnCl4 представляет собой бесцветную жидкость. Наиболее характерными свойствами железы EG4 являются ярко выраженная склонность к аддитивным реакциям. Например, SnCU легко образует комплексы С HCl, H2O, NH3, оксидами азота, PCU и др., а также со спиртом, эфирами и многими другими органическими веществами.
Химическое вещество compounds. In в частности, соли сложных кислот, таких как NaElGv, очень стабильны. Например, соль в композиции (NH ^ JSnCle) кристаллизуется из смеси растворов SnCl *и NH * C1, которые проявляют нейтральную реакцию на лакмус. При приеме внутрь в достаточно высоких концентрациях он не разрушается заметно даже при кипячении.
Соли кислородных кислот четырехвалентных Ge, Sn и Pb являются uncharacteristic. In в частности, были получены сульфат 3 (SOih) и ацетат E(CH3COO).Все они легко гидролизуются. Производное четырехвалентного свинца является очень сильным окислителем (в кислой среде).Именно поэтому при кипячении в 30% серной кислоте Pbo2, несмотря на то, что он сам является очень сильным окислителем, окисляет двухвалентный мл до марганцевой кислоты.
Реакция протекает по следующему уравнению: 5P02 + 2MnS04 + 3H2S04 = 5PbS04 + 2NMn04 + 2NaO В частности, на основе окислительных свойств четырехвалентного свинца основана работа свинцово-кислотных аккумуляторов.61 * 62 В отличие от венца EG4, Галогенидные производные 2-валентных Sn и Pb четко выражены в характеристиках соли.
Все они имеют хорошую кристаллизацию, плавятся только при относительно высоких температурах, а гидролиз в растворе значительно меньше, чем соответствующий галогенид EG4.Слабо неустойчивый двухвалентный Германий несколько ближе к последним характеристикам 83-69 многие Pb (OH) 2-Sn (OH) 2-Ge (OH) 2 из-за ослабления основных свойств гидроксида гидролиз разбавленных солей, полученных в этой серии, усиливается.
Соли двухвалентного Pb слабо гидролизуются, но производные двухвалентного Ge в растворе слабо гидролизуются. он почти полностью разобран производителем. Соль Sn24 ″ занимает промежуточное положение. Большинство солей Sn2 * бесцветны и очень растворимы в воде. Поскольку Sn2 * имеет тенденцию мигрировать в Sn4*, двухвалентное производное олова (еще больший диапазон-Германий) является сильным восстановителем.
Их раствор постепенно окисляется кислородом воздуха. Наиболее практичным значением соли Sn2 *является хлорид олова (SnCl2), который в основном используется в качестве восстановителя. Например, соли ртути восстанавливаются до металлов. HgCl2 + SnCl2 = SnCl4 + Hg Соли кислородных кислот двухвалентного олова (и Германия) нехарактерны.
Из них SnS04 используется для электролитического лужения (то есть покрытия других металлов оловом). В отличие от аналогичных соединений олова, соли двухвалентного свинца не являются восстановителями. Большинство из них бесцветны, слабо растворимы в воде. Что часто встречается на практике, так это то, что только азотная кислота[Pb (M03) 2]и уксусная кислота[Pb (CH3COO) 2) хорошо растворимы в 7 * — 7e Сульфиды, соответствующие типу 3S и 3S2 (за исключением PbS2) , могут быть получены как сушкой(из элемента), так и действием сероводорода на растворы соответствующих солей, содержащих Е-или Е «non.
In в последнем случае образуется осадок следующего цвета: GeS2 Ул. СЖ ГЭС КНС ПБС Белый желтый коричневый красный дВ воде и разбавленных кислотах, эти сульфиды практически нерастворимы. Исключение составляет то, что ГЭС *слабо растворим в воде и разлагается гидролизом. Сульфиды типа 3S и Eb существенно отличаются по отношению к аммонию sulfide.
It не действует на первую, но последняя переходит в раствор с образованием аммониевых солей т и о-германиевой (HjGeSj) и тиозной (HiSnSs) кислот по схеме (NH4) 2S + 9S2 =(NH4)23S3 Поскольку эти тиаты в свободном состоянии нестабильны, подкисление раствора их солей приведет к удалению H2S и отложению сульфида E$ 1.77-88 ′ Именно их водородные соединения обладают несколько иными химическими свойствами Ge, Sn и Pb.
In в случае двухвалентных элементов они не характерны, но в случае четырехвалентных элементов стабильность ряда Ge-Sn-Pb ухудшается очень быстро, поэтому наличие PbHi может быть доказано, но его свойства не изучены. Когда кислота разрушает магний и сплав этих элементов, все 3 гидриды образуются в виде следовых примесей, чтобы hydrogen.
By охлаждая газовую смесь жидким воздухом, ее можно отделить от водорода. Пространственная структура EN * гидридов соответствует тетраэдру, центрированному на атоме Е. Физические свойства Ге и СНЧ ^похожи на СИ и C аналогичными соединениями. Кроме того, как видно из следующего сравнения, это бесцветный газ с низкой температурой плавления и низкой температурой кипения. CH4 SIH4 Q » H » SoH4 Тепж>их образование, ккал / моль+ 18 −8 −22 −39 <(ВАННАЯ), ТЕЛЕВИЗОР…………. 1.09 1.48 1.63 1.70 Энергия связи 3-Н, ккал / моль••99 76 74 h 71
Точка плавления, * С*. 。 •-184 −185 −166 −146 Температура кипения,°С….. −161 −112-88 −52 В процессе хранения гидриды Германия и олова постепенно разлагаются на элементы. Коллапс такого GeH * происходит быстро примерно при 350 ° С, а SnH4-примерно при 150°С. Вода разлагается относительно медленно, как и разбавленные растворы кислот и щелочей. Оба гидрида по токсичности близки к водороду мышьяка.
Добавь 1) Германия в 1871 И. Д. было предсказано Менделеевым, и был обнаружен в 1886 году(ви§ 1).Свинец относится к элементам, известным человечеству с древних времен. Египтяне смогли вынюхать их из руды, более чем за 3000 лет до нашей эры. e. In Индия, Евнея стала известна около 2600 лет, олово-около 1500 лет до нашей эры. е. выплавка олова осуществлялась в Древнем Китае (рисунок х-72).
2) природный Германий состоит из изотопа с массой 70(20,5%).»72(27.4)»、73(7.8)、74(36.5)。 78(7.8); ’oooooo’-\ 2(0.9%)、114(0.7)、115(0.3)、118(14.2)、117(7.6)、118(24.0)、119(8、 6)、120(33.0)、122(4.7)、124(6.0); нормальный свинец-202 (след)、204(1.4%)、206(25.2)、207(21.7)、208(51.7)。 8) в основном состоянии атомы элементов германиевой подгруппы имеют структуру электронной оболочки 4s * 4j *(Ge), 5 $ * 5p (Sn), 6 $» 6p»(Pb) и являются двухвалентными. Возбуждение квадрантных состояний Ge (4 $ 4p) и Sn(5s5p120 и от атома ккал / г соответственно.
Непрерывная энергия ионизации всех 3 атомов элементов показана ниже (eo): I II III IV Гэ 7.88 15.93 34.21 45.7 ЗП 7.34 14.63 30.49 40.72 Свинец 7.42 15.03 31.93 42.31 Электронное сродство атомов Германия оценивается в 24 ккал / г атомов. 4) Богатые германием минералы-Германий и nt (Cu? SCuS-GeSj) и альгеродит (4Ag2SGeS2)—редки. Напротив, следы Германия были обнаружены во всех исследованных силикатах. Известны случаи, когда значительное количество этого элемента (до 1%) содержится в золе твердых и бурых углей. О Германии и ее соединениях имеются обзоры и монографии.
5) олово почти всегда встречается в виде оловянных камней (иначе оловянные камни).Разработка оловянной руды является рентабельной (т. е. экономически целесообразной), даже если Оловянная Руда содержит 0,2 мас.%Sn. Самая важная руда свинца-Галеновая (иначе свинцово-глянцевая), не менее важная-минерал cerussnt-PbCOz. с)Среднее содержание элементов подгруппы Германия в естественных условиях составляет 10 ″ * Вт.%От заказа. Однако некоторые растения имеют содержание 3 мас. Концентрируйте свинец, когда он достигнет%.Биологическая роль всех 3-х элементов неизвестна, но Германий стимулирует активность костного мозга и селезенки.
Человеческое тело содержит около 2 I0 «s олова и 110» *% свинца по весу. Из отдельных частей тела, наиболее высокое содержание СН в языке, а PB в длинных трубчатых костях. Считается, что средний суточный рацион человека включает около 17 мг олова и 0,3 мг Рb. Оба элемента выводятся в основном с калом. 7) в конечном счете, GeOa будет отделен от природных материалов, включая Германий. Затем водород снижает его примерно до 1000°C Металл.
Простейшая схема промышленного производства свинца основана на двух последовательных реакциях: 2PbS + 30 * = 2SO * + 2PBO + 202 ккал, 2PBO-f PbS — f-56 ккал = SO, — fЗРЬ. 8) чистка руководства может быть сделана более удобно электролизом. Электролит представляет собой раствор PbSiF.В качестве анода используется пластина из технического металла, а на катод наносится чистый свинец(99,99%).
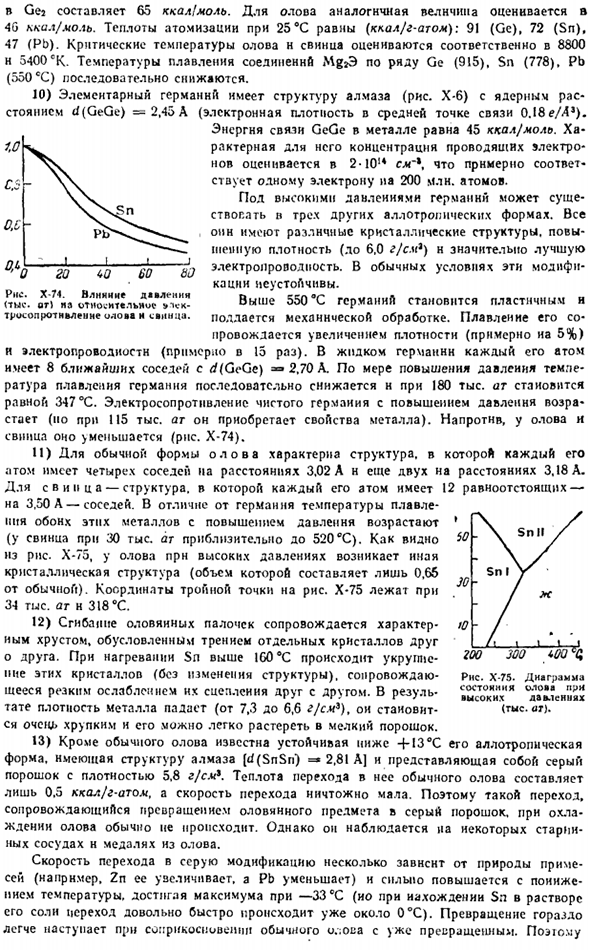
9) степень сжатия элементов германиевой подгруппы относительно невелика (рис. х-73).Теплоты их плавления и теплота испарения имеют следующие значения, соответственно.7.6 и 80 (Ge). 1.7 n 69 (Sn), 1.2 и 43 атома ккал / г (Pb).Пара олова и свинца почти исключительно состоит из одноатомных молекул, и в Германии (относительно низкая температура-1G00-T-2000°K), Ge полимеры также включены. Где n = » 2-f-7.
Объединение энергии Геге * Джон сой О. успехи в химии. 1956 год. М.| 105. Новотный Х.. Достижения в области химии. 1958, м. 8.997.Н » В. А. Заря, Андрианов А. М.. Успехи в химии. 1965 год. .В » 8. 1313. ** Давыдов В. И. Германия. М. Металлургов. 1964 год. / Е6 п р и Н И Е » И. В.. ШП и РТ М. Я. Химия Германии. М..«Химия.» 1967.451 секунды Самсонов Г. В. Бондарев В. Н. Жерменды. М.. Металлургия 1968.220 секунд 21 Б. В. Некрасов Х-72.Выплавка олова в Древней Китии. Фигура / ’J и с J 6У порядка ФФ и V см Рисунок Х-73.Степень сжатия элементов подгруппы germanium.
In в Геа она составляет 65 ккал-моль. Для олова аналогичное значение оценивается как 4G ккал / моль. Теплота распыления при 25 ° С равна (ккал / Гатом): 91 (Ge), 72 (Sn), 47 (Pb).Критические температуры олова и свинца оцениваются соответственно в 8800 и 5400 экв. Температура плавления соединений Mg * 915 серии Ge (778), Sn (550°C) и Pb (3 ° C) постепенно снижается. 10) элементарный Германий имеет структуру алмаза с ядерным расстоянием d (GeGe)= 2.45 A (электронная плотность в средней точке связи равна 0.18 e / A*) (рис. X-6).
Энергия связи Геге в металле составляет 45 ккал / моль. Характерная для него концентрация электронов проводимости оценивается в 2-10 см-1,что соответствует примерно 1 электрону и 2 миллиардам атомов. Под высоким давлением, Германий присутствует в 3 других аллотропных. Кристаллическая структура всех СПЭ различна, плотность увеличена(до 6,0 г / см), и электрическая проводимость значительно improved. In в нормальном состоянии эти изменения неустойчивы.
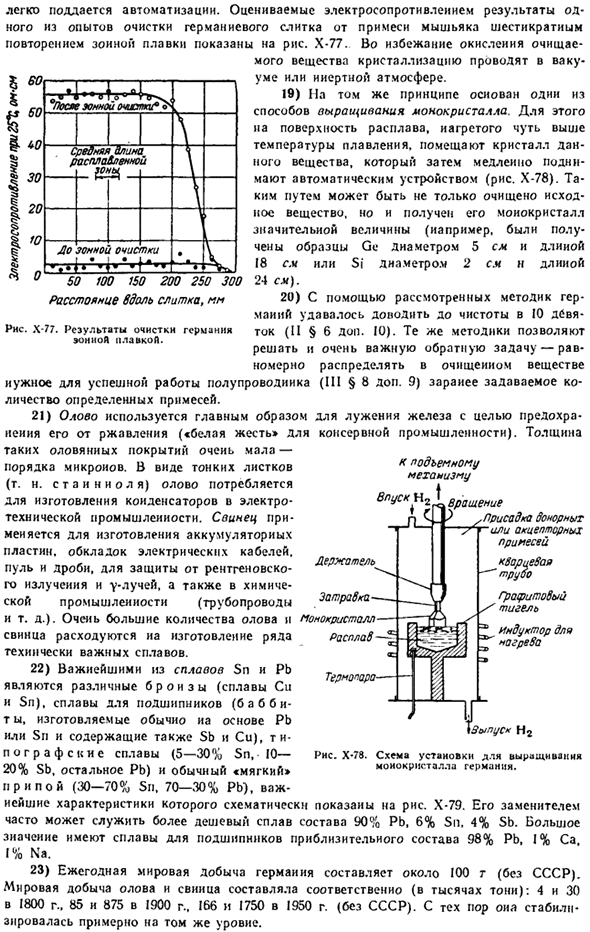
Более 550 * с, Германий становится пластичным и может подвергаться обработке. Его плавление сопровождается увеличением плотности (примерно на 5%) и проводимости (примерно в 15 раз). в жидком Германия каждый атом имеет 8 ближайших соседей, d (GoGe)=■ » 2.70 A. At при увеличении давления температура плавления Германия постепенно снижается, и при 18 тысячах градусов она равна 347°С.
Электрическое сопротивление чистого Германия увеличивается с увеличением давления(однако при давлении 115 тысяч он приобретает свойства металла).Напротив, он уменьшается с оловом и свинцом (рисунок х-74). I) типичная морфология олова характеризуется структурой, в которой каждый атом имеет 3,02 расстояния с 4 соседними атомами, а другой с 218 расстоянием с 2 соседними атомами. — Neighbors.
In в отличие от Германия, Температура плавления обоих этих металлов увеличивается с увеличением давления (свинец составляет 3 млн. Ат. Примерно до 520°С). Как видно из рисунка х-75, при высоком давлении на олове появляется другая кристаллическая структура(ее объем обычно составляет всего 0,65).Координаты тройной точки х-75 на рисунке составляют 318 тысяч при 34°С. 12) изгиб жестяной палочки сопровождается характерным хрустом, вызванным трением отдельных кристаллов друг о друга.
При нагревании Sn до 1g0°C и более эти кристаллы становятся крупнее (без изменения их структуры) и их взаимная адгезия резко снижается weakened. As в результате плотность металла снижается (с 7,3 до 6,6 г / см*), масло становится очень хрупким, его легко измельчить и превратить в мелкий порошок. 13) Кроме обычного олова, аллотропное, стабильное ниже-f 13°C, имеет алмазную структуру(d(SnSn)= * 2.81 A) и представляет собой серый порошок с плотностью 5.8 г / СМГ.
Нормальная теплота перехода олова к нему составляет всего 0,5 ккал / г атомов, а скорость перехода пренебрежимо мала. Поэтому такой переход с превращением оловянных предметов в серый порошок обычно не происходит при охлаждении олова. Однако ОИ наблюдается на некоторых древних кораблях и оловянных медалях.
Скорость перехода к серому обесцвечиванию несколько зависит от природы примесей(например, 2n увеличится, но Pb уменьшится), причем с понижением температуры она значительно возрастет, а при максимуме −33°С(если Sn находится в растворе солей, переход произойдет довольно быстро) — 0°С. Когда нормальные островки вступают в контакт, трансформация становится значительно легче; OVA с теми, которые уже преобразованы.
Для Рисунок Х-74.Иосит «li1> s» ЧСК-Тросолротнмайн на олове и свинце Влние дпслинн(тысяча штук). Рисунок Х-75.Государственная схема олова в случае большого количества пожертвований (в тысячах).Вы можете»заразить» предметы олова друг другом, и таким образом распространить»болезнь», которая называется»чумой олова».
Последний часто встречался в Средние века, а домашняя кухня богатых слоев населения изготавливалась из различных сплавов, главным образом на основе tin. In в большинстве случаев поражались органные трубы, изготовленные из довольно чистого олова. Экспедиция Скотта на Южный полюс угасла в 1912 году, когда был уничтожен запаянный оловом сосуд с жидким топливом. Жестяной песто следует принимать во внимание, особенно если вы храните запас олова.
14) серые кристаллы олова могут быть получены из насыщенного раствора ртути при −65°C. It обладает полупроводниковыми свойствами и характеризуется особой чувствительностью к инфракрасному излучению (до 15 мкм). Добавление 0,75% Германия может увеличить практическую область стабильности серого олова до-f GO°С. 15) Германий является типичным полупроводником с запрещенной зоной 0,75 ea (l-tnpa) и имеет множество применений в электротехнике.
Наиболее широко применяются в производстве выпрямителей переменного тока. Это приложение описывает однополярную проводимость, возникающую в результате контакта между чистым Германием и сплавом Германия и Индия (III§ 8 add. II) основывается на. Ток (поток электронов) в таких установках протекает почти исключительно от Германия к сплаву, но наоборот. Германиевый выпрямитель характеризуется очень высоким (около 98%) КПД и очень длительным (при правильном использовании) сроком службы. Основным недостатком таких выпрямителей является их чувствительность к теплу-выше 70°С, и эффект быстро снижается.
1С) важной областью применения Германия является инфракрасная оптика. Это связано с тем, что он практически не задерживает лучи с длиной волны более 2 мкм. Напротив, на свету и в близком к нему диапазоне (0,2-j-2 мкм) Германий интенсивно поглощает энергию. Если глянцевая металлическая поверхность (тепло хорошо сохраняется, но хорошо нагревается) покрыта тонкой пленкой Германия, то поверхность нагревается гораздо сильнее, чем без него. film.
It сообщалось, что в резервуаре, приготовленном под воздействием солнечного света таким способом, получается кипяченая вода. 17) чтобы использовать Германий в качестве полупроводника, он должен быть очень чистым. Например, содержание As не может превышать 10 7% (10 атомов на 1 миллиард атомов Германия). для достижения такой высокой чистоты сырье для полупроводниковых материалов должно быть сначала тщательно очищено.
Это вещество. 18) такая чистка обычно основана на нем. При частичной кристаллизации расплавленного вещества примеси не распределяются равномерно между твердой и жидкой фазами. Чаще всего они концентрируются в расплаве (описание рассматривается ниже).Простейший вариант применяемой технологии схематично показан на рисунке. Х-7г. при этом расплав в огнеупорной лодке непрерывно охлаждается с одной стороны (рис. х-76.
А), примеси выталкиваются до тех пор, пока они окончательно не затвердеют. удаление этого края слитка даст вам более чистый материал, чем оригинал. еще один более продвинутый вариант зоны плавления (см. Рисунок х-76). 図X-76.fi () — перед нагревом и плавлением последовательно обнажаются отдельные участки материала, помещенные в огнеупорную лодку, и движущаяся зона плавления переносит иримит на один конец слитка.
Захристалгазвавший деталь В Направление кристаллизации — Направление тепловыделения Кристаллизация и плавление некоторые аллеи в / заеружа 5 месяцев Кусок. Направление движения зоны расплава ’ Рисунок X ГБ. Чистая схема очистки кристаллизации. Легко автоматизировать.1 результаты экспериментов по очистке слитков Германия от примесей мышьяка с 6 циклами зонной плавки, оцененные по электрическому сопротивлению, приведены на рисунке 1. X-77.
To во избежание окисления очищаемого вещества кристаллизацию проводят в вакууме или инертной атмосфере. 19) 1) один из методов выращивания монокристалла основан на том же principle. To для этого кристаллы этого вещества помещают на поверхность расплава, который нагревают чуть выше температуры плавления, и медленно подтягивают его автоматическим устройством (рис. х-78).
Таким образом, можно очистить не только исходный материал, но и получить кристаллы значительных размеров(например, был получен образец Ge диаметром 5 см и длиной 18 см, или образец Si диаметром 2 см и длиной 24 см). 20) используя методы, описанные выше, можно было довести Германий до чистоты 10 девяток(II§ 6 добавление.10).
Этот же метод позволяет решать очень важные обратные задачи-равномерно распределить по очищенному веществу Заданное количество определенных примесей, необходимых для нормальной работы полупроводника (III§ 8, 9). 21) олово в основном используется для лужения железа для защиты железа от ржавчины («жесть» в консервной промышленности).Толщина такого оловянного покрытия очень тонкая- К лифту. К механизму Свинец расходуется на изготовление многих технологически значимых сплавов. 22) наиболее важными среди сплавов Sn и Pb являются различные бронзы (сплавы Cu и Sn).
Несущие сплавы (обычно на основе свинца или олова, а также содержащие SB и Cu баббиты), печатные сплавы(олово 5-30%, Sb 10-20%, остальное свинец) и обычный»мягкий»припой (30-70%) Sn.70-30%Pb), его наиболее важные свойства схематично показаны на рисунке. X-79.In во многих случаях его можно заменить более дешевыми сплавами с составом Pb 90%, Sn 6%. 4% СБ. Большое значение имеют сплавы для подшипников с составом приблизительно 98% Pb, 1% Ca и 1% Na. 23) мировое годовое производство Германия составляет около 100 тонн (без учета Советского Союза).
Мировое производство олова и свинца (тыс. тонн) соответственно: в 1800 г.-4 и 30, в 1900 г.-85 и 875, в 1950 г.-166 и 1750 (за исключением СССР).С тех пор нефть стабилизировалась примерно на том же уровне. Я с 6 * I-40 В Тридцать Двадцать — ! После очистки меня* \ Морской фонтан асплаленнс Жо * * и\ \ МО Т5 ″ зона Оке 1. 4JX Так 100150200250300 расстояние вдоль слитка, мм {г Да. Рисунок Х-77. Результат очищения Германии путем плавления Аона. Заказ микрона. Тонколистовой формы (т. А Т и Н и о л и), олово расходуется при производстве конденсаторов в электротехнической промышленности.
Свинец используется при изготовлении аккумуляторных пластин, крышек электрических кабелей, пуль, выстрелов, защите от рентгеновских лучей и радиации, а также в химической промышленности (трубопроводы Н2 На Входе Я Держатель Вид Термопара Расплав — ^ — КГФ-’ Аддитивная донорная или акцепторная примесь J кварцевая » труба графитовый тигель Индукторы для нагрева Выпуск и 2 Рисунок Х-78.
Схема установки для выращивания монокристаллов в Германии. И так далее).24) летучие соединения свинца в большом количестве олова и монокристаллов окрашивают бесцветное пламя газовой горелки в бледно-голубой цвет. Даже в очень малых дозах они постоянно вводятся в организм, накапливаются (частично замещают костный скелет кальцием), и его токсическое действие постепенно усиливается. Отравление свинцом может проявляться как профессиональное заболевание человека, который постоянно имеет дело со сплавами или свинцовыми изделиями (например, пишущей машинкой).
Первым симптомом хронического отравления является боль в животе, которая может иметь серый ободок на коже. gums. In в дальнейшем возникают различные расстройства нервной системы. Предельно допустимое содержание Pb в воздухе производственных помещений составляет 0,00001 мг / л, а в воде водоемов-0,1 мг / л. острое отравление свинцом вызывает серьезные повреждения желудочно-кишечного тракта tract. In при остром отравлении в качестве первой помощи используют разбавленный раствор H2SO4.
25) соотношение элементарных и индивидуальных кислот в подгруппе Германия очень различно. Соляная кислота не влияет на Германий. Олово только растворяется очень медленно в разбавленном I1Cl, но в концентрате реакция протекает легко (особенно в IgA) по схеме Sn + 2HCI » SnClj + Hj. При взаимодействии с HC1 свинец покрывается слоем плохо растворимого PbClj для предотвращения дальнейшего растворения металла. Аналогично происходит взаимодействие p, / C. x-79.Ягрыд свойства и используют серную кислоту, но только те, у кого есть припой.
Пока его прочность не превышает 80%.Больше пиара При высоких концентрациях H2SO4 образуются растворимые кислотные соли Pb (HS04h (или hjpb (SO<) jJ), которые перестают защищать от дальнейшего действия свинцово-серной кислоты. I t2S04 оба элемента растворяются по схеме: E + 41 laS04 = E ($ 04B + 2SOj-f4HrO. Благодаря действию азотной кислоты Ge образуется гидрат-xGeOj-1 / hso осадок диоксида formed. As ну а схема Sn + 4IINO3 = SnOj + 4NOj-f 2H20-концентрированная азотная кислота также действует на олово, но, наоборот, очень разбавляется холодной HNOj оловом, Sn (. Оно растворяет медленно вместе с образованием OJ.
In в этом случае выделяется водород, но он переходит к восстановлению азотной кислоты. 4h20 отлито в форму Pb (NO.) j. эта соль неразрешима в сконцентрированном HNO и защищает металл от более дополнительных кисловочных влияний. 26) щелочной раствор почти не влияет на Германий(поскольку HjOj присутствует в то же время, он легко растворяется).Если окислителя нет, то олово и свинья будут медленно растворяться в сильной щелочи по схеме. E■+ * 2N’AOH-NajSOb + H-растворимость олова в щелочи используется для удаления олова из старого can.
In на практике такой лизис (обычно с добавлением метанитробензойной кислоты) проводят по схеме PS: Sn-2NaOH + Oj = Najsnj + 1LO. В связи с высокой стоимостью олова его воспроизводство(обратный прием) имеет большое экономическое значение. 27) стабильность свинца в воде в значительной степени зависит от содержания углекислого газа, растворенного в воде. Его низкая концентрация способствует стабильности свинца, так как на его поверхности образуется слой Pb03, который практически нерастворим.
Напротив, при высокой концентрации CO2 образуется кислый карбонат свинца (Pb(HCOj) 2]), который становится раствором. При употреблении содержащей его питьевой воды отравление свинцом происходит постепенно. * Об этом свидетельствуют результаты анализа реликвий древних римлян. 28) ниже сравнивается окислительно-восстановительный потенциал ©, соответствующий типичному валентному переходу Германия и его аналогов(левая часть соответствует кислой среде, а правая-щелочной среде). 0 +2 ! (0.0)Дж 1 −0.14!Я-0,13! * −1.0- −0.91 Я −0.54 Я Значение Ge Sn Pb +4 +4 −0.12 +0.15 + 1.68 −0.90 +0.28
Эффективные радиусы E * * и E44 составляют 0,98 и 0,44 (Ge), 1,02 и 0,74 (Sn) соответственно. 1.32 и 0,84 а (ПБ).Для силовых констант простых связей ЭО приведены значения 2,8 (Sn) и 1,9 (Pb). в 29) значения теплоты образования ЭО-оксидов из элементов(ккал / моль) составляют 61(Ge), 08 (Sn), 62 (Pb).
Оксид Германия получают путем проведения реакции, протекающей при 700-900°C: CO,+ Ge GeO + CO. At при этих температурах он летуч (ji (GeO)= 3,27]и осаждается в виде аморфного бледно-желтого порошка на охлажденной поверхности. Диоксид Германия (mp 1116, mp.1200 * C), приобретение металлического Германия наоборот, SnOj (точка плавления 1630 * C) и PbO (точка плавления 886.Температура плавления 1680 ° с) получают путем нагрева металла на воздухе.
Оксид олова получают нагреванием раствора именно sncl2 с щелочью. В ее состоянии, она, как правило, демонтированные по 2SnO-SnOj-СН схема и стабилизирована в жидкости (плавящиеся при температуре 1040°С) и газов(плавящиеся при температуре 1425 ° с). Для получения PbO обычно используют реакцию свинцово-уксусной кислоты с отбеленной известью и протекают по схеме: Pb(CH3COO),+ Ca (CI) OCI-F H, 0-PbO, J-f CaClj + -f CHF, COOH.
Когда отопление Буп, последующим формированием низшего оксида свинца происходит: ПБО (290-320 см) — Pb20, (390-420°с) — Pb50 (630-550°С) — Н-ПБО. 80) диоксид Германия присутствует в 2 кристаллических формах с различной плотностью (6,3 или 4,3 г / см*), температурой плавления (1086 или 1116°С) и химической активностью.
Наиболее устойчивая форма высокой плотности (тетрагональная) нерастворима в воде и взаимодействует с HCl или HF и очень медленно растворяется в горячих растворах NaOH, но обычно форма низкой плотности (4 г / л) заметно растворяется в воде и реагирует с HCl или HF, а в горячих щелочных растворах легко растворяется. 1. температура превращения из одной формы в другую составляет 1033 * С, но переход происходит очень медленно.
Аморфный ГСО (плотность 3,7) обладает свойствами, сходными с гексагональными, например, его расплав быстро охлаждается и является основным продуктом дегидратации гидроксида. Геоиндивидуальная форма, образующая тепло от Элементаля, составляет 139, 133 и 128 ккал / моль.
- Диоксид олова растворим только при длительном нагревании в концентрированных H, SO4 и практически нерастворим в сильных щелочах(но может быть превращен в растворимое состояние путем слияния с ними). он довольно легко взаимодействует с кислотами и щелочами. Низк-окись (тип EO) рассматриваемого элемента почти неразрешима в алкалие, и своя растворимость в кислотах повышена серией Ge-Sn-Pb. 31) двуокись
Германия очень важна для индустрии оптического стекла. Это не удивительно, потому что диоксид кремния, когда он частично заменен, производит стекло с очень чистым и высоким показателем преломления. Двуокись олова используется при изготовлении эмали и глинозема в керамической промышленности, а также используется для полировки стекла. SnO * стекло с поверхностным слоем имеет полупроводниковую проводимость. Оксид олова используется для производства стекла (для получения рубинового стекла) и трафаретной печати.
Диоксид свинца(иногда называемый перекисью) потребляется в спичечной промышленности. Людмила Фирмаль
Восстановитель.)Оксид свинца известен в двух вариантах: желтый («масикот») и красный («ризаж»). Менее 489°C, самая стабильная форма согласно удовлетворенности. Теплота перехода составляет всего 0,4 ккка / моль. Растворимость в большей воде (0,05 г / л) составляет примерно половину растворимости Мюссе. Оксид свинца предназначен для медицинского применения(свинцовые пластыри) и потребляется во многих странах. industries.
It также используется в производстве замазки смешанной с глицерином для металла, стекла и камня. 32) для молекулы ЭО приведены следующие значения: b(ЭО)= 7,4. 5.5. 4.5; м = 3.28, 4.32,4.64.Энергия связи оценивается в 156, 126 и 89 ккал соответственно в моле, то есть в ряду Ge-Sn-Pb она быстро уменьшается. 33) свинцово-глицериновую замазку готовят путем тщательной сушки при 300°С ягодицы и тщательного смешивания с безводным глицерином (весовое соотношение 5: I).
Он твердеет через 30-40 минут и твердеет через несколько часов (за счет образования свинцово-глицеринового соединения).Полученная твердая масса является газо-и водостойкой, обладает высокой механической прочностью и выдерживает нагрев почти до 300°С. Перед нанесением шпатлевки поверхность, подлежащую склеиванию, следует протереть глицерином. 34) формы гидратации, описанные в тексте-E (OH) 3 и E (OH) — являются simplest. In дело в том, что осадок гидроксида содержит разное количество воды, состав которой имеет более общие формулы xEO•yN20 и xEO | * t / li20.
Соответствующие им комплексные соединения известны в виде специфических гидратов. Например, случай гидрата SnOj * 4HjO представляет собой соль соединения молибдата олова MdSnfMosOr).Здесь M-одновалентный металл. Германий также известно, что аналогичное гетероперехода. 35) двухвалентное олово и свинья Sn (011) t (PR I•10″) и Pb (OH) a (PR = I•10″, b) константа Pb (OH)на первой стадии основной диссоциации при постепенной нейтрализации разбавленного (0,01〜0,1 м) кислотного раствора солей a (PR = I•10″) кислоты равна I10 * 10 ″ N.
То есть каждая молекула диссоциирована по типу кислоты, 1 миллиард молекул диссоциирован по основному типу. Константами основных 2 стадий диссоциации Sn (OH) 2 и Pb (OH)*(EOH * ** E «+ OH’) являются I * 10 ′ и 2 * 10〜 .Кислота из диоксида Германия, полученная HjGeOj (/,«=! 10′ * K * «= 2-10’») n HjGesOi: (K,= 6•10″’, K: −2• 10 f), но наличие 2-го неоспоримо, если гидрат диоксида олова, известно только значение первой константы диссоциации кислоты:/ C / = 4•10〜, C. 36) гидрат двуокиси олова обладает свойствами gel.
It содержит большое количество воды (например, из-за действия NaOH на SnCl4) свежеосажденной, и при исследовании рентгеновскими лучами она не показывает кристаллической структуры. Если его поместить под раствор или нагреть, он будет постепенно разрушаться. По-видимому, этот процесс состоит из полимеризации молекул xSnOj•t / H20, которая протекает с удалением water.
As в результате он становится все более крупным, а частиц с ним все меньше water. At известная стадия старения, рентгенологический анализ уже выявил микрокристаллическую структуру (соответствующую структуре СНО) в геле. Они образуются при действии концентрированного HNO на металл олова—внутренняя кристаллическая структура позволяет получить непосредственно хорошо выраженный подобный гель. По мере старения геля SnOj меняются не только его физические, но и химические свойства.
Разница между двумя крайними случаями-вновь нанесенным гелем и сильно состаренным-очень велика, поэтому ее следует рассматривать отдельно. Форма, в которой осаждается соль, обычно называется кислотой а-олова и сильно стареет (или получается при действии концентрированной HNOj на олово) — Р олова.
С другой стороны, переход от А-формы к 0-форме постепенно протекает естественным образом. Инверсию можно проводить только при сплавлении Р-типа и щелочи с последующей обработкой сплавов кислотами. Сравните обе формы с приведенными ниже соотношениями HCf и KOH.
0-Оловянная кислота Оловянная кислота Под действием концентрированного HCI, образование SnC может легко растворить гомосексуалистов!」 Он легко растворяется при образовании KjShOj под действием растворов KOH (как сильных, так и разбавленных).Эта соль также получается в кристаллическом состоянии (KjSnOj-3HjO). Под действием концентрированного Хо заметных изменений с осадком не происходит.
Затем при разбавлении водой образуется осадок пептида и прозрачный золь. Добавление концентрированного HCl к последнему сопровождается коагуляцией и обратным осаждением Т-винной кислоты. В сильном растворе кон растворяется. Затем, сильно разбавленный водой, отстаивают осадок и формируют прозрачный золь. Кристаллические соли из последних получить невозможно.
За счет испарения Золя образуется сной гель. В том числе адсорбционной щелочи. Изоэлектрическая точка вновь осажденного геля * Sn02 f / HjO расположена вблизи рН 10. 37) 2-валентный гидроксид Германия получают восстановлением фосфористого раствора GeO2 в сильной HCl и последующим осаждением его избытком аммиака. Все манипуляции проводятся в атмосфере азота. Gc(OH) a выделяется в виде рыхлого осадка, и его цвет (белый, желтый или красный) зависит от условий приготовления.
Растворимость этого гидроксида в HCl выше, чем у NaOH, то есть его основное свойство преобладает над кислотными свойствами. С помощью инфракрасной спектроскопии было показано, что структура сухого и двухвалентного Германия фактически соответствует формуле Ge (OH) 2. При нагревании до 350°C IAH превращается в коричнево-черный GeO. 38) структура обоих промежуточных оксидов свинца может быть обоснована результатами их взаимодействия с разбавленной азотной кислотой. Например, из самых маленьких, 3 мин 2 всего свинца растворяется в Pb (N05) 2.
В течение оставшихся 3 минут 1 остается в виде PO2.Это доказывает, что в молекуле меерка есть 2 2 свинцовых и 1 4валентных атома. Аналогичным образом была продемонстрирована структура n-оксид-оксид. 39) путем смешивания щелочного раствора Pb (OH) 2 и Pb (OH), как оксид свинца, так и оксид могут быть obtained. In наличие избытка щелочей низкой концентрации, осадка закиси азота (в виде гидрата Pb2Os•ЗН20) и его высокая concentration-minimum. In технология, последняя получена путем нагревать PbO в воздухе к 450-500°C, добавляя кислород к PbO.
Порошок суриката, смешанный с льняным маслом, используется в качестве замазки и делает стыки труб газо-и водонепроницаемыми. 40) в дополнение к соли metacaric кислоты производные от H * эквивалентными часами эксплуатации гидрат,»(т. е. ЭО «•Н20), соли orthoic кислоты и «Е0″(т. е. Е02•2H20 является также известный как элемент интереса)) и смесь гидрокси кислоты (например, е (ой) е02•4H20).К последнему типу солей относятся, в частности, натриевая перлитная кислота (Na ^ Sn (OH) e]) и многие другие сульфаты.
Этот тип соединения является основным из солей свинцовой кислоты и гельмонатов (по крайней мере, в растворе).При нагревании до 100-150°С гидрозоль обезвоживают по схеме.. Номер 3 [е(о)с)-3H20f + НС ^ ОИ. Полученная безводная соль обычно очень тугоплавка(например, Na2GcOj плавится при 1083°C). Пиролиз станната калия (с потоком сухого азота) протекает по схеме: 3K2SnOs®2KgO | ++ KjSnjO? (Выше 830°C), то l ^ SnjO,= KrO | + 3Sn02 (выше 900°C).Подобные соли-KrpO3 и K2Pb307-также известны для свинца.
Потому что термическая стабильность многих солей свинцовой кислоты намного выше, чем у PbO2.Они получают путем накаливания на воздухе смеси PBO и соответствующего оксида металла (или гидроксида). 41) окрашивание тканей, изготовленных из натуральных волокон, осуществляется либо непосредственно путем сильной адсорбции краски на ее поверхности, либо путем осаждения красных частиц в порах, присутствующих в волокнах. Последнее достигается с помощью NRI Используйте разные methods.
In в некоторых случаях ткань пропитывают коллоидным раствором краски (водным раствором многих органических красителей), и благодаря действию электролита этот раствор затвердевает в воде. pores. In в других случаях ткань пропитывается раствором вещества, которое не является самой краской, но может быть превращено в нерастворимую краску, которая остается захваченной в порах волокон посредством соответствующей химической обработки (например, действия окислителя).
Но довольно часто (особенно окрашивание хлопка) ни один из вышеперечисленных методов не соответствует действительности. Затем используют так называемое травильное окрашивание. При таком окрашивании вещества, которые прочно удерживаются в волокнах, а также краска, которая хорошо адсорбируется, предварительно осаждаются на ткань.
Гидраты многих оксидов (в частности, * Sn02•(/Н20) ассоциируется с такими веществами, поэтому соль, которая дает их при гидролизе, используется в качестве протравы(например, Na ^ Sn (О!{)«]).в момент получения она окрашивается в нужный цвет. 42) образование истинных пероксидных соединений на элементах германиевых подгрупп не характерно, но известны некоторые продукты присоединения кристаллизованного пероксида водорода.
Например, в результате взаимодействия K2G0OS с 30%-ным раствором NaOa prn 0°C образуется белый кристаллический осадок K2Ge20s•2I202•2H20 (ранее считавшийся солью сверхмумановой кислоты— K2Ge207•4H20).Похожая соль, к? Sn2Os * 2H * 0 * * H20 известен для олова. Сообщалось также, что в составе Sn03-2Ha0 и sn2oj этого элемента образуются пероксиды•ЗН20.Они также, вероятно, являются добавкой к перекиси водорода (SnOj•H2Oj•HjO и 2Sn02•ЗИ202).Производные свинца неизвестны. 43) для предотвращения гидролиза станита раствор должен содержать избыток щелочи.
Если концентрация последнего низкая, то реакция разложения протекает в растворе медленно по схеме N’alisn02 = NaOH + SnO. As в результате раствор станкните при стоянии (быстрее-ПРН и нагревании) становится black. In при наличии большого избытка щелочи реакция разложения протекает по схеме: 2NaliSn02-Na2Sn03 + — f Sn-hH20.При выделении мелкодисперсного олова раствор в этом технологическом направлении также окрашивается в черный цвет.
Для элмита также характерны реакции взаимодействия, но их распад доминирует в высокощелочных средах благодаря схеме NallGeOj-f NaOH = Na2GeOjЧ-Hj. Основная форма присутствия эльмита. В щелочном растворе могут встречаться стэнднит и свинец. М(Е (О) Е).Здесь M-металл с 1-валентностью. Некоторые stanites этого вида-НС(ЗП (ОИИ) с).Ба | СН (о) Дж] 2 и т. д. были разделены в кристаллическом состоянии. Сплавление PbO и NaOH привело к получению свинца в составе Na2p02 (mp 820°С).
44) для солей типа mne02 элементов 4-й группы, В общем случае, Таутомерия возможна по схеме H_O_O_M * * 0 = E(H)-O_M. по-видимому, первая из этих структур соответствует производной Pb элемента pb_sn_ge_si_c, а вторая-производной C (формиат).Из промежуточных элементов 2-я структура также характерна для Si, но кажется, что существует равновесие в виде как Ge, так и Sn. 45) сравнение некоторых физических свойств, например, железы следующие:
ФГОС «ГЦСИ» Гебр «гель» СЯС «SnCI4 Снбр» Snl4 Пбф » РБС1″ Жара Знания. ккал / моль. 284129 83 34 126 97 225 79 Длина связи НАПР.. А. 。 1.67 2.1! 2.28 2.29 2.50 2.44 2.64 2.43 Энергия связи НАПР.. ккал / моль. 85 68 50 82 65 47 Цвет…..Бесцветный. Бесцветный бесцветный клаен. Бесцветный бесцветный желтый цвет Температура плавления Ния. °С. 。 −15-50 4-26 147-33 +30> 456С0-15 (Утвердительный ответ) Температура кипения Ния. °С. 。 −37 +83 187377705 205 344 (подл.(Г «Эл.) (подл.)
В отличие от газообразных при нормальных условиях ФГОС <| *(ФГОС)= * 5.3), Snfa и PbF4 являются чрезвычайно гигроскопичными кристаллическими материалами. Молекулы остальных рассматриваемых соединений имеют тетраэдрическую структуру с указанным выше ядерным расстоянием. Связи Gecl и SnCI характеризуются силовыми константами 2.9 и 2.7. 46) для Германия и олова было получено несколько галогенидов.
Пример GeFjCI(Мп.66.Мп.-20°С), GcFjCI *(Мп.52.Мп.-4 КС) и GeFCIj(Мп.-50) bp +37°C) или бесцветный SnCUBr (bp −1.bp 50°C) и желтый SnClBr3 (bp +1, bp 73°C).он нестабилен из-за выраженной тенденции спонтанной симметризации (add$ 4,99). 47) четыре-фторированной Германий обладает резким запахом (запах и т. д.), что вызывает задымление в воздухе.
Для него известен бесцветный и очень гигроскопичный кристаллогидрат GeF <-3H«0.Тетрахлорид практически нерастворим в концентрированной соляной кислоте. Но он хорошо растворяется во многих органических растворителях (и жидких SOj).Он гидролизуется с водой. Реагирует с сухим аммиаком по схеме: GeCl «+ 6N’hj * * 4N’hicl + — f Ge (NH) j. красный Qel » становится оранжевым при охлаждении до −10°C и бледно-желтым при температуре жидкого воздуха. При превышении температуры плавления начинается разложение по схеме. Гель » = Oel2-Ф Эй.
Акцепторные свойства тетрагаллида Германия более выражены, чем у соответствующего тетрагаллида кремния. 4J) GECL при 430°C <бесцветный кристалл Ge * Cle был получен (mp 41°C) за счет взаимодействия пара с металлическим порошком Германия. Давление паров при комнатной температуре составляет 3 мм рт. Искусство. Вода Ge ^ Cle разлагается на HCI и нелетучее белое вещество и, вероятно, имеет аналогичный сиди-Кош по составу (QeOOH) j и становится электронной кислотой (§ 4 add.76).
49) Эх самое практическое значение Галоида 4 * хлорид олова, который первоначально был описан Лнбавиусом (I§ I).Технически он обычно получается путем обработки использованных жестяных банок сухим хлором. Последний не действует на железо, а олово, покрытое тонким слоем, легко образует SnCl.4. хлор в воздухе превращается в дым(вследствие гидролиза атмосферной влагой), легко смешивается со многими низкополярными растворителями и является подходящим растворителем для многих неэлектролитов (например, l2, PS).
Олово обычно выделяют из водного раствора тетрахлорсодержащего олова в виде бесцветного кристаллогидрата SnCU•5Н: 0 (при температуре 19-56°С).Среди различных продуктов, кристаллический SnCU•2OPCI3 (mp.59, очередь 117 * 0) также не связывается с хлорным оловом, но рели интересен и дополняет кислородную конфигурацию к октаэдру (см. Рисунок IX-63). <is-polo-ЖС1п1 и друг друга, то есть обе молекулы оксихлорида фосфора расположены бок о бок.
H0) 4-валентный Порфторид Can 6Uts получается при действии фтора на PbFj при 250°C. масло очень чувствительно к влаге, оно водуха тот час тиыпефет(превращается в PbO).Тетрахлорид свинца. При охлаждении он образует ft в результате PbOa свободной формы и но strong. It является очень неустойчивым, и под влиянием Сун он растворяется в PbC и Clj даже в присутствии следовых количеств влаги. Номер бромида Schw.
Бессвинцовый не получается. 51) из производных рассматриваемого элемента, которые включают как кислород, так и галоген, интересным является оксо-хлорид Германия (GeOCIj), состав которого аналогичен фосгену. Это вещество представляет собой бесцветную, маслянистую, нерастворимую жидкость в нормальном растворителе (Мп.-56°с). GeOCIj растворяет воду quickly. In кроме того, Германовая кислота не образуется, а Ge (OH) j. продуктами пиролиза GeOCIj являются хлор и оксид Германия.
Последний получается в виде желтого фиксатора, который выходит за пределы 650°С и становится обыкновенным черным. Следует отметить, что существование GeOCIj было поставлено под сомнение recently. At в то же время имеются признаки возможного формирования Окофж (при взаимодействии ГЭФ и Сож).Также по схеме ES14 + C120 22CЬ4-EOS1 *были получены оксокролиды олова и свинца. Самый хорошо изученный Сноций-белый.
Очень гигроскопичный аморфный порошок, который распадается на SnOj и SnCI при 155°С. По-видимому, этот оксокролид является тримером и имеет циклическую структуру. Снофдж, Снобр и Снол также известны. 52) 4-валентность цианида Германия, аналогичная галилиту, получена по схеме: GeI + 4AgCN 4Agl + Gc (CN) 4.It это белый цвет solid.
It реагирует с водой или нагревается до 80°C и выше. KCN разлагается в растворе и, по-видимому, образуются ионы Ge (CN) e}. 83) известно, что и германий, и олово являются твердыми родами Анидо-3(NCS).Жидкость в нормальных условиях (Мп. При-8 ° С), мы получили около Германия (и кремния), но мы не получили олово. Напротив, азидное производное описано только для олова: это твердое вещество, синтезированное по схеме SnCU + 6NaNj = * 4NaCl 4-Nej (Sn (N3) e]и лишь медленно гидролизующееся на воздухе. Получаем Sn (N3). — Не получилось, — сказал он.
64) образование кислоты типа H ^ EHv в растворе приводит к неполному гидролизу Галидовег4.Таким образом, уравнение гидролиза, например SnCI», принимает вид 3SnCI» 4- + 4HjO 2HjSrtCle + Sn (OH) 4.Таким образом, гидролизуется только 3-1 от общего количества SnCl.- Но гидролиз этого Толети идет на свободную основу. То есть она протекает почти полностью. 63) гидрид фтористого водорода (HfGeFi) и его соли характерны для Германия(и кремния), примерами которых являются термически устойчивые KiGeFj (mp 730, mp 835°C).
Тетрахлорид Германия не проявляет кислотных свойств с жидким хлористым водородом (сходство с SiCl4 и различие с SnCU), а соли HjGeCle с Rb, Cs и объемными органическими катионами могут быть получены (различие с SiCI и сходство с SnCU). 33) в олове аналогичная соль была получена для всей половины ЭГ, но наличие производного 1b (PbBrv1 и HJPble) сомнительно. Некоторые из этих соединений стабильны даже при умеренном нагревании.
Например, желтый комплекс (NliVJlfPbCU) разлагается, когда он превышает 225°C. Эта соль высвобождается, когда NHiCl добавляется в раствор pbclj, насыщенный хлором при 0°C с концентрированным is1.In в отличие от аналогичных солей олова, PbOj. Ф — ТЫ!- Снижена устойчивость сложных жестяных гирлянд серии Br-I. 57) расстояние ядра * E-G некоторые ионы [EGvr sopos + avleni меньше (A): галстук-П Гэ-ХЛ, СН-ки ЗП-Бр СН-я ПБ-ХЛ Ил 2.13 2.42 2.59 2.50 2.84
Все они значительно крупнее соответствующего тетрагалоида (дополнительно 45).Для non-ІХ например ХТ обязательного принудительного cocell| — половина-пена стоимость: 4.4 ’(СЯС), 2.0(SnCI). 1.7 (PbCI).Некоторые свободные комплексные кислоты, например HjSnCU•6HjO(mp 20°C), были выделены в виде кристаллогидратов. Производное кислоты типа H / 9Fs1 также известно в Sn и Pb. Например, (M4) 4ShF.
Однако в некоторых из этих соединений было обнаружено, что истинное координационное число центрального атома бородавки составляет не 8, а 6.Ник. Кристаллы кислотной соли tHnaКЗЫЗР состоят из Nomos K * и HF£.Но и олово и Германия Получены кристаллические производные состава 4XeF «* EG4».Структура вероятна(XeFsh3Fi. 68) четырехвалентный сульфат олова[Sn (S04) a1 образуется при взаимодействии Sn с сильным hjso высокой температуры. из pdctBOpa выделяют Sn (SOA) в виде бесцветной иглы в составе 2-2HjO. Snc (S04) 2 SnSO * * * — f SO «составляет от 5 до 10*.
Желтый кристаллический порошок Pb (S04) 2 получают электролизом 80% HjS04 с использованием свинцового электрода. некоторые другие металлы образуют желтую двойную соль состава Mjtpbffsovh.) jは完全に加水分解されてPbOjを生成します.Ge (S04) я подвергаюсь аналогичному гидролизу. это же ГЭК!
59) взаимодействие SnCl4 с N20 $было результатом образования 4-валентного олова (NOj) 4.It представляет собой большой прозрачный кристалл (Мп.91°с).Можно сублимировать в вакууме. Оценка методом инфракрасной спектроскопии. Связь Sn-NOj осуществляется 2 атомами кислорода. Вода Sn (NO) 4 быстро гидролизуется. CC14 растворяется без крекинга и окисляет углеводороды.
Реакция, используемая для получения этой соли по схеме sncl4-f 4CINOs = 4Cb-h Sn (N03) 4,также интересна в качестве примера взаимодействия атомов хлора с ошибочной поляризацией(отрицательной в SnCl4, положительной в CINOj).Из композитных нитратов перечислены SN, v, Sn (NOj) 4-2Py и CsjJSnfNOs)®. Связи Sn-NO осуществляются в них 1 атомом кислорода. 60) тетраацетат (Pb (ClljCOO)
4) образуется под действием теплой уксусной кислоты и хлора и мочевой кислоты по следующей реакции: Pbs04-f 8CH3COOH-f — Cl2 = PbCl2 | + — f 2Pb(91bcoo)4 + 4I20.При охлаждении раствор Pb (CH3COO) 4 кристаллизуется в виде белой иглы (mp 175°C).Кристаллы имеют схожие особенности. Ge (CHjCOO) 4 (mp 156°С) и Sn (CHsCOO) 4(mp 253°С). в случае квадривалентных Пойлов известны соли и многие другие органические кислоты. Взаимодействие Pb(CH3COO) 4 и HU3 в безводном CHjCOOH производит желтую комплексную кислоту Hg (Pb (10e) b).
61) свинцовая батарея состоит из сетчатой свинцовой пластины, заполненной PBO и пастой воды, погруженной в 30% серной кислоты(плотность 1,2 г / см*).По реакции PbO-f H2SO4″PbSO» — f 1120 на поверхности пластмассы образуется слой плохо растворимого сульфата свинца. Когда постоянный ток протекает через всю систему в направлении, указанном стрелкой(рисунок х-80.
А) следующая реакция происходит на пластине (процесс зарядки). Отрицательный электрод положительный электрод PbS04-Ф 2С + 2Н * = РВ + Н, S04 PbS04 + так? — 2e-Pb (S04) 2 (ПБ «- Ф 2е = РВ) (РВ»-2е «ПБ») Свинец (S04) 2 + 2H20 PbOa + 2112S04 Так, при зарядке аккумулятора отрицательная электродная плата становится куском металлического свинца в виде губки, положительная электродная плата становится коробкой, а концентрация серной кислоты в растворе увеличивается.
Если оба электрода не соединены друг с другом проводником, батарея будет оставаться заряженной в течение очень долгого времени. Если же, наоборот, они включены в цепь, то ток начинает протекать через последнюю в направлении, указанном стрелкой (Б, рисунок х-80).Генерация электрического тока происходит за счет следующих реакций на электродах (процесс во время разряда).
Отрицательный электрод положительный электрод Pb-f Sa; = PbS04 + 2e Pb02-4-2HjS04 в Pb (S04)? — f 2H, 0(Pb ’»Pb» — f 2c) Pb (S04) 2-f 2e + 2H * ■ = PbS04-f H2S04 (РВМ + 2е » РВ * ’) Эти процессы происходили, когда аккумулятор был заряжен. Если перенос электронов от 1 Pb к другому Pb происходит по всем осям и это вызвано поглощением энергии, то во время разряда электроны естественным образом оттекают от нейтральных атомов свинца от ионов Pb*.
Напряжение тока тока полученного при сканировании свинцовой батареи составляет около 2 в. Такое большое количество соединений СБМ. Х-80.Схема свинцово-кислотных аккумуляторов. Эмуляторы могут быть сконфигурированы с батареями, которые являются достаточно мощными, чтобы обеспечить работу электровоза. 62) интересна реакция гипохлорита с пруруводоксидами, протекающая по схеме: 2PB02-f 4HOCI = 2PBC1a-f 2H20 + 302.
An примером может служить реакция по формуле. 2Cr (OH) j + 3PO2 + + 10KOH = 2K2SU4 + 3K2PO02 + 8H20. 63) некоторые характеристики Галоидных солей Sn2 *и Pba *сравниваются ниже: SnF j SnClj SnBrj Snlj PbF, PbClj PbBrj Тепло?* Образование. Сто шестьдесят два ккал / МО ^ б……. 79 62 35 86 68 42 Длина связи-E-G. A. 。 2.06 2.43 2.53 2.78 2.13 2.46 2.60 2.81 Цвет………..Яростный.
Бесцветный желтый клаен. Я люблю эту игру. Бесцветный, бесцветный, желтый Температура плавления. °С. 215247232320822501501370412 Температура кипения. °С. 。 。 623 638 718 1200 554 914 872 Помимо мономеров, в бункере ShF2i было обнаружено присутствие димеров и триммеров. Кроме того, бифторид свинца имеет тенденцию к рассогласованию по схеме: 2PbFa = PbF4-f Pb.
Олово галлия легко растворимо в воде (кроме Snij). в серии CI-Br-I растворимость обоих уменьшается. Интересно, что галогенид Pb2 является более формамидом, чем вода (§ 2 ext.83), его растворимость обращена вспять (I> Br> C1).Значения констант диссоциации ионов EG *в водном растворе составляют: 1 * 10 *(SnF), 9 * 10 (SnCl). 2-I0 ′ 1 (SnBr). 3-10 ″ 1 (PbCI).*(PbBr)〜2-10.1•10- *(РЫ -). 64) удалить грубые олова от свинца с помощью плавления безводного именно sncl2 время от времени(реакция именно sncl2-ФБ = PbClj + ЗП).
Хорошо растворим в ацетоне (примерно 1: 2 по весу) и других органических растворителях (спирты, эфиры) и отделяется от водного раствора в бесцветный кристаллический гидрат именно sncl2•2Н20 («Оловянная соль»), которая плавится при температуре 40°С. фторид олова. Он представляется наиболее эффективной добавкой фторида в зубной пасте. Тип пбфр смешанной соли руководства (растворимость около 0-5 моль! Л, С1-Бр -!
Незначительное увеличение ряда) иногда используется при определении фтора. 65) распространенным способом образования двухвалентного Галогенида Германия является реакция по схеме Ger4 + Ge = 2GeI * 2.Теплота образования молекул из элементов равна (ккал|моль): 113 (F), 42 (C/). 16 (Vg); −18 (I), а для средней энергии связи 94 (CI) дается 82 (Br) ккал / моль.
Галогенид GeTj представляет собой бесцветное (за исключением желтого Gel2) твердое вещество, которое может быть неизменным в Ger4 и Ge. Серия F-Cl-Br-I улучшает стабильность. Вода была сильно гидролизована. 66) путем пиролиза GeCl4 при температуре около 1000°с, gocl состава коричневого (после очистки-желтого) Германия (точнее GeCl0. «) Было получено.
Это микрокристаллическое вещество устойчиво в вакууме до 360°C. дальнейшее нагревание вызывает диспропорционирование в Ge и GeCl4. 67) считается, что частичное образование подобных субгалогенидов Sn и Pb ответственно за растворимость этих металлов в сплавленных ГАЛОГЕНИДАХ EH2.Эта растворимость увеличивается по мере увеличения количества c / — Br-I галогенов и повышения температуры.
Например, Sn (0.07) при sncl2 0.003 и SnBr 500°С, и РБС при PB PB / 2-600 ° с 0.02 при 700 ° С при 0.05, 800° при 0.12 с. 68) EG4, а также галогенид. Двухвалентная галоидная соль Ge. SN и PB могут образовывать комплексные соединения, но они значительно менее стабильны. Такую тенденцию к комплексообразованию можно обнаружить в серии F> CI> Br >> 1.In дело свинцово-ретроградное. Они характеризуются комплексами типа M [EG$) и M ^ EG»).в разбавленных водных растворах они разлагаются на простые ионы, которые почти полностью соответствуют.
Наоборот, в более мощном решении (или в избытке) IOIA D) значительное количество сложных ионов являются formed. It определяет лучшую растворимость Галогенидной соли по отношению к сильному раствору галогеновой кислоты или ее солей по сравнению с чистой водой. Двойные соли состава 2SnFa * NaF структурно interesting.
In в его кристалле существует поперечная связь фтора между 2 молекулами SnFa[d(FSn)= 2.22 AJ (почти бесцветный (Мп 349°С) раствор ацетона в безводной форме является водочувствительным реагентом, так как он быстро желтеет вследствие разложения выделением Pblj под действием воды. Нестабильная постоянная nova a [Pblj ’равна 2•10″.
70) белые игольчатые кристаллы sns04 легко растворяются в воде (примерно 1: 2 по весу).Пиролиз по схеме SnS04 = SnOj + SO>происходит при 360°С и выше (в атмосфере азота).Пиролиз оксалата олова (по схеме SnCa04 = » COj-f CO + SnO) выступает в качестве способа получения его оксида. 71) нитрат свинца и уксусная кислота («свинцовый сахар» — Pb (CH3COO) a « ZH20.Mp58°C) » обычно получают растворением свинца в соответствующей кислоте.
Первые соли этих солей в основном используются в качестве исходных материалов для получения других соединений свинца, а вторые соли используются в крашении и фармацевтике («свинцовые лосьоны» и др.).Нитрат свинца в растворе довольно сильно диссоциирован(константа диссоциации PbNOj * ion равна 0,7).Молекулы Pb (CHjCOO), malodissoci-irovaia (/Ci = 3-10_a. / C2 4•10〜*это после пропитки раствором свинца, высушенная бумага не горит при воспламенении, а тлеет, как кратер.
Расплавленный PbCI *имеет значительную электрическую проводимость, и когда он затвердевает, он образует роговые массы («horny eunitz»). 72) бесцветные Pb (CN) j и Pb (NCS) j сходны по свойствам с двухвалентными галогенидами свинца. Pblj очень низкая растворимость в воде. PbS04 и PbCl4 используются для химического анализа. Хромат свинца также используется в качестве желтой минеральной краски («хром желтый»).Цианамид свинца (PbNCN) используется в составах антикоррозионных покрытий.
При нагревании выше 250°С (в отсутствие воздуха) эта соль разлагается по схеме 2PbNCN = 2Pb-F. +(СиЭнЭйч + На. 73) ниже приведены данные о растворимости некоторых солей свинца при 20°С(г безводной соли на 100 г воды): Анна»]…….. Ной СН3СОО ’ ки ’ Бр ’ Чзк ’ ф ’ л ’ так * со * Кро » Растворимость в соли.34 31] 0.8 0.5 0.07 0.06 0.004 0.0003 0.000005 Константа диссоциации PbS04 составляет 2 × 10-4, и эту соль можно считать слабым электролитом.
При медленном охлаждении раствора PBLJ, который термически насыщен (предпочтительно слегка подкислен), эта соль выделяется в виде очень красивого сусального золота. Его светочувствительность: во влажном воздухе, когда образуются PbO и I, он постепенно разлагается на свету. 74) в течение длительного времени карбонат приблизительного состава 2PbCOe-Pb (OH)*был действительно важной основной солью двухвалентного свинца.
Используется для изготовления белых масляных красок-белого свинца. Последний использовался самостоятельно и смешивался с другими красками. Процесс получения основного карбоната свинца подробно описан в работе Феофраста «обработка на камне»(315 г. н. э.).Существует возможность и возможность использования этого вещества в качестве сырья для производства искусственного жемчуга.
Преимуществом свинцовой побелки является ее большая укрывистость. Серьезным недостатком является то, что цветные объекты в воздухе, в том числе следы H * S (особенно городской воздух), постепенно становятся белыми, а белые основные карбонаты мигрируют в черные PbS. Из-за токсичности свинцового белого их использование в настоящее время запрещено. /
5) свинцово-белые и другие масляные краски получают путем растирания с сушкой на воздухе твердых частиц определенного цвета. Растительное масло (обычно льняное или конопляное).Сушка этих масел происходит за счет окисления кислородом воздуха. Наличие небольшого количества определенных оксидов (PbO, MnOj и др.) в масле, которое служит катализатором, значительно ускоряет его.
Растительное масло с таким оксидом («осушителем») называют сухим маслом. Цвет масляной краски, приготовленной на лаке, всегда содержит мелкий белый порошок, за исключением веществ, придающих определенный цвет («пигмент»). он придает краске непрозрачность и предотвращает образование пор при высыхании масла. Такие «основания» особенно полезны для первичных карбонатов свинца. ОИ дает краске большую кроющую способность. Это позволит вам удовлетвориться нанесением объекта на очень тонкий слой.
76) почтовые расходы все картины старого мастера расписаны краской, приготовленной на основе свинца White. As со временем темнеет, эти картины мионеу уже потеряли свою первоначальную оттиску. Последний часто может быть восстановлен путем тщательной обработки картины разбавленным раствором перекиси водорода. В соответствии с этим действием черный PbS изменится на белый PbS04.Это почти тот же цвет, что и основной свинец Кап6охата.
77) приведены следующие значения теплоты образования кристаллических сульфидов и их аналогов из элементов (ккал / моль): Ocsosei GeS Gesse Gesse I SnS, Snse J SnS SnSe SnTe I PbS PbSe PBE 37 15 17 9 8 | 20 20 26 22 15 I 24 24 16 78) сульфид аммония SnS (точка плавления 880, точка плавления 1230 * С) не эффективен, GeS (точка плавления 615, точка плавления 827°С) мало действует, но мультизерн (из-за избытка серы) окисляет их до сульфидов 3s2 и переносит их в раствор.
Тиостанаты известны в двух типах-MjSnS » и Mmsns *(M-одновалентный металл).Когда раствор подкисляется, SnS2 выпадает в осадок. В отличие от SnS (и GeS), сульфит свинца (PR = 8-10〜, c) также растворим в сульфиде аммония. Эта ситуация важна для аналитической химии, поскольку она позволяет отделить SnS и PbS друг от друга. 79) Кристалл PbS (mp 1114 ° С) имеет решетку типа NaCI. Как металл Германий (дополнительный 16).
Это вещество интенсивно поглощает свет и энергию, близкую к своей range. It фактически передает тепловое излучение. Аналоги сульфида свинца-PbSe (mp 10G5 * C) и PbTe (mp 924®C)-обладают полупроводниковыми свойствами, а селенид свинца очень чувствителен к инфракрасному излучению. Известно также аналогичное соединение олова-SnSe(mp.860°C) и Снтэ (Мп.800°с).
Для Германия был получен селен-коричневый GeSe (mp 667°C) и желтый GeSe2(mp 707 ° C), а Тип A \ 6 [Ge2Ser) — селеновые соли 9HaO(M-Na или K).Теллурид Германия также известен-Гете (mp 725°С).Молекуле (паре) рассматриваемого соединения задается следующее значение дипольного момента: ГЭС КНС ПБС и Гесе SnSe pbse от меня ГТД (SnTe РЬ 2.0 3.3 3.8 я 1.6 2.8 зл я 1.1 2.2 2.7 80) непосредственное применение этих сульфидов найдено главным образом в кристаллическом SnS2, порошок которого входит в состав золота под названием»муснвного золота».
Его изготовление обычно осуществляется путем постепенного нагревания смеси сернистой амальгамы олова и NH C1 C1 до 300°C, с помощью которой SnSj получается в виде золотисто-желтой пластины. Самое древнее описание Лосиного золота, переданное нам, содержится в работе китайского химика ко Хонга(i§ 1 add.4). Термическая диссоциация SnS2 начинается при 520 ° С и более(GeS2-около 800°С).
Дисульфид олова, полученный сухим способом, нерастворим в HCl, но кристаллический гидрат SnSj-2HjO осаждается из достаточно сильного (более 5 Н) раствора соляной кислоты и растворяется по схеме: SnS2 + 2HCl * = SnCl2-FS — {- S. 81) красно-коричневый PBSJ, нерастворимый в воде и органических растворителях, получают взаимодействием с PB (SR) органическим соединением свинца и серой в бензольном растворе.
Этот сульфид уже медленно разлагается в нормальных условиях. Для резки HjSj под действием сильного HCI его следует рассматривать как производное сероводорода, содержащее двухвалентный свинец. 82)для свинцовой и оловянной извести двухвалентных, нестабильных и летучих производных циклопеитадиена — (Цшс) 23. Oii = < / (PbC) «2.78 и d(SnC)= 2.71 a» цена » (§ 2 ext.34) имеет нормальную структуру сэндвича.
83) азотсодержащие соединения всех элементов рассматриваемой подгруппы являются наиболее характерными для Германии. Его серый нитрид (Ge $ N») может быть получен при 700°C действием NHa на металлический Германий (или GeOj).Вода, щелочи и разбавленные кислоты не действуют на нитрид Германия, и разложение до элемента составляет всего около 800°C. ночная поездка Браунов(Sn3N4″) аналогична по составу и распадется на элементы даже при 360°С.
84) в дополнение к вышесказанному, для Ge (и Sn) известен нитрид состава Ge3N2, производное 2-валентного Германия. OI-это темно-коричневый порошок, который легко гидролизуется. Разложение Ge3N2 на элементы начинается примерно при 500°C. относительно кремния (§ 4 add.32), двойной нитрид LijGeN3, содержащий литий, был получен для Германия.
85) нитриды Pb неизвестны. Оранжевый красный цвет и свинец m и d(PbNH) получают взаимодействием Pb (N03) a и KNHj в жидком аммиаке. Это вещество очень неустойчиво, оно не легко взрывается при нагревании или контакте с жидкостью water. It разлагается на Pb (OH) j и аммиак водяным паром. Альтернативные продукты известны как металлы водорода и нитриды свинца (PbNCI) в PbNH.
88) при взаимодействии GeCl4 с жидким аммиаком в виде белого аморфного порошка образуется Германий дневной, нагретый до 150°С и затем нагретый до 300°с, Ge(NH)* — + — HN(GeN) 2 — + — Ge3N4.Производные имедио двухатомного Германия (GeNH) получают в виде желтого порошка под действием жидкого аммиака и геля. С водой это соединение легко гидролизуется до Ge (OH) j и NHj, а при нагревании до 250°C распадается по схеме:3GeNHNH3 4- + Ge3N. 87) двухвалентный имид олова (SnNH) представляет собой коричневое аморфное вещество, которое при нагревании (340°C в вакууме) отсекается от аммиака с образованием Sn3N2.
Для четырехвалентного олова реакция Snl4 + 6KNH » = 4 ki 4-KJSn (NHj> e) характеризуется образованием комплексного стираната Амида калия, протекающего в жидком аммиаке. Последние выделяются в виде микрокристаллических осадков. 88) из фосфатированного Германия был получен только Гэп. Его кристаллы имеют структуру типа NaCl. Для олова присутствие Sn3P4 было подтверждено, и SnP был синтезирован.
Последний похож на графит в механическом отношении properties. As для свинца было отмечено присутствие Pb3P2.Более сложными фосфидами являются LisGePj (также известный как LUGeAs3) и смешанные полилиниды свинца (M-Zn, Cd, Hg) в составе MPPC. Эти серые кристаллические вещества не проводят электрический ток, они химически достаточно инертны (но медленно окисляются во влажном воздухе).
При взаимодействии AsH3 со спиртовым раствором SnClj был получен арсенид олова Sn»ASj obtained. It имеет полупроводниковые характеристики. 89) образование стенометана (SnH4) может происходить в консервных банках вследствие действия органических кислот на food. In случай тяжелого отравления может быть связан с употреблением консервированных продуктов Davio.
Предельно допустимое содержание олова в них составляет 0,02%. 90) средняя энергия связи SnH оценивается в 62 ккал / моль. Реакция разложения SnH4 является самокаталитической(катализатором является металлическое олово, образующееся при разложении).Энергия активации этой реакции (олова) составляет 9 ккал / моль, и при комнатной температуре она движется уже медленно. Правда, до первого появления Катализаторы имеют длительный период, когда реакция не протекает («индукционный период»). 91) из очень небольшого количества гомологов SnH4 был получен только крайне нестабильный Sn2H6, но его характеристики не описаны.
То же самое относится и к Sn2Cl6, который разлагается на SnCI, а SnCI2 уже выше −65°С. Он гораздо более стабилен, чем Sn2 (CH3COO). это белый кристаллический порошок, который разлагается только при 300°C и выше. 92) моногельман (GeH») получают обработкой Mg2Gc раствором бромистого аммония в жидкости ammonia. As для решения кислоты и алкалиа, он очень более стабилизирован чем он.
Пиролиз моногельмана. Как и SnH, это автоматический катализатор. Однако энергия его активации значительно больше (в объеме-51, В Германии-41 ккал / моль).так, с замечательной скоростью реакция протекает только при высоких температурах(примерно от 220°С).За счет пиролиза моногермана на стекле и других изоляторах создается тонкая пленка Германия, которая используется в производстве высокоомного электрического сопротивления.
93) наиболее близкий гомолог моногермана образуется при обработке Mg2Ge кислотой одновременно с Gcha, от которой он может быть отделен фракционно (при пониженном давлении). таким образом, жидкость GcjHe была получена в нормальных условиях(mp.-109, Мп.+31°С). Гэ, ч(Мп.105.ВР. Жестокое°с), Гэ-Hi0 (ВР.177°C) и Ge5H | 2 (bp 234°C).Для последних 2 гидридов присутствие изомеров было подтверждено.
Было также указано, что жидкость, образующаяся под влиянием Тихого разряда при»ГЧ»(-78°С и при пониженном давлении), также содержит более высокие концентрации (по-видимому, до Ge » H20).Но их количество быстро уменьшается с увеличением молекулярной массы. Все эти соединения более нестабильны, чем GeH. В случае Gc2H были определены следующие параметры: tf(GeH)= 1.54,d (GeGe)= 2.40 A, Zhge = 106°.
Суммарная энергия GeH оценивается в 74 ккал / моль. Потенциальный барьер вращения для связывания GcGc составляет 1,5 ккал / .Нол. 94) как Силан. Гидрированный Германий при взаимодействии с Галогенидом водорода может непрерывно замещаться атомами водорода с галогенами. Исключение составляет йодистый водород, который реагирует с моногерманом по схеме: GeH «+ 2HI = » = Gel2-fЗН2.
Благодаря взаимодействию Ge2He с базовым узлом −63°С, он стабилизировался только в твердом состоянии Gc2H5I(an.-17°С). 95) наиболее интересным из галогенводородных производных Германия является лиманохлороформ (GcHClj).Это удобно получить путем протекания пр 40°С с выделением тепла реакции: НС! + GeCI2 = GcHCI3.Молекула этого вещества имеет искаженную тетраэдрическую структуру с атомами Германия вблизи ее центра (d (GoH)=1,55.D (GeCI)= 2.1!A. ZClGeCI =108е).
Гермиохлороформ-бесцветная жидкость (Мп.-7!mp.75°С). Gehcla + реагирует с узлами по схеме GeCl3I + HI (может использоваться для количественных измерений); под действием воды разлагается с осаждением 2-валентного гидроксида Германия. Последняя ситуация и наличие солей, таких как MGeCI3 (M-Cs, Rb, K, NH<), указывают на это.
Германохлороформ соответствует комплексной формуле H [GeCI3). в то же время он очень близок к хлороформу по своей молекулярной структуре и физическим свойствам, а углерод является четырехвалентным. Таким образом, элмиохлороформ является, так сказать, промежуточным звеном между молекулой с низкополярной связью (CHC13, SiHClj) и типичным комплексным соединением-H [SnCl3]. Ч(РВС!3).
96) получено большое разнообразие производных одновалентного гелеобразующего радикала-GcH3(сродство к электронам оценивается в 32 ккал / моль).Самый простой пример-мельница хлоридного геля (GeH3Cl).Его полярность характеризуется молекулами= 2,13) и параметрами d (GeCI)= 2,15, d (GeH)= 1,52 А. Жгех » III. это вещество представляет собой бесцветную жидкость, которая очень летуча(Мп.- 52, Мп.+28°С).Производные germylles Он более стабилен, чем аналогичные соединения.
Обычно характерные аномалии строения не выявляются(§ 4 доп.10!это не. Однако плоская конфигурация группы NGe найдена в (GcH.) jN[с rf (GeN) −1.84 A).Интересно, что с молекулами эфира(EH.) 0 угол EOE изменяется вдоль ряда C (112°)-Si (144е)-Ge (127«®).То есть Германий больше похож на углерод, чем на кремний. Ряд смешанных германиевых сил, простейшим из которых является газ при нормальных условиях H ^ GeSitb (mp −120. mp. 4-7°C). его молекулы почти неполярны (q-0,1), длина связи GcSi составляет 2,36 а, а вращательный барьер-1,1 ккал / mol.
In случай олова, производных радикалов и ила (SnH.) не характерен: кроме CH «SnH» (вращательный барьер 0,7 ккал / моль) были получены только нестабильные хлориды-SnH, C) V. 07) производные интересных гелевых мельниц и Гидрокарбонила марганца (§ 1 ext.85) представляет собой бесцветный Летучий HjGeMn (CO) s (mp 24°C), содержащий прямую валентную связь GeMn. Структурно изучены аналогичные соединения красного олова GlSn | Mn (CO). СБ(Мп 177°с).
Его молекулы содержат атомы Sn в центре искаженного тетраэдра, d (SnCl)= = 2.43 и d(Sn. Mn (-2.74 A) (at d (MnC) 1 1, 81 * A). 98) в отличие от CH»и SiH», миогельман сравнительно легко образует продукт с замещением водорода на metal. So » под действием Гэ с раствором металлического натрия (или калия) в жидком аммиаке можно получить Германик sodium-NaGeH. It представляет собой белое твердое вещество, легко растворимое в жидком аммиаке и частично диссоциирует на Na и GeH〜.
При температуре −33°С германский натрий постепенно желтеет, а при дальнейшем нагревании происходит разложение по схеме.2NaGeH» = » = — 2NaGe-f Зиг. Аналогичное литиевое производное было также получено в виде желтовато-серого аммиачного лиганда> −2НМ. 99) среди других реакций замещения атомов водорода, GeHметалл Metal, интересно взаимодействие с agnoy, которое протекает по формуле geh — F 4agn03 c geag < + 4hno>.Раствор AgN08 также разлагает SnH. Твердый щелочной и концентрированный H, S04.
100) производные олова, подобные германилу-NaSnHs-образуются сходным образом и обладают сходными свойствами. Однако стабильность станила натрия значительно ниже, и при температуре −63 ° С он растворяется при удалении аммиака(до NaSn и Hj). 101) состав (ГЧ? Н) и (гель! Гидрид Германия) несколько отличается от рассмотренного выше. Первый из них образуется при разложении Германизированного кальция (клетка) в разбавленном виде HCl.
It представляет собой очень реактивное желтое твердое вещество, которое при нагревании разлагается на элементы. Известны также белые соединения того же состава, растворимые в жидкости NHj. Однако даже при низких температурах он склонен к гисм-Тасину по схеме 3GeHs GeH + 2QeH. Гидрид (GeH) n получают в виде коричневого твердого вещества путем воздействия раствора NHBR-Br в жидком Германии на Германий натрия (NaGe).Менее стабильная желтая форма этого вещества также известна.
При нагревании элементы являются decomposed. At в то же время при температурах выше 1000°с оказалось, что летучесть атмосферы Германия и водорода значительно выше, чем в атмосфере инертного газа. Увеличение волатильности объяснялось образованием (GeH)*. 102) элементы германиевой подгруппы непосредственно сходны с C и Si по атомной структуре, поэтому они обычно производят один и тот же тип соединения.
Однако свойства этих соединений изменяются несколько естественным образом из-за изменения химических свойств самих элементов. В частности, серия C-Pb уменьшает энергию связи E-E: 83 (C — C), 53 (Si — Si), 45 (Ge — Ge’). 37 ккал / моль(Sn-Sn).С другой стороны, количество корректировок элементов увеличивается по тем же линиям. Например, в фторидном соединении максимальное координационное число углерода составляет 4 (CF4), кремния и Германия-6 (соли Hi3Fe), олова и свинца-8(соли h43f>).
Что касается более громоздких галогенов, максимальное конфигурационное число кремния (и углерода) больше 4. в GE ОИО, только хлор, а для SN и PB, йод тоже увеличивается до 6.Таким образом, увеличение числа координационных связей ряда С-Р обусловлено увеличением размеров соответствующих атомов и ионов того же ряда.
103) одинаковое значение валентного и Координационного числа углерода приводит к увеличению химической стабильности многих соединений, что очень важно для химии их соединений. Последнее связано с тем, что fact. In химические процессы (особенно между молекулами с низкополярными связями), первая стадия-присоединение 1 из часто реагирующих частиц к другой, с последующим образованием новых соединений и обменом атомами (или ионами).
Очевидно, что если координационное число элемента совпадает с его валентностью, то трудно совместить чужеродные молекулы (ионы nln) с центральным атомом, так как внутренняя сфера уже filled. It видно, что комплексообразователь экранирован. То есть он»защищен» от внешних воздействий окружающими атомами, что замедляет течение всего процесса или, тем не менее, почти полностью прекращает свое существование.
По существу, это должно произойти. По-видимому, это способ понять многие характерные различия между производными Si и углеродными соединениями, которые похожи на них, например»более высокая стабильность CC1 к воде, щелочным растворам и другим реагентам, которые легко разлагают SiCl.»Нет сомнения, что химическая инертность насыщенных углеводородов в какой-то степени обусловлена равным числом конфигураций с валентностью углерода.
Смотрите также:
| Кремний | Подгруппа титана |
| Коллоиды | Третья группа периодической системы |
