Оглавление:










Химическое равновесие
- Химическое равновесие. Если водород и кислород газа смешиваются, то взаимодействие между ними не происходит в нормальных условиях. Значительное количество воды (водяного пара) начинает образовываться очень медленно только при температуре около 400°С. дальнейшее нагревание исходной смеси значительно ускорит комбинированный процесс, приводя к взрывной реакции при температуре свыше 600 ° С. Немедленно.
- Так, скорость реакции образования воды из элементов во многом зависит от внешних условий. В связи с возможностью количественного изучения этой зависимости, в первую очередь необходимо выявить саму единицу измерения. Концентрация часто выражается в молях на литр, количестве часов (секунд, минут и т.), в зависимости от скорости той или иной реакции.
Скорость химической реакции характеризуется изменением концентрации реагентов (или продуктов реакции) в единицу времени. Людмила Фирмаль
Изучая объект, мы всегда каким-то образом отграничиваем его от окружающего пространства. Смесь веществ или веществ, находящихся в определенном ограниченном объеме(например, объем контейнера), называется химической системой, а отдельные вещества, образующие эту систему, называются ее составными частями. components. In кроме того, предполагается, что рассматриваемая система является газом или раствором. Молекулы системы могут взаимодействовать только в столкновениях.
Чем чаще это происходит, тем быстрее реакция. Но количество столкновений во многом зависит от концентрации реагирующего вещества. Чем больше они важны, тем больше количество столкновений. Ярким примером эффекта концентрации является резко различная энергия сгорания воздушных веществ (около 20% кислорода) и чистого кислорода. Общая формулировка влияния концентрации на скорость химических реакций дается законом массового действия.
Скорость химической реакции прямо пропорциональна продукту концентрации реагирующего вещества substance. So, для реакции A-f B = C, v = k [L} (B], где y-скорость, k-пропорциональный коэффициент (константа скорости), а[L]и[B — концентрация веществ A и B. Когда несколько частиц вещества вступают во взаимодействие одновременно, их концентрация должна быть повышена до показателя, равного числу частиц, содержащихся в уравнении реакции.
Например, формула для скорости реакции по схеме 2H2-fO2=2НгО имеет вид: у= / F [ hopf02] .1-4 В дополнение к концентрации реагентов, температура должна зависеть от температуры. Это неудивительно, ведь с его увеличением скорость движения молекул увеличивается, а значит, и количество столкновений между ними также увеличивается.
Опыт показывает, что при повышении температуры каждые 10 градусов скорость большинства реакций примерно в 3 раза выше. С другой стороны, согласно кинетической теории увеличение числа столкновений Температура очень мала и полностью противоречит подобной ускоренной реакции. Однако это противоречие между теорией и опытом является obvious.
In дело в том, что химическое вещество не обязательно должно возникать каждый раз, когда частица реагирующего вещества сталкивается. Существует множество таких ассоциаций, после которых молекулы расходятся без изменений. Если относительное положение частиц в момент удара благоприятно для протекания реакции, а молекулы сталкиваются достаточно энергично, то есть с большим запасом энергии, происходит химическое взаимодействие.
Относительное число таких «успешных» встреч во многом определяется характером самого реагирующего вещества. Поэтому, даже если общее число молекулярных столкновений одинаково, скорость отдельных реакций может сильно варьироваться. С другой стороны, при повышении температуры увеличивается не только общее число столкновений, но и резко возрастает процент успешных столкновений. Поэтому при нагревании скорость реакции быстро возрастает.
Для различных веществ число активных молекул увеличивается неравномерно-отсюда и разница в ускорении отдельных реакций-14 Когда водород и кислород соединяются, образуя воду при температуре около 1000°C, вода, которая взрывается при 5000°C, разлагается на водород и кислород.
Ниже приводится схематическое представление этого: При 1000°C Водород — {- кислород = вода При 5000°C Очевидно, что при некоторых промежуточных температурах возможны обе реакции. Это действительно происходит в диапазоне 2000-4000°с, когда происходит образование молекул воды из водорода и кислорода и разложение молекул воды на водород и кислород simultaneously. So, при этих условиях реакция взаимодействия водорода и кислорода будет значительно reversible.
In в общем случае процесс, который происходит одновременно в противоположном направлении от обоих, называется процессом. При их написании вместо знака равенства часто используются стрелки в противоположных направлениях: 2Н2-fOj 2Н2О Для скорости обеих реакций, которые противоположны друг другу, соответствующей этой схеме, можно создать следующую формулу: * 1- * | [N. P [(S и o2 = * 2 [H20] 2 Vi> o2 вызывает образование большего количества молекул воды, чем разложение в единицу времени. в случае vtCv2, он ослабляет больше, чем она образуется.
Наконец, для Vi = va число молекул воды, которые распадаются и формируются в единицу времени, одинаково. Предположим, что водяной пар нагревается до 3000°С в первый раз, еще нет молекул водорода и кислорода, и vi = 0.Наоборот, скорость u2 быстра, потому что есть много молекул воды. Следующий момент •На самом деле процесс образования воды из элементов гораздо сложнее(VII§ 2, доп. 19).
Когда некоторые из них ломаются, скорость Vi уже заметна, а скорость v2 несколько снижается. Далее вода разлагается, V \продолжает увеличиваться, v2-уменьшается. Наконец, наступает момент, когда обе скорости будут равны. Если вы начнете не с водяного пара, а с водорода и кислорода, то точно так же вы получите то же самое result. In в обоих случаях, когда скорости обеих реакций равны, химическое равновесие является established.
It внешне характеризуется тем, что концентрация водорода, кислорода и водяного пара при определенных условиях постоянна в течение произвольно длительного времени. Из вышесказанного видно, что химическое равновесие является динамическим equilibrium. It связано это не с тем, что достигший его процесс останавливается, а с тем, что противоположные друг другу реакции протекают с одинаковой скоростью.
Всегда происходит образование молекул воды и их распад, но число молекул, образующихся за единицу времени, равно числу молекул, которые распадаются. Поэтому кажется, что в системе нет никаких изменений. Используя приведенное выше уравнение для скорости прямой реакции и обратной реакции, мы можем приблизиться к важному понятию равновесия constant.
So в равновесии v \ = v2、 MH2] 2 [02] = * 2 [H20)2 чтобы разделить концентрацию делнм и константу скорости, с обеих сторон уравнения^ 2 (H2F (02] № 01 — (Х2) ’(0,1 Однако частное, делящее величину fc и kg на 2 константы (если заданы внешние условия), также является постоянной величиной. Это называется константой равновесия, обозначаемой буквой К.、 QW_K [НП (0,1 А
Исходя из вышеизложенного, практические правила составления выражения констант равновесия заключаются в следующем: в числителе дроби запишите произведение концентрации вещества на правую часть уравнения реакции, в знаменателе-на левую (или наоборот).при этом концентрация каждого вещества вводится в объеме, равном числу частиц, содержащихся в Формуле реакции. Численное значение константы характеризует положение равновесия при температуре в течение суток и не изменяется при изменении концентрации реагирующего вещества.
Количественные расчеты, связанные с равновесным коситом, составляют 1 предмет важнейшей кафедры физической химии. Но даже в качественной форме выражение константы равновесия дает ценные указания на вопрос о взаимном влиянии концентрации отдельных компонентов равновесной системы. Избыток водорода вводится в систему 2H2-f Og * * 2H20.
Постоянство величины константы равновесия может поддерживаться только в том случае, если соответственно уменьшается концентрация кислорода и концентрация водяного пара increases. In практика, это означает, что если вы хотите получить максимальную отдачу от кислорода в этих внешних условиях, вам нужно увеличить концентрацию водорода.
С другой стороны, чтобы получить максимальную отдачу от водорода, необходимо ввести в систему избыточный кислород. Тот же эффект-1 Лучшее использование реагирующего вещества-может быть достигнут за счет снижения концентрации других участников реакции. Система 2H2-f-02 2H20 не передает водяной пар и кислород, но он передает водород. Затем последний покидает систему, тем самым уменьшая знаменатель выражения константы равновесия.
При постоянстве K неизбежным результатом этого будет дальнейшее разложение водяного пара и накопление свободного кислорода в сосуде. До сих пор равновесные системы рассматривались при определенных внешних условиях. Общая формулировка последствий этих изменений дана принципом сдвига равновесия (Le Chatelier, 1884) и может быть выражена следующим образом: если в равновесной системе производится внешнее действие, то равновесие сдвигается в сторону, указанную этим действием, и возрастание в системе не равносильно действиям и поступкам из равновесной системы.
Общая формулировка принципа смещающего равновесия четко дана на примере следующей механической системы: представьте себе пружину, встроенную в неподвижную опору. Такие системы предоставлены сами себе и сбалансированы. При приложении определенной внешней силы для растяжения пружины равновесие системы смещается в сторону, указанную этим внешним воздействием-пружина растягивается. Однако в этом случае, когда пружина деформируется, ее упругая пружинная сила также увеличивается.
- Реакции растут в системе. Наконец, наступает момент, когда эта реакция становится равной внешнему действию. То есть устанавливается новое равновесное состояние, соответствующее вытянутой пружине. Смещение от оригинала в сторону, обозначенную внешними воздействиями. Принцип переключения равновесия очень широк. Вот почему общая формулировка несколько расплывчата.
Ниже мы рассмотрим этот принцип более подробно в отношении температуры и давления, которые являются наиболее важными внешними условиями для химии. А разложение водяного пара на элементы сопровождается поглощением.
Уравнение 2Н2+022Н20+ 116 ккал показывает, что сочетание водорода и кислорода сопровождается выделением тепла, Людмила Фирмаль
Рассматривая систему в равновесии при определенной температуре и нагревая ее, равновесное состояние постепенно смещается в сторону образования свободных водорода и кислорода в возрастающих концентрациях. Однако, согласно закону действия масс, реакция их сочетания, протекающая с выделением тепла, также ускоряется. То есть реакция в системе постепенно нарастает.
Новое равновесие устанавливается, когда концентрация свободного водорода и кислорода настолько высока, что количество тепла, выделяющегося при взаимодействии, одновременно равно внешне сообщаемой системе. Чем больше тепла передается системе, тем более благоприятным оно является для гашения водяного пара. Эндотермическая реакция.
Напротив, отвод тепла из системы путем охлаждения системы затрудняет разложение водяного пара, создавая тем самым более полное сочетание водорода и кислорода, то есть экзотермическую реакцию. Таким образом, при нагревании равновесной системы равновесие движется к эндотермической реакции, а при охлаждении-к экзотермической реакции. Для газовой системы 2H2-f 02 ^ 2H20, есть 3 молекулы на левой стороне уравнения и 2 на правой стороне.
Применение закона Авогадро, если весь водяной пар был разложен на водород и кислород, то видно, что система занимала 3 объема, а если разложения не было вовсе-2 объема. Количество фактических объемов, занимаемых системой, будет в некоторой степени промежуточным в зависимости от положения равновесия, а с переходом последнего к образованию водяного пара объем будет уменьшаться и увеличиваться в направлении его распада.
Изменение внешнего давления, приложенного к газообразной системе, должно вызвать соответствующее изменение ее volume. It уменьшается с увеличением давления, и увеличивается с уменьшением. Предположим, что давление на систему increases. In в этом случае равновесие движется в сторону образования водяного пара. Его относительная концентрация увеличивается.
Однако, согласно закону массового действия, разложение водяного пара на элементы с увеличением объема соответственно ускоряется. Это приводит к увеличению реакционной системы. Когда давление, создаваемое самой системой, становится равным давлению, создаваемому извне, с такой концентрацией водяного пара устанавливается новое равновесное состояние. Таким образом, при увеличении внешнего давления системы 2H20 —f Og 2H20 равновесие смещается в сторону образования воды и, при уменьшении, в сторону распада.
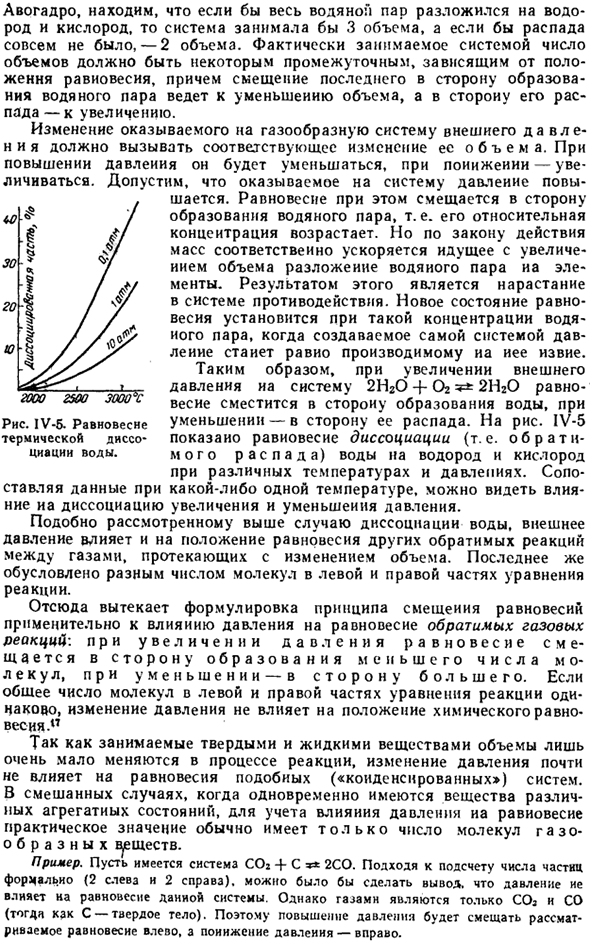
На рис. IV-5 показано равновесие диссоциации (обратимого разложения) воды на водород и кислород при различных температурах и давлениях. Если сравнить данные при любой температуре, то можно увидеть эффект увеличения или уменьшения давления и его диссоциацию. Как и в предыдущем случае диссоциации воды, внешнее давление также влияет на положение равновесия других обратимых реакций между газами, которые происходят при изменении объема.
Последнее обусловлено разницей в количестве молекул слева и справа от уравнения реакции. Отсюда вытекает формулировка принципа смещения равновесия по влиянию давления на равновесие обратимой газовой реакции: при увеличении давления равновесие смещается в сторону образования меньшего количества молекул, а при уменьшении-в сторону более крупных молекул.
Если общее число молекул в левой и правой частях уравнения реакции одинаково, то изменение давления не влияет на положение химического равновесия. Объем, занимаемый твердыми и жидкими частицами, практически не изменяется в процессе реакции, поэтому изменение давления практически не влияет на равновесие таких («конденсированных») частиц. systems.
In в смешанных случаях, когда вещества различных агрегатных состояний присутствуют одновременно, только число молекул вещества Е ^в Газе обычно имеет практическое значение, чтобы учесть влияние давления и равновесия. Образцы. Предположим, у вас есть система CO2 + C ** 2CO. Формально приближаясь к расчету числа частиц(2 слева, 2 справа). можно сделать вывод, что давление влияет на равновесие данной системы. Однако, только СО *и газами Co(ц-твердый).
Таким образом, увеличение давления сдвигает рассматриваемое равновесие влево, а уменьшение давления вправо. Диаграмма IV-5.Равновесие термической диссоциации воды. Если равновесие обратимой реакции очень сильно смещается в одном направлении, то при данных условиях она может протекать только необратимо, то есть в одном направлении.
Например, когда водород связывается с кислородом при 1000°C, кажется, что свободных молекул водорода и кислорода при 1000 ° C нет. all. In на самом деле, очень небольшое количество этих молекул все еще существует, и через столько времени, сколько они объединяются, они производятся из водяного пара. Таким образом, на самом деле обратимые реакции происходят во всем диапазоне температур, где рассматриваемое вещество может существовать при all.
In дело в том, что обратимость заметна только в определенном узком диапазоне. Например, реакция образования воды 2000-4U00°С(при нормальном давлении) Такой широкий диапазон соображений делает большую часть химического процесса обратимым типом, но во многих случаях обратимость не признается до тех пор, пока равновесие не смещается в одну сторону и внешние условия не изменяются соответственно.
Это обратимое расширение реакции позволяет исследовать равновесие и условия его замещения, что особенно важно для химии. Добавь 1) идеи, близкие к законам поведения масс, уже были включены в труды А. Bertolet.
At в то время расстояние между количеством и количеством материи было неясным, поэтому OI не смог суммировать и правильно выразить them. As часто бывает, что в результате поражения Бертоле во время спора с Прустом все, что было не так с его идеями, было отвергнуто.
По этой причине закон действия массы n вошел в сравнительно медленную науку. Многие исследователи участвовали в его разработке, и последняя формулировка этого закона постепенно эволюционировала. 2) Закон действия массы может быть выведен на основе следующих положений теории вероятностей: вероятность одновременной реализации независимых событий равна произведению их соответствующих probabilities.
In для того чтобы химические взаимодействия происходили, необходимо столкновение молекул, с которыми они вступают в реакцию. То есть они должны существовать одновременно в определенной точке пространства. Вероятность такого открытия (w) для каждой молекулы вещества прямо пропорциональна его концентрации. уа = а (а). ССБ = б [б]и т. д.. Где a, b и др. являются коэффициентами пропорциональности.
Таким образом, общее число столкновений в единицу времени u = w \•u> B = … … = А (А] — Б(Б)…Однако не все такие столкновения приводят к успешному химическому взаимодействию, а только некоторая их часть (а), величина которой при данном внешнем условии зависит только от природы реагирующего вещества, поэтому скорость реакции определяется по формуле а = а * у = А (А•Б (В))…
Объедините все константы (a, a.1), чтобы получить закон массового действия. Численное значение константы скорости (k) представляет собой произведение концентрации реагирующего вещества, где Stv равно 1. 3) возможность химической реакции, вообще говоря, чем больше число отдельных частиц, участвующих в ней, тем меньше.
Число этой частицы определяет молекулярную природу reaction. So реакция, приводящая к естественному разложению 1 молекулы, является единичной молекулой вследствие столкновения 2-х молекулярных частиц, 3-х частиц-3-х молекул и т. д. Реакции мышцы молекулярные относительно rare. In напротив, эти две молекулы представляют собой наиболее распространенные случаи.
Трехмерная реакция уже гораздо более редка, и тетрадная реакция фактически была discovered. As как видно из рисунка IV-6, молекулярная реакция Он оказывает большое влияние на процесс изменения концентрации реагентов с течением времени. Следует подчеркнуть, что действительная молекулярная природа химических процессов не всегда совпадает с кажущейся молекулярной природой, вытекающей из всего уравнения реакции.
«Эмпирическая формула процесса приблизительно совпадает с эмпирической формулой для фактического хода реакции и составляющего их уравнения органических соединений» (Н. А. Шилов).Несоответствие между фактической молекулярной массой и кажущейся молекулярной массой имеет место во всех случаях, когда процесс протекает непосредственно через промежуточные стадии в соответствии с общей реакцией equation.
In в таких случаях ход всего процесса определяется на самом медленном этапе. Например, при измеримой скорости около 500°C протекает формальная пентаметрическая реакция: 4НВг + 02 = 2нго-F 2brj. С другой стороны, опыт показывает, что это бинарная молекула. Видимо, на практике следующий этап уже сделан: NVg + O, — noovg медленная реакция NOOVg + NVg = 2novg высокая скорость 2 (Новг + Бромоводорода = Ю + Бр? Быстро )
Таким образом, экспериментально определив ход реакции во времени, можно установить действительную молекулярную природу и сделать важные выводы о химии исследуемых процессов. Однако следует помнить, что «вывод микроскопического механизма из макроскопических данных отнюдь не является полностью двусмысленным, и за одной и той же целостной картиной могут скрываться различные фундаментальные механизмы» (П. Рогийскны).
4) Если частицы могут сталкиваться в газовой смеси или растворе, ситуация отличается от химического процесса с участием твердого вещества matter. It понятно, что в реакцию вступят только частицы на поверхности. Поэтому скорость процесса в данном случае зависит от объемной концентрации. Но по размеру то surface.
So, условия проведения реакции будут следующими: чем предпочтительнее, тем более твердым будет измельченное твердое вещество. 5) число, характеризующее ускорение реакции при нагревании на 10 градусов, часто называют температурным коэффициентом speed. In в большинстве реакций значение этих коэффициентов при нормальных условиях колеблется от 2 до 4.
As температура повышается, она постепенно понижается. Мы приближаемся к единству. Исходя из среднего значения (3) температурного коэффициента скорости, нагревая его от определенной начальной температуры ( / ■ ) до определенной конечной температуры (fK), реакция протекает в 3 раза быстрее.
Где w = (/— /и): Yu, с другой стороны, число столкновений молекул в единицу времени увеличивается пропорционально VY (T-абсолютная температура).Например, при нагревании до 0-100°c количество столкновений увеличивается. V 373: / 273 = 1,2 раза. в) Средняя кинетическая энергия молекулы составляет около 0,002 Т ккал / моль. Где T-абсолютная температура.
В нормальных условиях он равен примерно 0.Гкхал / моль, а время контакта молекулы в момент столкновения оценивается примерно в 10 секунд, Дж секунд. Даже если 10 миллиардов столкновений происходят 1 раз (т. е. a = 10′), бинарная реакция протекает почти мгновенно. Диаграмма IV-6.Установлена зависимость протекания защитного гороха (эукцина) от его молекулярных свойств.
В ПЛ»?-•」 Отметим, что число столкновений молекул в растворе значительно выше, чем в случае газов той же концентрации. 7)важным условием возможности протекания химических реакций является правильное относительное положение молекулы в момент удара. Например. Взаимодействие H-H с 1-1 молекулами облегчается сходимостью параллельных валентных связей.
Относительной вероятностью возникновения пространственного расположения молекул в пользу той или иной реакции является так называемый стерический фактор (числовое значение, входящее в величину а).Например, для рассматриваемой реакции этот коэффициент будет близок к 0,1.То есть предпочтительное взаимное расположение молекул Na и Is происходит, в среднем, только в соотношении 10 к 1.
8) Еще одним важным условием возможности химической реакции является достаточная реакционная способность молекулы в момент удара. 1.Особенно от инструмента «гороховый нос«.Активная молекула является самой «быстрой» молекулой и обладает значительной кинетической энергией (см. Рисунок IV-2).Они могут быть возбуждены molecules.
In в этой молекуле некоторые электроны находятся не в норме, а на более высоком энергетическом уровне. Наконец, внутренняя структура момента столкновения(например, расстояние между ядрами) может активировать молекулы, отличающиеся от наиболее устойчивых ones. In во всех этих случаях избыточная энергия молекул определяет повышенную химическую активность.
9) рассматриваемое понятие имеет большое фундаментальное значение, поскольку предполагает отказ от принципа абсолютной идентичности всех молекул конкретного вещества. «Большинство естествоиспытателей полагает, что тождество и различие-непримиримые противоположности, но один полюс также истинен только во взаимодействии, в том числе и в различии тождества«(Энгельс).
Как видно из вышесказанного, на данный момент мы никогда не можем сказать, что все частицы материи полностью идентичны во всех отношениях, даже при одних и тех же внешних условиях. 10) энергия, необходимая для активации исходных частиц, называется энергией активации соответствующей реакции. Схема 1В-7, Как видно из рисунка.
Энергия, затраченная полостью при переводе исходного продукта (H) в активное состояние (L), высвобождается при переходе от X к конечному продукту (/С).Поэтому теплота реакции, которая определяется разностью энергий между исходным продуктом и конечным продуктом, не зависит от активации energy. At в то же время, в некоторых случаях, очень разная энергия активации является главным фактором.
Определите скорость реакции: это больше энергии. Молекула обладает им при дневных температурах, что замедляет reaction. As как правило, процессы с энергией активации менее 10 ккал / моль протекают неизмеримо медленнее при комнатной температуре, а когда энергия активации превышает 30 ккал / моль, они становятся неизмеримо медленнее.
Температурный коэффициент скорости также зависит от энергии активации. Значения 2, 3 и 4 при комнатной температуре соответствуют энергии активации 14, 21 и 28 ккал / моль. 11) с точки зрения механизма молекулярного взаимодействия энергия активации необходима для возбуждения переходного состояния реакционной системы. IV-8 в виде видео с фиг.
Процесс синтеза HI проходит через промежуточное образование «активного комплекса», где начальные связи (H — H и I — I) уже ослаблены. 5 Б. В. Некрасов Реакция Рисунок 1В-7.Схема протекания реакции активации. 3hdofnepuw9c / <(Р * reokii И финал (H-I) еще не полностью сформирован. Энергия активации рассматриваемой реакции составляет 39 ккал.
12) если исходное вещество может взаимодействовать одновременно в 2 (или более) различных направлениях, то такие реакции называются параллельными. Из них тот, который требует наименьшей энергии активации, протекает mainly. It следует подчеркнуть, что даже малейшая разница в этой энергии очень сильно влияет на относительную скорость параллельных реакций. Л / Т / Ш ^ 2.95 2.67• Рисунок СП-8.Схема реакции Hj + lt ^ 2H|.
13) параллельная реакция встречается гораздо чаще, чем кажется на первый взгляд. Лишь относительно небольшое число химических процессов протекает»чисто«.То есть, он почти полностью следует 1 конкретному уравнению. Такая реакция особенно ценна для аналитической химии.
14) в большинстве случаев уравнение реакции описывает только основной (то есть количественно доминирующий) процесс. Одовремино возникает «побочная» реакция, обычно согласованная, но с учетом ее потенциала Почти всегда explained. In связь с основными процессами, они могут быть либо параллельными (то есть непосредственно независимыми), либо непрерывными (то есть дальнейшая реакция продукта основного процесса).
15) для изучения химического равновесия используются различные методы.1. одним из наиболее распространенных является»замораживание» равновесия. Метод основан на следующем it. At при достаточно низких температурах скорость реакции падает почти до нуля.
Например, если поместить смесь водорода и кислорода в термостойкую металлическую трубку и подержать ее некоторое время при температуре 2500 ° С, то равновесие между сырым газом и паром устанавливается в ответ на эту температуру. Должный к очень быстрому охлаждать пробок, никакое время пройти в equilibrium.
In в дальнейшем равновесное состояние не проходит, так как скорость реакции при низких температурах крайне медленная. По этой причине, анализируя содержимое пробирки, можно получить результаты, соответствующие положению равновесия при 2500°С. Для контроля эксперимент повторяют, а с другой стороны он достигает equilibrium. In в этом примере вводится вода, а не сначала вводится смесь водорода и кислорода в трубку.
Результаты обоих экспериментов должны быть последовательными, поскольку одно и то же положение равновесия одинаково достижимо с обеих сторон. 16) в качестве простейшего примера экспериментального определения константы равновесия можно привести данные, полученные по реакции: H2-f составляет * * 445 ° C, полученные 2HI.
Рисунок 1В-9 показывает, что при приближении с обеих сторон рассматриваемой системы она достигает одного и того же равновесного состояния примерно через 2 часа(78% HI по объему, 11% Hi, 11% пара 12).Значение равновесной концентрации (моль / л) при различных неэквивалентных соотношениях реагентов было получено экспериментально и рассчитано по следующей формуле: (Нз10.0268 / Н, 1 (111 mjc LIS) 0.0002 Н. Н. Н. 0,0157, 0,017, 0,017 0,7 с НГ Диаграмма IV-9.
Двусторонний подход к балансу. ги <•и Yi ЖВ Из них, константа равновесия 0.0017 0.0114 0.0315 0.020 0.0003 0.0242 0.0202 0.0(8 От 0,0032 до 0,0078 0,0337 0,022 0.0099 0.0020 0.0328 0.018 IHJ) K IHIJ> Как видно из представленных данных, несмотря на значительные колебания относительных концентраций H *и B. постоянство величины K сохраняется очень хорошо.
Его среднее значение будет равно 0,02. 17) независимость химического равновесия от давления газовой системы, в которой число молекул не изменилось, справедлива только для идеала gas. In дело в том, что даже в такой системе равновесие несколько зависит от давления, так как фактическая степень сжатия газа несколько отличается.
Однако эта зависимость на самом деле заметна только при высоком давлении. 18) вообще говоря, в дополнение к температуре и давлению, может быть больше против химического равновесия! В меньшей степени, но на это влияет множество других факторов. Например, было показано, что равновесие газовой системы 2H * + Og ** 2H * 0 слегка смещается вправо под действием электрического поля.
Это связано с полярностью молекулы NaO и поляризацией молекулы Na n Oj. J9) чем больше вы меняете факторы, влияющие на равновесие, тем больше сдвигается химическое вещество equilibrium. At в то же время, если этот элемент изменяется на очень малую величину и на очень малую величину, то равновесие также смещается.
Поэтому процесс его вытеснения представляется непрерывным. Но эта преемственность очевидна. Это связано с тем, что даже самые незначительные химические изменения, которые мы замечаем, связаны с трансформацией миллиардов молекул.
Очевидно, что смещение равновесия меньше, чем химическое изменение в 1 молекуле, не может произойти, и другие молекулы должны соответствовать преобразованию целого числа molecules. So на практике в прыжке происходит сбалансированный сдвиг, но поскольку он очень мал, многие такие прыжки сливаются в один непрерывный процесс.
Смотрите также:
| Структура твердых тел | Вода |
| Водород | Роль воды в природе |
