Оглавление:










Вода
- Вода. Природная вода всегда содержит примеси. Некоторые из них находятся в суспензии, другие-в растворенном виде. Вода может быть удалена из большинства взвешенных частиц путем осаждения или более быстрой фильтрации толстым слоем, таким как sand. In для этой цели обычно используют лабораторную, фильтровальную (неклеющуюся) бумагу.
- Вода обычно очищается дистилляцией от растворенных веществ. Такая дистиллированная вода называется дистилляцией. Два Вода составляет 11,2 мас.% Водорода и 88,8 мас.%Кислород. In таким же образом, конечно, соотношение представляет собой объем газа, образующегося при разложении воды на элементы.
При образовании из элемента, содержащего 1 объем кислорода, 2 объема водорода являются connected. Людмила Фирмаль
Как видно из рисунка IV-10, оба атома водорода молекул воды расположены с одной стороны от атома кислорода. Благодаря этому и высокой полярности связи H_O, молекулы L0 характеризуются значительной полярностью в целом 4. Результаты определения молекулярной массы водяного пара показывают, что водяной пар соответствует простейшей формуле-HgO.
Напротив, в жидком состоянии вода является associated. In помимо простых молекул, они также включают более сложные структуры, соответствующие общей формуле (HgO).Где N = 2, 3, 4, и т. д. PN20 (H220) » при нагревании воды степень ее связывания уменьшается.* −7 О РНС. IV-10.Положение атомного ядра в молекуле воды. Жидкая вода с тонким слоем бесцветна, но темного цвета вода не имеет. bluish-green.
In в отличие от почти всех других веществ, его плотность увеличивается при постоянном охлаждении, а вода — f-самая плотная при 4°C (рисунок IV-11).8 — ’ 0 Чистая вода почти не проводит current. It требуется больше тепла для нагрева воды, чем для нагрева максимальной удельной теплоты всех жидкостей и твердых веществ, т. е. тех же степеней массы других жидкостей или твердых тел.
И наоборот, при охлаждении вода выделяет больше тепла, чем такое же количество твердого или жидкого вещества. ,,- 1c при низких температурах вода испаряется относительно медленно, но при нагревании давление пара быстро возрастает. Температура°C…….Около 5 10 15 20 25 30 40 50 75100 Давление пара, мм рт. ст.. 4, Г. Г. 5 9.2 12.8 17.5 23.8 31.8 55.3 92.5 289.1 760.0
Если в ограниченном пространстве над жидкой водой находится воздух, то парциальное давление водяного пара в нем соответствует заданной величине. Такой воздух насыщается водяным паром-при заданной температуре он перестает содержаться в воздухе. Обычно воздух содержит 30-90% от максимального количества водяного пара.
Охлаждение такого воздуха, который не насыщен водяным паром, постепенно достигает насыщения, а затем начинает выделяться в виде дождя, когда избыток водяного пара охлаждается в виде тумана или внезапно. Если весь процесс протекает при более низкой температуре, то соответственно будет получен мороз или снег.
На рисунке IV-12 показаны некоторые из красивых фигур с отдельными снежинками. Не ИЖ-12.Форма снега. Когда давление пара жидкости равно внешнему давлению, оно boils. At нормальное атмосферное давление (760 мм рт. ст.) воды, температура кипения 100°C. It понятно, что при понижении давления эта температура понижается, а при повышении-повышается. Ниже мы сравниваем некоторые данные о давлении и давлении, близкие к атмосферному давлению: атмосферное давление, мм рт. ст. Искусство.
Семьсот тридцать Температура кнпэия, В….. 98.9 Давление.,…………. Два Температура кипения,°С….. 120. Приведенные выше данные показывают, что при повышении давления температура кипения воды повышается очень быстро.20 ″ 23 Диаграмма IV-11.Изменение плотности влаги с температурой (г / см3). 740750760770770780 99.3 99.6 100.0 100.4 100.7 5 10 20 50100 151179211 263 310 Когда вода охлаждается до 0 ° c, она переходит в твердое состояние-лед.
Плотность льда составляет 0,92 г / с * 3.То есть, он легче, чем вода. Эта ситуация очень важна для жизни природы. Это неудивительно, ведь образовавшийся в акватории лед остается на поверхности воды, защищая ее глубокие слои от дальнейшего охлаждения. Если лед тяжелее воды, то все водоемы в холодном климате — это кубики льда, а летом они только тают с поверхности.
Природа воды в этом случае ненормальна (то есть она выходит за рамки общих правил).Это неудивительно, ведь большинство веществ в твердом состоянии плотнее, чем в жидком. Как и вода, лед может испаряться. Например, хорошо известно, что влажное белье сохнет даже в больших количествах. frosts. It также подтверждено, что зимой испаряется до 30% от общего количества выпавшего снега.
Однако давление водяного пара на лед при низких температурах очень мало, поэтому испарение льда происходит гораздо медленнее, чем испарение жидкой воды. Температура……….— 50 −30-20 −10-8 −6 −4 −2 0 Давление пара, мм рт ст… 0.03 0.3 0.8 1.9 2.3 3.3 3.9 4.Г Испарение льда ни в коем случае не является исключением. Некоторые (обычно незначительные, но не поддающиеся прямому измерению) давления паров присутствуют в твердых телах. Иногда он настолько велик, что становится noticeable.
An примером может служить нафталин, который используется для защиты одежды от na. Равновесная вода-объем льда в ледяной системе больше объема такого же количества воды, поэтому ожидается, что равновесие сдвинется влево при повышении давления increases. In практика, это означает, что при высоком давлении лед тает ниже 0 ° C.
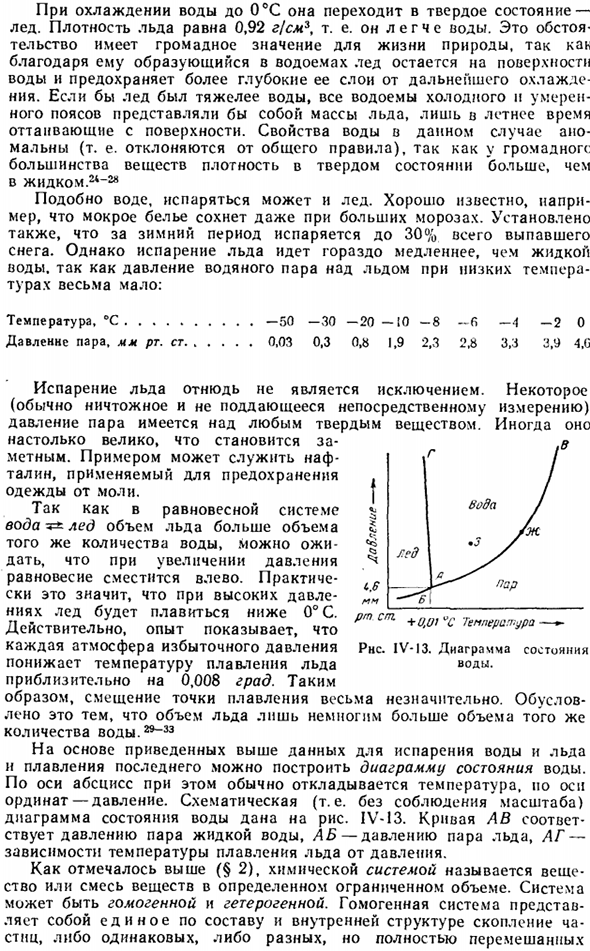
In опыт показывает, что каждое избыточное давление атмосферы снижает температуру плавления льда примерно на 0,008 градуса. Поэтому сдвиг температуры плавления очень незначителен. Это связано с тем, что объем льда лишь немного больше, чем такое же количество воды.29 ″ 33 На основании приведенных выше данных об испарении воды и льда и таянии льда можно построить диаграмму состояния воды. constructed.
In в этом случае температура обычно отображается в абсциссе, а давление-в ординате. Принципиальная схема состояния воды (то есть не соблюдается масштаб) показана на схеме. IV-13.Кривая AB соответствует давлению паров жидкой воды, AB соответствует давлению паров льда, а AG соответствует зависимости давления от температуры плавления льда.
Как упоминалось ранее(§ 2), химическая система представляет собой смесь веществ или веществ в определенном ограниченном количестве. Система может быть однородной или гетерогенной. Однородная система представляет собой единый кластер идеально перемешанных частиц, хотя состав или внутренняя структура одинаковы или различны ПМ см » температура — РНС. IV-13.Диаграмма состояния воды.
Друг другу. Такими системами являются, например, раствор воды, сахара или соли, смесь газов, однородное твердое вещество и т. д. Напротив, система неоднородна, если она одновременно содержит кластеры частиц различного состава или внутренней структуры, отделенные друг от друга границей раздела.
К неоднородным относятся, например, системы, состоящие из 2 несмешивающихся жидкостей, смеси льда и воды, твердого вещества и др. Компоненты гетерогенной системы, отделенные друг от друга, называются Phases. So, фазы называются однородными частями гетерогенных систем. Например, система, состоящая из 2 несмешивающихся жидкостей, является 2-фазной, в то время как твердая смесь состоит из того же числа фаз, что и эти вещества.
Очевидно, что единая система является однофазной одновременно. Если мы обратимся к диаграмме здесь IV-13, то увидим, что вся площадь рисунка разделена на 3 части. Каждая часть соответствует одной из стабильных областей агрегатного состояния воды.1. одной из фаз трехфазной системы: лед-вода-вода-водяной пар. Линии, разделяющие эти области, соответствуют условиям температуры и давления, в которых 2 фазы находятся в стабильном состоянии.
Равновесная вода > Лед > Лед Линию АВ » АГ » АБ 4-парная Вода Т * * — Иар Все 3 линии сходятся в точке A. At при соответствующей температуре (+0,01°С) и давлении (4,6 мм рт. ст.) в стабильном равновесном состоянии все 3 фазы могут быть произвольно удлинены. Поэтому этот пункт и называется тройной. Положение тройной точки диаграммы состояния определяет характеристики изменения агрегатного состояния при общих условиях давления конкретного вещества.
Если эта точка находится менее чем в 760 мм рт. Непрерывный нагрев техники, затем твердое вещество сначала переносит его в жидкость, а затем в газ (пар).Наоборот, если тройная точка превышает 760 мм рт. Затем рассматриваемое вещество переходит непосредственно из твердого состояния в газообразное. При нагревании он становится возвышенным.
Из вышесказанного следует, что для получения сублимируемого вещества в жидком состоянии необходимо нагревать его под достаточно высоким давлением. Вы можете создавать диаграммы состояния веществ (и смесей веществ). это очень удобно, потому что вы можете сразу определить условия, при которых эта фаза или фазовый баланс будет стабильным. Именно поэтому такие рисунки широко практичны.
С химической точки зрения вода является высокореактивным веществом. substance. It соединяется со многими оксидами металлов и полуметаллов, энергетически взаимодействует с наиболее активными металлами и вызывает множество других реакций весьма разнообразной природы. Поэтому необходимо часто реагировать на проявление химических свойств water. In обтекаемое образование названия соединения (II§ 5), термин»aquo»или»гидрат»используется в молекуле HGO (последнее из названий).
Добавь 1) показаны ли схемы очистки речной воды, обычно используемые в коммунальном хозяйстве? на РНС. СП-14.Первая операция включает добавление небольшого количества сульфата алюминия в воду для высвобождения большого количества осадка гидроксида алюминия, захвата различных частиц, взвешенных в воде, тем самым облегчая последующее осаждение в образце.
Осажденная вода фильтруется толстым слоем песка, после чего дезинфицируется хлорным обеззараживанием, а затем поступает в водопроводную сеть(в случае Москвы-400 млн м3 ежедневно). Очищенная вода Добавление сульфата алюминия Фильтр Насос РНС. 1В-14.Схема очистки речной воды. Во многих отношениях стерилизация йода озонообработкой имеет свои преимущества перед хлорированием.
Технически этот процесс полностью освоен», но его повсеместное внедрение затруднено, поскольку стоит в несколько раз дороже. 2) дистиллированная вода не содержит только нелетучих примесей. Они удаляют летучие вещества, добавляя вещества, которые вступают в реакцию с этими примесями, и пытаются произвести нелетучие продукты реакции перед дистилляцией. Тем не менее, все еще первая часть дистиллированной воды содержит растворенный воздух.
Если их присутствие вредно, то эти части не собираются. Как при перегонке в стеклянной таре, так и при хранении дистиллированная вода загрязняется щелочью, проходящей через стекло. Эти растворенные щелочи не вредят большинству его применений, так как их содержание незначительно.
Если требуется дополнительная высокая чистота, дистиллированную воду получают и хранят в емкости из кварца, олова или серебра. 3) водяной пар и тепло диссоциации 2 параллельные реакции протекают в:2НаО+ 116 ккал =2Н,+Оа и 2Н* 0 + 135 ккал =Н2+20Н. Пельвона-.Первый из них преобладает, а второй-только при очень высоких температурах. Гидроксильные радикалы, образующиеся в результате этой реакции, термически очень сильны. stable.
So их существование было установлено в атмосфере sun. In свободный гидроксил, d (HO)= 0.97 A, q = J. 66, энергия связи 101 ккал / моль, а постоянная силы k = 7.1.Электронное сродство газообразных радикалов он составляет 41 ккал / моль. Энергия ионизации равна 13,6 эВ. 4) эффективный радиус молекулы hjo составляет 1,38 а (от кристаллической структуры льда), а 3 момента инерции-1,02. 1. 92 и 2.95•10 * 4 * g-si1.
Его общая полярность характеризуется величиной q = 1.88.In кроме того, структура дипольного момента не совсем ясна. Н-О если полярность связи, но и предположить, что это связано. Но по орбите свободной электронной пары атомов кислорода молекулы эфира представлены на рисунке IV-15 (с равномерным распределением эффективного заряда между вершинами тетраэдра, каждая из которых должна быть 6 «±0,17).
Энергия ионизации молекулы H20 составляет 12,6 эВ, а сродство к электрону x оценивается в 21 ккал / моль. Связь H-OH характеризуется постоянной силы a = 110,5 Н со средней энергией 7,5 ккал / моль(III§ 5 add.12). 5) измерение плотности водяного пара при температуре кипения воды дает молекулярную массу 18,64.Это соответствует присутствию около 3,5% в паре Двойной молекулы.
Наличие в форме такой молекулы(HjO) j очень характерно для воды, растворенной в некоторых органических жидкостях (например, хлороформе). в) Вообще говоря, причиной молекулярной Ассоциации является…«Существует высокая вероятность полярности. Диаграмма IV-16、 Диаграмма IV-16. Cxi-m » Ассоциация r g Полярная молекула. Молекулы с постоянными диполями Вследствие взаимного притяжения противоположных полюсов, 2, 3 и т. комбинируются, но действующее в этом случае напряжение невелико, и в случае воды такая связь диполя играет лишь второстепенную роль.
7) образование так называемых водородных связей является наиболее важным для Ассоциации молекул воды. Последнее происходит потому, что, согласно приводимой схеме, водород одной молекулы воды сжимается с кислородом другой молекулы воды. H I О-О — О Я н Возможность такого сокращения согласуется с предположением, что и водород (dn +0,33), и кислород (up = −0,66) в молекулах воды имеют значительные эффективные заряды.
При этом начальная связь водорода с»своим» кислородом не теряется, поэтому он затягивается одновременно с 2 атомами кислорода, и обе молекулы воды соединяются между собой other. As Ну что ж. За счет образования водородных связей притягиваются 3, 4 и более молекул воды. По-видимому, в жидкой воде каждый из них прикреплен к другому.
В среднем 2 водородные связи. Прочность водородных связей значительно меньше, чем у обычных валентных связей(энергия воды составляет около 5 км / моль).Следовательно, молекулы, которые сжимаются вместе, могут рассеиваться и сжиматься снова с другими комбинациями, etc.
As в результате простые молекулы HjO и жидкая вода в то же время всегда содержат более сложные молекулярные агрегаты (H80) n. расчеты показали, что даже при очень высоких температурах водяной пар имеет отдельные молекулы (HgO).Есть признаки присутствия в атмосфере. Необходимым условием развития водородных связей является достаточная полярность валентной связи водорода в инициирующей молекуле.
Это происходит потому, что они больше всего удовлетворены H — F сцеплением. H-O и H-N. среди соединений, которые их содержат, обычно встречаются вещества, которые обычно связаны с образованием водородных связей. Заметим, что последнее также может происходить между неравными молекулами (например, водой и спиртом). 8) для каждой молекулы HjO было предложено название r id roll.
Результаты попыток определения относительного содержания гидрологии в воде противоречивы. Для одних из них при 0, 100 и 250°С она достигает 25, 40 и 90%, для других-менее 1% (нормальная температура). 9) причина мясистой аномалии воды Чио не была определена. При 0°C вода состоит в основном из (H20) s, а при нагревании до+ 4 eC утроенные молекулы преобразуются в(HgO)*, что, как полагают, увеличивает плотность.
При дальнейшем нагревании, простые молекулы начинают распространяться、 Плотность будет постепенно уменьшаться. Поэтому они пытаются объяснить аномалию плотности самой высокой плотностью» дигидроартемизининовой » воды. Другим объяснением аномалии плотности воды является наличие мелких кристаллов льда при низких температурах. При 0°с предполагается, что вода*содержит 0,6% таких кристаллов, и их количество очень быстро уменьшается при повышении температуры.
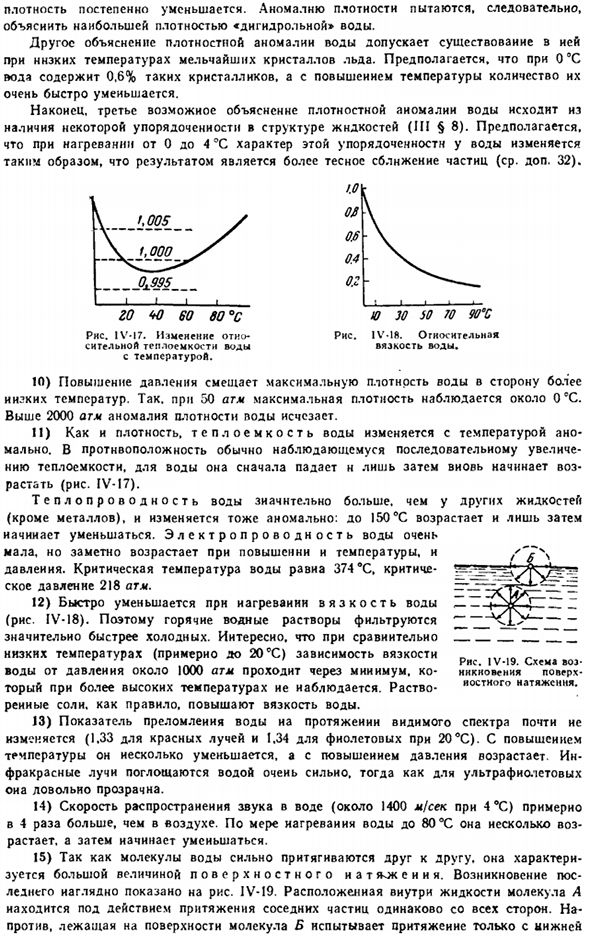
Наконец, 3-е возможное объяснение аномалии плотности воды исходит из наличия некоторого порядка в структуре жидкости(III§ 8). Нагревание от 0°до 4 ° С изменяет характер этого упорядочения в воде, что приводит к сближению частиц (см. Дополнительные 32). 30 50 70 90 ″ C Диаграмма IV-18.Относительная вязкость воды. Диаграмма IV-I7.Изменение относительной теплоемкости воды по температуре. th w w единица измерения°s 10) из-за увеличения давления максимальная плотность воды смещается к более низкой temperature.
So при 50 атмосферах максимальная плотность наблюдается примерно при 0 см3. Если она превышает 2000 атмосфер, аномалия в плотности воды исчезает. 11) как с плотностью, теплоемкость воды меняет ненормально с temperature. In в отличие от непрерывного увеличения обычной наблюдаемой теплоемкости, в воде она сначала уменьшается, а затем снова начинает увеличиваться (рис. IV-I7).
Теплопроводность воды значительно больше, чем у других жидкостей (кроме металлов), и также изменяется ненормально: она поднимается до 150°С, а затем начинает снижаться. Электропроводность воды очень мала, но она значительно возрастает с увеличением температуры и давления.
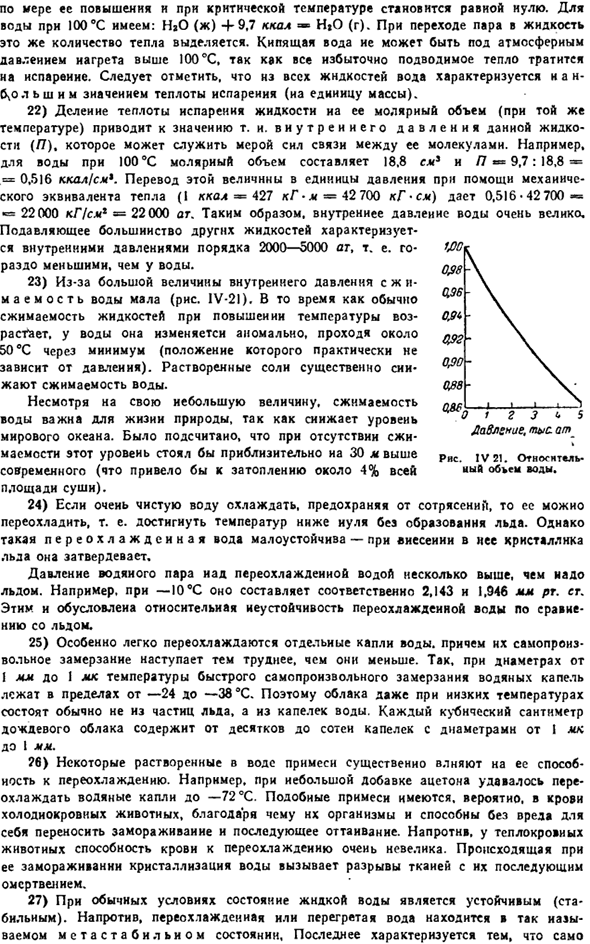
Критическая температура воды составляет 374°C, критическое давление-218 АТМ. 12) вязкость воды быстро падает при нагревании (рис. IV-18).Поэтому водные растворы при высоких температурах фильтруются гораздо быстрее, чем при низких. Интересно, что при относительно низких температурах (до примерно 20°С) зависимость вязкости воды от давления около 1000 атмосфер проходит через минимум, который не наблюдается при высоких температурах.
Растворенные соли имеют тенденцию увеличивать вязкость воды. 13) показатель преломления воды во всем видимом спектре изменяется приблизительно (при 20°C он равен 1,33 для красных лучей и 1,34 для фиолетовых).Когда температура повышается, она немного уменьшается, и давление повышается. Инфракрасные лучи очень сильно поглощаются водой, но в случае ультрафиолета они очень прозрачны.
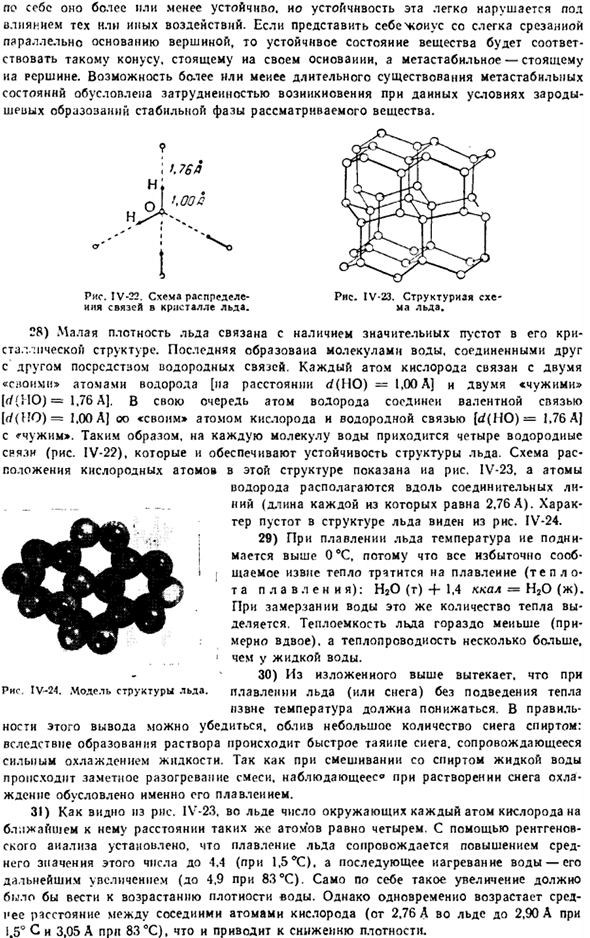
14) Скорость распространения звука в воде (4 ° C при скорости около 1400 м / с) примерно в 4 раза превышает скорость распространения звука в воздухе. Когда вода нагревается до 80°C, она немного увеличивается. Затем она начинает уменьшаться. 15) поскольку молекулы воды сильно притягиваются друг к другу, они характеризуются большим поверхностным натяжением s и S. внешний вид последних четко показан на диаграмме. IV-19.
Молекула а, находящаяся внутри жидкости, находится под действием силы притяжения соседних частиц, которые равномерно распределены по всем сторонам. Напротив, молекула в, лежащая на поверхности, получает притяжение только снизу. Диаграмма IV-19.Схема поверхностного натяжения. Сбоку и он втягивается в жидкость. Таким образом, вся поверхность находится в известном напряженном состоянии.
Под влиянием поверхностного натяжения небольшое количество воды стремится принять сферическую форму, соответствующую наименьшему возможному значению поверхности для данного количества вещества. Приближение к форме шара достигается при большем влиянии силы тяжести, то есть чем меньше вес шара, тем меньше его масса. drop. So, форма очень маленькой капли воды будет точно ближе к сфере.
Поверхностное натяжение воды также очень чувствительно к следовым примесям. 16) есть 2 случая, когда жидкость вступает в контакт с нерастворимыми веществами, такими как стекло. Если силы притяжения молекул жидкости к твердым молекулам сильны друг с другом, то мениск в стеклянной трубке жидкости (то есть граница раздела с воздухом) становится вогнутым Рисунок IV. (A. рисунок 1V-20), другой-выпуклый (B).Первый Формат SIT NS * ^ Бухточка.
Например, в воде 2-й-это ртуть. Они обычно говорят, что вода «Смочите» стекло и» смочите » ртуть. Если внутренняя поверхность стеклянной трубки покрыта парафином, вода не будет смачивать ее, и форма мениска будет выпуклой. 17) абсолютное содержание водяного пара в насыщенном воздухе изменяется в зависимости от температуры следующим образом:
Температура°C………. −20 −10 0 +10 +20 +30 Содержание водяного пара, и / М . 。 1.08 2.35 4.85 9.41 17.3 30.4 18) относительная влажность представляет собой процент от фактического содержания водяного пара при дневных температурах и соответствующий процент насыщения. Наиболее благоприятные условия для относительной влажности человеческого тела по сравнению с обычной комнатной температурой (0) хорошо переносятся в Формуле 50-3 (f-20).
Как видно из последней, чем выше температура, тем ниже относительная влажность. Относительная влажность воздуха зависит от географического положения (и многих других факторов).Например, среднее значение Москвы самое маленькое(8 месяцев), самое большое (2 месяца).А среднегодовой-57, 85 и 72% соответственно. 19) для поддержания определенной влажности воздуха в замкнутом пространстве можно использовать хорошо подобранный насыщенный раствор соли.
Например, относительную влажность около 20% при 50°C можно поддерживать с помощью Ca (NOi) j или NaHSO. 20) если вода нагревается равномерно для предотвращения встряхивания, полностью освобождается от взвешенной части и растворенных газов, вода может достигать температуры значительно выше 100°C до интенсивного кипения. При смешивании такой перегретой воды обычно происходит кипячение immediately.
- In фактически, он смог довести перегрев воды почти до 270°C. Последняя температура явно является пределом перегрева воды при нормальном давлении. При относительно небольшом перегреве часто приходится заливать кипящую жидкость, и в этом случае»удар» будет boil. To исключите перегрев и родственные явления, воздух повышает измерения против кипеть, поэтому очень тонкую стеклянную трубку с одним загерметизированным концом можно ввести в жидкость.
21) перевод вещества из жидкого состояния в газообразное требует работы по преодолению взаимного притяжения (и внешнего давления) молекул. Кашуж был отмечен ранее (II§ 2, 4).Величина этой работы, выраженная в калориях, называется теплотой горения данного вещества. «Когда температура повышается, критическая температура равна нулю.
Последнее * зависит от температуры, при которой происходит испарение и уменьшается Людмила Фирмаль
В воде при 100°C H> 0 (g) составляет 4-9. 7 ккал H » 0 (г).Когда пар входит в жидкость, выделяется такое же количество тепла. Вся избыточная подводимая теплота расходуется на испарение, поэтому кипяченую воду можно нагревать при атмосферном давлении выше 100°С.
Следует напомнить, что среди всех жидкостей вода характеризуется наибольшим значением теплоты испарения (на единицу массы). 22) расщепление теплоты испарения жидкости на молярный объем(при той же температуре) приводит к величине т. внутреннего давления (I) данного liquid. It действует как мера сил связи между молекулами. Например, в воде при 100°с молярный объем составляет 18,8 см 5, Р≈9,7:18,8 = = 0,516 ккал / см*.
Если перевести это значение в единицы измерения давления с использованием механического термического эквивалента (I ккал = * = 427 кг-м-42 700 кг-см), то получим 0,516•42 700. ■= 22 000 кг / см * = 22 000 Ат. Поэтому внутреннее давление воды будет очень высоким. Большинство других жидкостей характеризуются внутренним давлением 2000-5000 атмосфер, то есть значительно ниже, чем у воды.
23) из-за большого внутреннего давления, сжимаемость воды мала(рисунок IV-2И).Чем выше температура, тем выше степень сжатия жидкости. Вблизи воды она изменяется ненормально, проходя через минимум примерно при 50°с (ее расположение практически не зависит от давления).Растворенные соли значительно снижают скорость сжимаемости воды.
Несмотря на свои небольшие размеры, сжимаемость воды важна для естественной жизни, так как она снижает уровень окружающего мира Ocean. In из-за отсутствия сжимаемости, было подсчитано, что этот уровень будет примерно на 30 м выше, чем в настоящее время(это приведет к затоплению около 4% всей площади). 24) при охлаждении очень чистой воды, предотвращая встряхивание, она может быть переохлаждена.
Однако такая переохлажденная вода есть unstable. It затвердевает при введении кристаллического льда. Давление водяного пара на переохлажденную воду несколько выше, чем у льда. Например, при температуре −10°C она составляет 2,13 и 1,946 им. Искусство. Это связано с относительной нестабильностью переохлажденной воды по сравнению со льдом. 25) отдельные капли воды особенно легко охлаждаются, и естественное замораживание делает их меньше difficult.
So, если диаметр составляет от 1 мм до 1 мкм, то температура быстрого естественного замерзания капель воды находится в диапазоне от −24 до −38°.Поэтому облако, даже при низких температурах, обычно состоит из капель воды, а не частиц льда. Каждый кубический сантиметр дождевого облака содержит десятки и сотни капель от 1 микрона до 1 мм в диаметре. ?
6) некоторые примеси, растворенные в воде, значительно влияют на способность к переохлаждению. Например, добавление небольшого количества ацетона позволило каплям воды переохлаждаться до −72°С. такие примеси, вероятно, встречаются в отрубах холоднокровных животных. Поэтому их организм способен выдержать замораживание и последующее размораживание.
С другой стороны, у теплокровных животных способность крови к переохлаждению очень мала. Кристаллизация воды, которая происходит во время замораживания, вызывает разрыв ткани с последующим некрозом. 27)в нормальном состоянии состояние жидкой воды стабильно. Наоборот, переохлажденная или перегретая вода находится в так называемом стабильном состоянии, последнее характеризуется следующими фактами До 0 1 2 3 b $ Давление, тыс. Диаграмма IV 21.
Относительное количество воды. Сама по себе она более или менее стабильна, и эта стабильность легко нарушается воздействием различных воздействий. Если представить себе кебуций, вершины которого слегка срезаны параллельно дну, то стабильному состоянию вещества соответствует конус, стоящий у его основания, и метастабильное, стоящее у углубления.
Возможность более или менее длительного существования метастабильного состояния обусловлена трудностью возникновения в этих условиях эмбриогенеза устойчивой фазы вещества. ? И К 76 Д Н: О 1 НЖ. «Я ч( Диаграмма IV-22.Схема распределения связей в кристаллах льда. 28) низкая плотность льда связана с наличием больших пустот в его кристаллической структуре.
Последние образованы молекулами воды, соединенными между собой водородными цепями. Каждый атом кислорода соединен с 2″собственными»атомами водорода[расстояние</(HO)= 1,00 А]и 2″чужими» (1,76 а rf (HO)). [</(ИО)=Г1.00а] ОО»1″ водородная связь между атомом кислорода и»чужеродным» {</(110)= 1.76 а], так что 4 водородные связи связаны с каждой молекулой воды (рисунок IV −22).
Это обеспечит стабильность ледовой структуры. Расположение атомов кислорода в этой структуре показано на рисунке 1В-23. Водород расположен вдоль соединительной линии (2,76 а, соответственно).Характеристики пустот в структуре льда можно увидеть на диаграмме. IV-24.
29) когда лед тает, температура не поднимается выше 0°C / Тепло, поступающее извне для плавления (теплота плавления): Н20 (t) — f 1,4 ккал =Н20(g).Когда вода замерзает, выделяется такое же количество тепла. Теплоемкость льда значительно меньше (примерно вдвое), а теплопроводность несколько больше, чем у жидкой воды. 30) сверху, рисунок lv-24.
Модель структуры льда. Тающий лед (или снег) без добавления тепла Наружная температура должна понизиться. Правильность этого вывода можно подтвердить, разбрызгав спирт на небольшое количество воды. snow. As в результате образования раствора снег быстро тает и сопровождается мощным охлаждением жидкости. При смешивании жидкой воды со спиртом происходит заметный нагрев смеси, поэтому охлаждение, наблюдаемое при таянии снега, происходит за счет его таяния.
31) Как видно из рисунка IV-23.In лед, число атомов кислорода, окружающих каждый атом на самом близком к нему расстоянии, равно 4. Используя рентгеновский анализ, мы обнаружили, что по мере таяния льда среднее значение этого числа увеличивается до 4,4 (1,5°C).А последующий нагрев воды-ее дальнейшее увеличение (до 83°С до 4,9). само по себе такое увеличение приводит к увеличению плотности воды.
Однако при этом среднее расстояние между соседними атомами кислорода увеличивается (от 2,76 а до 1,5°С во льду до 2,90 а, а от 83 ° С до 3,05 а), плотность уменьшается. Диаграмма IV-23.Схема строения льда. 32) в современной науке, как общее мнение, бытует мнение, что таяние льда сопровождается не полным, а лишь частичным разрушением его кристаллической структуры, а отдельные его пустоты заполняются водой.
С этой точки зрения, большая часть жидкой воды в нормальных условиях не состоит из полииндрола (дополнительный 7) и состоит из кристаллической ледяной сети, которая несколько рыхлая и искаженная в состоянии непрерывного reconstruction. In свет этих данных, аномалия плотности воды (add 9) может быть интерпретирована следующим образом: от 0 до 4 С, увеличение среднего числа ближайших соседей, окружающих каждую молекулу HjO, является наиболее важным, и дальнейшее нагревание увеличивает среднее расстояние между ионами.
3.1) согласно другим представлениям, жидкая вода содержит более или менее обширную группу псевдокристаллов молекул Н » 0, образованных водородными связями. Такна постоянно разрушается, и вновь образованные молекулярные агрегаты («кластеры»), кажется, плавают в моногидрической воде (их относительные количества могут быть малы).
Нагрев способствует разрушению кластеров и равновесному перемешиванию в пользу гидролиза. 34) выдерживается при высокой температуре (под давлением), после чего охлажденная вода отклоняется от нормальной по некоторым характеристикам, а время возврата к»стандарту» сообщается в течение нескольких дней. Если все это правда, то это сообщение очень интересно.
35) по международному соглашению (1954) температура в тройной точке диаграммы состояния воды принимается за основу абсолютной шкалы температур (II§ 2 постскриптум 9), точное значение составляет 273,16°к. эта температура экспериментально воспроизводима с точностью 0,0001®К.
Как и прежде, градусная шкала температуры основана на интервале между температурой плавления и температурой плавления льда (0,0, 100°К ниже тройной точки) и температурой кипения воды при нормальном давлении. Начиная с 19b8, его основной точкой является температура (eC), соответствующая следующему процессу(при нормальном давлении):
Кипение водорода −252.87 плавление олова 231.968 «Неон-246.048» цинк 419.58 «Кислород-182.962» серебро 961.93 «Вода 100,000» золото 1064.43 Многие другие температуры также используются в качестве вторичной постоянной точки. 36) количество тепла, которое должно быть потрачено на сублимацию (сублимацию) вещества, называется сублимационным теплом. Например, для йода 12 (t)+ 15 ккал = I (g).
Температура сублимации(например, сублимация) понимается температура, при которой давление паров сублимированного материала достигает 760 мм рт. Искусство. Термин осаждение был предложен для обратной сублимации процесса, то есть прямого перехода вещества из парового состояния в твердое state. It следует отметить, что в физике атмосферы сублимация понимается именно как осаждение.
37) на практике сублимация очень часто наблюдается при атмосферном давлении, а также в веществах с тройной точкой менее 760 мм рт. ст. Искусство. Это происходит, когда некоторые из нагретых веществ свободно выходят из системы. Например, нагревая достаточное количество твердого йода в колбе, пар вытесняет с ней воздух. На 760 мм рт находится под давлением пара ИЖ. Искусство. Йод растает.
Напротив, при нагревании в открытой чашке пара I не накапливается, а твердый шнур испаряется. Происходит сублимация. Из вышеизложенного следует, что 1 то или иное поведение твердого тела при нагревании будет заключаться в том, что оно определяется не полным внешним давлением. Парциальное давление, создаваемое в системе паром относительно указанной тройной точки. 38)Как видно из РНС.
В точке 1, которая соответствует области присутствия 1 в-13 и 1 фазы (жидкой воды), как температура, так и давление могут быть произвольно изменены до известного предела, без ущерба для стабильности этого phase. As они обычно говорят: В этих случаях система point 3 имеет 2 степени свободы. В точке G, которая соответствует стабильному равновесию двух фаз (жидкой воды и пара), это равновесие можно нарушить, произвольно изменив только 1, либо температуру, либо pressure.
In в этом случае 1 конкретное изменение внешнего условия соответствует другому конкретному изменению (согласно кривой A B). таким образом, здесь система имеет только 1 степень свободы. Наконец, в точке а характерное равновесие всех трех фаз не может быть нарушено, ни температура, ни давление не могут быть изменены. Число степеней свободы, соответствующих этой точке, равно нулю.
39) чтобы подвести итог вышесказанному, нужно ввести отдельное представление о количестве независимых компонентов. Количество независимых компонентов e < * r — это минимальное количество веществ, участвующих в образовании системы, которое необходимо для представления химического состава всех phases. In в случае воды состав каждой фазы равен 1, так как она представлена одной и той же формулой-HjO.
Для более сложных равновесных систем CaCOa CaO + CO * число независимых компонентов равно 2.Это связано с тем, что при выборе 2 веществ, входящих в равновесие, состав каждой фазы может быть выражен в них (в данном случае 2 твердых компонента-CaCO», CaO-и 1 газ-СО*)… ■Со *(САО + со3), содержащей отдельные компоненты КоАП получается. CaO, COt » > > CaCO, CO, > CaC03, (CaCOj-COj), COa „«„CaCOj н Цао> CaCOe. Цао. (CaCOj-CaO)
В общем случае в равновесных химических процессах число независимых компонентов на 1 меньше их общего числа, то есть числа веществ, содержащихся в уравнении реакции. 40) число фаз, степени свободы и независимые компоненты равновесной системы связывают фазовые правила друг с другом(Гиббс, 1878).Если внешними условиями, влияющими на состояние равновесия, являются только температура и давление, то правила формулируются следующим образом: число степеней свободы и число фаз равно числу независимых компонентов и 2.
Или аббревиатура: C + F =. „/С + 2. Используйте фазу rule. By любые 2 характеристики системы (количество фаз, степени свободы, независимые компоненты), 3-я могут быть определены. Например, если требуется определить число степеней свободы по числу фаз и независимых компонентов(рис. IV-13): Пункт 3.0 + 1-1 + 2 С-2> “ против г. .С + 2-1 + 2С-I“ » А*. .С+ 3-1 + 2С-О Аналогично, сбалансированная система CaCO * * CaO + CO * имеет только 1 степень свободы (C + 3■■2 + 2).
Системы с числом степеней свободы, равным нулю, называются инвариантными в C-1 одномерными, C-2 днями и т. д. 41) строгое определение критической температуры(и добавление 1 доллара.16) Как видно, при условии области над ней система становится single-phase. At давление, не превышающее критического, обладает свойствами газа со случайным распределением частиц.
Однако дальнейшее повышение внешнего давления приводит к примирению и»насильственному» созданию на стадии учета меньшего или большего порядка, соответствующего структурным особенностям жидкости или твердого тела. Принципиальным отличием таких искусственно созданных «псевдоконденсатных» состояний (жидких или твердых) от обычных состояний является превосходство взаимного отталкивания над сжатием частиц.
42) кроме обычного льда, при высоком давлении могут быть получены и другие сорта. На рисунке IV-2S показана полная диаграмма состояния воды. Римские цифры на нем указывают на стабильные области различных типов льда (ранее предполагавшееся существование льда IV было также подтверждено позже).
Для Плотность этих льдов задается величиной 0,92 ( / ), 1,18 (II). 1.15 (///), 1.26(в). 1.34 (VI), 1.51 (VII). Тройная точка системы ice V / — Ice VII-жидкость и вода — находится в F82ec и 22 000 банкоматах. Присутствие льда VII при таянии при температуре+ 442°C (то есть выше критической температуры воды) можно проследить до давления в 20 миллионов атмосфер.
43) при очень низких температурах существует особая (метастабильная) форма ice. So, при резком охлаждении водяного пара ниже-124 ° С получается»стеклянный» лед, который характеризуется случайным расположением отдельных молекул воды, то есть отсутствием четкой кристаллической структуры.
Сообщалось, что при температурах ниже −173°С, при давлении порядка 10 ″* мм рт. ст., был получен лед с плотностью 2,3 г / см*. / см3, ооочень, а при более высоких температурах это только нормальные ооочень шестиугольники, причем последнее охлаждение не вызывает превращения в холодную форму J ’ 00
Смотрите также:
| Водород | Роль воды в природе |
| Химическое равновесие | Перекись водорода |
