Оглавление:






Перекись водорода
- Водород peroxide. In кроме воды известно еще одно водородокислородное соединение-перекись водорода (Н2О2). в природе он образуется как побочный продукт при окислении многих веществ кислородом воздуха. Следы его постоянно видны во время осадков. Перекись водорода частично образуется в пламени сжигаемого водорода и разлагается при охлаждении продуктов сгорания.
- Теплота образования перекиси водорода из элемента не может быть определена непосредственно. Возможность нахождения этого опосредованно зависит от Г. И. данного законом постоянства суммы теплоты, установленным Гессом (1840).
общий тепловой эффект ряда последовательных химических реакций равен тепловому эффекту ряда других реакций с тем же исходным материалом и конечным продуктом 3. Людмила Фирмаль
Сущность этого закона особенно очевидна в свете следующей механической аналогии: общая работа, выполняемая при опускании груза без трения, зависит не от его траектории, а только от разности начальной и конечной высоты. Аналогично, общий тепловой эффект этого nn в других химических реакциях определяется только разницей между результирующим тепловым потоком (NS-элементом) конечного продукта и исходным материалом.
Если все эти величины известны, то сумма ns тепла достаточна для расчета теплового эффекта реакции Вычитание суммы теплоты образования исходного материала, образующего конечный продукт. Закон Гесса часто приходится использовать при расчете цплот реакций, для которых такие прямые экспериментальные решения трудны или невозможны. Применительно к модели 202202 расчет может быть выполнен на основе рассмотрения 2-х различных методов водообразования. 1.
Когда водород и кислород объединяются, сначала образуется перекись водорода, а затем разлагается на воду и кислород. Тогда есть следующие 2 процесса. 2Н2-L202 =2Н202+2xcal 2Н202=2Н20+ 02 + 47 ккал Тепловой эффект последней реакции можно легко определить экспериментально. Добавьте оба уравнения на член и уменьшите один и тот же член、 2Н2+ 02 =2Н20+(2х-f 47) ккал 2.
Когда водород и кислород соединяются, вода образуется непосредственно、 2×2+ 02 =2×0 + 137 ккал В обоих случаях, поскольку исходный материал и готовый продукт одинаковы, 2x + 47 = 137 и x = 45 ккал. Это будет теплота образования граммовой молекулы перекиси водорода из элемента. Перекись водорода легче всего получить из перекиси бария (BaO3), действуя в разбавленной серной кислоте. Ba02-f H2SO < = BaS04-fH202
При этом наряду с перекисью водорода образуется сульфат бария, который нерастворим в воде, из которой можно удалить жидкость фильтрованием. H202 обычно продается в виде 3% водного раствора. 4-5. Чистый перекись водорода представляет собой бесцветную, сиропообразную жидкость (плотность около 1,5 г / с * 3), которая перегоняется без разложения в достаточно восстановленном состоянии.
Замораживание H202 сопровождается сжатием (в отличие от воды).Белые кристаллы перекиси водорода плавятся при −0,5°С. Примерно такая же температура. Как лед.* Структурная формула перекиси водорода-Н-О-Н-indicates указывает на прямую связь 2 атомов кислорода друг с другом.
Эта связь слаба и вызывает молекулярные instability. In факт, чисто Н202 может разложить в воду и кислород мимо explosion. In разбавленный водными растворами, он гораздо более стабилен. Как и вода, перекись водорода растворяет много соли well. It смешивается с водой (также со спиртом) в любых пропорциях.
Разбавленный раствор будет иметь неприятный «металлический» привкус. Действие G1rn на кожу сильного раствора обжигает, и обожженное место окрашивается в белый цвет. Перекись водорода является сильным окислителем. То есть они легко отдают избыток (по сравнению с водой, которая является более стабильным соединением) атомов кислорода. Поэтому под действием безводных и даже высоких концентраций Н202 на бумаге, опилках и других горючих материалах они воспламеняются.
Практическое применение перекиси водорода Оно главным образом основан на своем оксидативном влиянии. Мировое производство H2O2 в год превышает 10 миллионов тонн. Свойства окислительного разложения пероксида водорода могут быть схематически представлены следующим образом: К I =уО — + — о (для окисления) \ н-0W Кислотная среда благоприятствует этой порче по сравнению с щелочной.
Уменьшение затухания за счет схемы гораздо менее характерно для перекиси водорода. Ч-0 ЧАСОВ | = J + 2H (для уменьшения) Н—ОО Щелочная среда более благоприятна для такого распада, чем кислотная среда. Перекись водорода также очень слаба в кислотных свойствах. При взаимодействии с гидроксидом некоторых металлов образуется соответствующая перекись, поэтому ее следует считать солью перекиси водорода.
Это, например, реакция с гидроксидом бария: Ба (о) г + H2Ob Бао * + 2H20 Соль перекиси водорода характеризуется наличием в молекуле поперечной цепи из 2 атомов кислорода. В обычном оксиде такой цепи нет. Это видно из сравнения структурной формулы пероксида бария и диоксида олова, например. / О Ба < / 0 = СН = 0 XO В связи с этим соотношение перекиси и обычных оксидов к кислотам различно-первые реагируют с образованием перекиси водорода, а вторые-с водой: Ba02 + H2S04 = BaSO < — fH202 Sn02 + 2H2S04 = Sn (S04) 2 + 2H20
Изучая продукты реакции с кислотами, можно увидеть, являются ли определенные соединения кислорода пероксидами или обычными оксидами. Атомы водорода перекиси водорода замещаются не только металлами, но и кислотой radicals. In в последнем случае получается кислота, называемая Перикислотой, которая содержит в молекуле пероксидную цепь.
Поэтому они являются производными перекиси водорода(они, как и последние, обладают сильным окислительным свойством). примером может служить формула серной кислоты и персульфата натрия вместе с самой формулой. О-Н О-Н О-SO3H Я. О-Н О-Н О-SO3H Пероксид Натрия гидрокарбонат Пероксид водорода солнца является наиболее распространенным представителем производных пероксида.
Последние могут быть определены в общем виде как соединения, содержащие атомы кислорода, которые непосредственно связаны друг с другом. Обычный оксид (II§ 5) не содержит такой кислородно-кислородной связи, которая принципиально отличается от peroxide. In название соединения группы-О-О, часто используется термин»пероксид»или»перекись«(в конце названия). Добавь 1) имеется специальная монография по перекиси водородаи обзорная статья по неорганическим пероксидам*.
Химия образования lijOj при сгорании водорода не ясна. было обнаружено, что oi восстанавливается до комбинации радикалов 2 OH и присутствует в водородном пламени. Однако дальнейшие исследования не подтверждают этого предположения, и в настоящее время обсуждаются другие, более сложные пути реакции. При нормальном относительно медленном охлаждении продуктов сгорания образующийся HjO2 успеет полностью разложиться на воду и кислород.
Если тонкое водородное пламя направить на кусок льда (то есть за счет быстрого охлаждения продуктов сгорания), то в образовавшейся жидкости обнаруживается небольшое количество перекиси водорода. 2) при достаточно высокой концентрации(до нескольких процентов) Н202 получается взаимодействием молекулярного кислорода с водородом в момент его развития.
Перекись водорода также частично образуется, когда влажный кислород нагревается до 2000°C, когда тихий разряд проходит через влажную смесь водорода и кислорода, и когда ультрафиолет или Озон подвергаются воздействию воды. 3) строго говоря, некоторые Гессианы должны быть сформулированы как «закон инвариантной суммы энергии», поскольку при химическом преобразовании энергия может высвобождаться или поглощаться не только в термической форме, но и в механической, электрической, etc.
- In кроме того, рассматриваемый процесс протекает при постоянном давлении или постоянной температуре. volume. In принцип этот точно такой же, как и в случае химической реакции, и все остальные виды энергии могут быть пересчитаны из тепловой энергии. Поэтому нет необходимости менять практически удобное выражение закона Гесса в тексте. 4) нормальный водный раствор 3% H} 02 можно испарять на 60-70°С в течение длительного времени, так, что содержание перекиси водопода сможет быть 30%.
To чтобы получить более сильный раствор, воду следует отгонять при пониженном давлении. pressure. So ПРН 15 мм рт. ст. В дистилляционной колбе остается очень концентрированный раствор перекиси водорода, из которого при сильном охлаждении можно выделить белые кристаллы.
Сначала (примерно с 30°С), когда вода в основном испаряется и температура достигает 50°С. Людмила Фирмаль
5) основным промышленным способом получения перекиси водорода является взаимодействие серной кислоты (или некоторых ее солей) с водой, которое протекает легко по схеме: FhSsOe-f2H| 0 = 2HjSO » — Fjoj. Некоторые новые методы (например, разложение органических пероксидных соединений) и старые методы получения из Бао не столь важны.
Для хранения и транспортировки перекиси водорода в больших количествах лучше всего подходят алюминиевые контейнеры (чистота 99,6% и более). в) теплота перекиси водорода составляет 3 ккал / моль, теплота испарения-12 ккал! моль (pr 25°C).при нормальном давлении чистый H202 кипит при 152CC, вызывая сильное разложение(кроме того, пар может взорваться).
Для его критической температуры и давления теоретически рассчитываются значения 458°C и 214 атмосфер. * Пакет Сеттерфилда. Вентворт. Перекись водорода.*Пер с английского, Под * ред. А. И. Горбанева. М.. Падатмнлит. 95-й. 57В стр. * * Вольнов И. И. и успехи химии. 19/2, Н » 4, 60В、 Плотность чистого Н2Оа составляет 1,71 г / см9 в твердом состоянии, при 0°с 1,47 г / см*, при 25°с 1,44 г / cat3.Жидкая перекись водорода, как и вода, тесно связана.
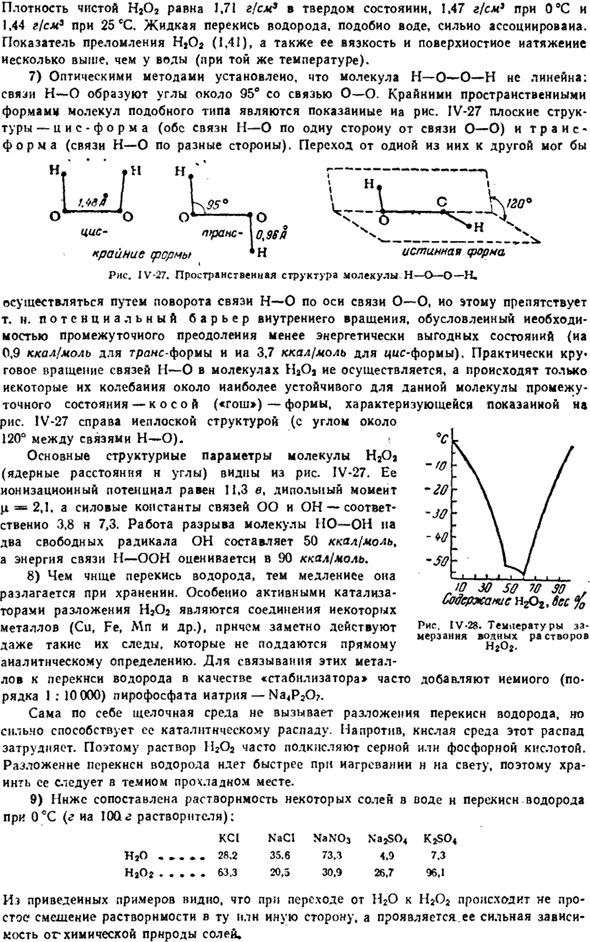
Показатель преломления HjO *(1,41), а также его вязкость и поверхностное натяжение несколько выше, чем у воды(при той же температуре). 7) оптическими методами установлено, что молекулы H — O — O-H не являются линейными. Связь H-O образует угол около 95°с связью O-O. На рисунке показана экстремальная пространственная морфология этого типа молекул. IV-27 представляет собой плоскую структуру, как-(оба из H-O связи на одной стороне o-o связи) и транс — (напротив H-O связи).
Переход от одного из этих 1 к другому Северный. * Н * г————-> / K95°\ CK / Вт О1 это’о о ^ −10 ч — ^ н < пгран-10.96 I \ ___ Экстремальная ферма * N true warna » РНС. ИЖ-27.Пространственная структура молекулы H_O_O_H. Связь О-О выполняется путем поворота связи Н—О вдоль оси. Потенциальный барьер внутреннего вращения из-за потребности в промежуточных соединениях преодолевает менее энергетически выгодное состояние (0,9 ккал / моль в транс-типе, 3,7 ккал / моль в цис-типе).
На практике происходит круговое вращение н—о связи молекулы Н2Оае, и только часть ее колебаний происходит вблизи промежуточного состояния, которое наиболее устойчиво для молекулы-формы Co-Oh («gauche»).1В-27 на правой стороне плоской структуры (угол между bond-bond скреплением около 120°). Основные структурные параметры (расстояние и угол ядра) молекулы HjOj можно увидеть на диаграмме. ИЖ-27.
Его потенциал ионизации равен 11,3 в, его дипольный момент равен t » C, а силовые константы связей OO и OH равны 3,8 N 7,3 соответственно. Задача разложения молекулы HOOH на 2 свободных радикала OH оценивается в 50 ккал / моль, а энергия связи H_UN оценивается в 90 ккал / моль. 8) Чем больше перекиси водорода, тем медленнее разложение при хранении.
Особенно активными катализаторами разложения NEO3 являются соединения некоторых металлов (Cu, Fe, Mn и др.), и даже следы их не могут быть определены непосредственно аналитически. Для того, чтобы связать эти металлы с перекисью водорода в качестве «стабилизатора», часто в небольших количествах (около I: 10 000) пирофосфата натрия-Na4P} 0?Вы также можете использовать его в качестве инструмента для создания собственных пользовательских виджетов.
Щелочная среда сама по себе не вызывает разложения перекиси водорода, но она сильно способствует каталитическому разложению. Напротив, кислотная среда затрудняет этот распад. Поэтому растворы H * Qa часто подкисляют серной или фосфорной кислотой. Разложение водорода происходит быстрее при нагревании на свету, поэтому его необходимо хранить в прохладном, темном месте.
9) сравнивают растворимость некоторых солей в перекиси водорода при 0°С (Г и 100 <г растворителя): ККИ Каси NaNOj NajS04 KjS04 Хьо. . 。 。 2ХА.2 35.6 73.3 4.0 7.3 HjOJ ….. 63.3 20.3 30.0 26.7 06.1 Как видно из приведенного выше примера, при переходе от Н 0 к Н2О3 происходит не простое смешение обратной растворимости, а сильная зависимость от химических свойств соли.
Диаграмма IV-28.Температура замерзания водного раствора N * 0 *. 10) несмотря на то, что перекись водорода по своему составу и многим свойствам очень похожа на воду, их смеси замерзают отдельно при гораздо более низкой температуре, чем в каждой department. As вы можете видеть, rns.
Есть смеси, которые замерзают только при 1В-28, не более 50°С. В этих условиях может образоваться очень нестабильное соединение с составом Н202-2Н20(именно поэтому нижняя часть кривой изгибается). Отметим, что водные растворы, содержащие более 50% Н2О2(и безводную перекись водорода), склонны к переохлаждению. Перекись водорода, как и вода, смешивается только в ограниченном диапазоне.
11) более половины всего полученного пероксида водорода обычно расходуется на отбеливание различных материалов, которое осуществляется очень разбавленным (0,1-1%) водным раствором H2O2.An важным преимуществом перекиси водорода перед другими окислителями является «мягкость» действия. Именно поэтому сам отбеленный материал практически не пострадал. Медицинское применение очень разбавленного раствора Н202 в качестве антисептика(полоскание горла и др.) связано с этим.
Высококонцентрированный (более 80%) водный раствор НГОГ используется в качестве источника энергии, а также в качестве окислителя реактивного топлива (используя катализатор быстрого разложения 202202, 1 литр жидкой перекиси водорода может производить смесь кислорода и пара, нагретую до 700°C, около 5000 литров) независимо.
Перекись водорода применяется в химической промышленности в качестве окислителя, в качестве сырья для многих перекисных соединений, в качестве инициатора процесса полимеризации, а также при изготовлении некоторых пористых изделий, а также для искусственного старения вина, окрашивания волос, удаления пятен и др.
12) восстановительное разложение перекиси водорода происходит, например, в присутствии оксида серебра: Ag20 +н 202= 2Ag-f-Н20+ 02.Аналогично, взаимодействие с озоном существенно протекает (О* — fH202e HjO■+■20а) и перманганатом калия в кислой среде: 2KMn04 + 5H2Oa + 3H2S04 = K * S04 + 2MnS04 + SO,+ — f-8H20.Последняя реакция используется для определения перекиси водорода.
13) сообщалось, что при взаимодействии с использованием разрядов 放電2 и 02 можно получить н20з. Согласно данным инфракрасной спектроскопии, молекулы этого пероксида имеют структуру 0 (0H) 2,а связь O-O примерно на 5% длиннее H202 и на 25% слабее. При температуре −60°C разложение HjO, H20, O *происходит в несколько hours. In нормальные условия, он совершенно нестабилен.
Смотрите также:
| Вода | Дисперсные системы |
| Роль воды в природе | Молекулярные растворы |
