Оглавление:

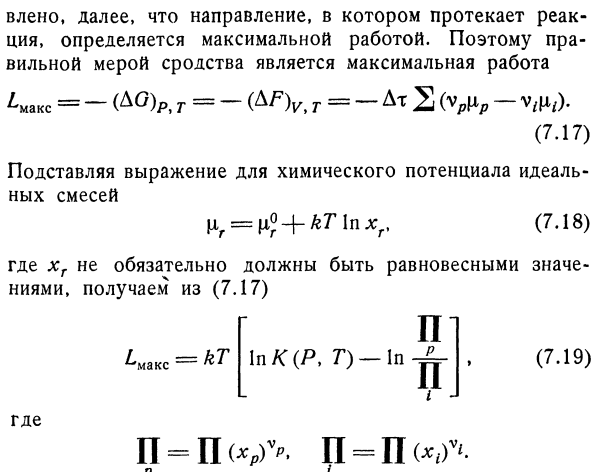







Химическое сродстово
- Химическое сродство В прошлом предполагалось, что тепло, выделяемое в результате реакции, является естественной мерой»сродства»между компонентами, входящими в реакцию, но на самом деле к этой точке зрения могут привести сжигание определенных материалов, смешивание воды и серной кислоты и многие другие эксперименты.
Быстро, например, реакция Br2 ~ 12 = 2 Br1. Кроме того, было установлено, что направление, в котором протекает реакция, зависит от максимального объема работы.Поэтому правильной мерой сродства является максимальная работа ^ Макс = — (д°) р, т = — т =(Ур«р-Vrfl,). (7.17) Используйте формулу вместо химического потенциала идеальной смеси | 1р = Т°+ ЛЛ * * Р, (7.18) если xi не должно быть сбалансированным значением, (7.17) In K (I, D) — в н. С. С. н. Я-Я. Л-кт. (7.19):) Куда? Если количество продуктов реакции невелико, а компонентов, участвующих в реакции, больше, чем в равновесной смеси, то величина£max положительна.Поэтому при реакции 1 моль (Ат — это число Авогадро) и определенном составе наибольшая работа П. С. ^ Макс = — АГ = — АГ0-РТ В-й-.
Благодаря этой теории, только экзотермические реакции могут происходить спонтанно, что неудивительно. Людмила Фирмаль
- Я… В состоянии равновесия L = O, или В-Г- = в K = — •(7 −20) П. Р. Я… Конечно, этот результат соответствует выражению (7.11).Однако стоит обратить внимание на эту формулу, так как в термодинамических таблицах это обычно не химический потенциал, а G0 и AG0.Иногда AG также может быть определена непосредственно путем измерения электроэнергии Мертвая сила гальванического элемента (см. Последнее задание в главе 4). — Спросил я.Я все выясню.: а) константа равновесия реакции Н2 = 2Н; б)р = 1 степень диссоциации в диапазоне температур 1000 −4000°К при атм\ в)р = 7,6 * 10-5 мм рт. ст.Искусство. Мы используем значение энергии диссоциации молекулы водорода 2en-eH2 = 4,47 эВ.
Внутри таблицы.На рисунке 1 показано значение-(G0 — £o)/ 7 «1 молекулы при давлении АТМ и атомарного водорода. Таблица 1 (з / m0l ’ °к г,°к \ / П2. 1000 118.91 138.01 2000 133.31 158.14 3000, 141.71, 170.71. 4000 147.71, 180.11 И решение тоже.Умножьте значение в первом столбце на 2 и вычтите значение во втором столбце, вы получите разницу-D (0° — Eq) / T. Константа равновесия/ C = exp (- DO°//? T)find.In кроме того, необходимо знать значение D£o.то есть тепло, поглощенное реакцией при T = 0, представляет собой диссоциированную энергию.Показана энергия, необходимая для расщепления молекул водорода на свободные атомы, величина которой составляет 4,47 эВ. Эта энергия, назначенная на 1 моль 4.47•4.8•10 „10•^•6.02。10• * 10 “ 7 = = 430,550 Дж / моль.
- Таким образом, мы получаем значение, указанное в столбце 1 и столбце 2 таблицы. 2.Потяните первый стол Со 2-го, результат/?Разделить на= 8.31 найти j \ mol, ДG0/ RT. значение Он расположен в 4-м столбце таблицы. 2. Таблица 2 Р,°К Г ((/> -* *) м <р РТ и к(п = 1 ПКР) (Р-1 АГМ)а(п-10 » 7 атм) 1000 99.8 430.6 39.8 4.7.10〜18 1,Н <Р9 6.9-У-6 2000 108.5 215.3 12.9 2.5-10 «6 8-U-4, 0.93. 3000 112.7 143.5 3.71 0.0245 7.8. У-2 4000 115.3 107.6 0.93 2.535 0.62 а (свободных и связанных) от общего числа атомов водорода N.At в то же время Ну = с,= а) n、 Поэтому степень диссоциации связана с константой равновесия следующей зависимостью: [Ч] 2_ 4а ’ 2 а— [Н2]-1-А2 ′ З
начение степени диссоциации указано в 5-й строке таблицы. 2. С. В реакции Н2=2Н, число молекул газа увеличивается на 1. АВ — = —В/) = Л、 Газ. Так, согласно (7.16), он переходит от давления Р = 1 атм к относительно высокому вакууму. Р = 7,6 * мм рт. ст., которую необходимо умножить на константу равновесия = 760 5 = 10L P 7.6-10 » 5
Как видно из последнего столбца таблицы. 2, удар давления очень prominent.At атмосферное давление, температура около 4000 ° К требуется для получения ярко выраженного dissociation.In а в вакууме, наоборот, уже при 2000°к степень диссоциации превышает 90%.
Степень диссоциации, конечно, можно определить как процент свободных атомов. Людмила Фирмаль
Смотрите также:
| Химическое равновесие.Координация реакции | Третий закон термодинамики.Тепловая теорема нернста |
| Закон действующих масс | Недостижимость абсолютного нуля |
