Оглавление:








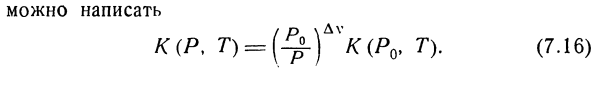

Закон действующих масс
- Закон масс (7.9) При расчете химического равновесия можно использовать химический потенциал идеальной смеси, то есть формулу (6.88) с высокой степенью точности.Поэтому в этой главе мы всегда будем / ИК =х®(7 \ р)+ т \ го Для каждого реагента. Приближение(7.9)можно обосновать следующим образом:используя формулу(6.88) или(7.9), вы игнорируете изменения в молекулярных взаимодействиях, которые происходят при смешивании ингредиентов.
Однако в этом случае вклад в q химических связей, образованных или разорванных в реакции, учитывается точно.Энергия связи учитывается в значении\ x°каждой молекулы.По сравнению с энергией связи энергия и ионные взаимодействия Ван-дер-Ваальса обычно незначительны.Подставляя формулу(7.9) в точное уравнение равновесия(7.6), получаем закон действия массы. Р <* р> в ’ = / C(Р. Т.)、 С. С. (7.10) П. С. см-в、) К-ехр (7.11) уз. — Функция только давление или температура.Этот закон был впервые принят Гульдбергом и Вааге (1864).Формула, выражающая закон рабочей массы, позволяет рассчитать состав конкретной системы в состоянии равновесия по химическому потенциалу всех молекул в системе. — Спросил я.
Фотосфера Солнца состоит в основном из атомов H, H-ионов и электронов e, а сродство водорода H к электронам A составляет 0,72 эВ. Людмила Фирмаль
Предполагая, что все 3 компонента можно рассматривать как идеальные одноатомные газы、 И Дж—СЕ / со> Где c-концентрация, f (G) — функция, содержащая L(среди задач, предложенных на экзамене Оксфордского университета 1962 года) Решение.По законам масс, которые у нас есть уз. Химический потенциал идеального одноатомного газа описывается в следующем формате(см. Главы 6, Глава 2 и стр. 2) со = е + т [в п-в Т + с const]、 Таким образом, можно принять + константа В этой связи en + her-en — = A — энергия связи электронов отрицательных ионов водорода.Дай Ljn = const PT — % A’KT. [И] [Е] Согласно предположению, давление просто P = NkTjV. Н = НХ + НГН — + НТ. Кроме того, молярная фракция[Н],…Замените на NnlNt, чтобы получить нужное выражение. Ч -, л т — * ч AikT — =сопи•cQl е Си. J) здесь и далее используется обозначение[X], которое используется в химии концентрации cx. Куда? 0.72 ’150-4′ 8 ′ 10 ′ U — =- — — — =8350°К. к 1.38 * 10 1.Пример.Равновесие системы азот-кислород. В качестве примера мы продолжим рассматривать азотно-кислородную систему, уже упомянутую в§ 1.Основная реакция этой системы, а именно、
[Нет] 2 k(pt [нет、] « [Н2] [02] — л> * [Н2] [02] 2-Д21 [нет] _k ж-д [°12-〜 [Н] [О]〜Аз[Н2]-[02]- Получите 5 алгебраических уравнений для определения состава. [Нет]:[N02]:[N]: [N2]:[O]: [02] Однако, если константа равновесия/ C(P, T)известна.Однако не все из многих уравнений, которые могут быть описаны таким образом, являются independent.In в данном случае только 4 из них написаны Потому что, как вы видите из этого, это K \ = KbKaKb.Получим еще одно независимое уравнение, задав соотношение£общего количества азота и общего количества кислорода. [N0] + [N02] +2 [N2)+ [N] [N0] +2 [N02] +2 [02] + [0] ’ Для воздуха / = 3,72.Конфигурация системы теперь полностью defined.By определение, 6 неизвестных молярных фракций соответствуют формуле Tslg,= 1
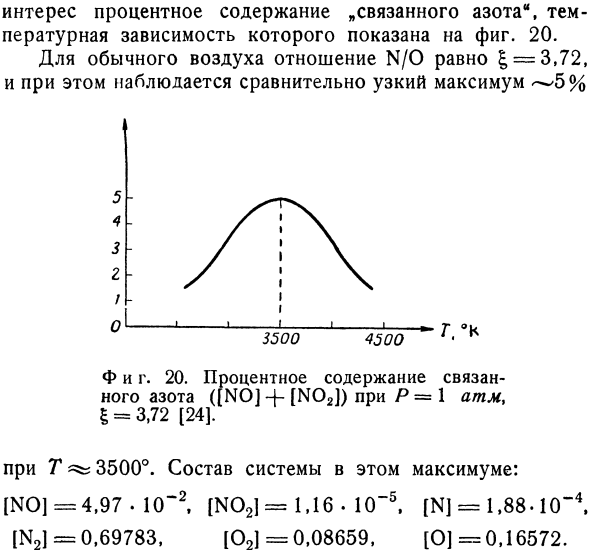
- Мы получаем еще 5 независимых уравнений. Последний расчет полного равновесия был сделан Ван Биком Виссером(1958) [24].Эти расчеты основаны на спектроскопических данных и, очевидно, очень точны.Подарки для химиков и инженеров Интерес представляет соотношение «связанный азот», температурная зависимость которого показана на рисунке 20. Для нормального воздуха отношение N / 0 равно 1 = 3,72, и наблюдается относительно узкий максимум 5-4.- 3.- г.- F и D.20. Р = 1 атм, I = 3,72[24]отношение связывающего азота ([NO] — \ — [N02]). T ^ при 3500°.Настроить систему на максимальное: [Нет] = 4.97•10-2, [с n02] = 1.16. 10-5. [Н] = 1.88•10-4, [Н2] = 0.69783、[02] = 0.08659、[О] = 0.16572.
Однако соотношение£= 3,72 не является самым благоприятным.Если усилить смесь кислородом, то выход значительно возрастет. согласно Ван Бику Виссеру, если| = 1, то получается максимум 6,4% связанного азота. 3.Основа Далее мы кратко рассмотрим, как изменяется химическое равновесие в результате изменения внешних условий.Объедините уравнение Гиббса Гельмгольца (см. Главу 4,§ 2) с законом массового действия (7.10、 д В К Д (7.12)) dt. РТ2. Где Q-тепло, поглощенное реакцией.
Согласно определению к, концентрация продукта реакции содержится в молекуле, поэтому, нагревая систему, выход продукта Увеличение эндотермической реакции (Q > 0), уменьшение в случае экзотермической реакции(Q <0).Это пример общего принципа, названного принципом Ле Шателье (1850-1936).Согласно принципу Ле Шателье, равновесие термодинамической системы при внешнем воздействии смещается в таком направлении, что система компенсирует влияние внешних воздействий. Аналогично, смещение химического равновесия с изменением давления является д \ п к _ ДК — ДП — — — — РТ * {’л6)
Где AV-общее изменение объема на 1 моль в процессе реакции. Этот эффект особенно выражен в отношении газообразных компонентов, которые могут быть записаны (см. Главы 6,§ 2 и 2 страницы). | я°= в п-ф-ф(т). (7.14 ′ Увеличение количества молей газа во время реакции АВ = 2(х» — в /). (7.15) Газ. Я умею писать. к(П. Т)=(^-) АУК(Ро> Т). (7.16)
Если реакция приводит к увеличению объема (слева направо), то равновесие сдвигается влево по мере увеличения давления. Людмила Фирмаль
Смотрите также:
| Электролиты | Химическое сродстово |
| Химическое равновесие.Координация реакции | Третий закон термодинамики.Тепловая теорема нернста |
