Оглавление:






I-S-диаграмма для газов и продуктов сгорания
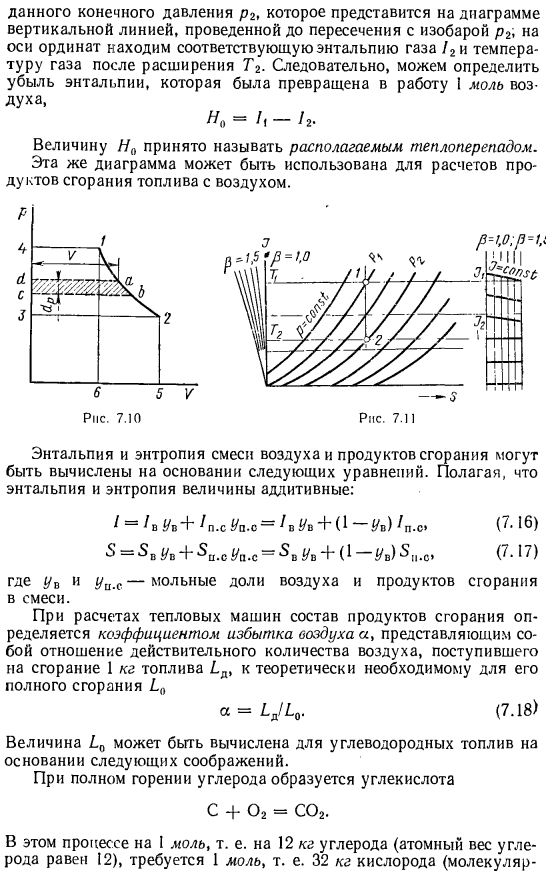
- T-s диаграмма является очень удобным и наглядным средством для изучения процессов и циклов, которые осуществляются в тепловых машинах и оборудовании. Использование этого показателя для вычислительных целей затруднено тем, что количество тепла определяется его площадью. Чаще всего в расчетных целях Энтропийная диаграмма, в которой координаты температуры заменяются координатами энтальпии по уравнению Я = 1lsrT. Поскольку теплоемкость газа зависит от температуры (см.[3.19] 1), разбивка осей координат происходит неравномерно. Расстояние между изотермами при одинаковом повышении температуры увеличивается с увеличением теплоемкости газа.
Изобары и изолинии идеального газа изменяются незначительно по внешнему виду, так как расстояние между изотермами увеличивается с повышением температуры, сохраняя при этом кривую равноудаленности. Его легко построить из точек, перенесенных с диаграммы Т-5.Изоляция этой фигуры остается вертикальной линией. Использование схемы I-5 основано на: процессе изоляции (?? = 0) из уравнения (4.17)、 а / = в ЛР Или после консолидации, от начального состояния газа в точке 1 до конечного (после инфляции) в точке 2 Признаки перемен, мы получаем U4r. Однако/ VЗр представляет собой техническую работу, полученную в машине (турбине) (PL.12341, рис. 10). так что вы можете написать равенство С — / г = 1″.
Чтобы избежать этого, значительная часть настоящей главы посвящается рассмотрению идеальной жидкости, физические параметры которой не зависят от температуры. Людмила Фирмаль
Исходя из этого, можно сделать вывод, что техническая работа газа при адиабатическом расширении определяется изменением энтальпии при расширении. Где Λ-начальная энтальпия газа при его поступлении в машину (турбину) и/ — конечная энтальпия при выходе газа после адиабатического расширения. На рисунке 7.11 показана схема I-5, созданная для 1-моля air. In в расчетах эта цифра используется следующим образом: будем знать, что воздух поступает в турбину под давлением ₁ и температурой Tc.
Найти начальное состояние газа в точке 1 на диаграмме пересечения Изобары P1 и изотермы T₁, а в ординате определить начальную энтальпию 1 моля воздуха^в турбине теоретически возможно адиабатическое расширение. Соответствующая энтальпия газа/2 и температура газа после расширения T2 отображаются на вертикальной оси заданного конечного давления p2, которое отображается в виде вертикальной линии, проведенной перед пересечением изобарной линии p2.Поэтому можно определить уменьшение энтальпии. -Я не могу в это поверить. Величину Np обычно называют доступной потерей тепла. Используя ту же цифру, можно рассчитать продукты сгорания топлива и воздуха. / в 0В + / С. С. Вверх. о = / в УФ +(1 -!/ ВМЗ.
(7-16) (7.17). Где uv и ya_e-молярная доля воздуха и продуктов сгорания в смеси. При расчете теплового двигателя состав продуктов сгорания определяется коэффициентом избытка воздуха а. это отношение фактического количества воздуха, подаваемого на сгорание 1 кг топлива ДД, к теоретически необходимому воздуху для его полного сгорания. а = 2.д / д₀.
- Вы можете рассчитать значение 1₀ для углеводородного топлива, основываясь на следующих соображениях: Когда углерод полностью сжигается, он производит углекислый газ. C +O₂=CO₂. В этом процессе 1 моль, то есть 12 кг углерода (атомный вес углерода равен 12), содержит 1 моль, то есть 32 кг кислорода(молекулярного Вес кислорода 32), или углерода на 1 кг= кислорода кг, а на 1 г углерода=углекислого газа кг водорода, при сгорании образуются водяные пары. Процесс горения протекает по формуле 2Н,+О₂ = 2Н/>. Чтобы сжечь 1 кг водорода, нужно a^ = 8 кг кислорода. Из 1 кг водорода получается 9 кг водяного пара.
Когда топливо содержит C кг углерода и 11 кг водорода, при полном сгорании сжигается необходимое количество кислорода (Ас + 8ч-0т) к; 7top°Ри ° м ’ Где от — количество килограммов кислорода, содержащихся в 1 кг Топливо. Около 23,2% (вес) содержится в воздухе Кислород, затем теоретически необходимое количество воздуха Полное сгорание топлива определяется по формуле ’»Ch5t (ц ги〜°’)» Продукт сгорания 1 кг топлива состоит из (А-1) воздуха и 1-4-чистых продуктов сгорания. Молярная доля воздуха в смеси составляет Вот и НП. с молекулярная масса воздуха и продуктов сгорания 、 Значение#=(1 — для жидкого и твердого топлива Для них ведь она равна почти 1 Л!
Таким образом, теплообмен в сущности обуславливается взаимодействием теплопроводности и переноса энергии движущейся ер еды внутри этого слоя. Людмила Фирмаль
Из формул(7.16), (7.17) и (7.20) / = /» + ^ = 21、(7.21) 5 = 5,+, 5С-5°-°. (7.22) Для чистых разбавленных продуктов сгорания (смесей продуктов сгорания и воздуха), при создании диаграммы I-5, удобно создавать масштабное значение p вместо избыточного воздуха coefficient. In двигатель внутреннего сгорания а = 0.7-5-1.8 в камере сгорания газотурбинной установки а достигает 4-5-6. Р-фактор считается равным в чистом продукте сгорания топлива (состав 85%Cu 15% H) Ra. s = 1,5;для чистого воздуха p0 = 1. Пневматическое соединение, задается соотношением П = С***.
Для определения положения пучка P = 1,5 используют линейную зависимость теплоемкости от температуры cc = a 4-LT с учетом 55 = — y、 Ко -«, > 1Н-М — +(4…- ».) Я,(7.241 Где: АП AB₁ 6б,.o 6P. S-постоянный коэффициент воздуха и чистых продуктов сгорания. 5p. ₀ =5В₀ = 0 —энтропия при температуре t = 273 ° K в начале координат. Если вычислить значение D5 по формуле (7.24) при различных температурах и построить эти разности энтропии по продольным осям диаграммы I-5, построенной для воздуха, то можно увидеть положение Луча p = 1.5, являющегося вертикальной осью координат чистого продукта сгорания.
Для Р-значения 1-1, 5. Луч строится по следующей формуле: 5-5В =3° — 3д-с =(5В-5″ .с.) (7.25 )) Энтальпия газа, учитывающая линейную зависимость теплоемкости от температуры, определяется уравнением / =(7.26) Где a = a + 273 b, T / 273°K и a / b = 0 При Луче Р = 1,5 шкала энтальпии строится по следующей формуле: Д / = / б.- /» =(а ^ .с-АО я + БН-б-бл(7.27) / начинать. дата.- /.начать- На рисунке справа показаны различные шкалы энтальпии Р-значений 1,0-1,5, построенные с использованием интерполяционных формул. (7.28) Ра. с.-1 Энтальпия продукта сгорания получается по вертикали с соответствующим значением Р.
Вертикальное значение p = 1 строится по шкале без искажения энтальпии воздуха. На диаграмме продуктов сгорания I-5 можно использовать те же изолинии, изобары и изотермы, что и воздух.
Смотрите также:
| Т-s-диаграмма для идеального газа | Дифференциальные уравнения термодинамики |
| Цикл Карно на Т-s-диаграмме. Обобщенный цикл Карно | Дифференциальные уравнения внутренней энергии, энтальпии, энтропии |
