Оглавление:






Инертные газы.
- Инертный газ. В 1893 году было обращено внимание на несоответствие плотности азота, получаемого при разложении азота и азотных соединений из воздуха. После удаления всего кислорода и азота был получен небольшой остаток (около 1%), который не реагировал ни с чем химически.
- Таким образом, открытие нового элемента, названного аргоном(по-гречески-неактивным), представляет собой «победу 3 знаков после запятой. Молекулярная масса аргона составляла 39,9.Его молекула является одноатомной, поэтому атомный вес аргона будет равен молекуле.
Следующий инертный газ-гелий («Солнце») — был обнаружен на солнце раньше, чем на Земле. Людмила Фирмаль
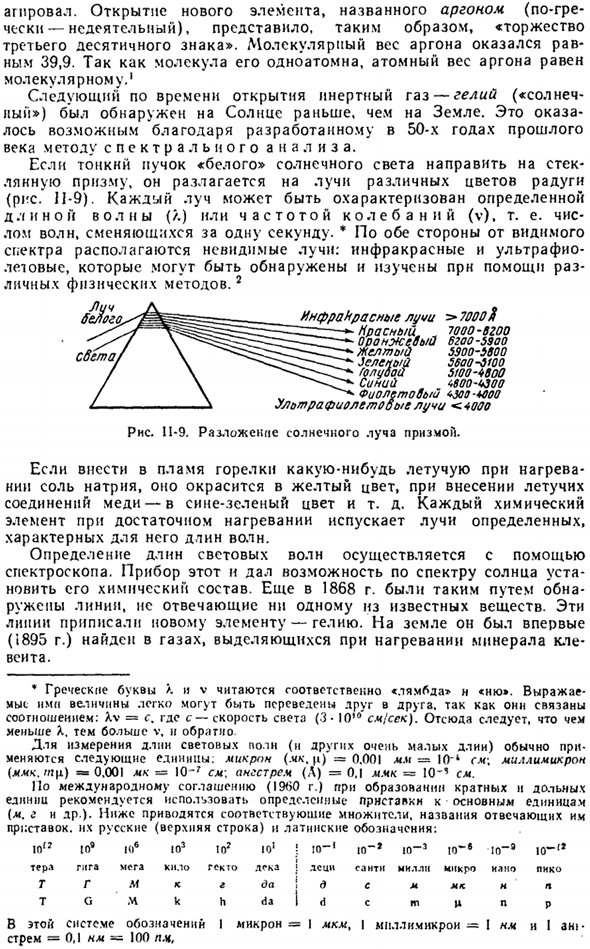
Это стало возможным благодаря разработанному в 1950-х годах методу спектрального анализа. Когда тонкий луч» белого » солнечного света направляется на стеклянную призму, он разлагается на лучи разных цветов радуги (рис.11-9).Каждый луч имеет определенную длину волны (/. он характеризуется частотой колебаний (v), то есть количеством волн, изменяющихся за 1 секунду.
По обе стороны видимого спектра находятся невидимые лучи инфракрасного и ультрафиолетового света, которые могут быть обнаружены и исследованы с помощью различных физических методов. Диаграмма II-9.Разложение солнечных лучей с помощью призмы.
Если натриевые соли вводятся в пламя горелки при нагревании, то летучие соединения меди становятся желтыми при их введении в сине-зеленое и т. д. Каждый химический элемент излучает лучи определенной длины, когда он достаточно нагрет волнами. Определение длины волны света осуществляется с помощью спектрометра.
Этот прибор также позволил определить его химический состав по спектру солнца. В 1868 году была обнаружена линия, которая не подпадает ни под одно из известных веществ. Эти линии приписываются новому элементу-гелию. Первым обнаруженным на Земле был газ, выделяющийся при нагревании (895) минеральной приманки Кри. * Греческая буква.>И v читается как» лямбда » n «n» n», соответственно.
Значения, представленные ими, связаны отношением Xv = * s, поэтому их можно легко преобразовать друг в друга. Где с-скорость света (3 * 10 ′ ®см / сек). Чем меньше X, тем больше v, и наоборот. Обычно следующий блок используется для измерения длины световых волн (и других очень коротких длин).
Микрон.(вопрос.) = 0.001 мм = i0 не 4 см 1С)= ■ 0.001 мкм= 10-7 см \Ангстрем (а)= 0.1 ММК = 10 см В соответствии с международными соглашениями (19 <> 0), при формировании нескольких десятичных единицах, основной блок(м. Рекомендуется использовать специальный префикс для вашего приложения (например, <адрес>, <адрес>, <адрес>, <адрес>, <адрес>, <адрес>, <адрес>, <адрес>, <адрес>, <адрес>, <адрес>, <адрес>, <адрес>, <адрес>, <адрес>, <адрес>, <адрес>, <адрес>, и т. д.).
Ниже приведены обозначения соответствующих элементов, названия соответствующих им префиксов, русского (верхний ряд) и латинского языков. 10ф? У®В6 I03!07 10″)10—» 10- * | 0-3 JO » 9 u-» Гига Терра mokokiro зона durz Гехт; реше сайты millk микро КАПО Пико Т Г М К Г Да а От 1 г м до ч да / д И М У П Р Это обозначение 1 микрон= 1 мкм, 1 нанометр 1 нм и I муравей Ход= 0,1 нм = 100 ПМ. Фиолетовый ням~ * воркует ^Фиолетовый ультрафиолет > 7000 л 7000-8200 6200-5900 5900-5800 5600-5 / 00 5100-4600 4800-U3 O O
Инфракрасный красный » оранжевый желтый Света. <4000 Через несколько лет после открытия аргона и гелия (в 1898 году) из воздуха было выделено еще 3 инертных газа. Неон («новый»), Криптон («скрытый»), ксенон («чужой«).Насколько трудно было их обнаружить, определялось тем, что только 1 кубический метр воздуха и 9,3 литра аргона содержали 18 миллилитров неона, 5 миллилитров гелия, 1 миллилитр Криптона и 0,09 миллилитра ксенона. Радон, последний инертный газ, был открыт в 1900 году, когда были изучены несколько минералов.
Его содержание в атмосфере составляет всего 610-8% в объеме (эквивалентно 1-2 атомам в кубических сантиметрах).было подсчитано, что вся атмосфера на Земле содержит только 374 литра радона. Инертные газы характеризуются полным отсутствием химической активности (He, Ne, Ar) или почти полным отсутствием (Kr, Xe, Rn).в периодической системе образуется особая группа (VIII).
Разделение инертных газов основано на различиях в физических свойствах 3 Наиболее важным для физических свойств вещества обычно является выяснение условий, при которых изменяется его агрегатное состояние (газообразное, жидкое или твердое).Для твердых тел каждое вещество характеризуется строго регулярным расположением составляющих частиц газов и жидкостей-несколько случайным.
При непрерывном нагреве твердого вещества энергия колебательного движения его частиц постоянно возрастает, в результате чего взаимное отталкивание возрастает. Рано или поздно притяжение друг к другу частиц достигает такой температуры (точки плавления), которая уже не может гарантировать точного порядка их расположения: вещество плавится.
Однако в жидкости взаимное притяжение молекул все еще достаточно, чтобы удерживать молекулы вместе, и только самые быстро движущиеся отдельные молекулы могут оторваться от поверхности. При дальнейшем нагревании количество таких молекул увеличивается. То есть давление паров некоторых веществ увеличивается.
Наконец, температура (Точка кипения), характерная для каждого вещества, достигается, когда давление пара становится равным внешнему давлению. Испарение начинается не только с поверхности, но и с жидкой массы. Последний «кипит». Очевидно, что температура кипения должна в значительной степени зависеть от внешнего давления.
Напротив, температура плавления не изменяется заметно при небольших колебаниях. Наиболее практически важным является знание температурного режима, который соответствует изменение агрегатного состояния при нормальном атмосферном давлении(760 мм Hg).
Они обычно обозначаются как температура (точка плавления) и температура кипения (точка плавления) вещества в воде. question. Is значение инертного газа видно? Следующее сравнение. Нэ кг Хе рН не Атомный номер. •••2 10 18 36 54 86 Атомный вес….. 4.00260 20.179 39.948 83 Вт 131.3 222 Точка плавления-271-249 ния,* С……. −189 −157 −112 −71 Температура, −269 * с. ……… —246-186 −153 −108 −62 Твердое состояние гелия стабильно при давлении не менее 25 атмосфер^ — Xk.
Все инертные газы бесцветны и состоят из одноатомных молекул. Их растворимость при переходе от гелия к радону будет в ближайшее время 1-это breathing. So, при 100 объемах воды, следующее количество объемов инертного газа растворится при 0°С. Не АР кг Хе рН 1.0 2.2 5.7 11.1 24.2 41.5 Органические растворители (спирт, бензол и др.) дают аналогичный ход изменений растворимости, но растворяют инертные газы гораздо лучше, чем подопечные.
Отсутствие полной химической инертности в тяжелых инертных газах было впервые обнаружено в 1962.It было установлено, что он может сочетаться с фтором (и только с фтором), который является наиболее активным металлоидом. Ксенон (и радон) очень чувствителен, а Криптон гораздо сложнее.
Получены XeF2, Xefa, Xefa и нестабильный KrF2.Все они бесцветные, летучие кристаллические вещества. Инертные газы обладают очень разнообразным практическим спектром действия. applications. In в частности, роль гелия в получении низких температур очень важна, так как жидкий гелий является самой холодной из всех жидкостей. 16-18.
По-видимому, вы можете подумать, что легкий инертный газ останется полностью инертным. Людмила Фирмаль
Добавь 1) проблема атомарности молекул Аргона была решена с использованием кинетической теории. Согласно последнему, количество тепла, которое должно быть израсходовано для нагрева молекулы газа грамм на 1 градус, зависит от количества атомов в его молекуле.
Для постоянного объема одной граммовой молекулы одноатомных газов требуется 3 калории, а диатомовых-5 calories. In в случае аргона эксперимент получил 3 кал, что показало, что молекула была одноатомной. То же самое относится и к другим инертным газам. 2) лучи вне видимого спектра имеют много интересного features.
As вы можете видеть, rns. II-10. ультрафиолет определенной длины аолн оказывает мощное бактерицидное (бактерицидное) действие, а ПРН немного крупнее-малиновый (что вызывает загар кожи).Облучение ими в умеренных дозах благотворно влияет на человека body. It известно, что насекомые очень чувствительны к ультрафиолетовому излучению и привлекают насекомых даже больше, чем обычный видимый свет. 、
Инфракрасное излучение составляет около 50%всей солнечной энергии, достигающей Земли, и является наиболее важным для жизни растений. Поскольку эти лучи редко задерживаются туманом, они могут быть захвачены на поверхности Земли, особенно через облачный покров (рис.11-11).
Инфракрасное излучение излучается от нагретых объектов, в том числе от любых теплокровных животных (характерная длина волны около 0,01 мм).Исследования, проведенные на гремучих змеях, показали, что перед головой имеются специальные теплочувствительные органы, и во время охоты они в основном ориентируются на тепловое излучение жертвы.
Высокочувствительный инфракрасный приемник обнаруживает перепады температур до 1000 градусов за 1 минуту. Такая «тепловизионная съемка» позволяет решать многие важные задачи-от медицинской диагностики того или иного заболевания до точного определения местоположения самолета в полной темноте. Рисунок 11 * Ю. Биологическая активность ультрафиолетового света. *
Дополнительную информацию о соединениях инертных газов см. В разделе VII $ I. 12. .3) вскоре после открытия инертных газов новая группа, образованная ими в периодической системе, была названа нулевой, чтобы подчеркнуть нулевое значение этих элементов, то есть отсутствие химической активности. Это название до сих пор часто используется в настоящее время, но в сущности периодического метода более уместно считать группу инертных газов 8-й.
Потому что в этих элементах начинаются и заканчиваются соответствующие периоды. Для инертных газов существует монография. * 4) количество тепла, необходимое для перехода вещества из твердого состояния в жидкое, называется теплотой плавления, а переход из жидкого состояния в парообразное называется теплотой испарения рассматриваемого вещества.
Обе величины обычно связаны с переходами, которые происходят при нормальном давлении. Для инертных газов их значение выглядит следующим образом (ккал / г-атом): Не Не АГ 0JX 0. 0.39 0.С5 0.60 Теплота испарения.# 。 。 。 0.020 0.43 1.56 2.16 3.02 4.01 Как видно из приведенных выше данных, теплота испарения во всех случаях значительно превышает теплоту плавления.
И эти тоже. Другие значения увеличиваются с увеличением температуры плавления и кипения инертного газа. 5) плотность инертных газов в жидком состоянии (температура кипения) и их относительная теплоемкость и температура (0 ° С) равны следующим значениям: Не N «при плотности кг Х*, дюйм / см»•• » ••СИЗ и 1.4 2.6 3.1 Относительная теплопроводность ■ воздух (air-I)….. 6.0 1.96 6.73 ОЗЯ 0.22 в)критическая температура инертного газа сравнивается ниже, и требуемое и достаточное давление для переноса газового состояния в жидкость при этих температурах является критическим давлением:
Не Ne при критической температуре Kg Xt Rn,°С-268 −229 −122 +64 −16.6 +104 критическое давление, атм 2.3 27 48 64 58 62 7) гелий был последним газом для перехода в жидкое и твердое состояние state. In связь с ним, были особые трудности с it. As в результате расширения при комнатной температуре гелий не остывает, а нагревается.
Только ниже −250°C он начнет себя вести abnormally. As в результате нормальный процесс повторного воспламенения может быть применен к гелию только после предварительного очень сильного охлаждения гелия. Между тем, критическая температура гелия очень низка. В силу этих обстоятельств при работе с гелием благоприятные результаты были получены только после освоения способа работы с жидким водородом.
В 1908 году удалось получить жидкий гелий, а в 1926 году впервые твердый гелий time. It интересно, что жидкий гелий практически не растворяет другие вещества. 1 рисунок 1MI. Туман m местности выстрел-видимый свет. Ъ-огонек).
* Phiikelshtayai D. N. инертный газ. М.. И » Дао Академии Наук СССР. 1961 год. 196 Ф.: Фа. «- С и я В. Г.. Roviysky А. Е. Петровский Ю. В. инертным га> ь. Я делаю. 2-й. М.. Atomk * дата, 1972.362 секунды S) температура кипения и плавления гелия является потенциальным пределом охлаждения вещества, то есть близким к абсолютному нулю, идея была впервые изложена М. В. Ломоносовым(1747). Это при −273.15°C (конечно).
Абсолютного нуля достичь невозможно, но в лабораторных условиях уже получены различные температуры для 100-тысячной части 1 градуса. * ’* I)от абсолютного нуля отсчет начинается при абсолютной температуре scale. It часто используется в научно-технических исследованиях.
Абсолютная температура очень удобна, так как не содержит отрицательных температур. Градусы (°К) имеют то же значение, что и n градусов по обычной шкале Цельсия (с). так, отношение показаний по шкале абсолютного (7) Цельсия ( / ) задается простыми формулами T = / + 273.15 и^ T-273.15. 10) по классической кинетической теории.
Абсолютный ноль температуры характеризуется именно этим. С ним устраняется всякое движение частиц, то есть начинается полный покой. Но «абсолютный мир может быть понят только в отсутствие матери» (Энгельс).Теперь было подтверждено, что частицы материи сохраняют свою колебательную энергию даже при абсолютном нуле.
Это «нулевая энергия», чем меньше масса частицы, тем сильнее взаимодействие между частицами. Полная нулевая энергия многоатомных молекул может достигать больших значений. 11) неустойчивость твердого состояния гелия при атмосферном давлении、
Небольшая сила сжатия между его атомами. Из-за этого только уже малой нулевой энергии гелия (около 50 кал / г атомов) достаточно, чтобы нарушить строгий порядок последовательности частиц. Это обязательно для solids. By повышая давление и искусственно связывая частицы, он компенсирует отсутствие натяжения самих частиц и тем самым повышает стабильность твердых тел.
12) если абсолютная нулевая точка радикально ограничивает возможность низких температур, то в случае высоких температур такого радикального предела нет. Чем выше температура, тем больше возможностей для взаимодействия между веществами, и эти взаимодействия развиваются быстрее. Однако, с более высокой рабочей температурой, технический дизайн соответствуя оборудования и затруднение деятельности увеличивают быстро.
Поэтому температура, которая фактически используется для проведения химических процессов, обычно не превышает 2000°С. 13) для приблизительных свойств высокой температуры иногда используется указание типа свечения нагреваемого вещества(твердого или жидкого).Обычно выделяют участки различной яркости красного (600-1000°C), желтого (1000-1EEC°С) или белого (1300-1500°С) цвета накаливания. 14) вы можете получить очень высокие температуры по-разному.
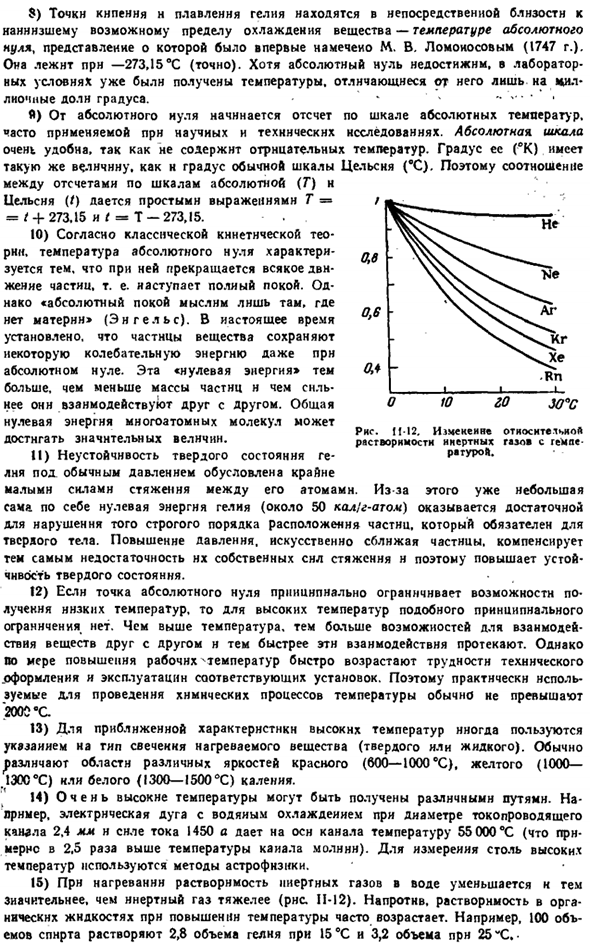
Например, электрическая дуга с водяным охлаждением с диаметром проводящего канала 2,4 мм и силой тока 1450 а будет иметь температуру 55 000°С в основном канале (примерно в 2,5 раза выше температуры канала молнии).Для измерения таких высоких температур используется метод астрофизики. 15) при нагревании растворимость инертного газа в воде уменьшается по мере того, как инертный газ становится тяжелее (рис.11-12). напротив, растворимость в органических жидкостях часто возрастает с повышением температуры.
Например, 100 объемов спирта растворяются при 15 ° С при 2,8 объемах гелия и 3,2 объемах при 25 ° с пр. Цифры 11-12.И » относительная растворимость инертных галош обусловлена гемами-п * тур. То же. 16) гелий (обычно добавляют 15% водорода) может быть использован для заполнения дирижабля в частности. Подъемная сила последнего определяется разницей в весе воздуха и наполняющего газа в объеме дирижабля.
Зная молекулярную массу газа и применяя закон Авогадро, соотношение подъемной силы дирижабля, когда дирижабль заполнен гелием или водородом、(29-4):(29-2)= 0.93 она будет равна. Таким образом, подъемная сила, сообщенная дирижаблю гелием, составляет 93% от подъемной силы, заданной гелием. hydrogen.
By исключающ горючесть, это уменьшение в полезной нагрузке оплачено for. To заполните центральный дирижабль, нам нужно около 10 миллионов M9 гелия. Производство больших объемов гелия стало возможным только после открытия источников природного газа, в том числе гелия. 9. в настоящее время этот газ доступен во многих технических областях.
Например, электрическая сварка металла в атмосфере гелия очень важна. promising. It следует отметить, что перегородки из стекла, пластика и некоторых металлов (но не железа) могут проникать с определенной скоростью. Они хранят его в коричневом цилиндре с белой надписью «гелий».
17) искусственный воздух, в котором Азот был заменен гелием, впервые был использован для обеспечения дыхания водолазов. Растворимость газов при повышенном давлении значительно возрастает, поэтому у водолазов, когда они спускаются в воду и снабжаются нормальным воздухом, в крови растворяется больше азота, чем при нормальных условиях.
Во время подъема, когда давление падает, растворенный взлет начинает выделяться, его везикулы частично закупоривают мелкие кровеносные сосуды, тем самым нарушая нормальное кровообращение и вызывая приступ кессонной боли. Из-за замены азота на гелий болезненное явление резко ослабляется из-за очень низкой растворимости гелия в крови. Это особенно заметно при высоком давлении.
Работа с атмосферой»гелиевого» воздуха позволяет водолазу спуститься на большую глубину (более 100 м) и значительно продлить продолжительность своего пребывания в воде. Плотность такого воздуха составляет около 3-1 от нормальной плотности воздуха, поэтому дышать легче. Этим объясняется медицинское значение гелиевого воздуха в лечении астмы, асфиксии и др., который может спасти жизнь, уменьшив дыхание пациента в краткосрочной перспективе.
Подобно гелиоому, воздух» xenoi » (80% ксенона, 20% кислорода) обладает сильным наркотическим действием при вдыхании, что позволяет использовать его в медицинских целях. 18) неон и аргон широко используются в электротехнической промышленности. Когда электрический ток протекает через стеклянную трубку, заполненную этими газами, газ начинает glow.
It используется при оформлении эвтрофикационных надписей и так далее.11-13, как видно из рисунка, помимо природы самого газа, характер непрерывного разряда в газовой среде зависит от давления (Р) этого газа, напряжения ( £ ) и плотности тока, то есть количества электричества, проходящего через единичную поверхность за единицу времени.
Тлеющие разряды, которые используются в разрядных трубках, содержащих инертные газы, производят красители с низким отношением Р / Е, то есть относительно низким давлением газа и высоким тоном и низким тоном. Энергопотребление таких газовых труб очень мало. Этот тип сильной неоновой трубки особенно подходит для маяков и других светофоров.
Это связано с тем, что туман слегка перекрывает красный свет. Когда давление в трубке уменьшается, испускающий цвет гелия изменяется от розового до желтого и зеленого. Для Ar, Kr и Xe характерны различные оттенки синего цвета. Аргон (обычно смешанный с азотом 14%) также поможет заполнить шарик.
Благодаря значительно меньшей теплопроводности, Криптон и ксенон более подходят для этой цели. Наполненные ими лампы излучают больше света при одинаковом потреблении энергии, выдерживают перегрузки и более долговечны, чем обычные. ОА ^ SkiSncS Г / 1- Ряса. 11-13.
Непрерывные условия разрядки человека в Газе. odwd ’ууу оооо * а Атмосфера аргона широко используется в качестве защитной атмосферы для различных химических работ и производственных процессов, когда необходимо изолировать реагирующие вещества от окружающего пространства. Аргон хранится в черном цилиндре, с синим аргоном, нависающим над ним, и белой полосой под ним.
Смотрите также:
| Химические формулы и уравнения | Кислород |
| Воздух | Озон |
