Оглавление:


Краткая характеристика элементов побочной подгруппы VI группы
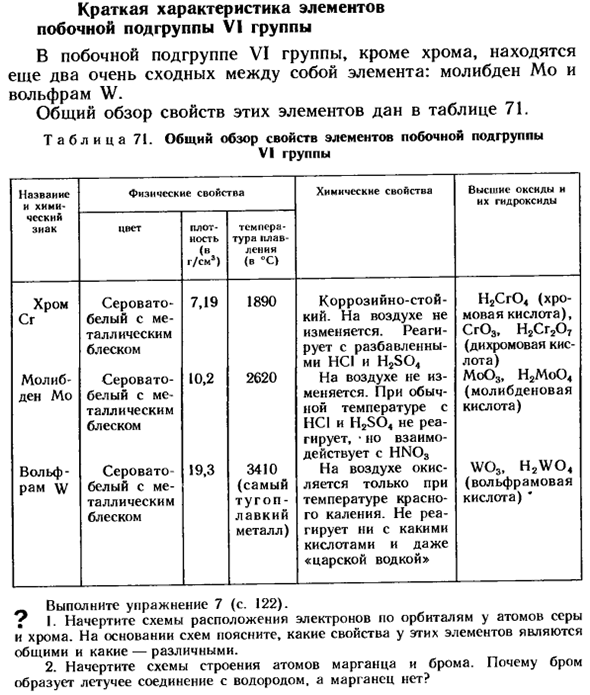
- Краткое описание элементов побочных подгрупп в группе VI В боковых подгруппах группы VI, помимо хрома, очень похожи 2 элемента молибдена Mo и вольфрама W. Общий обзор свойств этих элементов приведен в таблице 71. Таблица 71.
- Общий обзор свойств элементов подгрупп VI группа. Имя физические свойства химические свойства высокие оксиды и И химический-гидроксид Чески. ziak плотность цвета г / см») точка плавления (SS> Хром серый-7.19 1890 коррозионная стойкость-Н2Сг04 (хром СГ белый и металлический блеск Кий. Реагирует с разбавленным hci и h2so4 (кислотой), Cr03, H2Cg2Ot (дихроматом) Молибден-сероватый-10.2 2620 не в воздухе.
Воздух не меняется. Людмила Фирмаль
Mo03, H2Mo04 Denmo белый с металлическим блеском изменения. При нормальной температуре он не реагирует с HCI и h2s04, но взаимодействует с мала (молибденовой кислоты). Волк-greysch-19.3 3410-на воздухе-оксида wo3, h2wo4 Рамка W белая — (используется только в вольфраме Тарик зигоп-температура Красной кислоты)* Отполируйте скамейку metal.
It не вступает в реакцию с кислотами или царской водкой. Упражнение 7 (стр. 122). Д. И. нарисуйте расположение электронов, но орбиты атомов серы и хрома. Основываясь на схеме, мы опишем, какие свойства этих элементов являются общими, а какие-различными. 2.Нарисуйте схему строения атомов марганца и брома. Почему бром образует водород и летучие соединения, но не марганец?
3.Сравнение физико-химических свойств хрома и свойств алюминия ’ объясняет, почему хром обладает особой твердостью, основанной на изучении структуры металлических решеток. 4.Перечислите изделия, изготовленные из хрома и его сплавов, которые встречаются в производстве и быту. 5.Создайте формулу реакции, которая характеризует амфотерные свойства гидроксида хрома (III).
- 6.Создайте уравнение реакции, которое может выполнять следующие преобразования: а) Cr CrCl12 Cr (OH) 2 CrO b)Cr — » — CrC13 Cr (OH) s Cr2Os Cr 7.Напишите резюме ответов, характеризующих вещество, в котором дана формула: Cr, CrC13, Cr (OH)3, Cr208(I, стр. 43). #I. сколько тонн хрома и сплавов железа можно получить, восстановив 0,18 массовой доли, то есть 18 тонн хромистого железа с примесями 80%?
2.В состав соединения входят Cr-0,26517 массовой доли, или 26,517%, S-0,24525 массовой доли, или 24,525%, O-0,48958 массовой доли, или 48,958%.Определите химическую формулу конкретного вещества и дайте ему название. 1. 2 мл раствора I-сульфата хрома (III) наливают в 2 чистые пробирки, медленно добавляя раствор гидроксида натрия.
Лабораторные опыты Получение гидроксида хрома (III) и его взаимодействие с кислотами и щелочами. Людмила Фирмаль
Образуется зеленый осадок. 2.Вылейте избыток гидроксида натрия в одну пробирку и добавьте соляную кислоту в другую tube. In в обеих пробирках осадок растворяется, образуя прозрачный зеленый раствор. Задача. 1.Каков внешний вид зеленого осадка? 2.Почему этот осадок вступает в реакцию с кислотами и щелочами? Напишите уравнение соответствующей реакции.
Смотрите также:
