Оглавление:






Краткая характеристика элементов подгруппы кислорода
- Краткая характеристика элементов подгруппы кислорода Помимо кислорода и серы, в основной подгруппе VI группы присутствуют 2 аналогичных элемента-селен Se и теллур Te. Эти сходства и различия показаны в таблице 37.In подгруппы кислорода и галоида, относительная атомная масса увеличена и атомный радиус увеличен.
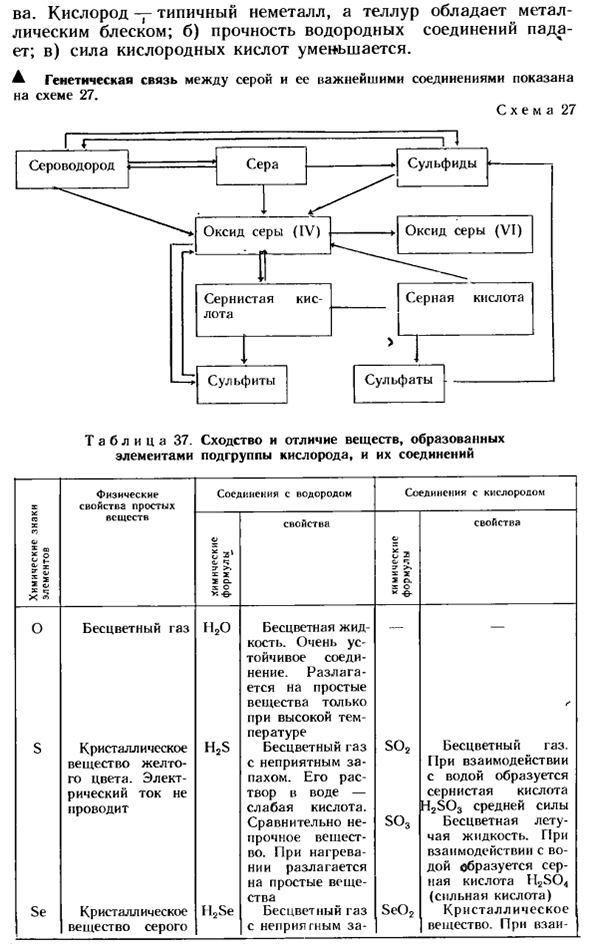
- а) неметаллические свойства будут естественно уменьшаться Вау. Кислород-типичный неметалл, а теллур имеет металлический блеск. б) прочность соединения водорода снижается. в)прочность кислородной кислоты снижается. ^Генетическая связь между серой и ее наиболее важными соединениями показана на схеме 27. Схема 27 Таблица 37.Сходства и различия между элементами кислородной подгруппы и веществами, образуемыми их соединениями.
Физическое соединение, содержащее водород соединение, содержащее кислород Людмила Фирмаль
Простое свойство x X в свойство BCUICCTB» Около 5 SO x O » x о h V>in. * Й ч*>.. Я х Z Х s. xoh х ех X 5 v-e- * Liquid бесцветный газ H20 бесцветная жидкость Кости. Очень стабильное соединение. Разлагается на простые вещества только при высоких температурах✓ S желтое кристаллическое вещество. Ток не проводит бесцветный газ H2S, который испускает неприятный запах.
Водный раствор представляет собой слабую кислоту. Относительно хрупкое вещество. При нагревании он разлагается на простое вещество so2 SO3 бесцветный газ. При взаимодействии с водой образуется серная кислота H2S03 средней прочности. При взаимодействии с водой серная кислота H2S04 (сильная кислота Se Gray h3se кристаллическое вещество бесцветный газ с неприятным зарядом se02 кристаллическое вещество.
Если ты продолжишь идти X физические свойства простых соединений содержащих водород соединений содержащих кислород n X » ■>оха £ * is * 0 < S3 вещество Ox XXAOXAO. Свойства U г свойства химическая формула Цвет. Ток течет, но это слабый (полупроводниковый) пах. J7.ro водный раствор немного сильнее кислоты, чем водород sulfide.
It это бесцветный газ, который менее долговечен, чем сероводород, и имеет неприятный запах. Водный раствор является кислотой, более сильной, чем H2Se. Очень хрупкое вещество, которое взаимодействует с водой, подобно диоксиду серы, но слабее, чем образует селеновую кислоту 1 l2SeO Кристаллический материал серебристо-белый и имеет металлический блеск. Течение более лучшее проводное чем материал Селена H2te Se03 Te02 teoe кристаллический.
За счет взаимодействия с водой образуется селеновая кислота H2Se04, но по прочности и свойствам кристаллические вещества аналогичны серной кислоте. При взаимодействии с водой образуется Теллуровая кислота Н2Те03, которая представляет собой кристаллическое вещество, значительно более слабое, чем h2seos. It реагирует только с теплом water. In в этом случае теллуровая кислота H2Te04XX2H20 (ндео.) является formed.
It это очень слабая кислота. Ответьте 0y точка росы и выполните 22-27 упражнений(стр. 174). * 1.Основываясь на теории строения атома, таблица 28 используется для объяснения того, почему кислород является более сильным окислителем, чем сера. 2.Используя данные таблиц 24, 28 и 29, мы объясняем, почему состояние окисления атомов хлора нечетное, а состояние окисления атомов серы четное. Почему кислород имеет постоянную валентность, а сера-переменную?
3.Сравните свойства кислорода и одиоза, кристаллической и пластической серы. На основе этих примеров мы опишем свойства аллотропии. 4.Перечислите природные соединения серы, напишите их химические формулы, определите степень окисления серы. 5.Создайте формулу реакции, в которой сложные вещества образуются из простых веществ. Своя формула является следующим: Li2S, ZnS, H2S, SO2, CS2 и SFe.
Таблица 29 (стр. 151) описывает свойства (окисление или восстановление), которые проявляет сера в этих реакциях. 6.Какая молекула сильнее по полярности химических связей: вода или сероводород-и почему? 7.It создается уравнение взаимодействия гидроксида кальция и сероводорода в водном растворе. При каких условиях получается: а) обычная соль; б) кислотная соль? Вы 8.
- Сравните следующие физико-химические свойства: а) сероводород и хлорметан. б)растворы сероводорода и соляной кислоты; в) сероводород и сероводород; г) растворы сероводорода и сероводорода. Приведите соответствующее уравнение реакции. 9.Напишите формулу реакции раствора сероводорода и раствора этих солей. Отбросьте таблицу в блокноте и поместите стрелки в соответствующую колонку- > 2 стрелки, если реакция закончена, или если реакция обратима.
Реакция реагента с физиологическим раствором Cu (none), NaCl ZnSO, PI) (none) j k, so4 AgNO, FeCI, MnSO, HgCI、 СЕРОВОДОРОД 10.Каковы различия между механизмами реакции образования оксида серы (IV): а) взаимодействие сильных кислот с сульфитами. б)взаимодействие концентрированной серной кислоты и меди?
11.Напишите уравнение реакции оксида серы (IV) и гидроксида кальция. Людмила Фирмаль
Каковы соли и условия, которые образуются во время этой реакции? 12.Создайте таблицу, которая объясняет химические свойства оксидов серы (VI).Таблица 33.4 13.In зимой между оконными рамами могут быть нарушены емкости с концентрированной серной кислотой. Зачем это делать и почему вы не можете заполнить верхнюю часть контейнера с кислотой?
14.Концентрированная серная кислота вступает в реакцию с ртутью и серебром, когда heated. It кажется, реагирует с медью. Эти реакции создают уравнения и указывают окислители и восстановители. 15.Используйте следующую схему для создания жизнеспособного уравнения реакции: kn03 + H2so » C11SO4 + HC1 НД + н2ѕо4 Конец C + HCI При составлении уравнения укажите условия реакции.
16.Объясните, почему серная кислота проявляет свойства окислителей, а диоксид серы проявляет свойства восстановителей. Составьте уравнение для соответствующей реакции и укажите переход электронов. 17.Как определяется скорость химической реакции? 18.Приведите пример реакции на работе или дома, когда увеличение или уменьшение скорости имеет положительное или отрицательное значение.
Пожалуйста объяснить. 19.В таблице 35 перечислены условия, влияющие на скорость химической реакции, и приведены примеры. Приведите каждому условию 1 или 2 дополнительных примера, сформулируйте соответствующие уравнения реакции и дайте им теоретическое обоснование. 20.Ниже мы опишем перечисленные типы химических реакций.
а) взаимодействие раствора хлорида железа (III) с гидроксидом натрия. б)разложение хлората калия при нагревании. В) взаимодействие раствора хлорида меди (II) и сульфата натрия г) окисление оксида серы (IV); г) разложение карбоната кальция при нагревании; д) взаимодействие алюминия и серы. Создайте уравнения для этих реакций. 21.Данное уравнение реакции: NaN03 + HCI-MgCl2 f H2S04 Na2S04 + HjSQ |- 2HgO * * 2Hg + 02-Q N2 + 31L 2HSN + Q N2-f 2NO-Q 2H2-f Oj 2HS0 + Q
В каком направлении происходит смещение равновесия? а) при повышении температуры; 6)при повышении давления? 22.Серную кислоту можно получить из следующих исходных продуктов: а) сульфид цинка; б) сероводород; в) сульфид сурьмы St ^ S *создают подходящую формулу реакции. 23.При строительстве пиритных печей они руководствовались законом. Скорость реакции возрастает с увеличением степени измельчения сырья и увеличением температуры обжига.
Объясните, какие трудности были связаны и как они были решены. 24.Как выполнить процесс преобразования оксида серы (VI) в серную кислоту. 、 25.Основываясь на теории атомной структуры, объясните, почему прочность соединения водорода постепенно уменьшается в следующих рядах: Н20, H2S, H2Se, Н2Те. 26.Создайте уравнение реакции, которое может выполнять преобразования.
а)Te Te02H2TeO, Na2te03 / В Нахтео, На, Тео, Нахтео.、 б)Се- * — H2Se-> — случае W’se02 Ca (HSe) s 27.Составьте уравнение реакции по схеме 27. 1. Известны соединения с массовой долей фосфора 0,27928 (27,928%) и с массовой долей серы 0,7672 (72,072%).Найдите его самую легкую формулу. Какой кислород похож на соединения фосфора? 2. При образовании I из элемента 332,8 кДж выделяется оксид серы (IV).Сколько тепла выделяется при сгорании 1 г серы?
3.Количество воздуха, необходимого для сжигания: а) 3,4 кг сероводорода. б) сероводород при 6500 me? 4. Из 0,60 массовой доли или 60% пирита FeS2, содержащего 16 тонн руды, было получено 14,112 тонны серной кислоты. Какова массовая доля или процент по сравнению с теоретическим выходом?
5.Если выход составляет 0,90 массовой доли, или 90% по сравнению с теоретическим значением, сколько тонн серной кислоты можно получить из пирита с 0,98 массовой долей, или 98% раствора, содержащего серную кислоту с 2,4 тонны? 6.Рассчитайте среднюю скорость реакции. А + В- » — 2С、 Если начальная концентрация вещества А составляет 0,22 моль / л, а через 10 секунд-0,215 моль / л, то как изменилась концентрация вещества в за это время?
7.Во сколько раз увеличивается скорость реакции при повышении температуры от 150 ° C до 200 ° C? Если температура повышается на 10°C, скорость реакции будет в 3 раза больше? Лабораторные опыты Влияние разбавленной и концентрированной серной кислоты на металлы. Положите 2 части цинка в 2 пробирки. Сначала вливают 4 мл разбавленной серной кислоты (1: 5), 2-й-4 мл концентрированной серной кислоты.
Разбавленная серная кислота в первой пробирке бурно реагирует с цинком. В результате реакции образуется водород. Зажечь огонь. Концентрированная серная кислота не вступает в реакцию с цинком при нормальной температуре. При нагревании начинается бурная реакция. Прекратите нагрев и осторожно понюхайте запах gas. It пахнет сероводородом. Поместите медную стружку в другие 2 трубки. ircpyiv 4 мл разбавленной серной кислоты заливают во 2-й 4 мл концентрированной серной кислоты и тщательно нагревают.
Задача. 1.На основании проведенных экспериментов сделаны выводы о том, как разбавленные и концентрированные серные кислоты связаны с металлами. Почему можно транспортировать концентрированную серную кислоту в стальном резервуаре? 2.Если вы знаете, что в этой реакции образуются сульфат цинка, сероводород и вода, напишите уравнение для взаимодействия концентрированной серной кислоты с цинком.
3.Каковы окислители при взаимодействии следующих веществ? а) разбавленная серная кислота и цинк; б) концентрированная серная кислота с цинком? 4.Почему оксид серы (IV) выделяется при взаимодействии концентрированной серной кислоты с медью и сероводородом, который вступает в реакцию с цинком? Условия, влияющие на скорость химических реакций.
Тест 1. Положите 2 части цинка в 2 пробирки. Сначала вливают 2 мл разбавленной соляной кислоты(1: 2), а во 2-е-такое же количество разбавленной уксусной кислоты (1: 2).Соляная кислота бурно реагирует с цинком, но уксусная кислота реагирует медленно. Тест 2.Насыпьте небольшое количество железного порошка в 1 трубку и насыпьте такое же количество железной стружки в другую трубку.
В обе пробирки налить 2 мл разбавленной соляной кислоты (1: 2).Соляная кислота более энергично реагирует с железным порошком, чем железный порошок. Тест 3. Положите 2 части цинка в 2 пробирки. Сначала вливают 1: 5 2 мл разбавленной серной кислоты, затем во 2-й-1: 10 разбавленной 2 ml. In в первой пробирке реакция протекает более энергично, чем во второй пробирке.
Тест 4. Положите 2 части цинка в 2 пробирки. Налейте 2 мл разбавленной серной кислоты (1:10) в обе пробирки. Слегка прогрейте 1 тюбик, оставив на 2-й, для сравнения. При нагревании серная кислота сильнее реагирует с цинком. Задача. На основании проведенных экспериментов сделаны выводы о факторах, влияющих на скорость протекания химических реакций.
Вспомним более ранний эксперимент, чтобы подтвердить этот вывод, запишем уравнение соответствующей реакции. Практика 5 Экспериментальные задания по предмету «кислородная подгруппа».Задание I. для пробирок с раствором: а) сульфат натрия. б) Сур!>Фито-натрий; в) сульфид натрия; г) хлорид натрия. Эмпирически определите, в какой трубке находится каждое из этих веществ.
Вопрос 2.Рассмотрим раствор сульфата меди (II). Получают раствор хлорида меди (II) 2 способами. Задача 3.In пробирка с небольшим количеством кристаллогидрата сульфата меди (II).Выполните реакцию, чтобы проверить ее качественный состав. Задание 4.5 приведены пронумерованные пробирки, в которых находятся йодиды, сульфаты, хлориды, бромиды, сульфиты и калийные соли сульфидов. Определите каждое из этих веществ, используя характерные реакции.
Задача 5.Выполните эксперименты по реализации следующих преобразований: а)сульфат цинка, гидроксид цинка, Цинк b) оксид меди (II) — * — сульфат меди (II) сульфид меди (II)) c) цинк — * ■ хлорид цинка — * ■ сульфид цинка Задача 6.Данное вещество: раствор серной кислоты, цинка, нитрата бария, хлорида натрия, хлорида кальция, хлорида меди (II). обязательно проверьте экспериментально вещество, в котором вступает в реакцию серная кислота.
Почему? Какая реакция связана с окислительно-восстановительными процессами? Мотивирует ответ. Задача 7.Проводят реакцию для проверки качественного состава серной и соляной кислот. Задача 8.Раствор сульфата натрия и серной кислоты. Используйте характеристическую реакцию для идентификации трубки, в которой содержится каждое вещество.
Смотрите также:
| Обратимость химических реакций. Химическое равновесие | Вывод химических формул |
| Производство серной кислоты контактным способом | Расчеты по химическим формулам |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
