Оглавление:









Минеральные удобрения
- Минеральное удобрение В результате проведенного анализа было установлено, что в состав растения входит около 70 элементов. Некоторые из них необходимы растениям большой массы (макроэлементы).Другие нужны с незначительной массой (микроэлементы).
- 1.Макроэлементы-углерод, кислород, водород, азот, фосфор, сера, магний, калий, кальций. 2.Микроэлементы-железо, марганец, бор, медь, цинк, молибден, кобальт и др. Для крупных растений необходимы 3 важнейших элемента-азот N, фосфор R, калий K. Поэтому удобрения, содержащие эти элементы производятся в промышленных масштабах.
Азот входит в состав белкового вещества растений. Людмила Фирмаль
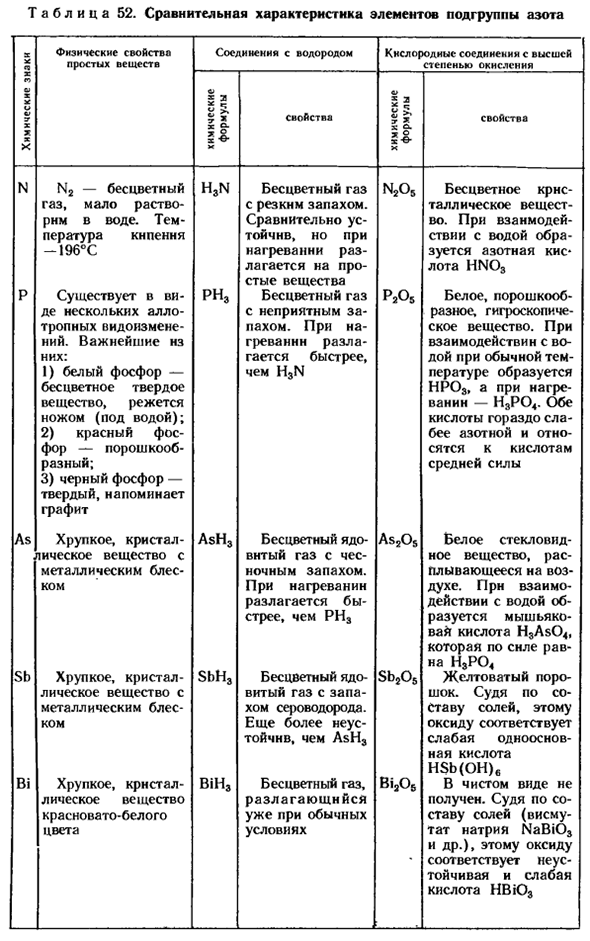
Из-за его дефицита задерживается образование зеленой массы, ухудшается рост растения, листья становятся бледно-зелеными и даже желтеют. Азотные удобрения особенно необходимы для весенних растений. Таблица 52.Сравнительная характеристика элементов подгруппы азота Соединения с высоким содержанием кислорода Простые физические свойства
Соединения, содержащие водород Физические характеристики Пойти спать — Так и есть Бесцветный Газ, слабо растворимый в воде. Кнепенная температура-19°C Она существует в виде некоторой аллотропной модификации. Самые важные из них: 1) белый фосфор-бесцветное твердое вещество, нарезанное ножом (в воде); 2) красный фосфор-порошок;
3) черный фосфор-твердый, подобный графиту Как хрупкое кристаллическое вещество с металлическим блеском Sb Хрупкое кристаллическое вещество с металлическим блеском Пока. Хрупкое кристаллическое вещество красновато-белого цвета Бесцветный газ с резким запахом.
Относительно устойчив, но при нагревании разлагается на простые вещества Бесцветный газ с неприятным запахом odor. It разлагается быстрее, чем H3N при нагревании Бесцветный ядовитый газ, пахнущий чесноком. При нагревании он разлагается быстрее, чем pH3 Бесцветный ядовитый газ с запахом сероводорода. Более летучий, чем AsH3 Бесцветный газ, который уже разложился в нормальных условиях Бесцветное кристаллическое вещество.
При взаимодействии с водой образуется азотная кислота * лот HN03 Белое, порошкообразное гигроскопическое вещество. При взаимодействии с водой комнатной температуры образуется НР03, а при нагревании-н30404.Обе кислоты намного слабее азотной кислоты и классифицируются как кислоты средней прочности. Белое стекловидное вещество, плавающее в небе.
При взаимодействии с водой образуется мышьяковая кислота H3As04.Это та же сила, что и Н3РО Желтоватый порошок. Судя по составу соли, этот оксид соответствует слабой одноосновной кислоте HSb (OH) 6. В чистом виде его не получают. Судя по составу соли (висмут натрия tat NaBi03 и др.), этот оксид соответствует нестабильным и слабым кислотам НВЮ3 Н H3n Н n2o5 РНК Р2О5 пепел、
В качестве операционной системы SbH、 SB2OS Bi206 Биг. Фосфор содержится в нуклеиновых кислотах, участвующих в окислительно-восстановительном процессе растений. Фосфор особенно важен для роста и развития репродуктивных органов (цветов, плодов, злаков). Калий ускоряет процесс фотосинтеза и способствует накоплению углеводов (сахар в сахаре, крахмал в картофеле). в злаках он способствует укреплению стеблей, тем самым устраняя их полегание.
Железо, марганец, бор и другие микроэлементы играют важную роль в растении life. So например, в присутствии микроэлементов растение лучше усваивает азот, фосфор, калий и дает лучший урожай. Медь, марганец и цинк ускоряют окислительно-восстановительный процесс и способствуют росту растений. Железо участвует в синтезе хлорофилла.
Эти микроэлементы и микроэлементы поглощаются из почвенного раствора в виде ионов (NH^», NO^», K+, H2PO ^ Fe3+, Cu2+, MnO^ и др.). В качестве минеральных удобрений используются вещества, содержащие 3 основных питательных вещества и способные расщепляться на ионы в почвенном растворе. Многие минеральные удобрения (KC1, NaN03, NH4N03) содержат только 1 из основных питательных веществ.
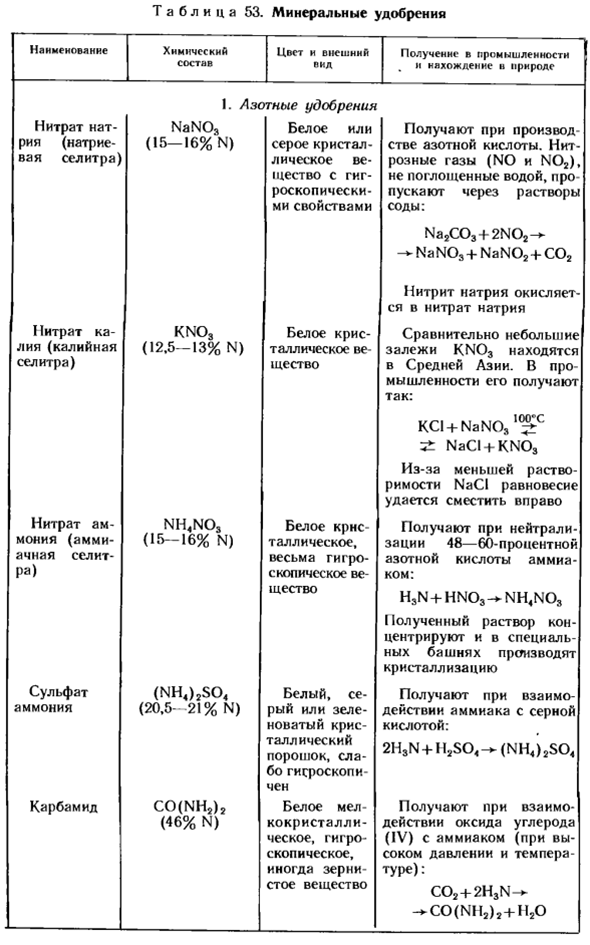
Такое удобрение называется простым. Более ценными являются минеральные удобрения, содержащие 2 или 3 всех основных питательных вещества (N, K, P).Такие удобрения называются комплексами. Основные сведения о наиболее важных минеральных удобрениях приведены в таблице 53.
В соответствии с решением XXVI съезда КПСС планируется увеличить производство фосфатных, концентрированных и комплексных минеральных удобрений и повысить эффективность их использования. В последнее время большое внимание было уделено производству polyphosphates. To для их получения раствор хлорида калия или аммиака наносят на смесь, содержащую ортофосфорную кислоту, бисфосфат (H4P207) и полифосфорную кислоту (содержащую до 10 атомов фосфора).
Комбинированное применение минеральных удобрений позволяет сэкономить трудозатраты и разгрузить транспортные средства. При хранении минеральных удобрений, они должны быть защищены от влаги. Соли аммония нельзя класть вместе с известью, цементом. Потому что, когда они вступают в контакт с ними, может произойти разложение солей аммония.
Также обратите внимание, что вы не можете хранить много минеральных удобрений (таких как нитраты, соли аммония), потому что они твердые и трудно измельчить. Не устанавливайте бак с аммиачной водой рядом с корпусом. Вода после мытья бака и других емкостей Таблица 53.Минеральное удобрение Имя химический состав цвет и возникновение ФТ Вил доступный в индустрии и природе 1.
Азотное удобрение Нитрат натрия (нитрат натрия) NaN03 (15-16%N) гигроскопическое белое или серое кристаллическое вещество, полученное под коннотацией азотной кислоты. Азотистый кислый газ (NO и N02), который не поглощается водой, проходит через содовый раствор: Na2C03 + 2N02 — * NaN03 + NaN02 + C02 нитрит натрия окисляется до нитрата натрия I1 нитрат калия (нитрат калия) KNO (12,5-13% N) белое кристаллическое вещество относительно небольшие отложения KN03 обнаружены в Центральной Asia.
In в промышленности он получается следующим образом: из-за низкой растворимости KCI + NaNOj1 ^ ’NaCI + KN03 NaCI равновесие сдвигается вправо. Нитрат аммония (аммиачная селитра) NH4NO, (15-16% N) белый кристаллический, сильно гигроскопичный substance. It получают путем нейтрализации 48-60% азотной кислоты аммиаком: h3n + hno3 — * nh4no3.
Полученный раствор концентрируют и кристаллизуют в специальной колонне. Сульфат аммония (NH4) 2so4 (20,5-21% N) белый, серый или зеленоватый кристаллический порошок, слегка гигроскопичный вследствие взаимодействия аммиака и серной кислоты рецептор: 2h3n +1 l2s04 (nh4)2s04 Карбамид CO (NH2) 2(46% N) белое кристаллическое, гигроскопичное, иногда зернистое вещество.
Полученный взаимодействием окиси углерода (IV) и аммиака (высокого давления и высокой температуры): C02 + 2H3N—* C0 (NH.), + H20 название химический состав цвет n внешний вид производство в промышленности и природе. 2.Фосфорное удобрение Простой суперфосфат Cas (Н2Р04) 2 ″ 2HACaS04 * 2Н20 (до 20% p2os) получают взаимодействием мелкозернистого порошка фосфита серого или Апатита с серной кислотой.
- Двойная фильтрация фосфата Са(Н2Р04)2•Н20(40%Р205)простой суперфосфат фосфата, а также производства в 2 шага сделал: а) СА3(P04)2 + 3H2S04->-2Н3Р04+ 3CaS041 CaS04 б)СА3(P04)2 + 4H3P04-«-Зса(H2P04) 2 3 калийные удобрения Хлорид калия KC1 (52-60% K20) белое кристаллическое вещество хлорид калия встречается в природе в виде сильвинитового минерала (NaCI X XKCI).Самые крупные месторождения находятся в Соликамске в Карпатах и в Солигорском районе Беларуси.
4.Сложное удобрение Аммоний дигидроартостомфат nh4h2po4 (содержащий примеси) белый или сероватый кристаллический порошок, полученный реакцией фосфорной кислоты и аммиака: H3N + H3P04» — NH42P04″ (NH4) 2S04 и другие примеси, содержащие гидроортретную кислоту аммония (NH4) 2HP04 то же, что и дигидрооритрат фосфат аммония и то же, что и дигидрооритарная кислота аммония препарат: 2H3N + H3P04 — — — (NH4) 2HPP04
Сильвинит измельчают и затем концентрируют Людмила Фирмаль
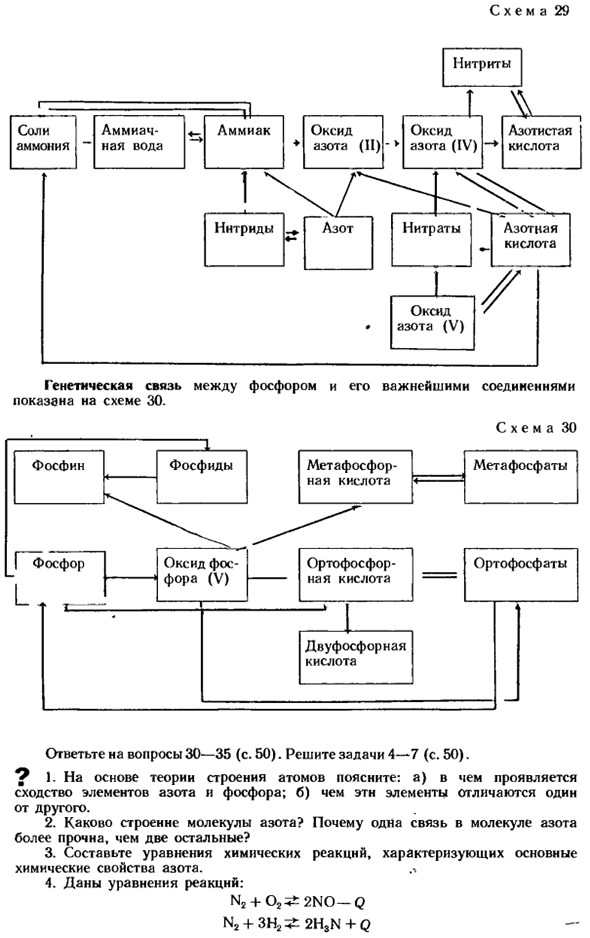
Запрещается вливать в водоразделы (реки, пруды и др.), если они содержат аммиачную воду. Ежегодный прирост объемов производства минеральных удобрений в Советском Союзе(один миллион тонн) 1953 1958 1963 1965 1975 1985 7 12.4 19.1 31.3 90.2 (планируется) 150-155 ^Генетическая связь между Азотом и его наиболее важными соединениями показана на схеме 29. Генетическая связь фосфора и его важнейших соединений показана на схеме 30.
Схема 30 Вопрос 30-35 (стр. 50).Задача 4-7 (стр. 50). ^ 1.Основываясь на теории строения атомов, объясните: а)в чем сходство между азотными и фосфорными элементами? Б) чем эти элементы отличаются друг от друга. 2.Какова структура молекул азота? Почему 1 связь молекулы азота сильнее, чем другие 2 связи? 3.Создайте уравнения химических реакций, которые характеризуют основные химические свойства азота. 。% 4.
Приведите уравнение реакции : N2 + 02 ^ 2N0-Q N2 +ЗН22H3N + Q Схема 29 Как меняется равновесие этих реакций? в) при изменении давления. Б) когда температура меняется? 5.Азот в 1 цилиндре, кислород в другом 1 цилиндре, и окись углерода (IV) в 3-ем. Как отличить эти газы друг от друга? 6.Некоторые горючие газы содержат свободные nitrogen. Do оксиды азота образуются при сгорании таких газов? Почему?
7.Напишите 4 уравнения химической реакции, в которой образуется аммиак. Я 8.Объясняется роль условий (давление, температура, катализатор) в промышленном процессе синтеза аммиака. 9.Когда аммиак проходит в трубку, содержащую раскаленный медный оксид (II), образуется металлическая медь. Напишите уравнение этой реакции, выделите окислитель в 1 строке, а восстановитель в 2 строках.
10.Почему аммиак более энергично реагирует с кислотой, чем с водой? В чем суть этих химических реакций? 11.Рисунок 93 (стр. 29) описывает химические свойства аммиака, используемого при изготовлении показанного продукта. 12.An водный раствор аммиака называют аммиачной водой и гидроксидом аммония. Обоснуйте эти имена. 13.Создают следующую формулу реакции: а) образуется дигидроарторминат фосфата аммония.
б) гидрофосфат аммония и в) ортофосфат аммония. 14.Нарисуйте таблицу в блокноте, в соответствующей графе запишите молекулярные и ионные уравнения реакции, которые описывают свойства соли, с которой указана формула. Соль для снегоступов. Некоторые соединения, общие с другими солями nh4ci (nh4) 2c03(nh4)2S4 (nh4) 2s04 15.
Бикарбонат аммония иногда используется для выпечки кондитерских изделий. Каковы свойства бикарбоната аммония, используемого для этого? 16.Оксид азота (I) или азот выделяется, когда разбавленная азотная кислота вступает в реакцию с некоторыми металлами (Mg, Zn).Напишите соответствующее уравнение реакции окисления-восстановления.
17.In удобряется почва, образуется карбонат аммония, а во время грозы образуется аммиачная селитра. В чем причина этого? Напишите уравнение соответствующей реакции. 18.Создайте формулу реакции для азотной кислоты из аммиака. 19.Определите, в каком направлении смещается равновесие реакции между оксидом азота (IV).
Вода и кислород в момент изменения: а)температуры; б) давления. Почему? 20.Опишите формулу реакции в виде молекул, ионов и ионов сокращается. Это позволяет различать соляную, серную и азотную кислоты. 21.Показывает уравнение реакции. а) характерно только для азотной кислоты. Б) общие для азотной кислоты и других кислот.
22.Напишите уравнение реакции, протекающей между медью, цинком и кислотами. б) разбавленная серная кислота; в) концентрированная серная кислота; г) разбавленный азот; г) концентрированный азот. Выделяем окислитель в 1 ряд, а восстановитель в 2 ряда.
23.Когда азотная кислота взаимодействует с медью, серебром и ртутью, а также когда она взаимодействует с цинком и магнием, когда азот изменяется на+1, 0 и −3, почему азот меняет состояние окисления с+5 на+4 и+2?Напишите уравнение соответствующей реакции. 24. 2 белые трубки содержат различные белые нитраты. 1. когда соль нагревается, выделяется бесцветный газ, и тлеющие пятна горели.
При нагревании 2-й соли выделяется коричневый газ. Что это за нитраты? Напишите соответствующее уравнение реакции окисления-восстановления. 25.Во время разрядов молнии в почве может образовываться нитрат кальция. Напишите уравнение соответствующей реакции. 26.Азот находится в природе в соединении и в свободном состоянии, а фосфор-только в соединении.
В чем причина этого? 27.Объясните свойства белого и красного цветов phosphorus. Is есть эксперимент, который может доказать, что белый фосфор и красный фосфор-это одна и та же модификация элемента? 28.Благодаря действию азотной кислоты на фосфор получается фосфорная кислота. Если вы знаете, что вода содержит и выделяется оксид азота (II), создайте уравнение для этой реакции.
29.Создайте молекулярные и ионные уравнения для реакции фосфорной кислоты. а) кальций и; б) использовать оксид кальция. в) избыток и дефицит гидроксида кальция. Введите название соответствующего вещества под формулой. 30.Объясните роль основных питательных веществ в жизни растений. 31.Перечислите наиболее важные азотные удобрения.
Создайте формулу реакции, которая является основой для производства этих удобрений. 32.Напишите уравнения химических реакций, которые помогут вам получить самое важное фосфорное удобрение. 33.Как получить калийные и комплексные удобрения? Приведите соответствующее уравнение химической реакции.
34.Напишите в блокноте краткое изложение ответа о веществе, формула которого H, N. NOj, HN03,NH4NO, H3P04, Ca(H2P04)2(I, стр. 43). 35.Составьте формулу реакции по схемам 29 и 30. * I. 10,7 г хлорида аммония смешивали с 6 г гидроксида кальция и смесь нагревали. Какова масса и количество выделяемого газа (н. э.)? 2. 0,5 массовой доли или количества аммиака, необходимого для получения раствора 50 тонн, содержащего 50% (n. a. it это не так.
Азотная кислота? 3. К соде добавляли раствор 300 г, содержащий 0,1 мас.% или 10% гидроксида калия, 0,1 мас.% или 10 г раствора, содержащего 400% нитрата. Какова реакция полученного раствора: нейтральная, кислотная или щелочная? Какие граммы соли образовались?
4.Содержание питательных веществ в фосфорных удобрениях рассчитывается по содержанию массовой доли или процентному содержанию оксида фосфора (V).Сколько азота содержится в простом N-суперфосфат? 5. 25,3 тонны простого суперфосфата для замены, сколько тонн двойного суперфосфата требуется? 6. Рассчитайте массовую долю оксида калия в калиевой соли, содержащей хлорид калия в 0,8 мас. ч. 7.
По сравнению с теоретическим выходом, если выход кислоты составляет 0,8 массовой доли, или 80%, 31.сколько фосфата можно получить из ортофосфата кальция Т? «Лабораторные опыты Возьмите аммиак и растворите его в воде. 1.In в фарфоровой ступке хорошо перемешать кристаллический хлорид аммония NH4Cl и порошок гидроксида кальция ca (OH) 2 примерно в равных количествах(если известь слегка влажная, эксперимент будет работать).
Вылейте приготовленную смесь в пробирку емкостью 1/3.Закройте трубку пробкой с газоотводной трубкой. Конец газоотводной трубки опускают в другую сухую трубку и закрепляют на стойке открывающимся концом вниз (рис.104).Смесь нагревают в пробирке. 2.As как только вы почувствуете резкий запах (понюхайте внимательно).Закройте пробку газовой трубкой, не переворачивая ее, замочите на водяной бане и откройте пробку. Замолчать. Рисунок 104.Возьми аммиак. Рисунок 105.
Горение аммиака в кислороде. Рисунок 106.Получают азотную кислоту из нитратов. ■ 1 гр 3.После заполнения трубки водой закройте отверстие пробкой и выньте ее из отверстия. water. In в полученный раствор положите красную лакмусовую бумажку-она станет синей. Затем добавьте в раствор несколько капель раствора фенолфталеина-появится малиновое пятно.
Задача. 1.Какие газы доказаны из наблюдений? Напишите уравнение соответствующей реакции. 2.Какие вещества образуются, когда образующийся газ растворяется в воде? Какие выводы подтверждает этот вывод? Напишите уравнение этой реакции. Горение аммиака в кислороде. Соберите прибор для газа. Пробирка, содержащая смесь хлорида аммония и гидроксида кальция.
Используйте кислород, чтобы вставить вентиляционную трубу в стеклянный цилиндр, и используйте стрелку, чтобы воспламенить газ(рис.105). Задача. Какие вещества образуются при сгорании аммиака? Если вы знаете, что бескислородный азот выделяется при сгорании аммиака, напишите соответствующее уравнение реакции.
Подчеркните окислитель 1 строкой, а восстановитель 2 строками. Взаимодействие аммиака и acid. As в предыдущем эксперименте соберите устройство. Пробирка с небольшим количеством смеси хлорида аммония и гидроксида кальция. В пробирку наливают 1 мл концентрированной азотной, соляной и серной кислот. Конец вентиляционной трубы должен находиться на расстоянии 5-6 мм от поверхности кислоты.
Задача. 1.Как объяснить появление»белого дыма»?Напишите уравнение соответствующей реакции. 2.Конец вентиляционной трубы не может быть погружен в кислоту, но и не может быть близок к нанометрам. «» Влияние водного раствора аммиака на показатель. Налейте небольшое количество раствора аммиака в пробирку и проверьте действие Красной лакмусовой бумажки-получится синяя.
Добавьте несколько капель раствора фенолфталеина-появится малиновое пятно. Задача. Следуя наблюдениям эксперимента, мы делаем выводы о химических свойствах водного раствора аммиака. Качественная реакция на нитраты. 0,5 г нитрата натрия(или другого нитрата) помещают в пробирку и добавляют большое количество концентрированной серной кислоты, чтобы покрыть соль, а затем кусок меди и нагревают.
Выделяется коричневый газ, и раствор становится синим. Задача. Какие газы выделяются? Почему раствор в трубке становится синим? Составьте уравнение реакции и укажите изменение степени окисления соответствующего элемента. Что окисляется и что восстанавливается с помощью этой реакции? Как можно отличить соль азотной кислоты от соли других кислот?
Взаимодействие солей аммония и щелочей (распознавание солей аммония). 1.Поместите небольшое количество кристаллического сульфата аммония (NH4) 2S04 в 1 пробирку и нитрата аммония NH4N03 во 2-ю пробирку. Налейте 1-2 мл раствора гидроксида натрия в обе пробирки и нагрейте их slightly. An выделяется раздражающий газ. 2.Поместите красную лакмусовую бумажку, смоченную в дистиллированной воде, в газовый поток. Бумага станет синей. Задача.
Какие газы образуются при нагревании солей аммония? Напишите уравнение соответствующей реакции. Как можно отличить соли аммония от других солей? Получают азотную кислоту из нитратов. Положите 4-5 г нитрата натрия в пробирку и добавьте большое количество концентрированной серной кислоты, чтобы покрыть все соли. Закройте трубу газовой пробкой. Опустите конец вентиляционной трубы на 2 пробирки.
Эта пробирка помещается в чашку с холодной водой (рис.106).Пробирки, содержащие нитрат натрия и серную кислоту. Желтоватая жидкость постепенно накапливается в приемном зонде. Задача. Какие вещества накапливаются в трубке приемника? Чем объясняется желтизна этого вещества? Напишите уравнение соответствующей реакции. Влияние азотной кислоты на медь.
Поместите медный наконечник в пробирку, добавьте концентрированную азотную кислоту и нагрейте ее. Выделяется буроватый газ, и раствор постепенно становится синим. Задача. Какие газы выделяются? Почему пробирка становится синей? Напишите уравнение этой окислительно-восстановительной реакции, выделив окислитель с 1 строкой, а восстановитель с 2 строками.
Растворимость ортофосфорной кислоты, гидро ортофосфорной кислоты, дигидро и ортофосфорной кислоты. Налейте фосфат кальция, гидрофосфат кальция и дигидрооритрат кальция (1 см3) в 3 пробирки. Налейте в них воду и перемешайте. Лучше всего плавится дигидротофосфат кальция, хуже-гидрофторфосфат кальция. Ортофосфат кальция практически нерастворим. Взаимодействие фосфорной кислоты и гидроксида кальция.
1. В пробирку наливают 4-5 мл свежеприготовленной известковой воды и капают раствор фосфорной кислоты (1:20).Раствор мутный. 2.Продолжайте заливать фосфатным раствором. Решение снова становится ясным. Взаимодействие фосфорной кислоты и нитрата серебра. К 1 мл 1%раствора фосфата добавляют 10%раствор ацетата натрия и небольшое количество раствора нитрата серебра.
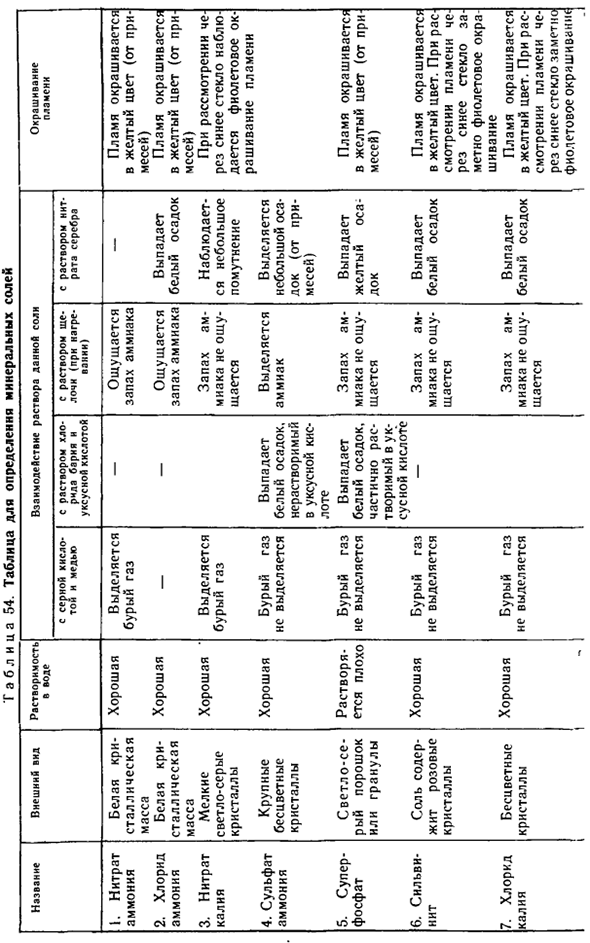
Появляется желтый осадок. Задача. 1.Зачем нужен раствор фосфорной кислоты Для измерения минералов Соль Г а б л Ц 54.Стол Растворимость в воде Цвет пламени Внешний вид Позиция Взаимодействие раствора этой соли С серной кислотой и медью В растворе хлорида бария и уксусной кислоты Щелочной раствор(при нагревании) Раствор нитрата серебра Белая кристаллическая масса Белая кристаллическая масса
Прекрасный светло-серый Кристалл Крупные бесцветные кристаллы Светло-серый порошок или гранула Соль содержит розовые кристаллы Выделяется коричневый газ Выделяется коричневый газ Коричневый газ не выделяется Коричневый газ не выделяется Коричневый газ не выделяется Белый осадок, нерастворимый в уксусной кислоте Частично растворим в Белом осадке уксусной кислоты Запах аммиака Запах аммиака
Отсутствие запаха аммиака Аммиак высвобождается Отсутствие запаха аммиака Аммиачные дыры, которые нельзя почувствовать Белый осадок Есть небольшая дымка. Мелкие примеси выделяются(из примесей) Желтый осадок Белый осадок Пламя желтеет(от примесей) Пламя становится желтым(от mssey) Если вы посмотрите через синее стекло, Вы можете наблюдать фиолетовое пятно пламени Пламя становится желтым(от смеси)
Хорошо. хороший. хороший. Хорошо. 1.Аммиачная селитра 2.Хлористый аммоний 3.Нитрат калия 4.Сульфат аммония 5.Суперфосфат Его трудно растворить. Хорошо. 6.Сильвинит Коричневый газ не выделяется Аммиачные дыры, которые нельзя почувствовать Белый осадок Хорошо. 7.Хлористый калий Бесцветные кристаллы Сначала мутность наблюдается с известковой водой, но когда в дальнейшем триллионы фосфатных растворов исчезнут?
Напишите соответствующую формулу реакции. 2.Какое вещество (желтый осадок) образуется при взаимодействии фосфорной кислоты и нитрата серебра? Напишите уравнение соответствующей реакции. Практика 2 Определение содержания минеральных удобрений (таблица 54).Пробирка содержит образец следующих минеральных удобрений: I) суперфосфат, нитрат аммония, сульфат аммония. 2) хлорид аммония, нитрат натрия, хлорид калия.
Определите пробирки, содержащие все перечисленные удобрения. Практика 3 Решение экспериментальных задач. I. получить аммиак и провести с ним характерную химическую реакцию. 2. Получают нитрат меди (II) 3 различными способами. 3.Эмпирически доказано, что сульфат аммония, нитрат аммония, хлорид аммония и фосфат аммония нельзя смешивать с известью. Предоставляет соответствующее описание. 4.
В 4 пробирках содержатся следующие кристаллические вещества: сульфат натрия, хлорид аммония и нитрат натрия. Определите пробирки, содержащие каждое из этих веществ. 5. 1. раствор фосфорной кислоты дают в одной пробирке, а раствор серной кислоты-в другой пробирке. Определите каждую из этих кислот. 6. Вводят ортофосфат натрия в 1 пробирку и ортофосфат кальция в другую пробирку. Определите эти соли.
Смотрите также:
| Ортофосфорная кислота. Ортофосфаты | Положение углерода и кремния в периодической системе, строение их атомов |
| Краткая характеристика элементов подгруппы азота | Углерод и его свойства |
