Оглавление:



Мольный объем
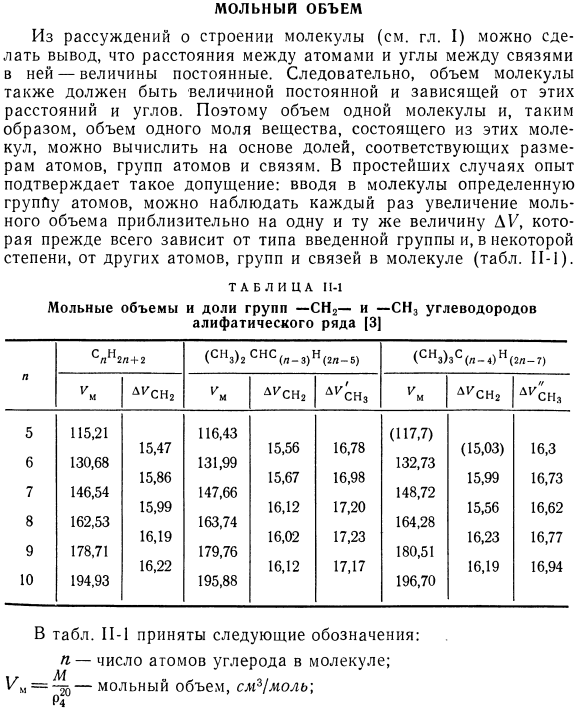
Мольный объем. Из обсуждения структуры молекулы (см. Главу 1) можно сделать вывод, что расстояние между атомами и угол между связями в атомах постоянны. Поэтому объем молекул также должен быть постоянным и зависеть от этих расстояний и angles. So, объем 1 молекулы, а следовательно и объем 1 моля вещества, состоящего из этих молекул, можно рассчитать исходя из процентного соотношения, соответствующего атому, группе атомов и размеру bond. In в простейшем случае эксперимент подтверждает это предположение: если ввести в молекулу определенную группу атомов, то можно наблюдать увеличение молярного объема с примерно одинаковым значением DE каждого time.
Аналогичное увеличение молярного объема наблюдается и в алифатических углеводородах с разветвленной цепью. Людмила Фирмаль
- В значительной степени зависит от типа вводимой группы и, в некоторой степени, других атомов, групповых связей в молекуле (таблица Р-1). Таблица 1У Молярный объем и доля-СН2-и-СН3 групп углеводородов Алифатическая колонка[3] Внутри таблицы. На С-1 были приняты следующие обозначения: р это число атомов углерода в молекуле. Молярный объем, СМГ! Литератор \ P4 p * 0-плотность, г / сл3; M-молекулярная масса. DKSn>-DO-cha group при запуске-молярный объем. D1 / sn3-доля первой группы-СН3 в позиции(2). D ^ cn, доля 2-й группы-это позиция (2) CH3. Сравните цифры в таблице. Когда цепи молекул углеводородов удлиняются путем введения P 1, SiG групп, можно видеть, что молярный объем увеличивается от 15,47 (разница между молярными объемами гексана и пентана) до 16,22 СМГ / моль (декан и Нонан).
В среднем 16 см3 / моль. Введение боковой группы-СН3 в цепь молекул алифатических углеводородов приводит к несколько большему молярному объему: от 16,78 (разница в молярных объемах 2-Метилпентана и Н-пентана) до 17,23 СМГ / моль(2-метилококтан и α-Октан) в среднем 17,15 см * / моль Если ввести 2-ю группу СН3 в цепь, где уже имеется 1-я боковая группа-СН3, то молярный объем алифатического углеводорода увеличивается с 16,3 (разница в молярном объеме 2,2-диметилбутана и 2-метилбутана) до 16,94 см * / моль. (2,2 диметилоктан и 2-метилоктан), в среднем 16,8 см ^ / моль. Таким образом, доля-СН2-группы в молярном объеме зависит от длины цепи, в которую вводится группа.
- Доля групп-CH3 зависит не только от длины цепи, но и от наличия других групп, связанных с тем же атомом углерода, к которому присоединена группа-CH3. Определим процентное содержание группы, расположенной в конце неразветвленной цепи алифатических углеводородов. Для этого вычитают из молярного объема данного углеводорода долю всей цепи группы-С и делят разность на 2 (2 группы-В конце цепи с СН3).): 33,6 СМГ {моль 115.2-3 * 16 Пентеан. Октановый. 162.53-6 * 16 Настоятель. 194.93-8 * 16 = 33.45 см *!Мэл. = 33,27 СМГ Можно предположить, что доля-CH3 концевой группы углеродной цепи составляет 33,5 см * 1 моль. Пример 11-1.Используя рассчитанные выше фракции, определяем молярный объем 2,2, 4-триметилметилпентана. Решение CH3 N СМ \ Я Я / См, Н Н 3 группа-СН2-3 до 16.0 = 48.0 2 группы-СН, терминал. 。 ••2 * 33.5 = 67.0 2 группа-ЧЗ, боковое положение(2)и (4)2 * 17.15 = 34.3 1-я группа-СН3, позиция (2) 16.8 СН3-С-С-С-СН3 В итоге. 。 。 166.1 им = 166.1 ЦМГ! Мэл.
В эксперименте обнаружен ум-165,07 см9 / моль. Погрешность расчета составляет+ 0,66%. Аналогично, как показано в приведенном выше примере, молярный объем можно определить, если, помимо атомов C и H, имеется группа, содержащая атомы O, 5, P, C1 и т. д. вводится в молекулу. Чем точнее нужно выполнить расчеты, тем более детально нужно просмотреть таблицу пропорций молярного объема в разных случаях соединения, а также соседей разных групп, влияющих на величину пропорций, используемых в расчетах.
Если мы суммируем связи, которые часто встречаются в органических молекулах, и их пропорции, мы приближаемся к молярному объему вещества без измерения его плотности. Людмила Фирмаль
- Такая пропорция не считается фактическим объемом, занимаемым группой атомов, но считается средним расчетным значением, которое наиболее удобно для расчета молярного объема органических веществ. Это обстоятельство объясняется тем, что под влиянием различных факторов, вызывающих деформацию и напряжение в группе атомов в молекуле, расстояние между атомами может фактически изменяться. Важным фактором, влияющим на изменение молярного объема углеводорода, например, является изменение площади поперечного сечения молекулы за счет вращения группы вокруг С-С связи цепи молекул.
Смотрите также:
Возможно эти страницы вам будут полезны:
