Оглавление:



Нахождение алюминия в природе, его получение и свойства
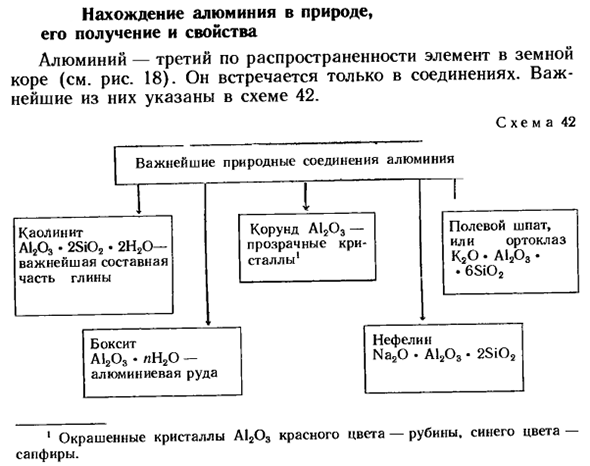
- Открытие алюминия в природе, его получение и свойства Алюминий-третий по распространенности элемент в земной коре(см. рис.18). он содержится только в соединениях. Наиболее значимые из них указаны на схеме 42. Рисунок 42 1 Красный Кристалл A12Oa-Рубин, Синий-Сапфир. Мы получили ваши отзывы.
- Немецкий химик Ф. в 1821 году получил алюминий путем нагревания щелочного металла и хлорида алюминия, содержащего калий и натрий без воздуха. A1C13 + ZK — ^ ZKS! + ИСКУССТВЕННЫЙ ИНТЕЛЛЕКТ В промышленном производстве алюминия разработаны способы получения алюминия из бокситов (с. 137).
Физические характеристики. Людмила Фирмаль
Алюминий серебр-белый металл, свет(п = 2.7 г / км3), плавя на℃660. он очень пластичен, легко протягиван к проводу и свернут в листы и foil. In по электропроводности алюминий уступает только серебру и меди (2/3 электропроводности меди). Химическое вещество properties. In электрохимическая серия напряжения тока, алюминий помещена как раз за самым активным металлом(стр. 89).
- Однако из повседневного опыта известно, что алюминиевые изделия и кухонная утварь, т., не работайте ни с алюминием, ни с водой при температуре кипения. Это объясняется наличием тонкой оксидной пленки на поверхности алюминия, которая предотвращает дальнейшее окисление оксида. Когда поверхность алюминия натирается ртутной солью, происходит реакция: 2A1-f-3HgCI2 — > — 2AICI3 + 3Hg ’
На сплавленной поверхности оксидная пленка не удерживается, поэтому алюминий реагирует с водой в нормальных условиях(рис. 125): 2A1 + 6HOH 2A1 (OH)3 | + 3H2t При высоких температурах алюминий вступает в реакцию со многими неметаллическими и композиционными материалами без амальгамации.
Выделившаяся ртуть растворит алюминий и образует сплав с ртутно-алюминиевой амальгамой. Людмила Фирмаль
О +30 ♦с-2> А12о3 −1 −1> 2A1C13 ♦с-2 A12S3 ♦с-1 о 2A1C13 + 3H2T О + 3CI、 О + 3С О 2A1-6ё ♦1 −1 + 6CH1 ♦2 + 3CuS04 n ai AI2 (SO4)3 + 3CU | + 2Na0H + 2H20 n (Во время нагрева)> ^ ^ + ^ Приложение. Алюминий используется в производстве различных сплавов. Наиболее распространенными являются дюралевые светильники, которые содержат медь и магний, а также силумин (сплав алюминия и кремния).Основными преимуществами этих сплавов являются легкость и высокая прочность.
Вышеуказанные сплавы широко использованы в воздушных судн, автомобиле, корабле, приборостроении, ракете, construction. In форма чистого металла, алюминия используется для изготовления электрических проводов и различного химического оборудования. Алюминий также используется для насыщения стальной поверхности, то есть насыщения, с целью защиты ее от коррозии. Рисунок 125.Сплавленный алюминиевый провод:/ — в воздухе:2-в воде Изделия из чугуна и алюминия Вопрос 2-6 (стр. 115-116).Решите задачи 1 и 2(стр. 116).
Смотрите также:
