Оглавление:





Характеристика элементов главной подгруппы II группы
- Характеристика элементов главной подгруппы II группы Глава VI,§ 4.Повторите от. Общее описание свойств основных элементов подгруппы II группы приведено в таблице 68. Таблица 68.Свойства элементов основной подгруппы II группы и свойства ее соединений.
- Особенности незнания элементов «оксид и гидроксид» и химического взаимодействия Вода и щелочь, содержащие символ элемента кислоты Бериллий Be +2НС1А — * beci2 + h2t be + 2naoh — * * na2be02 + h2f бериллий натрий 4 амфотерные вещества не реагируют при комнатной температуре: BEO-f 2hci — * * 12 + H20beo + 2naoh-v — * Na2be02 + H20 Кислоты и магний Mg реагируют более энергично, чем Be. Не реагирует со слабой водой.
Людмила Фирмаль
Это очень хорошее приложение. Бео никак не реагирует на это water. Be (OH) 2 в воде практически нерастворим и обладает только основными свойствами. MgO слабо реагирует с водой. Растворимость Mg (OH) 2 очень небольшое имя элемента и химический символ Видим режим пункт.
Характеристика оксидов и гидроксидов В воде В кислоте С щелочью Он реагирует с кислотой более энергично, чем Mg Он реагирует с кислотами более энергично, чем Ca Он реагирует с кислотой более энергично, чем Sr Реагирует при комнатной температуре : Ca + 2NOH- * — Ca (OH) 2 + H2t Более энергично, чем Калифорния Более энергично, чем старший.
Есть только основные свойства. ЦАО бурно реагирует с водой. Растворимость Ca (OH) 2 мала, но больше, чем Mg (OH) 2.Они имеют только основные характеристики. СРО более энергично реагирует с водой, чем с САО. Растворимость Sr (OH) 2 больше, чем Ca (OH) 2 Есть только основные свойства. Бао более энергично реагирует с водой, чем СРО.
Растворимость Ba (OH) 2 больше, чем Sr (OH) 2 Кальций Не отвечает em Стронций SR Не отвечает em Не отвечает Барий ва em Как видно из таблицы, элементы стронция Sr и бария Ba очень похожи на кальций. Тугоплавкие оксиды этих 3 элементов подобны тем из тяжелых металлов, которые ранее были вызваны Землей. Они бурно реагируют с водой и образуют сильную щелочь.
Отсюда их название стало щелочноземельным металлом. Магниевый элемент (с. 102), в частности бериллий, существенно отличается по своей природе от щелочноземельных металлов. Бериллий обладает двойными свойствами, так же как цинк и алюминий. То есть он реагирует как с кислотами, так и со щелочами.
Способность к взаимодействию с кислотами и водой постепенно возрастает в направлении от бериллия к barium. In в той же последовательности реакция оксида с водой изменяет энергию и растворимость гидроксида. Наиболее активным металлом этой основной подгруппы является Радий Ra.
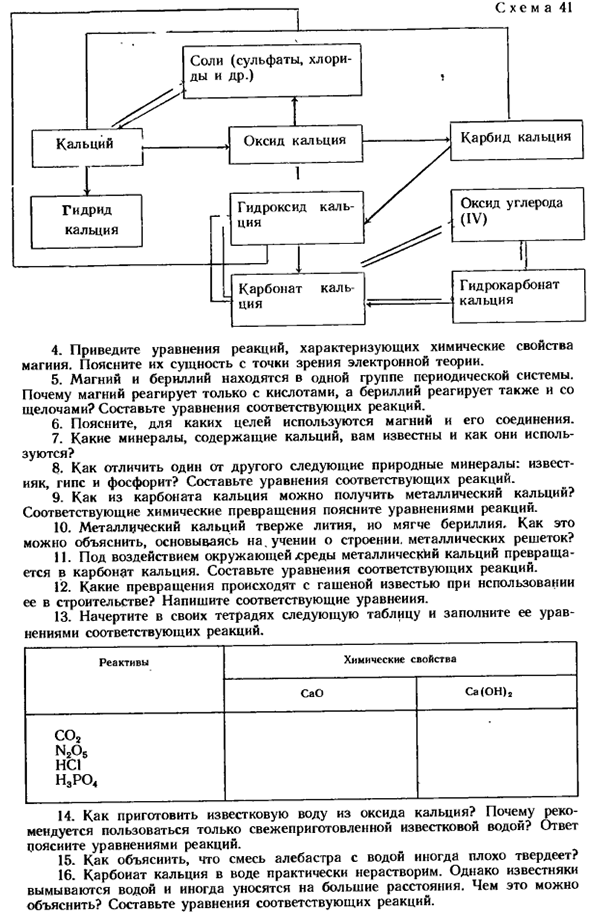
Генетическая связь между кальцием и его наиболее важными соединениями объясняется схемой 41(стр. 109). Вопрос 19-22 (стр. 110) просьба ответить. ? 1.На основании теории строения периодической системы и атомарного атома кислорода, в зависимости от того, какие свойства магния и кальция являются общими и какие свойства различны. Почему?
2.In в периодической системе кальций находится рядом с калием, но его химические свойства близки к свойствам натрия, которые находятся в разные периоды. Пожалуйста, объясните, почему. 3.In природа, карбонат магния был найден. Как я могу получить металлический магний из него? Создайте уравнение для соответствующей реакции. Схема 41 4.
- It дает уравнение реакции, характеризующее магическую химию. Объясните их сущность с точки зрения электронной теории. 5.Магний и бериллий относятся к одной группе периодических систем. Почему магний реагирует только с кислотой, а бериллий — со щелочью? Создайте уравнение для соответствующей реакции. 6.Объясните назначение магния и его соединений для использования.
7.Как известны минералы с кальцием и как они используются? 8.Как отличить один из следующих природных минералов: известняк, гипс и фосфит? Создайте уравнение для соответствующей реакции. 9.Как я могу получить металлический кальций из карбоната кальция?
Формула реакции объясняет соответствующие химические превращения. Людмила Фирмаль
10.Металлический кальций тверже лития и мягче бериллия. Как это можно объяснить на основе? Учение о структуре металлических решеток? 11.Под воздействием окружающей среды металлический кальций превращается в карбонат кальция. Создайте уравнение для соответствующей реакции. 12.Какие изменения происходят с гашеной известью при использовании в строительстве? Напишите соответствующее уравнение.
13.Нарисуйте в блокноте следующую таблицу и заполните уравнение соответствующей реакции. Химические свойства реагентов КоАП Св (о)、 И n2o5 нс1 Н ro4 14.Как приготовить известковую воду из оксида кальция? Почему рекомендуется использовать только свежеприготовленную известковую воду? Объясните ответ в уравнении реакции. 15.Как объяснить, что смесь алебастра с водой иногда плохо морозит?
16.Карбонат кальция в воде практически нерастворим. Но известняк также может быть вымыт водой и унесен на большие расстояния. Как это можно объяснить? Создайте уравнение для соответствующей реакции. 17.Почему мы не можем потреблять жесткую воду в паровом котле? Подтвердите ответ формулой реакции. 18.Каковы основные способы устранения бычьей жесткости?
Напишите уравнение соответствующей реакции. 19.Основываясь на учении об атомном строении, объясните, чем объясняются резкие различия в химических свойствах бериллия. б) из лития. 20.Основная подгруппа II группы описывает соотношение между элементами и кислотами, щелочами и водой.
Какие закономерности можно увидеть в изменениях химических свойств этих элементов? Почему? 21.Напишите резюме ответов, характеризующих свойства вещества, в котором дана формула: Ca, CaO, Ca (OH) 2, Ca(N03) 2, Ca3(P04) 2(I, стр. 43). 22.(«Оставьте формулу реакции по схеме 41. f I. сколько граммов раствора соляной кислоты с массовой долей 0,1 или 10% хлористого водорода необходимо для реакции с доломитом при 3,68 г?
2.Рассчитайте массовую долю и процентное содержание магния и оксида магния в доломите. 3. Прокаливании 50 кг чистого карбоната кальция его масса уменьшилась на 4,4 кг. Какой процент карбоната кальция*}разлагается? 4.Металл со степенью окисления+2 8 г реагирует с водой, водородом 4,48 л(n. a. It был освобожден).Определите относительную атомную массу металла и дайте ему имя.
5. Из 0,04 массовой доли, или 4 тонн известняка с 20% примесями, было получено 12 тонн гидроксида кальция. Какова массовая доля или процент по сравнению с теоретическим выходом? 6.Жесткая вода содержит 100 мг / л бикарбоната кальция и 30 мг / л сульфата кальция. Сколько карбоната натрия нужно, чтобы смягчить 1 мс такой воды? Лабораторные опыты Сжигание calcium.
In в середине небольшой кучки кальциевых чипсов поместите магниевую ленту и зажгите ее. Кальций горит ярким красноватым пламенем. Взаимодействие кальция с водой. 1. Положите небольшой кусочек кальция в пробирку с 2-3 мл воды. Кальций вступает в реакцию с водой, и выделяется газ. Раствор слегка мутный. 2.Принесите зажженные спички в трубку. Газ горит тихо, почти незаметно, пламенем или или.
3.Добавьте небольшое количество раствора фенолфталеина к полученному раствору. Отображается малиновый цвет. Задача. Вещества, образующиеся: а) при сгорании кальция. Б)когда кальций взаимодействует с водой, напишите соответствующее уравнение реакции. Гидратация оксида кальция. 1.Положите 2-3 г оксида кальция в фарфоровую чашку и залейте водой.
Наблюдается такой сильный нагрев, часть воды превращается в пар, фрагменты оксида кальция рассеиваются, в результате чего образуется сухой, разрозненный порошок. 2.Затем налейте еще воды в чашку, перемешайте смесь, а затем процедите. Потрогайте полученный прозрачный раствор пальцами-это мыло. Добавьте несколько капель раствора фенолфталеина.
Отображается малиновый цвет. Задача. Какие вещества образуются при взаимодействии оксида кальция с водой? Каков эксперимент, подтверждающий это? Напишите уравнение соответствующей реакции. Конверсия карбоната кальция в гидрокарбонат кальция и конверсия гидрокарбоната кальция в карбонат кальция. I. После 2-3 мл свежеприготовленной известковой воды пропустите через нее угарный газ (IV).Решение становится все более мутным.
2.Продолжить прохождение раствора монооксида углерода (IV). Суспензия будет постепенно растворяться. 3.Прокипятите трубку в прозрачном растворе. Образуется осадок. Задача. Почему оно затуманивается, когда мимо проходит известковая корова? Окись углерода (IV)? Если углекислый газ (IV) все еще проходит, почему раствор снова становится прозрачным? Объясните причину нагрева Этот прозрачный раствор образует осадок. Опишите уравнения соответствующей реакции в виде молекул, ионов и сокращенных ионов.
Смотрите также:
