Оглавление:





Одноосновные предельные карбоновые кислоты
- Одноосновные насыщенные карбоновые кислоты Одноосновные насыщенные карбоновые кислоты содержат органические вещества, их молекулы включают Карбоксильная группа, связанная с насыщенным углеводородным радикалом или атомом водорода. Структура молекул карбоновой кислоты может быть установлена таким же образом, как это было рассмотрено при изучении альдегидов(стр. 218).
- Электронная формула ограничения одноосновной кислоты выглядит следующим образом: Город: Р: ы * о компании: и Атом водорода гидроксильной группы карбоновой кислоты гораздо более подвижен, чем молекула спирта. Р-СОО «+ Н + Чун.
Поэтому водорастворимые карбоновые кислоты окрашивают лакмусовую бумажку в красный цвет, потому что ионы водорода разрушаются. Людмила Фирмаль
Различие в свойствах спирта и карбоновых кислот объясняется тем, что первоначально гидроксильная группа связывается с гидрокарбонатным радикалом, а 2-я-с карбонильной группой. Ослабление связи между кислородом и водородом в гидроксильной группе объясняется разницей в электроотрицательности атомов углерода, кислорода и водорода (I, p. I.).123).
Атом углерода карбонильной группы приобретает определенный положительный заряд (электронная плотность смещается в сторону атома кислорода карбонильной группы), в результате чего этот атом притягивает электронное облако от атома кислорода гидроксильной группы. Компенсируя смещенную электронную плотность, атом кислорода гидроксильной группы притягивает к себе электронное облако соседнего водорода atoms.
As в результате связь между атомом кислорода и водородом гидроксильной группы становится более полярной, а атом водорода приобретает большую подвижность. Электронный сдвиг карбоксильной группы может быть представлен следующей схемой: R-CT Ответьте на вопрос I-3 (стр. Решите задачу I (стр. 235). Гетеросексуальность и номенклатура.
Изомерия насыщенных одноосновных карбоновых кислот аналогична изомерии альдегидов(с. 219). Чаще всего используется название исторически сложившейся кислоты (муравьиная, уксусная и др.).Согласно международной номенклатуре, они образуются от добавления слова «кислота» к названию соответствующего углеводорода.
Например: Метановая кислота H-cf, CH3-этановая кислота Ченг 4 О В таблице 84 приведены формула и название наиболее важных одноосновных предельных карбоновых кислот. Таблица 84.Наиболее важные одноосновные насыщенные карбоновые кислоты Название формулы температура кипения (С) 4 муравьиная кислота, или метан, кислота 100,7 CH8 — (G ^ he уксусная кислота, или этановая кислота, 118,1 sn3-sn2-hon пролионовая кислота, или пропановая кислота 141.1 sn3-СН2-СН2-с; полироли масляная кислота, или butanic кислоты 163.3 CHe-(CH2) s-C ^ he
Валерианова или пентаитовая, кислота 186.4 ксон капроновая, или гексановая, кислота 205.4 CH3 — (CH2)$ — C 4 OH эмалевая кислота или гептановая кислота 223.5 CH3-(CH2)| 4-c ^ NOH пальмитиновая кислота или гексадекановая кислота 351.5 CH3 — (CH2) / b-s 4 стеариновая кислота, или октадекановая кислота 376.1 Быть на природе. Муравьиная кислота содержится в иглах муравьев, крапивы, ели.
Ожоги крапивы являются следствием раздражающего действия муравьиной кислоты. Масляная кислота (бутановая кислота) содержится в прогорклом масле, а валериановая кислота (пентановая кислота) — в корнях валерианы. Мы получили ваш feedback. In в лаборатории можно получить карбоновые кислоты из солей, воздействуя серной кислотой на нагревание.
Например: С> » О 2CH3-C + H2S04-I Na2S04 + 2CH3-C н0-НС хо-ч Ацетат натрия 2CH3—(CH2), b — C ^ + H2S04 ONa Стеариновая кислота натрия Да. Na2S04 + 2CH3 — (CH2) / 6-SG Эй, мужик. Стеариновая кислота В промышленности углеводы получают различными способами (таблица 85). Таблица 85.Основные способы промышленного производства углеводов Способ получения карбоновой кислоты окислением Углеводородный альдегидный спирт
1) 2ch4 + 302 — * 2H — C + * катализатор-OH_PATOR + 2H20-2CH, — CH2-CH2-CH3 + 502-V катализатор 4CH3 c ^ + 2HgO OH давление Этот метод является наиболее продвинутым. Советский ученый Н. м. развивал Emanuel. In в этом процессе используется недорогой Бутан 2) 2Х74+ 502 —Catalyst катализатор- ► 4С, 7НЯ5-с. + 2H20 Хон стеариновая кислота n 1) 2R — («.— Ч + 202-в-* — 2р-С +О 2 катализатора+ 2)CHsCH20H + 02 — > вох +Н2®2Р-СГ ^ + 02 — * „хн — 2Р-сравни каталог — \ автор Вопрос 4-7 (стр. 233-234).
- Решите задачи 2 и 4(стр. 235). Физические характеристики. Низшая карбоновая кислота-это жидкость с резким запахом, которая легко растворяется в воде. С увеличением относительной молекулярной массы растворимость кислоты в воде уменьшается, а температура кипения повышается(таблица 84).
Пеларгоновая кислота(нонановая кислота) высокая кислота, начинающаяся с CH3-(CH2) 7-COOH, представляет собой твердое вещество без запаха, которое не растворяется в воде. Химическое свойство. Общие свойства карбоновых кислот аналогичны соответствующим свойствам неорганических кислот(табл. 86). кроме того, карбоновые кислоты включают、 Таблица 86.
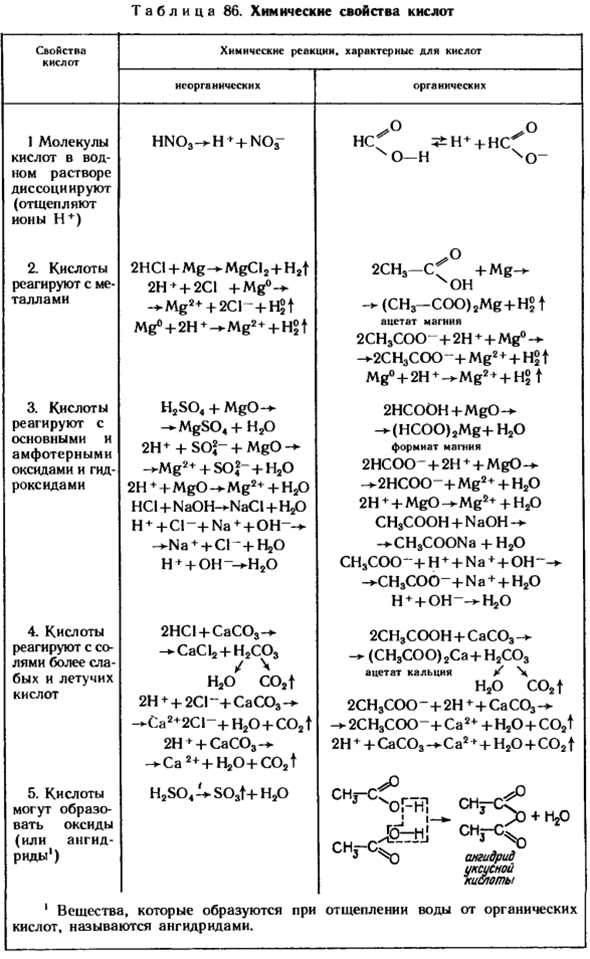
Химические свойства кислот Природа кислот химические реакции, свойственные кислот. Людмила Фирмаль
Неорганический органический Молекулы I кислоты в водном растворе диссоциируют (удаляют ионы H+) HN03 — * — H ’+ N0 ^ „NSG ^ H’ + Hcf 2.Кислоты реагируют с металлами 2HCI + раствор mgcl2 + H2f2h + + 2CI + МД2* + 2CI -> * мг2 * + 2CI — + ч $ т мг°+ 2Н * * Mg2 + для + Ч $ Т 2CH3-(Т + мг- * — НОХ-MCH3-КУ) 2мг + ч? Т ацетата магния 2CH3COO + 2ч♦ + мг° — 2CH3COO — + МД2 + — ф-т ГС, мг° — f2H + ^ МД2 + + + Н5 Т 3.
Реакция взаимодействия кислот с основными и амфотерными оксидами и гидридами, H2SO + MgO — * MgS04 + H20 2H * + S02 “+ Mg0 — * Mg2 + S0?-+ Н20 2Н * + МГО -“ — МД2 * — Л-Ю Нсl + NaOH в-нацмен + ч ^О.►НС+ Ди ^ + ю ч * + о-* ХСО 2HCOOH-Ф МГО-(HC00) 2мг + Н20 магний формиат 2HCOO-+ 2Н ++ МГО-к-►2HCOO_+ МД2 * + Н20 2Н + + МГО МД2 + ю СН3СООН + Nаон — — — СН3 Chcoo „Hcoo“ ч♦ + + + Н20 chco3 „НСО3“ НСО3 „НСО3“ НСО3 „НСО3“ НСО3 „НСО3“ ч♦ НС ♦ На » На «На На На» На » На » На » На » На » На » На » На » На » На » На » На » На» На » НС » ^ + о — ^ ю 4.
Реакция взаимодействия кислот с более слабыми летучими кислотными солями 2HCl + CaC03 — > CaC 12 + H2C03 / Н2®co2t 2H + + 2CI — + CaC03 — * — Ca2 + 2C1 — + Hjo-f C02t 2H + + + CaC03 — » — Ca2 + HaO + COjt 2CHOOOH + 33- * -(CH3COO) 2 + CA03〜 ca2t уксусная кислота 2ch3coo — + 2H + + CA co, — 2ch3coo — + Ca2* + H20 + C02T 2H♦+ Cacos — * Ca2♦+ H20 + C02 F 5.Кислоты могут образовывать оксиды (или ангидриды 1) H2S04 — ^ S03f + H20 c » _c -&!Уксусный ангидрид I3 1. вещество, образующееся при отделении воды от органической кислоты, называется ангидридом.
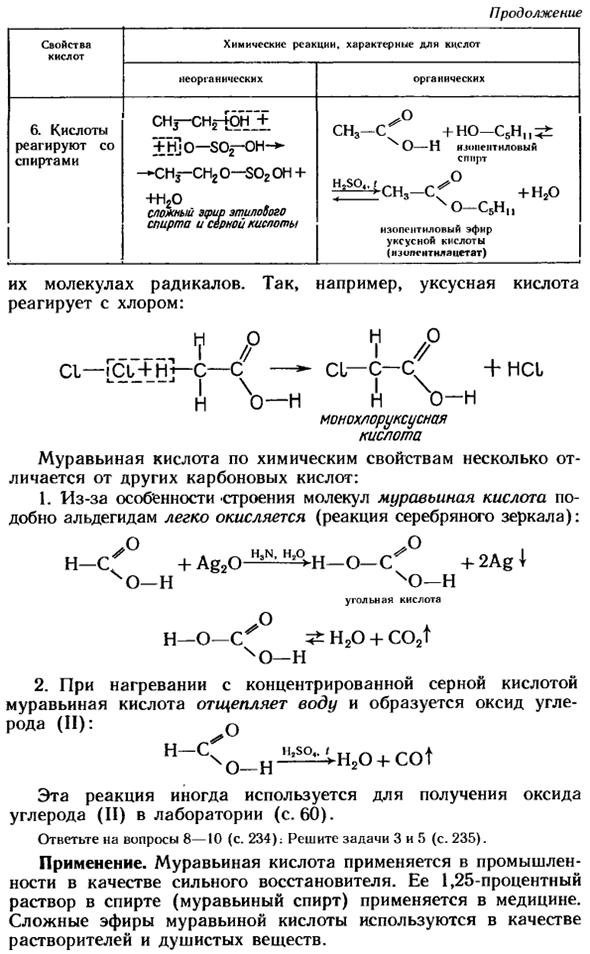
Характер кислотно-химической реакции, характерная длина киселя Неорганический органический 6.Кислота реагирует со спиртом CHj — + ±n] o-SOf-OH — * — cm3-CH2 o — $ o2 he + этиловый спирт и сульфатный эфир CH3-C ^ + HO-C5H-H и гептоиллоиловый спирт 7 * ^ CH3-Cf °2020чо — с5н » изопентилацетатные эфиры (■iopggagac) Те самые радикалы molecules. So например, уксусная кислота вступает в реакцию с хлором. В /°В / С1-Оук + ч — с-с /— СЛ — с-с + НСL * «- — — — Я \ Я \ A o-и A 0-n Монохлоруксусная кислота Муравьиная кислота по своим химическим свойствам несколько отличается от других карбоновых кислот.
1.Благодаря структурной природе молекулы муравьиная кислота, как и альдегид, легко окисляется(реакция серебряного зеркала): H — < ° + Ag20 ^^ H-0 — (/°+ 2Ag 1 4 на Чо-Н Углекислота Ч-О-с ^ Н2О + co2T 4 на 2.При нагревании концентрированной серной кислотой муравьиная кислота расщепляет воду, в результате чего образуется монооксид углерода(II). Ч — <О-Лл ^ Н2О +люлька Эта реакция иногда используется для получения монооксида углерода (II) в лаборатории(стр. 60). Вопрос 8-10 (стр. ответ 234): задачи 3 и 5(стр. 235). Приложение.
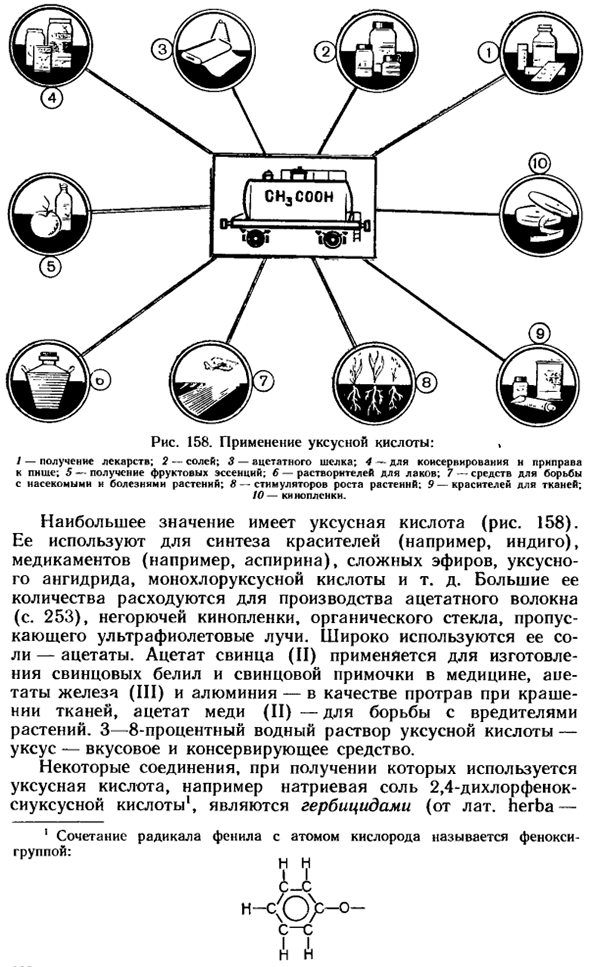
Муравьиная кислота используется в промышленности в качестве сильного восстановителя. В медицине применяют 1,25% раствор спирта(формальдегид).Эфиры муравьиной кислоты используются в качестве растворителей и ароматизаторов. Рисунок 158.Применение уксусной кислоты.
Введение препарата; 2-Соль; 3-ацетат шелка; 4-для записи консервирования и приправы; 5-Наличие фруктовой эссенции. 6-растворитель для лака; 7-средства для борьбы с насекомыми и болезнями растений; 8-стимуляторы роста растений; 9-красители для тканей; 10-кинопленка.
Наиболее важной является уксусная кислота (рис. 158). она используется для синтеза красителей (таких как Индиго), фармацевтических препаратов (таких как аспирин), сложных эфиров, уксусного ангидрида и монохлоруксусной кислоты. Многие из них изготовлены из уксуснокислого волокна (стр. 253), используемого в производстве негорючей пленки, органической glass.
It пропускает ультрафиолетовые лучи. Его Соль, ацетат широко используется. Ацетат свинца (II) используется в производстве свинцовых белых и свинцовых лосьонов в медицине, ацетат железа (III) и ацетат алюминия используются в качестве протравителей при крашении тканей, а ацетат меди (II) используется для борьбы с вредителями растений.3-8%водный раствор уксусной кислоты-уксус-является ароматизатором и консервантом.
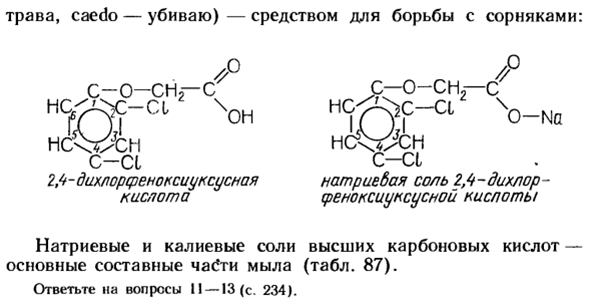
Некоторые соединения, используемые при приготовлении уксусной кислоты, например натриевая соль 2,4-диклофена-1, является гербицидом (лат. Герба- Комбинация 1 фенильного радикала и атома кислорода называется Феноксигруппой: Н. Н. Н. Ага. нс; с-с А. А. Трава, клен-убить) — борьба с сорняками: так-ЗП-с От С-КИ 2 / т-дизеноксикислота Да. 7/7 С—О—СН9—С \ НС ^ с-а C-CL 2,4-дихлорфеноксиуксусная кислота натрия 0-н а Натриевые и калиевые соли высокосортных карбоновых кислот являются основными компонентами мыла(таблица 87) вопрос II-13 (стр. 234).
Смотрите также:
| Альдегиды | Краткие сведения о непредельных карбоновых кислотах |
| Карбоновые кислоты | Сложные эфиры |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.
