Оглавление:
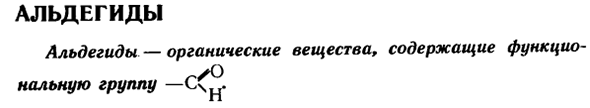







Альдегиды
- Альдегид Органические вещества, содержащие альдегиды и функциональные группы- Мы уже знакомы с некоторыми альдегидами. Например Да. Альдегид муравьиной кислоты, или формальдегид, Н-С сформирован Да. Метанол, альдегид уксусной кислоты, оксидация ацетальдегида, п CH3-Sch-окисление ethanol. In все молекулы альдегида-\ Икс) Группа-С связана с углеводородными радикалами.
- Это-Чн Препарат представляет собой формальдегид, а альдегидная группа в молекуле присоединена к атому водорода. Строение молекулы. Мы уже знаем, что для определения химической формулы органического вещества мы сжигаем небольшое количество органического вещества, а затем проверяем процесс горения products. So например, при сжигании 3,75 г формальдегида получали 2,25 г водяного пара и 5,5 г монооксида углерода.
Установлено, что плотность паров формальдегида по водороду равна 15. Людмила Фирмаль
Используя эти данные, можно увидеть количество углерода и водорода, содержащихся в 3,75 г формальдегида. M (CO2)= 12 + 32 = 44; M = 44 г /моль 44 г CO2, 12 г CO2, 5,5 г CO2″ x { 44: 5.5 = 12: x; x、= 5’5 ^ 12 = 1.5; t ©= 1,5 г M (H20)= 2 + 16 = 18? M = 18 г / моль 18г Н20 содержится 2Г ч 2,25 г Н20 ″ Х2 18: 2.25 = 2: x2; x2 = 2 = 0.25; t (N)= 0.25 g найти общую массу углерода и водорода:+ * 2 = 1.5 + 0.25 = 1.75
Поскольку для сжигания использовалось 3,75 г формальдегида, можно рассчитать массу кислорода. 3.75-1.75 = 2; t (O)= 2 g найти простейшую формулу. С: Ч:0 = ^:^:^ = 0.125:0.25:0.125 = 1:2:1 Поэтому наиболее простой рецептурой исследуемого вещества является СН20. Знать плотность паров формальдегида в водороде, найти его молярную массу: M-2£> n,= 2 * 15 = 30; M = 30 г /моль Найти молярную массу по простейшей формуле. L*(CH20)= 12 + 2 + 16 = 30; M (CH20)= 30 г /моль
Таким образом, молекулярная формула формальдегида CH20. А. М. Согласно положениям теории строения бутрелова, существует только 1 структурная форма, соответствующая этой молекулярной формуле. muleH-рассмотрим электроотрицательность элемента С Хна (H, C, O, I, p.123), заключает, что связи между атомами в молекуле формальдегида должны быть полярными.
Поэтому его электронную формулу следует изобразить следующим образом: И R 49 Н 1С.. ИС Н-Ы \ Н. Н. Н. В молекулах формальдегида существует связь между атомом углерода и атомом водорода, а между атомом углерода и атомом кислорода существуют связи 1 и 1 I (рис.157). Электронная плотность, главным образом I-связь, смещается от атома углерода к электроотрицательному атому кислорода, потому что он является наиболее подвижным.
Ответьте на вопросы I и 2 (стр. 222).Решите задачу I (стр. 223). Гетеросексуальность и номенклатура. Альдегиды характеризуются противоположной изомерией углеводорода radicals. It это либо неразветвленная цепь, либо разветвленная цепь. Название альдегида происходит от исторического названия соответствующей органической кислоты, которая преобразуется в процессе окисления (муравьиный альдегид, уксусный альдегид, пропионатный альдегид и др.).
Международный? Название альдегидов получают от названия соответствующего углеводорода, добавляя суффикс-al%.Пример: Рисунок 157.Образование связей молекул формальдегида. 3 2 1 Н-ку sn3-ы; снз-СН-ср. ч 1 н] н Метанару этанор^Нз 2-metroproanal Мы получили ваш feedback. In в лаборатории альдегиды получают окислением первичных спиртов.
Оксид меди (II), перекись водорода и другие вещества, способные выделять кислород, используются в качестве oxidants. In в общем, это можно показать следующим образом: Р-СН2-о + но-р-с; + Н2О х В промышленности альдегиды получают по-разному ways. It наиболее экономически выгодно получать метанал путем окисления метана непосредственно кислородом воздуха в специальном реакторе: Н Н-С-Н + О2 500 00> Н-с ^°+ Н20 IX катализатор-* н
Смесь метана и воздуха проходит через реакционную зону с высокой скоростью, так что метанал не успевает окислиться. Метанал в промышленности также получают окислением метанола, пропуская его пары вместе с воздухом в реактор раскаленной медной или серебряной сетки. 2CH3on + О2 в промышленных масштабах> 2ч-е /°+ 2H20 ЧН
Однако этот метод экономически менее выгоден. Этанар в промышленности получают гидратацией ацетилена в присутствии солей ртути в качестве катализатора (реакция М. Г. Кучерова):^ H-C = C-H + H2O-5 ^ CH3-C ’ ЧН Недавно был разработан новый способ получения ацетальдегида, поскольку в качестве катализаторов этой реакции используются токсичные вещества-соли ртути: смесь этилена и воздуха проходит через водный раствор солей меди.、
Железо и палладий. Упрощенный процесс может быть представлен следующим образом: /> CH2 = CH2 +0 — ►CH3-C ° с катализатором G1 Вопрос 3-5 (стр. ответ 222 −223).Решите задачи 2 и 3(стр. 223). Физические характеристики. Метаналь-бесцветный газ с резким запахом. Водный раствор метаналь (35-40%) называют формалином. Остальные члены многих альдегидов являются жидкими, а высокосортные альдегиды-твердыми.
Химическое свойство. Альдегиды наиболее характерны для реакций окисления и присоединения. 1.Реакция окисления. 1) высококачественная реакция к альдегиду реакция серебряного зеркала. Для его осуществления в чистую пробирку наливают аммиачный раствор оксида серебра (1), добавляют в него раствор альдегида и нагревают.
Отложения серебра на стенках трубок в виде блестящих покрытий восстанавливаются, а альдегиды окисляются до соответствующих органических кислот. 2) другой характерной реакцией является окисление альдегидов гидроксидом меди (II).Когда раствор альдегида добавляют к синему осадку гидроксида меди (II) и смесь нагревают, сначала появляется желтый осадок гидроксида меди (I).
- При дальнейшем нагревании он превращается в Красную медь (I)Cu20: О, да. R-C ’+ 2Cu (OH) 2-lR-C(+ 2Cu0H + H20 Н-синий, о-желтый 2 CuOH Cu20-f H20 Желто-красный В этой реакции окислителем является медь со степенью окисления+2, а степень окисления снижается до степени окисления+1. 2.Реакция присоединения обусловлена наличием карбонильных групп самосвязей, которые разрываются easily. At место его разрыва, атомы и атомные группы combine.
So например, если вы пропустите смесь метанала и водорода на нагретый катализатор, он будет восстановлен до метанола. Н— + Н2 — — — — * H3C-ой \ _. * Катализатор° л метанола Метаналь. Также добавляют водород и другие альдегиды. Вопрос 6-8 (стр. 223).Задача 4 (стр. 223). 1 Ag20 фактически не растворяется в воде, но вместе с аммиаком образует растворимое соединение (Ag (HsN) 2jOH). Приложение.
Наиболее широко используются метанал и этанал. Людмила Фирмаль
В большом количестве формальдегид используется для получения фенолформальдегидной смолы, которую получают в результате взаимодействия между формальдегид и фенол. Эта смола используется в производстве различных пластмасс. Фенол-пластик, который сочетает формальдегидную смолу с различными наполнителями, называется фенольной смолой.
Фенол-при растворении формальдегидной смолы в ацетоне или спирте получают различные лаки. Когда метанол взаимодействует с мочевиной CO (NH2) 2, он дает мочевинную смолу, из которой получают аминопласт. Микропористые материалы изготавливаются из этого пластика для удовлетворения потребностей электротехники. Метанал также необходим для производства некоторых лекарственных средств и красителей.
Широко используется водный раствор, содержащий 5 месяцев 0,4 дня. d. или 40%, метанальный формалин. Его использование основано на свойствах складывания proteins. So например, в кожевенной промышленности дубильный эффект формалина объясняется коагуляцией белков, в результате чего кожа не затвердевает и не гниет.
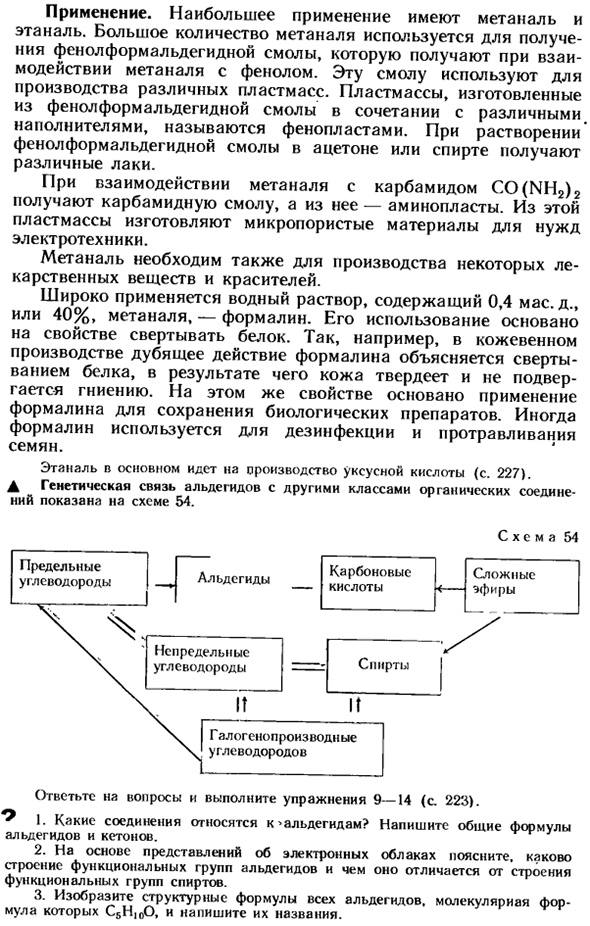
Использование формалина для сохранения биологических продуктов основано на тех же свойствах. Формалин иногда используется для дезинфекции семян и подкормках. Этанар n в основном идет в воду уксусной кислоты(стр. 227). Генетическая связь между D-альдегидами и другими классами органических соединений показана на схеме 54. Образец 54 Отвечая на этот вопрос, выполните упражнение 9-14(стр. 223).
1.Какие соединения связаны с альдегидами? Напишите общую формулу для альдегидов и кетонов. 2.Основываясь на концепции электронных облаков, мы объясним, какова структура альдегидных функциональных групп и чем они отличаются от структуры альдегидных функциональных групп. Ильтов. 3.Опишите структурные формулы всех альдегидов, молекулярная формула которых C5H10O, и напишите их названия.
4.Name вещество со следующей структурной формулой. CH3 ЧС-СН-СНО-СН2-СF СН3 — — — чо-с? Ч «Я \ Н CH3 SI、 5.Создайте формулу реакции, которая может получить альдегиды в лаборатории и в промышленности. 6. 1-пропанол и 2-пропанол создают уравнение реакции окисления. Каковы сходства и различия в молекулярной структуре полученного продукта? 7.Как вы можете доказать двумя способами, что этот раствор содержит альдегиды? Создайте уравнение для соответствующей реакции.
8.Основываясь на структуре функциональной группы, мы объясним, почему реакция присоединения характерна для альдегидов. 9.Пожалуйста, перечислите наиболее важные области применения альдегидов. Какие свойства основаны на использовании? 10.Что такое фенопласт? 11.Создайте уравнение реакции. Вы можете использовать его для выполнения следующих преобразований: CH4 CrH2 CH3-(G-CH3-CH ^ OH-CH8-CH2Bg + QH CH3-CH2OH-CH3-C ^ Ч?- Ч-с ^ — СН3ОН-CH3C1-Н-C2He-в? — QHsOH -? — СН3-С ^ N3H
12.Напишите формулу и название спирта, альдегида и кислот, полученных из Формулы метана, этана, пропана, с-Бутана, с-пентана и гексана. 13.In в соответствии с рисунком 54, материал используется для создания соответствующих уравнений химической реакции. 14.Составьте резюме ответов, характеризующих метанал и этанал(I. p. 43). № 1.
При сжигании 7,5 г органического вещества образуется 4,5 г водяного пара и 11 г окиси углерода (IV).Если вы знаете, что плотность паров в водороде равна 15, найдите молекулярную формулу и назовите это вещество. 2. 2 моль метанола окисляли и полученный метанал растворяли в 200 г воды. Рассчитать процент формальдегид в растворе.
3. Если вы хотите получить раствор с массовой долей 0,4 или 40%, какое количество воздуха необходимо для окисления метанола? 4.При окислении этанара выделялось 2,7 г серебра. Требуемая масса этанара (n. A. вычислить количество ацетилена (объем и масса), необходимое для получения а). Лабораторные опыты Производство этанола путем окисления этанола. Налейте 0,5-1 мл этанола в пробирку и замочите раскаленную спираль из меди wire.
It обладает специфическим запахом, а медная проволока приобретает глянцевые свойства металлической меди. Задача. Какие вещества образуются в этом эксперименте? Напишите уравнение соответствующей реакции. Окисление метаналь (этаналя) оксидом серебра (я).Промойте трубку thoroughly. To сделайте это, влейте в него концентрированный раствор оксида натрия, нагрейте его в течение нескольких минут и доведите до кипения.
Затем влить гидроксид натрия и промыть его несколько раз дистиллированной водой. Чистый. 5.вновь приготовленный раствор, содержащий 0,02 мес 2 мл, выливают в пробирку. d. или 2% AgNOs, и растворяют осадок, который появился первым, капая в него разбавленный раствор аммиака. К полученному раствору добавляют несколько капель раствора метанала или этанала. Положите трубку в горячую воду.
На стенках трубки образуется осадок металлического серебра. Окисление метанала (этанала) гидроксидом меди (II). Налейте 1 мл (раствор этанола) в пробирку и добавьте 5 мл раствора, содержащего 0,02 1 месяц. d. раствор, содержащий, или 2%, CuSO -, и 0,1. d. или 10% NaOH. Нагрейте полученную смесь. Образуется синий студенистый осадок. При нагревании осадок растворяется, и жидкость становится желтой, затем Красной.
Задача. 1.Что образуется при окислении альдегидов? Как отличить альдегиды от других органических веществ? 2.Почему взаимодействие альдегидов с гидроксидом меди (II) выглядит желтым, а затем красным? Напишите уравнение соответствующей реакции.
Смотрите также:
| Многоатомные спирты | Карбоновые кислоты |
| Фенолы | Одноосновные предельные карбоновые кислоты |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.
