Оглавление:




Фенолы
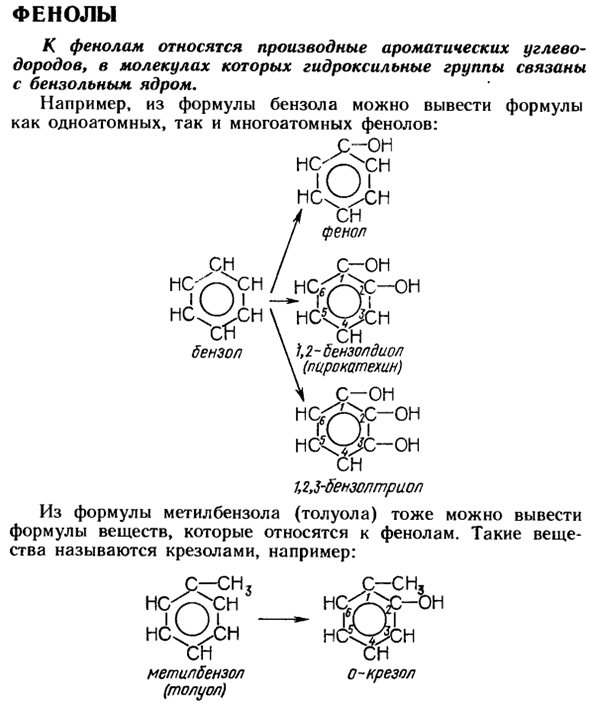
Фенолы Фенол содержит производные ароматических углеводородов, а гидроксильная группа в молекуле присоединена к ядру бензола. Например, из уравнения бензола можно вывести как одноатомные фенольные, так и многоатомные фенольные выражения. К-ОУ S J1 MCV ^ CM SI фенол См / С-он НС ^ СН в ХК ^ ихъ Бензол\ 1,2-бензендиол (катехол) С-он MCij ^ С-О ХК ^ ЙК-ой СИ Магбензол, Рио.
Из Формулы метилбензола а (толуола) может быть также получена формула вещества, относящегося к фенолу. Такое вещество называется крезол, например: С-СИ С-СИ」 новый Южный Уэльс НБС ^и- СИ Метилбензол (толуол) Производные ароматических углеводородов, содержащие гидроксильные группы в боковой цепи относятся к ароматическим спиртам.
Так, например, из Формулы метилбензола можно вывести формулу ароматического спирта (бензилового спирта). Людмила Фирмаль
Бензиловый спирт Химические свойства ароматических спиртов аналогичны одновалентным насыщенным спиртам. Фенол имеет практическое значение. Фенол. Строение молекулы. Молекула фенола содержит бензольное ядро(стр. 185).Если мы выведем 1 атом водорода из уравнения бензола, то получим группу атомов, называемых фенильными радикалами-C6H5.
В отличие от насыщенных углеводородных радикалов (СН3—, С2Н5-и др.), фенильный радикал C6H5-обладает свойством слабо притягивать электроны атома кислорода гидроксила group. So в молекулах фенола химическая связь между атомом кислорода и атомом водорода становится более полярной, а атом водорода становится более подвижным и реактивным. Мы получили ваши отзывы.
Мы уже знаем, что фенол отделяется от каменноугольной смолы(стр. 197).Однако потребность в феноле настолько велика, что этого источника недостаточно. Для получения фонола был разработан синтетический метод.1 из них выполнены по схеме С6Н6-*С6Н5С1С6Н5ОН Атомы галогена с бензольным ядром связаны более прочно, чем насыщенные углеводородные радикалы, поэтому замена их гидроксильной группой требует более жестких условий. СМ-О Н < ^ > Ч 10 I + NaCl НСО-оСНСН давления Хлорбензол Толуол СИ Сресенор.
Но этот метод является относительно дорогим economically. In в нашей стране разработаны более дешевые методы получения фенолов из бензола. Они рассматриваются в специальных курсах органической химии. Вопрос 1-3 (стр. 216). Физические характеристики. Фенол представляет собой бесцветное кристаллическое вещество с характерным запахом. Его температура плавления составляет 40,9°C.
In в холодной воде он растворяется незначительно, но уже при 70°С в какой-то форме. Фенол токсичен! Химические свойства фенола обусловлены наличием гидроксильных групп и ядер бензола, которые взаимно влияют на молекулу. Наличие гидроксильной группы определяет сходство фенола и спирта (таблица 83).Влияние ядра бензола на гидроксильную группу определяет большую подвижность ее водорода atom.
So, в отличие от спирта, фенол реагирует со щелочью(таблица 83).То есть, он имеет слабую кислоту properties. It иногда его называют углеводной кислотой. Это объясняется тем, что бензольное ядро притягивает к себе электроны атома кислорода гидроксила group. To компенсируя это, атом кислорода притягивает электронную плотность от атома водорода к электрону. itself.
As в результате ковалентная связь между атомами кислорода и водорода становится более полярной, а атомы водорода становятся более mobile. In в свою очередь, гидроксильная группа увеличивает подвижность атома водорода в положениях 2, 4 и 6.Это один из примеров 1, который подтверждает правильность теории АМ. Маслоров о взаимном влиянии атомов в молекуле. Таблица 83
Химические свойства фенола Гидроксильная группа с бензольным ядром 1.Характеристики, аналогичные характеристикам спирта: 2cehsoh + 2Na -> — 2ceh6ona + h2t фенолат натрия 1.Реакция бромирования: 2,4, B-trybolf 2.Характеристики, отличные от характеристик алкоголя: SbH5ON + NaOH — * CeH5ONa 4-H20 2.Реакции нитрования: наиболее важные химические свойства C-on-on — g,*> / — trhstrsphenol фенола приведены в таблице 83.
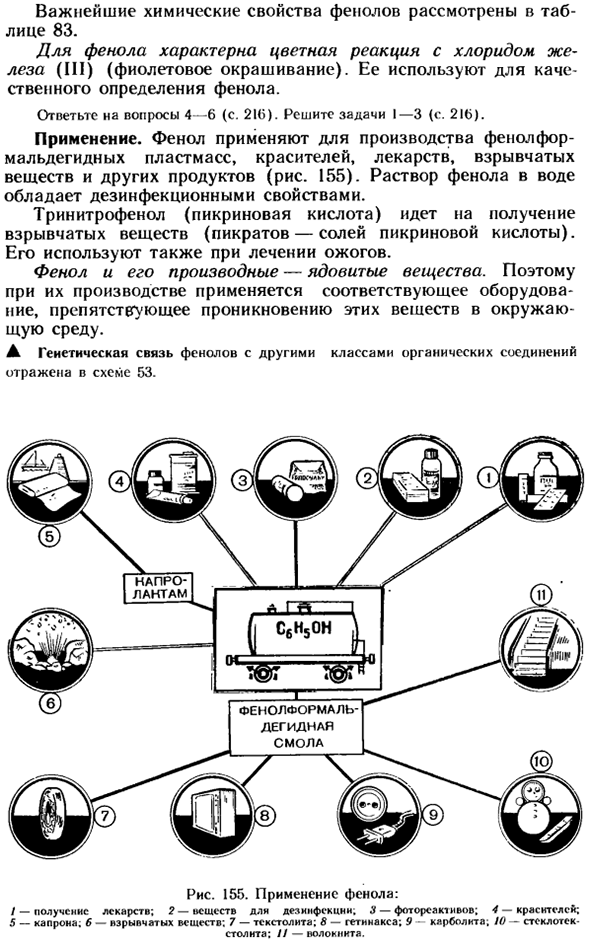
Фенол характеризуется реакцией окрашивания с хлоридом железа (III) (фиолетовый). он используется для качественного анализа фенола. Вопрос 4-6 (стр. 216).Решите задачу 1-3(стр. 216). Приложение. Фенол используется в производстве фенолоальдегидных пластиков, красителей, лекарственных препаратов, взрывчатых веществ и других изделий(рис.155).
Водный раствор фенола обладает дезинфицирующими свойствами. Тринитрофенол (пикриновая кислота) используется в производстве взрывчатых веществ (пикрат-пикрикаты), а также для лечения ожогов. Фенол и его производные являются токсичными веществами. Именно поэтому в производстве используется соответствующее оборудование для предотвращения проникновения этих веществ в окружающую среду.
- Генетическая связь между фенолом и другими классами органических соединений отражена на схеме 53. Рисунок 155.Применение фенола: / — доступность препарата. 2-вещества для дезинфекции. 3-световой реагент; 4-краситель; 5-капрон. 6-взрывчатые вещества; 7-тексолит; 8-гетинакса; 9-Карболит; 10-стекловолокно. Рисунок 53
Предельные углеводороды Ненасыщенный углеводород Ароматический углеводород Галогенированные ароматические углеводороды \ Выполните упражнения 7-9. Да. * Нарисуйте структурную формулу от 2 до 3 представителей, принадлежащих: а)фенолу; б) ароматическому спирту.
1.Какие вещества представляют собой фенолы и ароматические спирты? Людмила Фирмаль
2.Он создает электронную формулу фенола и объясняет, почему атомы водорода гидроксильных групп чаще двигаться, чем в молекулах одноатомных спиртов. 3.Напишите формулу реакции, которая позволит вам получить фенол. 4.As в результате каких экспериментов можно проверить, что группы атомов в молекуле фенола (гидроксильные группы и бензольные ядра) взаимодействуют друг с другом?
Напишите уравнение соответствующей реакции. 5. 2,4,6-тринитрофенол и 2,4,6 — как трихлорфенол происходит от фенола? Создайте уравнения для этих реакций. 6.Раствор фенолятов натрия становится мутным по причине: а) с добавлением соляной кислоты. Б) если монооксид углерода (IV) прошел через соответствующее уравнение реакции.
7.Создайте уравнение реакции, которое может выполнять следующие преобразования: а) SI4 C2H2 QHe CBH5OH 2, 4, 6-трибромофенол b * CH4-C2H6 Cjl 18 C6H, пикриновая кислота 4 * * CbH6 8.In в соответствии со схемой 53, опишите соответствующее уравнение химической реакции с использованием материала для генетического связывания.
9.Напишите резюме ответов, характеризующих фенол(I, стр. 43). Я не уверен. Раствор, содержащий фенол 0,1 моль, подвергался воздействию избытка проглоченной бромной воды. Какие вещества и количества образовались? 2.Фенол 4,7 г сжигали, а полученный монооксид углерода (IV) пропускали через избыток раствора гидроксида кальция. Сколько граммов карбоната кальция образовалось?
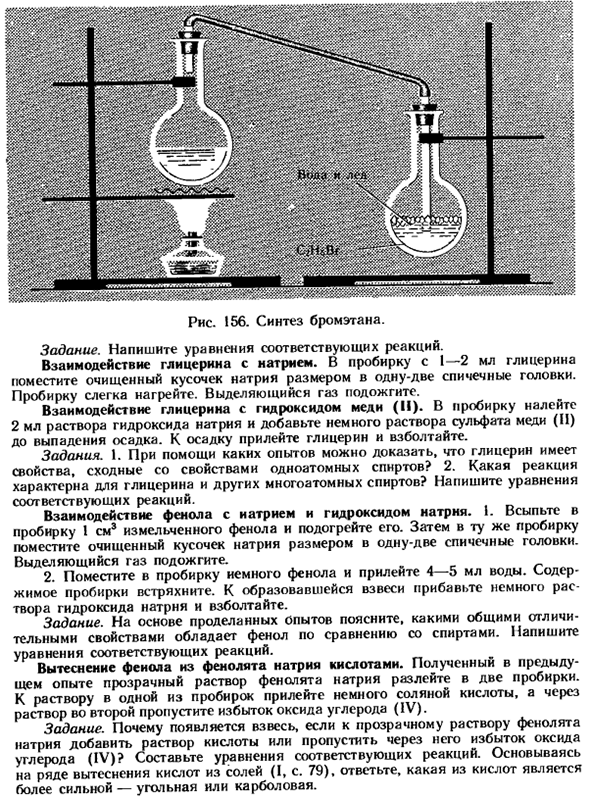
3.Рассчитайте количество брома в растворе, если осадок в 24 г выпал при воздействии избытка фенола. Лабораторные опыты Взаимодействие этанола и бромистого водорода. Изготавливают устройство по фиг 156 и получают бромэтан при взаимодействии этанола с водородом bromide. To для этого осторожно влейте 3 мл этанола и концентрированную кислоту H2S04 в колбу объемом 50 мл.
После того как смесь остынет, капните 3 мл воды, добавьте 5 г бромида калия или натрия, закройте колбу пробкой в холодильнике и опустите конец в колбу со смесью льда и воды. Во время реакции контролируют конденсацию паров бромэтана в холодильнике. Когда маслянистые капли больше не поступают в приемник, он перестает нагреваться. Содержимое приемника выливается в воронку сепаратора и жидкость осаждается.
Затем отделяют нижний слой бромоэтана, добавляют воду, встряхивают и снова вливают в распределительную воронку. После отстаивания бромэтан снова отделяют. Рисунок 156.Синтез бромоэтана. Задача. Напишите уравнение соответствующей реакции. Взаимодействие глицерина и натрия. Поместите 1-2 мл очищенного натрия в 1 или 2 кусочка размером со спичечный коробок в пробирку, содержащую глицерин.
Нагрейте трубку немного. Воспламените выделившийся газ. Взаимодействие глицерина и гидроксида меди (II). Налейте 2 мл раствора гидроксида натрия в пробирку и добавьте небольшое количество раствора сульфата меди (II) до образования осадка. Влейте глицерин в осадок и встряхните. Задача. 1.Каковы эксперименты, которые могут доказать, что глицерин похож на свойства моногидриколя?
2.Каковы характерные реакции глицерина и других многоатомных спиртов? Напишите уравнение соответствующей реакции. Взаимодействие фенола с натрием и гидроксидом натрия. 1.Налейте измельченный фенол на 1 см3 в пробирку и нагрейте его. Затем поместите очищенные кусочки натрия в ту же пробирку размером 1 или 2 спичечных головки. Воспламените выделившийся газ.
2.Небольшое количество фенола помещают в пробирку и добавляют 4-5 мл воды. Встряхните содержимое тюбика. Добавьте небольшое количество раствора гидроксида натрия в полученную суспензию и встряхните ее. Задача. На основании проведенных экспериментов охарактеризуйте общие характеристики фенолов по сравнению со спиртом. Напишите уравнение соответствующей реакции. Замещение фенола из фенолата натрия кислотой.
Прозрачный раствор фенолата натрия, полученный в предыдущем эксперименте, разливают в 2 пробирки. Налейте небольшое количество соляной кислоты в 1 раствор пробирки и пропустите избыток оксида углерода (IV) через 2-й раствор. Задача. Почему суспензия появляется при добавлении кислого раствора к прозрачному раствору фенолятов натрия или при пропускании через него избытка монооксида углерода (IV)?Создайте уравнение для соответствующей реакции. Основано на замещении ряда кислот из солей (I, с. 79), какая кислота сильнее-угольная или углеводная.
Смотрите также:
| Одноатомные предельные спирты | Альдегиды |
| Многоатомные спирты | Карбоновые кислоты |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.
