Оглавление:







Одноатомные предельные спирты
- Одновалентный насыщенный спирт Структура проекта molecule. In в молекуле Алкана мы уже знаем, что атом водорода может быть заменен атомом галогена(стр. 152). в связи с этим возникают проблемы arise. Is можно ли заменить атом водорода Алкана он-гидроксильной группой? Как это можно сделать?
- Для этого сначала получают галогеновые алканы, а затем воздействуют на них гидроксидом серебра (I)! СН4 — ^ СН3С1 -^.СНз-ОН 4lightl Метиловый спирт СН3-СН3 — ^ СН3-СН2-сі — ^ ISN3-СН2-он Этиловый спирт Таким образом, алканы могут быть фактически преобразованы в соответствующие им моногидрические спирты (включая 1 гидроксильную группу).
Наличие гидроксильных групп в молекуле спирта может быть доказано и в другом случае way. Людмила Фирмаль
As в качестве примера рассмотрим, как экспериментально определить структуру молекулы этилового спирта. Элементный анализ этилового спирта показал, что он состоит из: углерода с-0,5217 5 месяцев. d. кислород O ^ 0.3478 5 мая. д. и водород Н-0,1305 5 мес. е. плотность паров этилового спирта по водороду 23.Эти данные могут быть использованы для получения молекулярной формулы этилового спирта.
Г. и Р \ _ 0.5217 0.1305. 0.3478 _ \ 2〜 ’1′ 16 ~~~ = 0.0435:0.1305:0.0217 = 4.35:13.05:2.17 = 2:6:1 Итак, самая простая формула для этилового спирта-C2H60.Определите молярную массу этилового спирта, используя относительную плотность водорода. M = 2Dna = 2.23 = 46 M (C2H60)= 46 г / моль Вывод: самой простой формулой для этилового спирта является его молекулярная формула. А. М.
Согласно структурной теории Бутлерова, этой формуле соответствуют 2 структурные структуры. N N N N N N N н-с -<!:- О(я)н-так-с-н(второй) П н н н н н н н Проблема заключается в следующем: какая структурная формула соответствует структуре молекулы этанола? На основании теории, что молекулярная структура определяет свойства вещества, в молекуле вещества, структура которой соответствует исходной структурной формуле, 1 атом водорода связывается с атомом кислорода.
Эта химическая связь более полярна (ближе к ионной связи), чем химическая связь между углеродом и водородом atoms. By по аналогии с кислотами, ожидается, что атом водорода, который присоединен к атому кислорода, будет заменен атомом металла. Этот эксперимент доказывает, что этанол действительно вступает в реакцию с активным металлом. В нормальных условиях 11,2 литра водорода заменяют на 46 г этилового спирта.
То есть B-часть общего количества водорода, присутствующего в 1-Моле этила alcohol. By это、 Н. Н. Н. Выражение H-U-o-H является истинным выражением 14 Н В Что я должен сказать своему врачу, прежде чем принимать это лекарство? 2-й структурный выражение H_C_O_C_H. Н. Н. Н. Соответствует другому веществу-D и метиловые эфиры не вступают в реакцию с металлами.
Электронная формула этилового спирта представлена следующим образом: Н. Н. Н. Ч: с: с: б: ч•••••• Н. Н. Н. Из электронной формулы видно, что 1 из химических связей между атомами кислорода и водорода также очень полярна по отношению к молекуле спирта (как и в молекуле воды). Как кислород образует химическую связь с углеродом или водородом?
Для этого вспомните энергетический уровень и расположение электронов атома кислорода на подуровнях. Ис2 2s2 2р * О QT] [th] |и 11 I Валентные электроны образуют 2 гантелеобразных электронных облака, перпендикулярных друг другу.1 из них перекрывает гибридное облако атомов углерода, образуя химическую связь между атомом углерода и атомом кислорода (- C-O -).2-е облако, перпендикулярное первому облаку, покрыто s-электронным облаком водорода atom.
As в результате перекрытия электронного облака возникает дисбаланс в распределении электрона density. In молекулы этанола, угол между валентным электронным облаком атома кислорода достигает 110°: Другие молекулы спирта 1-валентности также имеют приблизительно то же самое angle. In молекулы воды, она становится чуть меньше-около 105°. Исходя из анализа структуры молекулы, спиртам можно дать следующее определение:
Спирт является производным углеводорода в молекуле, в которой более 1 атома водорода замещено гидроксильной (гидрокси) группой. Гидроксильная группа-OH является функциональной группой спиртов. Функциональные группы-это группы атомов, которые определяют свойства и химические свойства определенного класса веществ. Общая формула для одноатомных спиртов-SlNglchYUN. +8 Ответит на вопрос 1-4 (стр. 208).
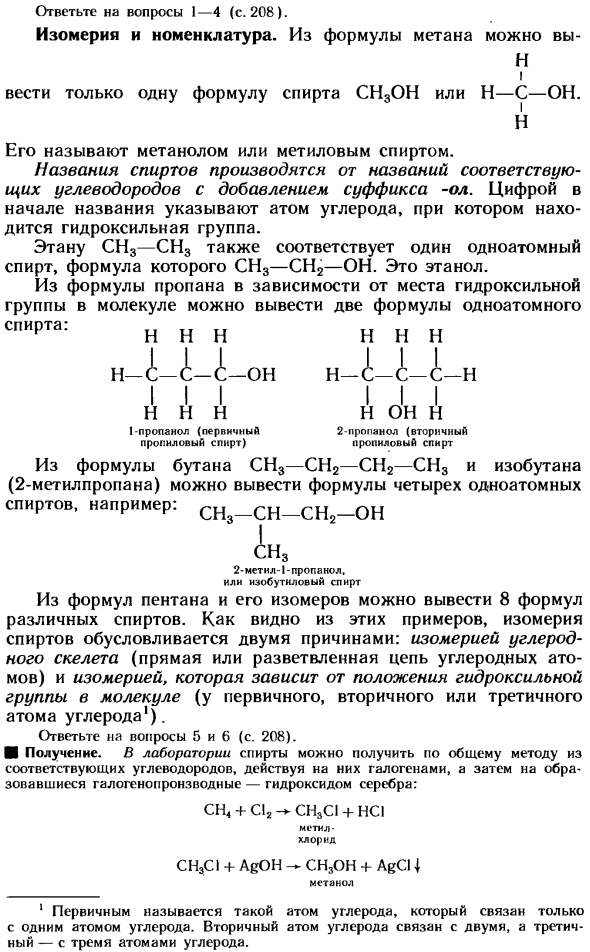
Гетеросексуальность и номенклатура. Из выражения метана можно Н Я Держите только 1 спирт CH3OH или H — C — OH. Н Он называется метанол или метиловый спирт. Название спирта происходит от названия соответствующего углеводорода, добавляется суффикс-ол. Число в начале названия указывает на атом углерода, в котором находится гидроксильная группа.
Этан CH3-CH3 соответствует 1 одновалентному спирту, формула которого CH3-CH2-OH. Это этанол. Из Формулы пропана, в зависимости от расположения гидроксильной группы в молекуле, 2 Формулы одноатомных Алкоголь: н н н н н н н Н-А-А-А-А-О! Болезнь н н н н н он Н 1-пропанол (первичный 2-пропанол (вторичный Пропиниловый спирт) пропиловый спирт
- Из выражения СН3-СН2-СН2-СН3 и изобутана (2-Метилпропана) Бутана можно вывести выражение 4 моноспиртов. Например, ч, — ч, — ч, — о H3 2-метил-1-пропанол, или нзобутиловый спирт Из Формулы пентана и его изомера можно вывести 8 формул различных alcohols. As как видно из приведенных примеров, изомерия спирта обусловлена 2 причинами: изомерией углеродного скелета(линейная или разветвленная цепь атомов углерода) и изомерией (1-й, 2-й или 3-й атомы углерода
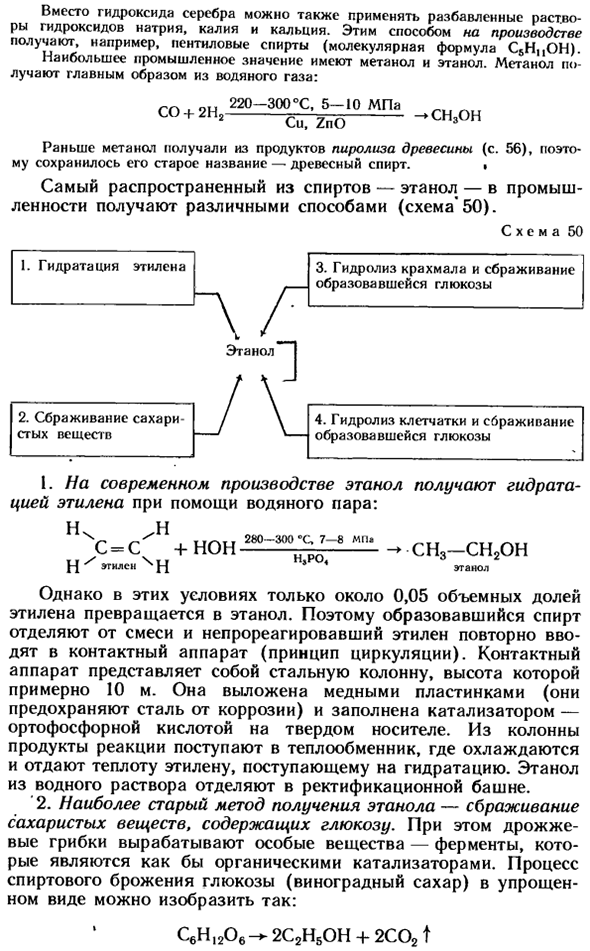
1), которая зависит от положения гидроксильной группы в молекуле. Ответьте на вопросы 5 и 6 (стр. 208). ■ Reception. In в лаборатории, согласно общепринятым методам, спирт получают из соответствующих углеводородов, после чего на них воздействует галоген, а затем полученное склонное к галогенам производное воздействует гидроксидом серебра. СН4 + С12 CH3C1 + ТХП Метилхлорид CHgCl + AgOH-CH3OH + AgCI \
Один 1 первичный атом углерода, который связан только с 1 атомом углерода. Людмила Фирмаль
Вторичные атомы углерода связаны с 2, а третичные атомы углерода — с 3 атомами углерода. Вместо гидроксида серебра можно также использовать разбавленный раствор натрия, калия и кальция gendroxine. In таким образом, например, получают пентиловый спирт (молекулярная формула C5H, OH). Наиболее важными в промышленности являются метанол и этанол.
Метанол в основном получают из водного газа. со + 2Н! н0-30 ^ −10мпа ^ CHzone Ранее метанол использовался в качестве продукта термического разложения древесины(с. 56), а его старое название-древесный спирт-сохранилось. 」 Этанол, наиболее распространенный спирт, получают в промышленности различными способами (Схема * 50). Рисунок 50 И.
В современном производстве, этанол, полученный путем гидратации этилена водяным паром. Н «С = С» ч + хох _. sn3-sn2on это хорошая вещь. / H * 1 HtrUa 1-1″ WUIIKU ^ 1-1 ″ тип Но в этих условиях только около 0,05 объемной доли этилена превращается в этанол. Таким образом, образовавшийся спирт отделяют от смеси, а непрореагировавший этилен вновь вводят в контактное устройство(принцип циркуляции).
Контактное устройство представляет собой стальную колонну высотой около 10 м, облицованную медными пластинами (она защищает сталь от коррозии) и заполненную фосфорной кислотой-катализатором на твердой подложке. Из колонны продукты реакции поступают в теплообменник, где они охлаждаются и тепло передается этилену, который поступает в гидрат.
Этанол из водного раствора отделяют в дистилляционной колонне. 2.Старейшим способом получения этанола является ферментация сахарных веществ, содержащих glucose. At в то же время дрожжи вырабатывают особые вещества-ферменты, подобные органическим катализаторам. Процесс алкогольного брожения глюкозы (глюкозы) в упрощенном виде можно представить следующим образом: C6Hi206 + 2C2H50H + 2C02T
Этот процесс происходит при производстве вина. 3.После этого из крахмалистого продукта стали получать этанол. Согласно этому способу крахмал при гидролизе в присутствии ферментов превращается в глюкозу, из которой при брожении образуется спирт. 4.Из древесины получается значительное количество этанола-гидролиз волокон и ферментация полученной глюкозы.
Около 1 тонны сухих опилок может производить около 200 литров этанола. Такое же количество спирта получается из 0,7 тонны зерна или 1,5 тонны картофеля. Ответьте на вопросы 7 и 8 (стр. 208). Физические характеристики. Одноатомное ограничение с короткой цепью атомов углерода спирт первого сорта-это жидкость, самый высокий(начиная с С12Н25ОН) — это solid.
As молекулярная масса спирта увеличивается, температура кипения increases. In по сравнению с соответствующими углеводородами, температура кипения спирта значительно выше. Это можно объяснить образованием особого вида химических связей, называемых водородными связями. Водородные связи образуются как между молекулами спирта (а), так и между молекулами спирта и молекулами воды (б). Р-Р-Р-О-Х ХШ.> 0-H ^ H ..> 0-ч (6+)(6-)(6+)(6-)А Б
В молекулах спирта и воды водородные связи образуются за счет свободных электронных пар кислорода atoms. An атом кислорода может взаимодействовать с атомом водорода другой молекулы, имеющим небольшой положительный заряд. Прочность водородной связи составляет около 10/1 от нормальной ковалентной связи.
Связывание (связывание) молекул в результате образования водородных связей является причиной того, что спирт кипит при гораздо более высокой температуре по сравнению с соответствующим углеводородом. < Метанол, этанол и пропанол в воде растворяются в неограниченных количествах. Растворимость других гомологов значительно ниже.
Высококачественный спирт (начиная с 230230H) практически не растворяется в воде. Метанол, этанол и и-пропанол имеют характерный алкогольный запах, а родственные вещества, которые следуют за ними, имеют сильный запах, а также неприятный запах. Высококачественный алкоголь не имеет запаха. Метанол (метиловый спирт) CH3OH является высокотоксичным!
Даже небольшое его количество может вызвать слепоту или даже стать смертельным. Химическое свойство. 1.Одноатомный спирт не является ни ярко выраженным щелочным, ни кислым. Водный раствор спирта не влияет на показатель. 2.Спирт, как и вода, вступает в реакцию с активным металлом.
Например, при взаимодействии натрия и этанола с водой образуется этоксид натрия и выделяется водород. 2CH3-CH2-OH + 2Na 2CH3-CH2-ONa + H2t Этанол Ethyrate натрия в воде гидролизуется: CH3-CH2-ONa + HOH ^ CH3-CH2-OH + NaOH Равновесие сильно смещается вправо. 3.В присутствии концентрированной серной кислоты, спирт реагирует с галогеноводородными кислотой с образованием галогенированных углеводородов. CH3-OH + H-Cl I ^ CH3Cl + H2O
Метанол, метил Хлорид 4.In в присутствии водорастворимых веществ, при высоких температурах, вода отделяется от молекулы спирта, и образуются ненасыщенные углеводороды. Н3С—СН2—ОН « Т40’с>Н2С=СН2+Н20 ° ’HjSO» конц * Этилен Если спирт избыточен и температура низкая, то получается эфир. СН3СН2ОН+НО-СН2-СНз1^^Г sn3-СН2-о-СН2-sn3 +номера Диэтиловый эфир 5.Одноатомных спирты сравнительно легко окисляются.
В этом случае образуются альдегиды. Например, нагрев медных спиралей, покрытых оксидом меди (II), до этанола приводит к тому, что спирали становятся блестящими и имеют неприятный запах, характерный для ацетальдегида. Н. Н. Н. н-ы-так + н + х cn3 для ЦУО — + КР + Н20 II ЧН Н. н. Н. Этанол в воздухе горит голубоватым пламенем: С2НБОН + 302 — * 2С02+ЗН20
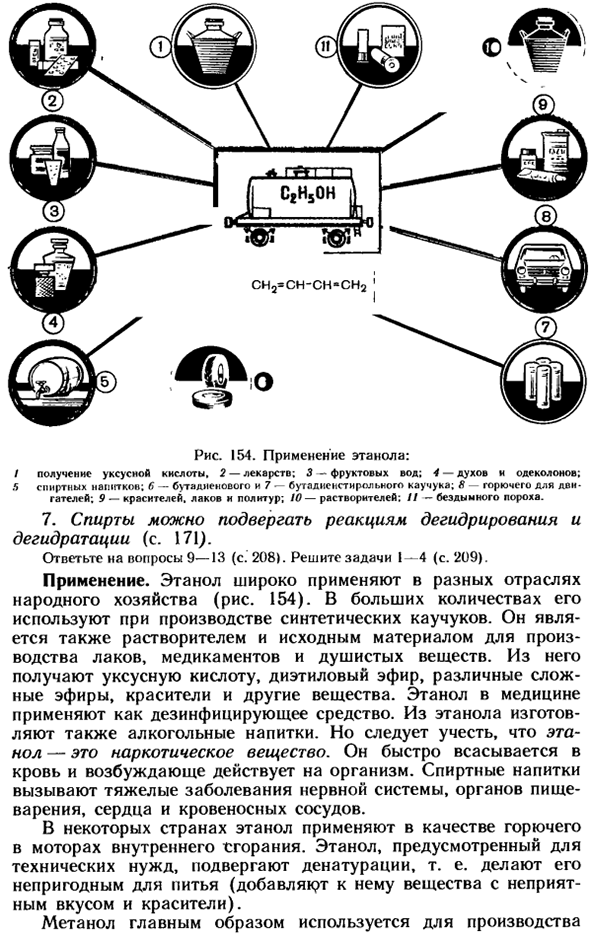
6.Спирт реагирует с кислотой с образованием сложного эфира(стр. 237.): О ЧГ-Ср + Н-О-СН2-СН3 = Р ^ СН3-БФ + хох ^ gch2- Уксус этанол этиловый эфир Уксусная кислота Т II-з —, 22-13 ^— в>Г1z-в ^. О-О-Ч, — СН、 Рисунок 154.Применение этанола: наличие/отсутствие уксусной кислоты. 2-лекарственные препараты; 3-фруктовая вода; 4-спирты и одеколоны; 5-алкогольные напитки; б-бутадиеновый каучук; 7-стиролбутадиеновый
Каучук; 8-моторное топливо. 9-красители, лаки, полироли; 10-растворители; II-бездымный порошок. 7.Алкоголь может подвергаться реакциям дегидрирования и дегидратации(стр. 171). Ответ на вопрос 9-13(стр. 208).Решение задачи I-4 (стр. 209). Приложение. Этанол широко используется в различных отраслях народного хозяйства(рис.154). в больших количествах он используется в производстве синтетических rubber.
It также является растворителем и исходным сырьем для производства лаков, лекарственных препаратов, ароматизаторов. Из него получают уксусную кислоту, диэтиловый эфир, различные сложные эфиры, красители и другие вещества. Этанол используется в медицине в качестве дезинфицирующего средства. Алкоголь также производится из этанола.
Однако следует отметить, что этанол является наркотическим средством substance. It быстро всасывается в кровь и стимулирует работу организма. Алкогольные напитки вызывают тяжелые заболевания нервной системы, органов пищеварения, сердца, сосудов. В некоторых странах этанол используется в качестве топлива внутреннего двигателя X: Gorania.
Этанол, исходя из технических потребностей, делает его непригодным для денатурации, то есть для питья(добавления веществ и красителей с неприятным вкусом). Метанол в основном используется в производстве СН2 ″ СН-СН-СН2 Формальдегид, определенный medicines. It также используется в качестве растворителя для лаков и красок. Пентиловый спирт используется в производстве сложных эфиров, его используют в парфюмерии.
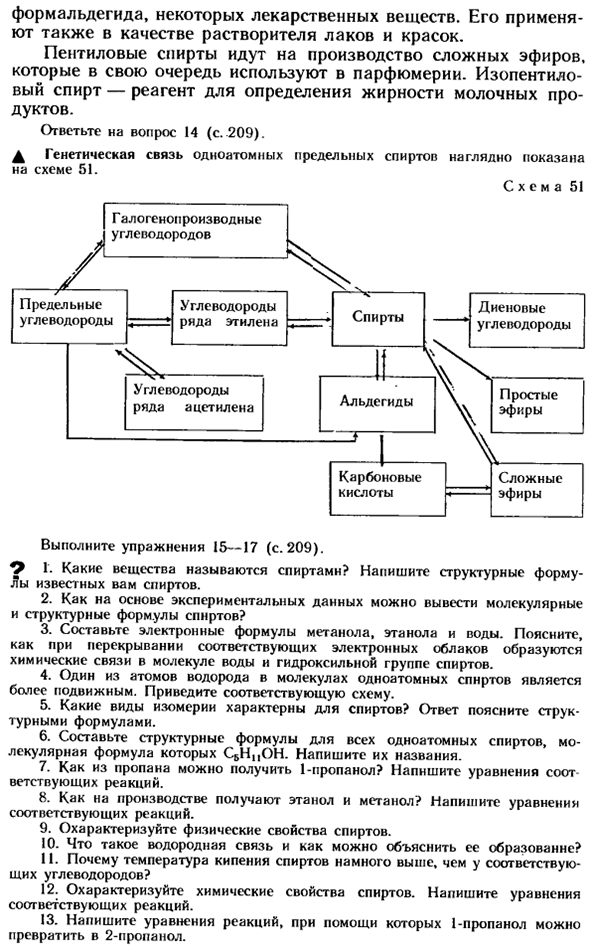
Изопентиловый спирт является реагентом для измерения содержания жира в молочных продуктах. Ответьте на вопрос 14 (стр. 209). ^ Генетическое родство одновалентного насыщенного спирта ясно показано на схеме 51. Образец 51 Выполните упражнения 15-17(стр. 209). ^ 1.Что такое вещество под названием алкоголь? Запишите структурную формулу известного вам алкоголя. 2.Как можно вывести молекулярную и структурную формулу спирта из экспериментальных данных?
3.Создайте электронную формулу метанола, этанола, и water. It объясняет, как образуются химические связи в гидроксильных группах молекул воды и спиртов, когда соответствующие электронные облака перекрываются. 4.1. один из атомов водорода в молекуле одновалентного спирта более мобильным. Покажите соответствующую диаграмму.
5.Что характерно для противоположного пола при употреблении алкоголя? Объясните ответ в структурной формуле. 6.Создайте структурную формулу для всех одновалентных спиртов, молекулярная формула которых QH, OH. Пожалуйста, напишите свое имя. 7.Как я могу получить 1-пропанол из пропана? Напишите уравнение соответствующей реакции. 8.Как производится этанол и метанол в производстве? Напишите уравнение соответствующей реакции.
9.Объясните физические свойства алкоголя. 10.Что такое водородная связь и как можно объяснить ее образование? P. почему температура кипения спирта намного выше, чем у соответствующего углеводорода? 12.Объясните химические свойства спирта. Напишите уравнение соответствующей реакции. 13. 1-напишите формулу реакции, которая может преобразовать пропанол в 2-пропанол. 14.Что пользы метанола и этанола?
15.Создайте уравнение реакции, которое может выполнять следующие преобразования: а)CH4 CH3-CH3-v CH3-CH2-OH — >CH3-CH3 Г»СН3—СНа—ОН-СН2″ =СН2-СН3-СН3-«-СН3— CHJ успешно — ки? СН,-С^ Ли. в)СН3-СН2-о -►?- *- (- СН2-СН-СН2-СН2 -) я d)CaCO3 CaC2-C2H2 CH3-CH2-OH CH3-CH2-CI CH2 » CH2 16.In в соответствии со схемой 51, используют материал по генетическому сцеплению для создания соответствующего уравнения реакции.
17.Составьте сводку ответов, характеризующих метанол, этанол и I-пропанол(I, стр. 43). № 1. Количество воздуха, необходимое для сжигания 1 литра метанола (Р = 0,80 г / см3) 2. Монооксид углерода (IV), образующийся при брожении 100 г раствора глюкозы, пропускали через гидроксид кальция. Осаждается 10 г карбоната кальция. Рассчитайте массовую долю глюкозы в растворе.
3. Количество литров раствора, содержащего 0,96 массовой доли, или 96%.Этанол (Р = −0,80 г / см3), этилен 1000 м3(н. у)? 4: 1-10 литров воздуха требовалось для сжигания водорода, выделившегося при реакции пропанола и металлического натрия. Вычислите количество граммов пропанола, который прореагировал.
Смотрите также:
| Нефть | Многоатомные спирты |
| Коксохимическое производство | Фенолы |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.
