Оглавление:







Периодическая система элементов и электронная структура атомов
- Периодическая система элементов и электронов Атомная структура. Для каждого атома В принципе, неограниченное количество лиц 18.Электронная структура Состояния, в которых энергия атомов кислорода отличается в виде квантов Из них только государство из ячейки н = 2 * Вместо терминов слой # и оболочка, уровень и «Подуровень», и» оболочка», и»под-оболочка».
- Противоположная ориентация спина называется антипараллельной. Меньшая энергия называется нормальной или не возбужденной. Все остальные. Энергетическое состояние с большим запасом энергии называется возбужденным состоянием чтобы перевести атом ми из нормального состояния в возбужденное, вам необходимо: Энергия-скажите ему энергию возбуждения. К
огда дело доходит до Электронная структура атома в основном подразумевает нормальное состояние ние. Людмила Фирмаль
При переходе атомов из возбужденного состояния в нормальное состояние Восстанавливается структура электронной оболочки. Строение атома Она описывается классической физикой, отражающей непрерывность изменений Свойства атомов одного и того же химического элемента в нормальном состоянии Он имеет другую электронную структуру и теряет свою индивидуальность В данном случае различие между элементами и само понятие химии Смысл стихии теряется.
Наличие химических элементов Их специфическими свойствами являются、 Однако благодаря этому структура электронной оболочки атома находится в нормальном состоянии Он однозначно определяется зарядом ядра или порядковым номером элемента Регулярная система. При заполнении электронного слоя и оболочки атом следует: 1) Самый маленький энергетический шифр, в котором электрон сначала заполняется Орбитальная в небе с минимальной энергией. 2) принцип Паули. 3) правила Гунда-в вырожденных орбитах общее число спинов электронов равно Но она максимизирована.
Та же энергия, квантовая клетка популяции Электрон так что атом имеет наибольшее количество неспаренных Electronic. It соответствует нормальному состоянию атома (минимальная энергия). Рассмотрим взаимосвязь между электронной структурой атома и расположением элемента Короткая система цикла 8 клеток (см. форзацы).Каждый трек имеет Элементы периодической системы по сравнению с предыдущей Электроны большие.
Простейший первый период системы, состоящий из Только 2 elements. In водород, один электрон является самым низким По энергии орбиталь есть, и гелий на этой орбите имеет 2 электрона антипараллельных Льняная спинка. Гелий заканчивает первый период работы системы и изнашивается все вариации квантового числа при n = 1.So атом гелия-это Формируется слой Y, ближайший к ядру. Формирование-слоя (u = 2) начинается с лития, а лития-3 Электронный.2 электрона, такие как гелий, заполняют слой.
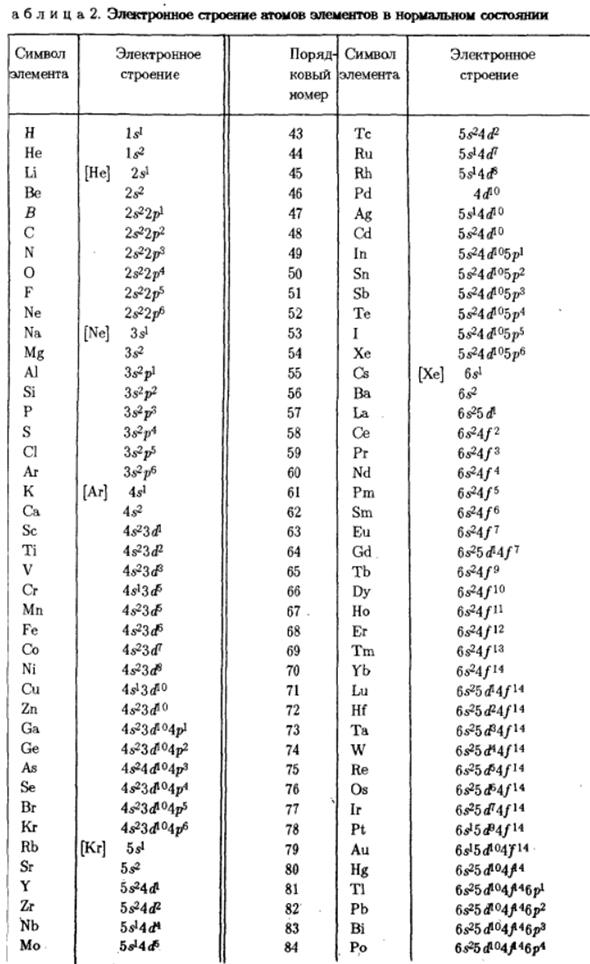
Высшее электрон На траектории ls электрона Вакансий нет. Поместите 3-й электрон в орбиталь S, которая является самым большим электроном Если его емкость равна 2, то это противоречит принципу Pauli. In Элементы льда во 2-м периоде — все траектории s и p в неоне-n = 2 Он полон. Электронная структура атомов элемента в его нормальном состоянии Она приведена в таблице. 2.In это, квадратные скобки символизируют электронную структуру-
Редкие газы, которые органически входят в атомную структуру Ив стихии. 3-й период (n = 3) начинается с натрия, и электронная формула Is22s22p63s1, или согласно таблице. 2, [NejSs1.Окрашен аргоном Полностью n-Z b и p оболочка все. Аргон заканчивает 3-й период. Регулярная система. Но все возможности квантового изменения Число простых чисел, основное квантовое число которых равно 3 (см. таблицу 2). н = 3 Существует 5 3 ^орбит(/ = 2), каждая из которых содержит 2 электрона Rona.
So далеко, все эти орбиты пусты, и следующий элемент аргона-это Добавляется калий-первый представитель 4-го периода системы. Вся вакансия RF оболочки A0 остается пустой в 3-м слое) Калий и кальций начинают заполнять 4-й слой (n-4).Об этом Спектр и химические свойства этих элементов являются химическими Аналоги натрия и магния, соответственно. Если последний имеет внешний 3 ″ электроны, то калий и кальций являются наиболее удаленными от ядра Рик е 4 секунды.
Помимо чисто «химического» обоснования порядка урегулирования、 17. по аналогии с химическими свойствами элементов на рисунке З = 19? Энергия, как и 3S орбиту 21 близко. Следовательно, калий (Z = 19) и Электроны кальция (Z-20) существуют в 4 ″ орбитах. На основе анализа Электронная энергия и серийный номер (см. Рисунок 17) В. М. Кречиковский. А954) сформулировать правила порядка заполнения электронных оболочек
Проверка атомов химических элементов. это правило-правило называется (n+/)、 Сведения о минимальных энергетических условиях при заполнении электронной оболочки И слои. По словам кречковского, сначала вводится траектория низкого значения Сумма главных и квадратичных квантовых чисел (n + 0-если эта сумма равна В некоторых состояниях главную роль играет главное квантовое число.
- То есть заполнение орбиты осуществляется последовательно от малого значения Больше. Рассмотрена электронная структура атомов калия и кальция、 Следуйте правилам krechkovsky. In факт, для орбиты 4c (n = 4,/ = 0) Для суммы(n + l)= 4, 3 ^орбит (n-3,/ = 2) эта сумма равна 5.И так оно и есть.、 4 # оболочки будут заполнены быстрее, чем 3 ^оболочки. Начиная с 21-го элемента скандия, 3 ^оболочка*заполняется. * Скандий имеет 2 варианта.4p — (n + / = 5) или 34-я орбита (n + + / = 5).
Общее число n + l одинаково на этих орбитах, поэтому согласно правилу Клеха Ковского, первый снаряд Зи будет заполнен. Ребенок принадлежит к предыдущему слою с n = 3.Поэтому в строке 4 Периодическая система не имеет заметного уменьшения слева направо Внешний электронный слой (n = 4) 2 электронный Ds2).Исключение составляют хром и медь. Выпадение электрона Это также наблюдается в других элементах (см. таблицу 2).
Происходит «пробой» 4 электронов-с 3 < / 1 орбиты. Людмила Фирмаль
Они были энергетически оправданы.、 Что следует принципу минимальной энергии и находит экспериментальное Проверка микроструктуры спектра*.Полностью 3 < / — orbi Подъем заполнен с zinc. In галлий как алюминий, 1 электрон Рон на; п-оболочка Д / П1).Четвертый период также заканчивается знатью Полностью заполненная оболочка 4p6 криптоновым газом.
Во время кальция DS2) Галлий D / «1) 10 элементов от скандия до цинка» клин」、 Он характеризуется заполненностью электронами 3< / — орбит. Эти металлы Sc-Zn Плагин формирует первые 10 элементов за десятилетия. 5-й период похож на 4-й период. Вот 2-й 10 элементов Y-Cd металл, для этого Заполнение 4 < / — trajectory. In Индий, начинка 5 начинается; Р-орбита、 Конец с ксеноном atoms. In в этом случае 4/ -, 5d и 5 / орбита пусты. 5-й период полностью завершен.
Это、 Это быстрее, чем квантовый слой. Эта закономерность хорошо видна. Она начинается с третьего триместра. 5< / — 6-й период после фонаря, в котором появились орбиты Образуется 1 электрон, за которым следуют 14 лантаноидов. Они характеризуются наполнением В основном 4 / орбита. 5< / — 1 электрон (как фонарь) появляется на орбите- Только гадолиний (Z = 64) и Лютеций (Z = 71).Лантаноиды Представитель шестого периода, глубокий Начальный (ha-2) слой; их наружный наружный слой и структура 2-го слоя полностью Полностью идентичный.
Это имеет решающее значение в химическом поведении лантана. Объясняет очень замечательную аналогию химического вещества Свойства этих элементов. 5 < / — второй электрон на орбите появляется только в гафнии (Z = 72)、 Полностью 5 > 1 оболочкой ns2np6. 3.Для элементов общих элементови основных подгрупп (Группа А)、 За ним непосредственно следует типичная вертикаль, которая заполняется снаружи орбиты ns (группы IA и IA), или внешние n ^ мербиталы (IIIA-VIIIAA- Группа.)Элемент с заполненной траекторией ns называется » — Element»、 то, что характерно для заполнения N ^marvital, называется p-element.
In Элементы боковой подгруппы (группа B), содержащей боковую подгруппу VIII Группа*, внутренние (и-1) радиочастотные орбиты будут заполнены(если нет) С индивидуальными электронными провалами).Они могут быть (/- элементами или переходные металлы в отличие от так называемых s-и p-металлов Оттаявший металл. 4.Для лантаноидов и актинидов, глубоко(n-2)/- Орбиты(4 /- и 5 / орбит соответственно).
Следовательно, лантаноиды и Актиноиды связанные с / — элементами. 5.Для аналоговых элементов, такое же количество электронов на 1 Номинальные орбиты при различных значениях основного кванта number. So … Физический смысл периодического закона заключается в периодическом изменении Характеристики элемента в результате периодического возобновления аналогичного электричества Атомная оболочка с непрерывным увеличением значения основного Квантовое число.
Таким образом, по мере увеличения порядкового номера происходит заполнение орбиты Умрите в следующем порядке:Bp <6s и 4-й st <6p <7s » 5 / 6rf <1p Незавершенный * Открытие 105-го элемента, зарегистрированного Государственным Советом Изобретение и открытие Совета Министров СССР 1972-5-16 В честь Нильса Бора я попытался назвать его Нильс бориум (Ns). * * Типичным Менделеев назвал элементы 2-го и 3-го периодов. 。 * * * Необычная боковая подгруппа группы VIII состоит из семейной металлической триады 6 элементов железа и платиновой группы.
Я Полудлинный 18-клеточный цикл Элементы системы (Таблица 3) подключаемые декады ячейка между элементами A и p. Такие как Систему можно легко разделить на отдельные секции(см. Рисунок 19)Е -, Р -, D-и/ — в зависимости от расположения элемента. раздел, обозначенный буквой s, содержит 2 элемента. Каждый период, раздел с-6, раздел d- 10. максимальные р и с-19-по схеме заполнения, например»* -,»* -. Емкость раковины.
Такие испытания составляют половину длины R «и / орбит Венозное деление на формы периодических систем периодических систем Отдельные разделы еще раз показывают тесную связь со структурой Электронные оболочки атомов химических элементов. Однако в полудлинном варианте периодической системы вертикальные элементы Я хочу быть снаружи в течение длительного времени без этого дефекта 32 система клеточного цикла.
Это показано в таблице. 4.Ее Ланта нооиды и актиниды вводятся между группами BB и IVB РФ elements. In длина Из обычного варианта системы выделяют элементы (лантаноиды и Актиноиды) (вставить / — элементы для вставки.
Смотрите также:
| Квантовые числа | Строение электронной оболочки и свойства элементов |
| Многоэлектронные атомы | Химическая связь и валентность |
