Оглавление:




Многоэлектронные атомы
- Многоэлектронный atoms. In сложные атомы, на этот электрон не влияют Не только ядро, но и все доступные электроны. Каждый электрон отталкивается от Все остальные электроны подчиняются закону Кулона, и поэтому все волны Ваши функции взаимозависимы. Расчет энергетических уровней и распределение электроэнергии Плотность плотности может быть осуществлена, в принципе, на основе решения уравнений Шредингер многих частиц.
- Однако, точное решение такого уравнения Это неизвестно. Аппроксимация Томаса и Ферми исходит из статистической модели Применимо к атомам, которые являются атомами и содержат достаточно много электронов (Она начинается примерно в середине периодической таблицы.)
С этим Приблизительно определяют радиальное распределение электронной плотности по методу Он Ли Быть Н Нет. Ка ЗН ЗР НД НД- 17. Людмила Фирмаль
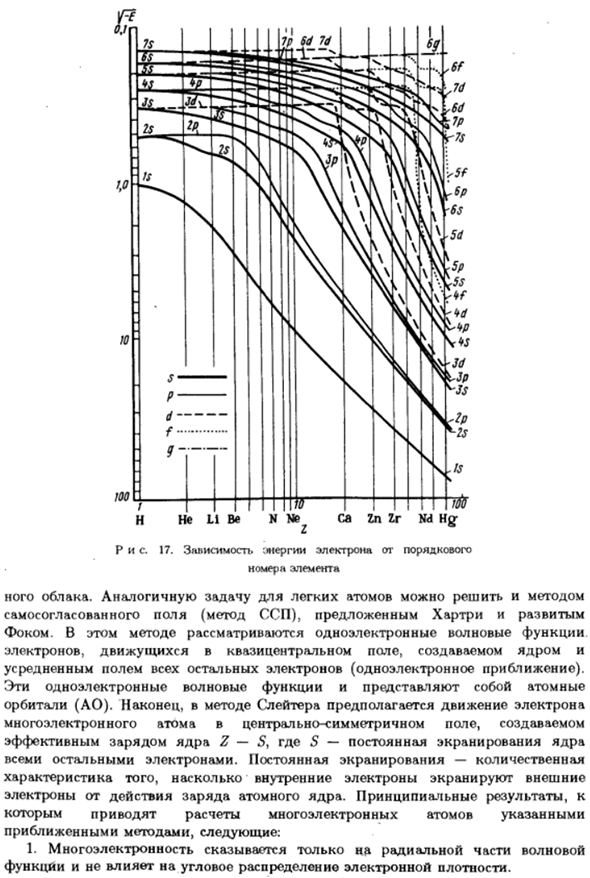
Зависимость энергии электрона от порядка Номер материала Облако. Аналогичная задача с легкими атомами может быть решена этим методом Собственного поля нет-поля (метод ССП), предложенная и разработанная Хартри) ФОКом. Этот метод учитывает волновую функцию одного электрона. Электроны, движущиеся через квази-центр поля, создаваемого ядром
Среднее поле всех остальных электронов (приближение 1 электрона). Эти одноэлектронные волновые функции являются атомарными. Орбита (АО).Наконец, метод Слейтера предполагает движение электронов Многоэлектронного атома в Центральном симметричном поле, созданном Действительный заряд ядра Z-S, 5-постоянная экранирования ядра Все остальное электронное.
Щит постоянный-количественный Особенности того, как внутренние электроны экранируют внешние Электроны под действием заряда атомного ядра. Основные результаты、 Это задается расчетом многоэлектронных атомов по заданной Метод аппроксимации, далее: 1.Многоэлектронный эффект влияет только на радиальную часть волны Функции и не влияет на угловое распределение электронной плотности. -Я не уверен. -Я не уверен.
Тридцать семь 2.Состояния многоэлектронных атомов, электронов и атомов воды Она однозначно определяется значениями определенных квантовых чисел n, f, pc и ms. Они имеют то же значение, что и атомы водорода. 3.Определяется энергия электронов многоэлектронного атома (в отличие от По значению первичного и вторичного квантовых чисел (атомов водорода).
Поскольку энергия увеличивается с увеличением обоих квантовых чисел, орбиталь ns、 (n -) d и (u-2)/разность энергий относительно невелика, всегда более низкая энергия, чем pr 4.Энергия орбиталей изменяется от атома к атому в зависимости от порядка величины. Номер второго элемента. На рисунке 17 показана зависимость энергии электрона Номер строки элемента. Единичной энергией считается энергия электронов атома водорода В основном состоянии он равен 13,6 эВ*.
- Электронные подсистемы многоэлектронных систем (атомы, молекулы, кристаллы) Они восстанавливаются квантово-механическими закономерностями, называемыми принципом Паули. Согласно этому принципу, в электромиографической системе каждого состояния Число, определяемое полным набором из 4 квантовых чисел, равно、 Несколько электронов.
Следовательно, все наборы квантовых чисел По крайней мере 1 квантовое число должно отличаться друг от друга. Основа Паули вращает полуцелое число (e、 (Например, тон, нейтрон, позитрон и т. д.).Принцип Паули * * ограничение количества электронов В атоме каждого значения основного квантового числа n (III.35) согласно、
Так как для данного квантового числа n возможны только 2n2 состояния、 Людмила Фирмаль
Из-за запрета Паули в этом электронном слое не может быть электричества за пределами 2n2. Рассмотрим изменение квантового числа, определяющего состояние 2n2 нового электрона Ронов. Главное квантовое число n = 1.Тогда(III. 26) Согласно/и η принимать только нулевые значения. Таким образом, можно выделить электроны при n = 1 Друг от друга только по значению спинового квантового числа: Первичная электроника 2-й> Один Один Я Ноль Ноль Тщательный Ноль Ноль 77лс + 72 −72.
Аналогично, мы можем показать, что он может быть максимизирован с помощью N-2 слоев 2n2 = 8 электронов с квантовым числом. Я 1-й Электрон 2 0 0 + 7g 2-й> 2 3-й > 2 4-й> 2 5-й> 2 6-й > 2 День 7> День 2 8-й> 2 Ноль Один Один Один Один Один Один Ноль −1 −1 Ноль Ноль +1 +1 −72. + 72 Два + 72 −72. +72 — 7г *Это значение вычисляется по формуле Z = 1 и берется из b = 1 (III. 9). * «Из-за негативного характера это также называется запретом Паули. Скопление электронов с одинаковым квадратичным значением квантового числа это удобно для вызова ля / электронные оболочки*.
Независимо от главной ценности Для квантового числа электронная емкость Альфа-оболочки равна 2, А Р-оболочки — 6 Оболочка-10, и / или оболочка содержит 14 электронов. Существует 2 традиционных способа представления населения электронных устройств Оболочка атома: форма электрона и форма кванта cell. In В первом способе сначала описывается символ соответствующей электронной оболочки、 И в виде экспоненты рисуется число электронов на данной оболочке.
Например, Электронное выражение атома водорода в нормальном, невозбужденном состоянии Состояние будет is1, натрий-Is22s22p63s1.Сумма надстрочных индексов равна Порядковый номер элемента, т. е. равный общему числу электронов в атоме. Недостатком электронных формул является то, что они используют только 2 Кванта Номер выхода: Пи /.Метод электронов в атоме более полно объяснен Квантовая ячейка, которая использует все 4 квантовых числа. Каждая ячейка Если определенная траектория соответствует, то электрон рисуется в виде стрелки、
Последняя доска олицетворяет спиновый Квант number. In каждая орбита Может ли существовать 1 электрон (в квантовой ячейке) или 2 электрона Задняя часть противоположной * * свободной ячейки и орбиты свободны、 Когда атом возбужден, он может быть занят электронами. На рисунке показана электронная структура атома кислорода в виде кванта Обогнать.
При этом энергия орбиты растет вертикально、 mu с тем же значением, что и основное квантовое число p-ячейки он расположен выше, чем »- клетки». в многоэлектронном атоме энергия Зависит от квантовых чисел Пи/.Это результат работы электрона-электрона. Первое приближение отталкивания).Также、 С увеличением этих квантовых чисел энергия возрастает.
Однако рисунок 18 Квант Клетки с определенным слоем (квантовое число n постоянно)、 Горизонтально, хотя на практике есть небольшие отличия Энергия различных орбит. Атом кислорода имеет первый электронный слой (n = = 1) состоит из 2 пар электронов ls (/=0, mi = 0), антипараллельных Моя спина (МС =±Yi) — 2-й слой (n = 2) 2 * клетки содержат 2 пары электронов. В ячейке 2p есть 4 electrons. So … МЮ из 2 пар электронов является магнитным Квантовое число mi одинаково и отличается Только с противоположной стороны.2 других. Непарный (одиночный) Р-электрон Различные суммы прекращаются mi
Смотрите также:
| Основы квантово-механического рассмотрения атома водорода. Орбитали | Периодическая система элементов и электронная структура атомов |
| Квантовые числа | Строение электронной оболочки и свойства элементов |
