Оглавление:




Основы квантово-механического рассмотрения атома водорода. Орбитали
- Основы квантовой механики Атом водорода. Орбитати. Решение уравнения Шредингер-это атом водорода. Ма это complex. At в то же время, полученные результаты- При применении квантовой механики Задача атома водорода является основной Значение для современной теории строения атомов В общем, мова.
- Поэтому рассмотрим только узлы Вопрос о квантовом механическом представлении Атом водорода, математические детали опущены Применяется уравнение Шредингера (III. 19) Что касается атома водорода, то он описывается следующим образом: dh2 du2 dz2 + 2y0 Е2] (III. двадцать один) Задачи Удобнее рассматривать движение электронов в ранее преобразованных атомах Из декартовых координат (x, y, z) к уравнению полюса сферы(III.21) добавляется Координирует.
Где-e2 / g-потенциальная энергия; g-расстояние электрона от ядра. Людмила Фирмаль
Положение точки P в полярных координатах, центр Он совпадает с ядром, как показано на рисунке 12.Линия, соединяющая точку p Начало координат-радиус-вектор g, где d-угол (широта). Эта линия формируется вместе с осью Z. проекция радиус-вектора на плоскость xy сделайте угол с осью x<p (долгота).Полярные координаты r, B и<p уникальны п определяется. Они связаны с Декартовыми координатами следующими отношениями: Это не одно и то же.: х-потому что РСМ г р, г = РСМ Т) грех <р и Z = rcos
Приводится формула (III. 22) и Формула (III.21) преобразуется следующим образом: (III. двадцать два) д 7г! Один d2f 2sin 20 Д <Р2 д. ДФ T7i SIn » T7G ДВ \ ДД (III. двадцать три) Решение уравнения Шредингера атомов водорода в полярных координатах (III. 23) после разделения переменные могут быть представлены в виде продуктов 3 отдельные функции, каждая из которых зависит только от 1 аргумента That.
In самая общая форма, это была бы волновая функция формы: ф(г、 (III. двадцать четыре) Где R ® называется радиальной составляющей волновой функции、 積 (<P) — это его углы*.Формула (III. двадцать три) Функции 0(x) и Φ (^) также называются сферическими. Существует бесконечное количество решений. Но как они имеют смысл объяснять Движение электронов внутри атома, они должны соответствовать стандартным условиям.
Кроме того, он будет автоматически отображаться в соответствии с 3 степенями свободы 3 значения, которые могут принимать только целочисленные значения. Радиус Основные части волновой функции включают pi/, а угловые функции включают / и qc.、 Другая часть волновой функции Φ (y) содержит числовой ПК. В общем и целом Уравнение (III. 23) решение представляет собой функцию нхми. Р, 9,<Р)= дн Р(Т^) Φ^ / ^. (С. двадцать пять) Формула (III. 25) безразмерная величина, входящая в n, I и m, отсутствует、
Квантовое число. Уравнение для квантового числа суперпозиции (III. 23) при решении Учитывая строгое граничное условие, он может принимать следующие целые числа Число: Н-1、2、3、4、…ОО; F= 0、1、2、3、…(Н-1)); М/ = 0、±1、±2、±3、…,±/. А11. Двадцать шесть) Формулы с учетом стандартных условий (III.23) допустимое решение Требованиями(раздел III.26) называется собственным функциям. Формула (С. 25). Является полной собственной функцией уравнения Шредингера атома водорода. Функции характеризуют состояние электронов в атоме、
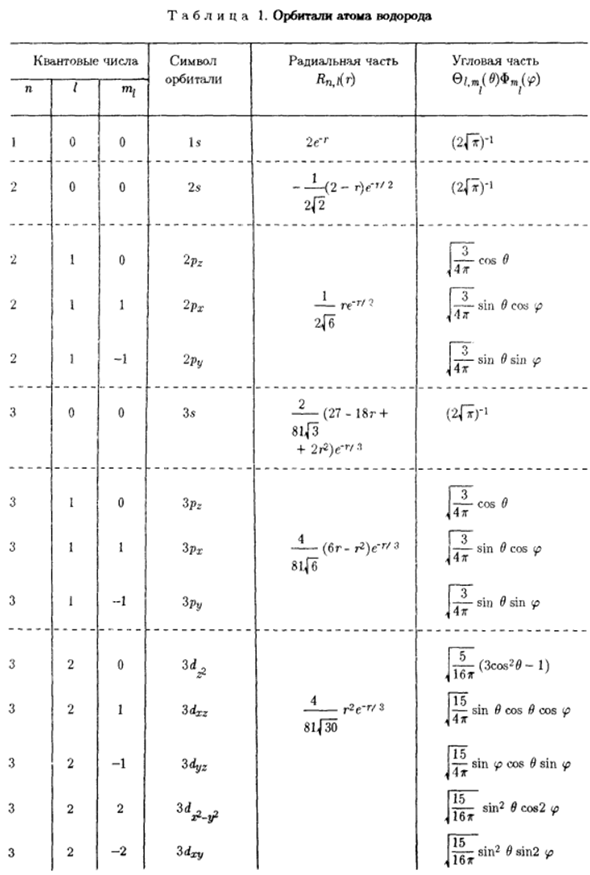
- Атомные орбиты. Состояние электрона, или орбиты, определяется однозначно Набор квантовых чисел n,/, и pc. Потому что этот вывод имеет общий смысл、 Как эти квантовые числа определяют состояние не только атомов, но и электронов Не только водород, но и другие атомы. В таблице. На рисунке 1 показаны собственные функции или траектории атомов водорода. Выразите выражения для Радиальной и угловой частей в явном виде.
Таким образом, полная собственная функция получается как произведение излучения И функция угла. Также укажите траекторию (знак орбиты) Квантовое число n представлено числом, а значение/представлено латиницей в нижнем регистре Письмо: / O 1 2 3 4… Укажите AP d f g \ \и так далее. 、 Нижний индекс справа от символа. Для графического отображения атомов 4 орбиты (зависимость Φ от r, 9 и ip) требуют 4-мерного пространства. А это практически невозможно.
А разница в значении квантового числа m \для одного и того же n и / равна Людмила Фирмаль
Поэтому, согласно таблице. 1 раза Собственные функции и использование радиальных и угловых частей 2 графические зависимости. Вероятность нахождения верхнего электрона Различные расстояния от ядра являются так называемыми График радиального распределения. Это мера присутствия электронов Расстояние ядра вдоль указанных линий сферического слоя между r и r + froT Угол B и ip.
Объем между 2 сферами Радиус r и r + dr равны Arr ^ dr и вероятности того, что электрон остается в этом Основной сферический поверхностный слой пропорционален 4π2[Dn /(g)] 2.Рисунок 13 приведен Радиальное распределение 4irr2 [Rnj ®] 2, характеризующее плотность Вероятность нахождения электрона на разном расстоянии от ядра. Диаграмма 13、 Из теории Резерфорда Бора 、
По движению электронов Круговая орбита*, Квант Электромеханическая модель Рон может остановиться в любом Область атомарного пространства、 Только с разными вероятностями. Если бы я мог быть маленьким Покадровая фотография Мы ставим электроны на место、 При нанесении тысячи таких фотографий Граф получает фотографию Электронное облако. Никогда. Электронная плотность Облака в различные моменты н = 3 0.2 о OJ. ПРМ Ф Г, ИМ. 13.
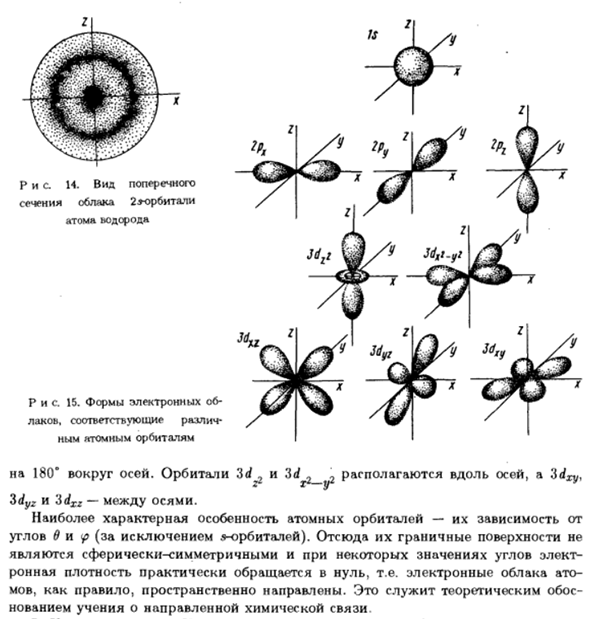
Функция радиального распределения Дайте вероятность нахождения электрона Стоящий из основного г Она определяется вероятностью того, что электрон останется. Таким образом, электронное облако— Это облако вероятности, чтобы найти электрон. Эти облака состоят из сгущения. Редкость, придающая определенную форму. Рисунок 14 приведен Электронное облако сечением 2 * орбит возбужденных атомов воды Род, соответствующий кривой 2s на рисунке (n = 2,/ = 0) 13.In будущее
Мы используем его взаимозаменяемо «Электронная вероятность», «электронная плотность» и » плотность Электронное облако.」 Затем сравните радиус геостационарной орбиты Бора с абсциссой наибольшей Рисунок плотности материнских электронов 13.Радиус бурской орбиты отличается Она пропорциональна квадрату главного квантового числа и равна друг другу 0.053-I2, 0.053-22; 0.053-Z2 Нм и др. для рисунка орбиты 13, 2 и 3 являются следующими Расстояние обозначается пунктирной линией.
Все орбиты нс только Радиус первой траектории Бора совпадает с местоположением максимальной плотности Найди электрон. Из других состояний 2p-это совпадение、 3Д… Орбита. В химии распределение угловой плотности является наиболее важным. Электронный cloud. As вы можете видеть из таблицы. 1, NS орбита не зависит от сферы Углы: их собственные функции не включают термины, которые зависят от углов И<p. таким образом, все атомные ns-орбитали сферически symmetric.
To На рисунке 15 показаны различные соответствующие электронные облака Атомные орбиты. На рисунке 15 показано геометрическое представление квадрата Собственная функция-это угловая доля 0/, m@).)(^) я、 Табуляция. 1.15 чтобы правильно понять рисунок необходимо отметить что он дает Визуальное представление интерфейса внутри электрона Плотность высокая (90%), но небольшая снаружи.
Особенности интерфейса Является электронной плотностью, то есть это поверхность, равная электрону Плотность. Все траектории представлены трехмерными фигурами. Происшествие Например, траектория p может быть представлена вращением 2-мерного изображения. Поэтому * электроны запрещены между орбитами. IS Рис.14.Горизонтальный вид 2.9 секция орбитального облака Атом водорода Рис.15.Электронная форма Соответствует лаку Атомные орбитали 180°вокруг оси. Орбита 3d 2 и 3d 2 2, ось, 3dXy、 З х г Между zdyz и 3dxz-осью.
Наиболее характерными особенностями атомных орбиталей являются、 Углы в и<p (за исключением s-орбит).Таким образом, граничная поверхность их является Сферическая симметрия, в зависимости от электрического угла плотность Рона практически исчезает. Электронное облако арматура, как правило, направлены в пространстве. Это служит теоретическим обоснованием. Нововведение в принципе дирекционного химического выпуска облигаций.
Смотрите также:
| Строение атома по Бору | Квантовые числа |
| О квантовой механике | Многоэлектронные атомы |
