Оглавление:



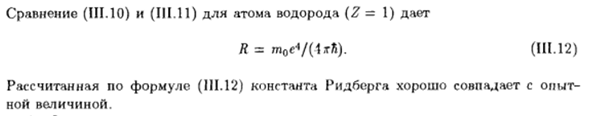

Строение атома по Бору
- Строение атома вдоль Бора. Планетарная модель Резерфорда противоречит С точки зрения закона классики Physics. In дело в том, что движение электронов по орбите электрическое Электрический ток, который индуцирует электромагнитное поле в space.
- To создать Последний потребляет энергию электростатического взаимодействия с электронами. В результате электроны должны перемещаться по спирали (а не в замкнутом состоянии Его орбиты) и падают на ядро, это эквивалентно удалению атома. In реальность, атом-это исключительно Устойчивое развитие education.
По расчету, время жизни атома в этом случае равно Это должно быть около 10-8 seconds. Людмила Фирмаль
In кроме того, когда электроны движутся по спирали, энергия Эта гамма должна непрерывно уменьшаться, и атомный спектр Непрерывный. Из опыта известно, что каждый атомный спектр имеет дискретный характер. (Доминантный признак. Выход из этой ситуации был открыт великими учеными Дании Нильс Бор в 1913 году. Он исходил из модели Резерфорда, основанной на доктрине Эйнштейн, квант света A905) и о квантовой теории планковского излучения А900).Согласно последнему, вещества поглощают и выделяют энергию раздельно.
Порция-то amount. In в данном случае квантовая энергия электромагнитного излучения Пропорциональна частоте этого излучения. E = hv, (III L) Где h-постоянная Планка. Наряду со скоростью света и электронов Постоянная Планка-это 1 из основных констант природы. Бор сформулировал основные принципы теории атомных структур в следующем виде. Предубеждения. Эти предположения позволили Классические формы движения в физике.
Первое предположение Б- P a: электроны в атоме могут стать только стационарными или квантовыми Дискретное значение энергии, которое атом не испускает? — Это статус. В стабильном состоянии момент импульса электрона м Целое число, кратное постоянной Планка fi-Л/Втг), то есть, М = НТ = НХ / ВХ)*, (раздел III. Два) Где N-целое число. Первое предположение Бора называется условием квантования Орбита явно не соответствует классической физике.
Рой электронов, движущихся через энергию, может принимать любое значение. 2-й пост} ’ Lat Bora (условие частоты): при переключении с 1 Устойчивое состояние различных атомов испускает или поглощает Квант электричества Магнитное излучение, частота которого определяется соотношением ЛГ. Ан-Э = ХВ. (Раздел III. Три) для N> М, атомы переходят из высшего стационарного состояния Энергия на орбиту низкой энергии обусловлена излучением кванта лучистой энергии в случае n <m с поглощением фотонов наблюдается противоположная картина.
- Атом Новое (нормальное) состояние поглощает и пропускает только кванты света Возбужденное состояние. Возбужденные атомы поглощают и Он испускает фотоны. Длительность возбужденного состояния атомов Они составляют порядка 10-8 секунд. Стационарная модель соответствует бору или допускается Орбита, на которой электроны не теряют свою энергию.
Возможно Бор Электроны движутся вокруг ядра по разрешенной круговой орбите. Затем, (III. 2) Вы можете написать следующее: movr = nt, (HI-4) Где mo-масса электрона. в электронной скоростью. г-радиус траектории. для эксплуатации Вокруг электрона афференты должны информировать его Ускоряющий. Действие с ядром электронов, а значит и равенство Или * L = A / Bt) также называется константой Дирака, а il = 1,054-10〜34 он будет равен J-s. III. 5) (W. 4) разделить на、 в=
Это ускорение V2 / r сообщает электронам силу кулоновского взаимодействия Людмила Фирмаль
То есть скорость, а значит и кинетическая энергия электрона обратно пропорциональны Целое число n называется главным квантовым числом, и в модели Бур означает порядковый номер допустимой орбиты от атомного ядра до атома. От (Раздел III.5)и (III.6) получить Р = ВСН.2 /(t0eSch.(Раздел III. Семь) Так, радиус разрешенной траектории называется 12: 22: 32 и т. д. Для (III. 7) если вычислить атомы водорода(n = 1 и Z-1), то r = 0,053 Нм. Этот.
Величина действует как характерная длина и называется радиусом Бора. Для элементов с порядковым номером Z радиус первой орбиты в Z раз меньше Шея. Важнейшей заслугой теории Бора является、 Водород и водородоподобные атомы. Полная энергия электрона Атомы состоят из кинетического (mov2 / 2) и потенциального — (e2Z / r), или III. 5) когда следует принимать во внимание、 E = mov2 / 2-e2Z / r = m0v?/ 2-m0v2 — мои?/ 2. (Раздел III. Восемь)
Именно поэтому полная энергия электрона равна его кинетической энергии, которая получается из обратной Знакомый знак. (III. 8) (III.6) заменить формулу для электронной скорости от、 Мы получаем E = — m0i, 2/2 = — moe «27n2» 2). (W. Девять) Бурские частотные условия (III. 3), учитывая (Ш.9) и затем、 Или ху = Откуда Коэффициент перед скобками является теоретическим представлением константы ридбурга
Выражение R для описания спектральных линий атома водорода в видимой области (серия Бальмера): Дж / = да / 22-1 / Н2). (Раздел III. Одиннадцать) (SLO) и (III.11) сравнение атомов водорода (Z = 1)、 Р = m0e * / ДСП). (Раздел III. Двенадцать) Формула (III. константа ридбурга, вычисленная при 12) хорошо согласуется с экспериментом Ценность Ноя.
Смотрите также:
| Химический индивид. Химическое соединение | О квантовой механике |
| Модели строения атома | Основы квантово-механического рассмотрения атома водорода. Орбитали |
