Оглавление:













Подгруппа брома
- Подгруппа брома. Содержание брома в земной коре составляет 3 * 10«%, содержание йода-4•10-в%.Из — за характера распределения природы оба элемента очень похожи на хлор, но образование вторичных кластеров не характерно. Свойства этого элемента практически не изучены 1 Основными источниками промышленного производства брома являются соленая озерная вода (0,01-0,5% ВГ) и морская вода (в среднем 0,007% ВГ).
- Некоторые примеси также извлекаются из бромистых соединений, которые обычно встречаются в природных отложениях калийных солей, и из буровых вод (0,01-0,1% Vg) в нефтеносных районах. В промышленном производстве йода первостепенное значение имеет буровая вода со средним содержанием 0,003% I, а еще 1 источником этого элемента является зола морских водорослей. Бром выделяется из раствора первой соли, в виде йода, который является тяжелой жидкостью, в твердом состоянии.
Для получения свободного брома и йода можно использовать замену nx-хлором. Людмила Фирмаль
По основным физическим характеристикам бром и йод, как видно из приведенной ниже таблицы, естественным образом выстраиваются в ряд с хлором и фтором(сюда же относится и водород). Молекулярная масса (Округляется) В нормальных условиях-температура плавления.
Температура кипения. °С Агрегатное состояние цвета Газ бесцветный. 。 。 — 259-253. Почти бесцветный газ-220-188 Газ-желто-зеленый-U1-343 Жидкость темно-коричневая-7 59 Темно-серый. 。 114 186 Химикаты Н? Ф С! Ух… И затем Два 3S 71 1 GO 254 Плотность брома составляет 3,1, йода-4,9 г / см3.Поскольку давление паров твердого йода очень велико, он легко сублимируется при нагревании.
Техническая сублимация йода используется для его очистки V-7 Остро пахнут пары йода темно-фиолетового и красно-коричневого брома (в большей степени).Благодаря воздействию на организм бром становится близким к хлору. Бром в основном используется для изготовления специальных присадок к бензину в автомобилях. Йод в виде 5% спиртового раствора («модная настойка») используется для стерилизации раны.
Оба соединения тяжелых галогенов очень важны для фотографии, медицины и т. д. Ежегодное мировое производство брома составляет десятки тысяч тонн, а йода-несколько тысяч тонн S-i0 Тонны Растворимость брома в воде составляет около 35 г, йода-1 г на 0,3 литра. Оба этих галогена (и астатины) растворяются гораздо лучше в различных органических растворителях. По наиболее характерным химическим функциям бром и йод являются одновалентными металлоидами.
Некоторые из чисел являются Мы сравниваем высокие свойства этих элементов с аналогичными данными по хлору и фтору(где G-общее название галогена): Крот-Кв. ИА Як Рзстой-НИС. И энергия пищеварения, ккал’.моль / г эффективный радиус атома. kka. Ch г-н огом Ион г-эффективный радиус. Энергия гидратации, KKQAitUOH F * 1.42 38 F 0.71 81 F » 1.33 116 CI, 1.08 58 CI 0.99 85 SG 1.81 84 Wh, 2.29 46 Wh 1.14 79 Wh-1.96 76 б 2.67 36 я 1.33 72 2.20 Д 67 Активность галогенов (в растворе) пропорциональна энергии, выделяющейся при переходе атома из нормального состояния в гидратированный Ион G’.
Эта энергия равна половине энергии диссоциации молекулы T%, сродству атома к электрону и алгебраической сумме энергии гидратации без G. 7 ккал / г атомов в случае I).Значение этой полной энергии следующее (ккал / г атома): F CI Br I 178 BO 128114 Серия F-C! В связи с уменьшением этих значений в-Br-I, каждый галоген может заменить все галогены, которые находятся на его правой стороне от соединения.
Например, бром заменяется хлором в соответствии со следующим уравнением: Сl2-4-2-комнатная ’= 2Cl — Ф Бк2-Ф 2(140-128) ККА. g = 2CG-f Br, — f 24 ккал Химическая активность брома и йода ниже, чем у хлора, но все же велика. Некоторые элементы свойств многих металлов и полуметаллов (например, фосфора) позволяют им взаимодействовать при нормальных условиях conditions.
At в то же время бром немного менее активен, чем хлор, но он значительно отличается от хлора. м-32. Взаимодействие брома и водорода происходит только при нагревании. Йод реагирует только с водородом и при достаточно сильном нагревании, не completely. It происходит разложение йодистого водорода, потому что начинается обратная реакция.
Согласно схеме, удобно получать оба галогенида водорода путем расщепления воды соответствующих Галогенидных соединений Rg3, представленного-fЗНоО = нзроз + знг? Реакция протекает легко даже при комнатной температуре 33 Подобно хлористому водороду, HBg и HI являются бесцветными газами, которые хорошо растворимы в воде. Некоторые из их характеристик сравниваются со свойствами HF и HC1 в таблице ниже Галоген-тепло, выделяемое из элемента водорода, расстояние ккал, моль яда.
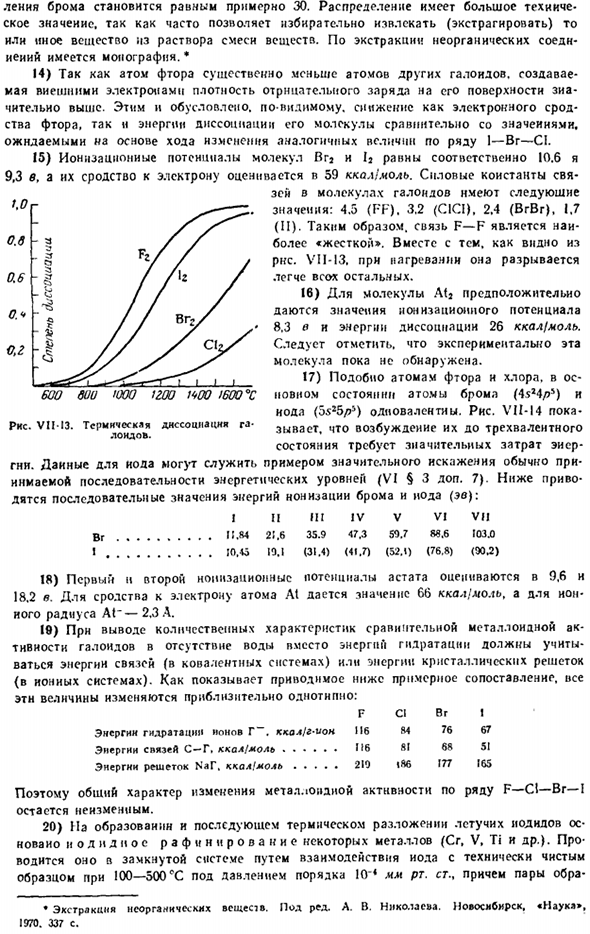
Лидия говорит: «к-Ла-Ларио. Диполь. И температура расплава is. it это синий цвет. °C температура высокая. ° С растворимость. моль / Лatат 10 ° с. Степень диссоциации 0,1 н. раствора. Х f если 65 0.92 0.36 −83 + 19.5 и 9.0 HCI 22 1.28 0.23-болезнь-8G> 14 92.6 ОНВ 8 1.41 0.17 —87-67 15 93.5 Привет〜6 1.62 0.09 −51 −35 12 95.0 Рисунок VI1-12.As видно, что свойства меняются вполне закономерно в ряду HI_HBr_HC1,но дальнейший переход к HF приводит к резкому скачку, даже в обратном направлении, в некоторых случаях это общий ход.
Это связано с сильной ассоциацией фтора Нет никакого водорода. Его аналог. Химические свойства HBr и HI очень похожи на хлористый водород. Подобно последнему, он не действует на большинство металлов в безводном состоянии, а в растворе йода образует очень сильные бромистоводородные и гидроиодные кислоты. Первая соль называется бромид или бромид, вторая соль называется оба или оба На или на(как правило, производное галогеновой кислоты является галогенид или галогенид).
в большинстве случаев растворимость бромида и йодида аналогична растворимости соответствующего хлорида. Для астатинов установлена возможность присутствия отрицательных одновалентных ионов. Существуют значительные различия во взаимоотношениях HI, HBr и HCl с окислителями.
Молекулярный кислород постепенно окисляет иодистоводородной кислотой даже при комнатной температуре(кроме того, под действием света реакция сильно ускоряется). 02 + 4HI = 2H20 b Водородные кислоты брома и 100 взаимодействуют гораздо медленнее, а соляная кислота вообще не окисляется молекулярным кислородом.
Однако соляная кислота может окисляться под воздействием MnOj и др. таким образом, из вышеизложенного видно, что галогенид водорода (за исключением HF) действует как поглотитель кислорода, то есть как восстановитель, и наиболее активен в этом отношении HI. Водород водород в газообразном водороде может даже сжигаться с кислородом (образование HgO и b).
Легкий антиокислительными свойствами в растворе являются производными отрицательных одновалентного Астата, я- * Если рассматривать кислородные соединения брома и йода, как в случае хлора, то удобно исходить из обратимой реакции Г2 + н, о НГ + ног 4 Когда мы переходим от хлора к Брому, а затем к йоду, равновесие смещается влево. Сорок один Г. tgpsp * digssiaia » вч 90. В * 20 УФ * 70 −40 Один- −00 Так… Так… — ТАК Сорок / 00 Тридцать zZ К Десять 2.0 ■ 1.8 ЛО — /4 Так что nvg также молекулярный вес Диаграмма VII-12.Собственность га. ндовородов.
Будь то Можно получать растворы гипобиотиков(HOVg) и кислот гипо-йодной кислоты (HOI), а также хлорноватистую кислоту. Обе кислоты неудачны, являются соединением, устойчивым к воздействию oxidants. In серия HOC1-HOBr-HOI, и стабилность и оксидативная деятельность уменьшены.
В том же направлении, от хлора к йоду, кислотные свойства соединений тумана также ослабляются. Гипобромная кислота уже очень слаба, а йод обладает свойствами обоих полов. Обе кислоты известны только в разбавленном растворе желтовато-зеленого цвета с характерным запахом. Помимо окислительного разложения, реакция по схеме очень характерна для новг и Хой. ZNOG = 2NG + NGol Приводят к образованию бромата (HBr03) или йодной кислоты (HC3).
Первые известны только в растворах, а последние могут быть отделены в виде легко растворимых кристаллов. Обе кислоты бесцветны. Свойства кислоты бромата очень подобны к HC103, но и оксидация и кислотные свойства иода более менее pronounced. In серия HC103-HBrO3-IIX3, растворимость солей обычно уменьшена. Подобно хлоратам, бром и йод в щелочных и нейтральных средах не являются окислителями.45 ″ 48 Если вы тщательно обезвожите NYU3, то получите белый порошок безводного йода I2O5.
It обладает сильными окислительными свойствами и снова дает йодную кислоту в воде.49 ″ 52 Соль броматной кислоты (HBr04) образуется при окислении бромата фтора в щелочной среде. Набро,+ F2 + 2 NaOH = 2 \ TaF-f Набро, — f H., 0 Прочность самой кислоты близка к хлорной кислоте, но ее стабильность значительно ниже (она известна только в растворах), она является более сильным окислителем.
Его соли (дихроматы) по своим свойствам близки к перхлоратам. Йодную кислоту (NU<) можно получить электролизом раствора НУз [по схеме Н20 + ну3 = h2f (катод) + ну4(анод)].Бесцветный кристаллогидрат выделяется в виде НУ4 * 2Н* 0. Кислотная природа НУ4 слаба по сравнению с кислотной природой нсу4, и наоборот, природа окисления гораздо более ясна. Большинство физиологических солей йодистой кислоты (и Эр и д о т в) слабо растворимы в воде.
Как видно из приведенного материала, сходство соединений брома с йодом и хлором в их кислородных соединениях уже значительно менее выражено, чем с водородом. Регулярный характер характерных изменений при переходе вдоль ряда CI-Br-I в основном ограничен кислотами типа YOG и NG03 и их солями. Единственное, что известно о кислородных соединениях Астатина, — это то, что они существуют, и самое высокое состояние окисления-это Ион AHG, то есть валентность 61
Добавь 1) природный бром состоит из» Br » (50,5%) и 81 Br (40,5%) изотопов и изотопов. Йод является «чистым» элементом, но он состоит из атома I. Для астатина известны только радиоизотопы с коротким атомным временем жизни (для долгоживущих 2 | AAt, в среднем, 12 часов. Йод был открыт в 1811 году. Бром-1826.Наличие astatin Д. И. Она уже была задумана Д. И. Менделеева. Этот элемент был получен искусственно в 1040 году.
Происхождение брома и йода на поверхности Земли такое же, как у хлора и фтора(§ Добавьте его в список. 2) — основная масса обоих элементов выделяется из горячего ядра Земли в виде водородных соединений. 2) Если вы получаете бром из воды моря(или озера), подкислите его до рН ==•3,5 серной кислотой и обработайте хлором. Выделившийся бром перегоняют в содовый раствор воздушным потоком. Содовый раствор подкисляют, после чего он хорошо насыщается бромом.
Реакция протекает по следующему уравнению: 2NaBr-f Clj-2NaCl + Vga. Тогда 3Br,+ 3Na2CO3 = 5NaBr-f NaBrOj-f 3COj and. At последний. 5NaBr + Н’abro, — Ф 3Н, S04 ″ 3NaaS04 + 3Br2-f 3U20. Промышленный бром часто содержит смесь chlorine. To очистите его, он обработан с концентрированным раствором CaBr2.In кроме того, хлор вытесняет бром, и когда бром разбавляется, он выделяется в виде слоя, содержащего только несколько (около 0,05%) растворенной воды.
В безводном состоянии бром получают перегонкой из смеси с концентрированным HjSO. Тройная точка диаграммы состояния соответствует температуре −7,3°C и давлению 46 мм рт. ст. Искусство. Диэлектрическая проницаемость жидкого брома очень низкая (Е = 3).Когда насыщенный водный раствор охлаждается, кристаллогидраты Br2-8!120 (Мп.(°C) is formed.
It также известно, что бензол является нестабильным кристаллическим сольватом состава Br2 * QH®(mp 14 3) содержание йода в буровой воде очень мало, поэтому основной задачей при его получении является концентрация. Это обычно происходит с выделением йода в свободном состоянии (чаще всего по следующей реакции: 2 \ ’al-f 2NaNOi + 2H2SO» = 2Na2SO » — f — + — I)-f 2NO-f 2HjO) и последующей адсорбцией на активированном угле.
Из последнего йода извлекают его термическим раствором гидроксида натрия(по реакции: 31 * — f 6NaOH = 5N’AI + NalOj-f 3IlO).После насыщения раствора кислыми кислотами снова собирают свободный йод(по реакции 5NaI-f NalOj-f 3H2S04 = 3Ma2S04-f 3I2 + 3HaO). 4) морская вода содержит около 0,0000005%йода, Йод извлекается из водорослей и накапливается.
Например, ламинария (морская капуста), широко используемая китайцами и японцами в качестве пищевого продукта, содержит около 0,5% йода в кондиционированных условиях. 6)для получения йода из золы морских водорослей его обрабатывают водой, раствор выпаривают, а затем crystallized. In при этом большая часть хлоридов и сульфатов содержится в золовом осадке, а более растворимые йодидные соли остаются в растворе.
Йод затем извлекается путем обработки раствора хлором (или MnHb и H2SO2). c) для температуры плавления и кипения астатина указаны значения 227 и 317eC. Теплота плавления брома, йода и астатина составляет 2,5, 3,8 и 5 ккал / моль соответственно, а теплота их испарения (температура кипения) — 7,1, 10,0 и 13 ккал / моль. Критическая температура брома 311, йода 553AC.
It интересно, что давление паров брома и йода в присутствии различных газов (N2 и др.) выше, чем при той же температуре, где они отсутствуют. 7) тройная точка диаграммы состояния йода соответствует температуре 11°С и давлению 90 мм рт. ст. Искусство. Поэтому для получения жидкого иода необходимо, чтобы создать условия, при которых парциальное давление пара превышает 90 мм рт. Искусство. (IV§ 3 доп.36).
Этого проще всего добиться, нагревая достаточное количество кристаллов йода с помощью тонкой колбы в горлышке. Диэлектрическая проницаемость жидкого йода достаточно высока (e = I).ОИ-это с. ка распустить. Те. Йодид содержится во многих металлах и многих органических соединениях. Раствор йода-кала в нем проводит электрический ток. Сам йод диссоциируется по схеме I2 * * I » + I*.Но эта диссоциация очень мала: [Г11″] I0 ″ 41.
8) физиологическая роль соединений бромида в нормальной деятельности организма еще недостаточно изучена. Центральная нервная система наиболее чувствительна к дополнительному введению. Бромиды используются в медицине как седативное средство, повышающее возбудимость.
Их чрезмерное накопление способствует появлению кожных высыпаний. Они выводятся из организма очень медленно (в основном с мочой).Токсическое действие паров брома Хлор (§ 2 доп.12).Если кожа горит жидким бромом, рекомендуется промыть пораженный участок разбавленным раствором аммиака. 9) соединения йода играют важную роль в регуляции metabolism. In в животном организме йод накапливается преимущественно в щитовидной железе (астатины, введенные в организм, ведут себя аналогично).
В организме человека содержится около 25 мг йода, из которых около 15 мг содержится в щитовидной железе. Среди обычных продуктов питания наиболее богаты йодом лук и морская рыба. Недостаток йода вызывает заболевание, известное как зоб. Иногда все население этих территорий (в основном на высоте, удаленной от моря) страдает от этой Волеси. Слишком мало йода в воздухе, воде и пище.
При поступлении клубеньков (как примеси к хлориду натрия) в небольшом количестве-около 0,1 мг, можно полностью избавиться от этого disease. In в Китае больных зобом уже давно лечат морской хлопковой золой (содержащей до 8,5% йода).Если добавить в пищу йодсодержащие водоросли, то содержание молока у коровы увеличивается, а шерсть у овцы растет быстрее.
Также отмечено благотворное влияние небольшого количества клубеньковых соединений на яйценоскость, например курицы, открытой свиньи. 10) широко применяемая «йодная настойка» может быть приготовлена путем смешивания 10% раствора (95%) йода в спирте и 4% водного раствора Ки в равной пропорции.
Добавление йодида калия повышает стабильность жидкости при хранении. Обратите внимание, что это не только сам йод. Однако многие его соединения (особенно ки) хорошо усваиваются организмом даже из неповрежденной кожи. Иногда при атеросклерозе назначают прием йодной настойки внутрь(1-5 капель молока).Чрезмерное поступление йода в организм может вызвать неприятные явления (насморк, сыпь на коже и др.), которые исчезают при остановке йода.
I) растворимость йода в воде значительно возрастает с повышением температуры, достигая 100 г / а при 3,3°С; Как видно из приблизительных данных, органическая жидкость растворяется гораздо лучше воды(масса в нормальных условиях%): CjHsOH (CjH5hO Ce H «CHClj CC /» CSj 20 24 12 2.5 2.5 13 12) цвет раствора йода в разных растворителях разный: фиолетовый. Красный, коричневый, нейтральные цвета.
Наличие последних в растворе (например, CC1″или HF») указывает на отсутствие выраженной сольватации растворенной молекулы йода, так как йодная пара, состоящая из свободных молекул Ij, сама по себе характеризуется синим цветом и при смешивании с воздухом становится purple. In напротив, коричневый цвет раствора (например, вода или спирт) указывает на сильную сольватацию. В отличие от йода, цвет раствора брома практически не зависит от природы растворителя.
13) из-за более высокой растворимости Галона по сравнению с водой в органических растворителях, когда водный раствор вступает в контакт с органическим растворителем, 66,1% галогена переносится в органический растворитель. solvent. In в этом случае Галон распределяется между органическими растворителями и водой в строго определенном соотношении.
Если взять в качестве примера бром и сероуглерод(CS2), то для различных суммарных количеств растворенного брома отношение коиторани брома в фазе сероуглерода к концентрации в воде является постоянным и остается приблизительно равным 80. Инвариантность соотношения концентраций веществ, распределенных между 2 смешивающимися растворителями (точнее, соотношения активности), является так называемым законом распределения.
Но он мыслит только в том случае, если вещества, распределенные в обеих фазах, имеют одинаковый состав(состоят из молекул и т.) и не вызывают прямого химического взаимодействия с растворителем. Найденный коэффициент концентрации (80 в данном примере) называется коэффициентом разбиения. Его величина (при постоянной температуре) характерна для данной системы.
Плавильная машина а представляет собой распределяемое вещество-растворитель В. например, при замене сероуглерода ia CC14 коэффициент распределения Задержка брома составит около 30 минут. Распределение имеет большое техническое значение, так как оно часто способно избирательно извлекать (извлекать) вещество из раствора смеси веществ.
Имеется монография по экстракции неорганических соединений. * 14) поскольку атом фтора намного меньше атомов других галогенов, плотность отрицательного заряда, создаваемого внешними электронами на его поверхности, намного выше. По-видимому, именно по этой причине и электронное сродство фтора, и энергия диссоциации его матрицы уменьшаются по сравнению с ожидаемыми значениями, основанными на процессе изменения аналогичной величины в ряду I-Br-Cl.
15) потенциалы ионизации Vga и 12-молекулы составляют 10,6 и 9,3 В соответственно, а их сродство к электронам оценивается в 59 каймолов. Константа прочности связывания молекулы галогена имеет следующие значения: 4.5 (FF). 3.2 (СЖ). 2.4(BrVr), 1.7(второй).Поэтому связь F — F является самой»жесткой».Однако, как видно из RNS. VII-13.При нагревании он ломается легче, чем другие.
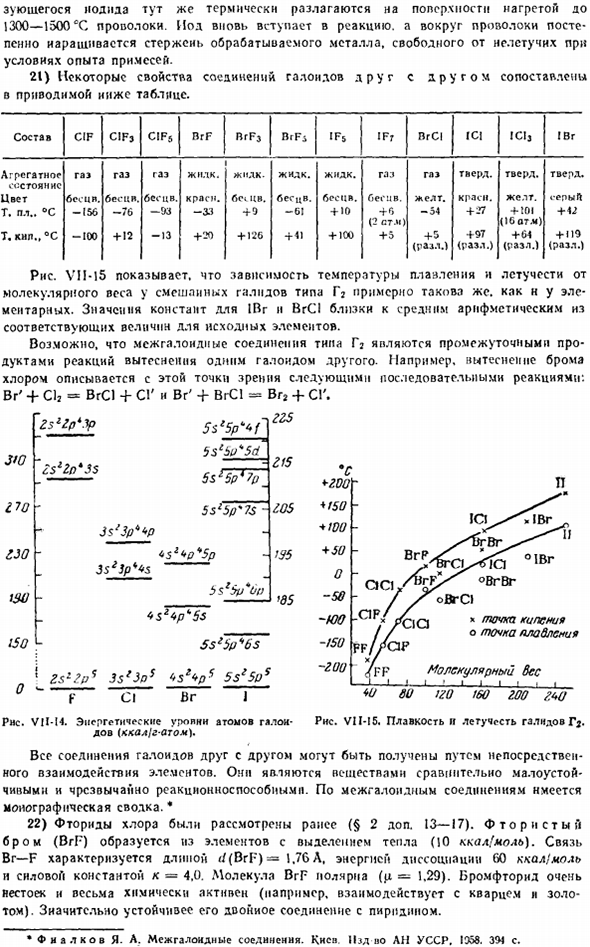
16) в случае молекул Atj потенциал ионизации 8.3®и энергия диссоциации 26 ккал / моль могут составлять given. It следует отметить, что экспериментально эта молекула еще не была открыта. 17) как атом фтора и атом хлора, os-1200 WOO! При 600, » в новом состоянии, атом брома (4sa4 / > 5) и Йод(5 $ 25 /?5) унивалентен. Рисунок VII-14 до свидания. VIM3. Диссоциация TciMffNnmi по 3-валентному возбуждению Это состояние требует значительной энергии.
Краситель йода служит примером значительного искажения общепринятой последовательности энергетических уровней (VI§ 3 add.7).Ниже приведены непрерывные значения энергии ионизации брома и йода (эВ): I II III IV V VI VI VI VII Br………. И5.ВТ 21.6 3С.9 47.3 С9. 7 88.6 103.0 1……….. 10.45 19.1(31.4)(41.7)(52.1)(76.8)(90.2) 18) 1-й и 2-й потенциалы ионизации астатинов оцениваются в 0,6 века и 18,2 века.
Электронное сродство атома At задается при значении 66 ккал / моль и 2,3 а для ионного радиуса At -. 19) при определении количественных свойств активности галогенидов в отсутствие воды вместо энергии гидратации следует учитывать энергию связи (ковалентную) или энергию кристаллической решетки (ионную). account.
As примерное сравнение ниже показывает, что все эти значения изменяются почти одинаково. Энергия гидратации G-mons. Коул/ г-Ион Энергия связи B-C, ккал / моль…… Энергия решетки — NaT. ккал’mol ….. Таким образом, общий характер изменения активности металлоидов в ряду F-C1-Br-I остается неизменным. 20) с образованием летучих йодидов и последующим пиролизом, основания являются основными и используются для очистки некоторых металлов (Cr, V, Ti и т. д.).
Она осуществляется в замкнутой системе с взаимодействием технически чистых образцов с йодом при температуре 10 * 4°С под давлением около 100-500 мм рт. ст. Искусство, и пара F CI Vg 1 116 84 76 67 N6 81 68 51 219 ″ I6 177 165 * Извлечение неорганических веществ. Эд. А. В. Николаева. Новосибирск, «наука», 1970.337 С. Склерозирующий кивок быстро пиролизуется на поверхности проволоки, нагретой до 1300-1500 см3.
Йод снова вступает в реакцию, и вокруг проволоки сердцевина металла в процессе обработки будет постепенно расти, а в экспериментальных условиях примеси будут отсутствовать нелетучие вещества. 21) в таблице ниже мы сравниваем несколько свойств соединения галогена друг с другом. Состав CIF CIF CIFS BrF BrFj BrFi IF5 IFr BrCl 1C / ICtj(Vg Агрегатный газ Жндк.
Жидкость. Жндк. Газ-твердое. Трудный. Трудный. Хорошо. Бесцветный демон СР. Дьявол с. Белый. «iv. что я должен сказать своему врачу, прежде чем принимать это лекарство? Я люблю эту игру. Желтый клаен. Желтые ноги Элли Т. ПЛ.°C −156 −76 −03 −33 + 9 −61 + 10 +6(2 СТМ)-54 + 27 + 101 (16 Ат. Я)+ 12 Т. Бейл.°С, ° С-100 + 12 −13 +20 + 126 + 41 + 100 +5 +5(разложение)+97 (действительное число)+61(ppm.+119 (рвота))
- Рисунок VIM5 показывает, что зависимость типа G2 mixed Gale от температуры плавления и летучей молекулярной массы примерно одинакова. Как элементарные n. константы 1BR и BrCl близки к среднему арифметическому соответствующих значений в начальном элементе. Этот тип галлонного соединения может быть промежуточным продуктом реакции замещения с одним галогеном.
Например, замещение брома хлором объясняется следующими последовательными реакциями с этой точки зрения: view. BR ’+ Cb = BrCl + SG и Br’ + BrCl = Br2 + SG. 2С * 2pl3p б $ ЕВС * 5д cszzp’3s 6sz5p * 7п SS * bp%7 секунд- 3 $ ’ 3Р * * Р б $ 1och5r 3п * 3Р * < > с 5 секунд SP 5С * 5П * 6С 1 2szZp * 3С * 3д * БС’op * 5С br. Рис. VU-H. энергетический уровень атома галогена (ккал} г атома). JW 170£30 W ISO O г15 > КС * 0 601201160 зоопарк£40 рисунок VI1-15.
Плавкость и летучесть Галогенида G*. Второй$ Сто девяносто пять КИ ф Все галогенные соединения получают прямым взаимодействием элементов. Они являются относительно нестабильными и очень реактивными веществами. * 22) хлорфторуглероды были испытаны ранее(§ 2 ext.13-17).Фторид брома (Брф) образуется из элементов с выделением тепла(10 ккал / моль). Связи Br-F характеризуются длиной/ / (BrF)= 1.76 A, энергией диссоциации G0 ккал / moi и постоянной силы k = 4.0.
22) хлорфторуглероды были испытаны ранее(§ 2 ext.13-17). Людмила Фирмаль
Молекула BrF является nolnrna (q-1.29).Фторид бромида очень нестабилен и очень химически активен (например, он взаимодействует с кварцем и золотом).Двойные соединения с пиридином гораздо более стабильны. * Ф-ролл я-А. В смеси Галоидных. Киев / 1zd но СССР. 1958 год. 391р. 23) в порошковой форме фторид был получен взаимодействием элементов при −45°С(CGljF).
Для него известна теплота образования d (IF) α= l, 9lA и 23 ккал / моль. Уже при −14°С разлагаются на ИФе и Ij. In подобный путь, он также был приобретен для dtr и фторида и D. It устойчив только до −28°С. Оба низших фторида йода гораздо более стабильны в своей форме, образуя двухкомпонентное соединение пиридина и бесцветное.
В другом способе (начиная с йодида K, Rb, Cs и IF) было получено бесцветное солеподобное производное трихлорэтилена типа MF-IF.Наиболее устойчивые из них, соли цезия разлагаются только при 120°С и выше 24) фторид бромида образуется из элемента со значительной теплотой (72 ккал / моль) и является стабильным в нормальных условиях. Молекула BrFj полярна (c = 1.19) и состоит аналогично молекуле CIFj (рисунок VI1-7) и имеет 1 короткую связь Br-F (1.72 A), 86°2 длинную (1.81 A) n angles.
In твердое состояние, плотность BrFj составляет 3,2 г / см, вероятно, ионная структура(BrFjBrF»).Плотность жидкости BrFj составляет 2,8 г / см.* Не смешивать со свободным бромом. Множественный фторид металла (Na. К. Ag. Ba. It хорошо растворяется (Sn, Sb и др.), образует с ними двойные соединения, и когда избыток растворителя испаряется, он выделяется из раствора Брфж.
Примеры KF-BrFj, белое кристаллическое вещество (mp 330°C).Отрежьте BrF3 только около 350°C и прореагируйте с водой m это burio чем BrF3.Последнее действие во многих металлоидных оксидах, фторидах металлов, образуется в ответ на высвобождение свободного брома N кислорода.
Часто из-за того, что Сиитезы неорганические фтористые, этот способ удобнее всего переносить. 25) бромпентафторид более экзотермичен (тепло, выделяемое элементом, составляет 90 ккал / моль) и начинает разлагаться примерно при 400°С. молекула BrFs представляет собой полярный (ji = * 1.5) тетраэдр с атомом фтора и атомом брома вблизи центра основания.
Иначе эту структуру можно описать как искаженное 8-стороннее тело, где 1 направление вершины заполнено свободной электронной парой атомов брома. Плотность жидкости BrF $составляет 2,5 г / см, характеризуется низкой диэлектрической проницаемостью(e>8″).она очень активна химически, но не так хорошо изучена, как BrFj. Для него известно кристаллическое бинарное соединение типа MF•BrFs. Где: М-КС, РБ, К. 26) выделяемая теплота и 1 элемент фтора очень высоки (209 ккал / моль).
И это соединение начинает разлагаться только при температуре более 400°C, если молекулы ifs являются полярными (c = 2,2), аналогичными по структуре молекуле BrF5.Плотность твердого иодпентафторида составляет 3,7.А жидкость-3,2 г / см3. В отличие от BrF, он характеризуется достаточно высокой диэлектрической проницаемостью (e = 37).
Он известен для бинарных соединений пентафторида йода и фторида других элементов, например, KF-IFS (бесцветные кристаллы, которые разлагаются при 200X).Особо следует отметить производные ксенона-XeFj-IF (mp 100°C) и XcF » •IF $(decomp. At 92°C).С фтористым водородом, если $(например, BrFj) не образует соединение. Его химическая активность менее выражена, чем у других галогенированных фторидов, поэтому его можно использовать для фторирования органических соединений.
27) интересны свойства йодного раствора ИФ*.Коричневый без влаги, если этот раствор присутствует, очень медленно синеет (от нескольких часов до нескольких недель).Результаты исследования голубого раствора различными методами приводят к выводу, что существует катион 6if5 ~ f 212 51 * + 5 формируется по уравнению 1.
Равновесие, основанное на схеме 1+ ifs I * + IIF ^кажется, что синий цвет, скорее всего, будет слабой связью II аниона IaF7(§ 3 add. II). 28) нанофторированный йод в нанокристаллах составляет 229 ккал / моль (паровая фаза). If7 молекул, значение d(!F)=имеет пятиугольную двойную пирамидальную структуру «1,83 пятиугольной плоскости и 1,94 вертикали».
Гептафторид йода имеет неприятный затхлый запах. При нагревании 2 атома фтора отделяются очень легко. Химическая активность очень высока (например, если бензол воспламеняется), но он не связывается с CsF. Есть монография на галоген фтор. * 29) Образование BrCl из газообразных брома и хлора протекает с незначительной теплотой (0,2 ккал / моль).Запах хлорида очень нестабилен.
В нормальных условиях пара диссоциирует примерно на 25%.Для константы равновесия диссоциации (K = «[Br2] [Cla] / 1BrCl) 2) получено значение 0,1. Связь Br-C1 характеризуется длиной 2,14 а, энергией 53 мкал, постоянной силы 2,7. 30) теплота образования 1с1 из элемента составляет 8 ккал / ’ моль, тепловая диссоциация его паров относительно невелика (в нормальном состоянии-около 0,3%).
Известны только хлориды в 2 кристаллических формах, из которых менее устойчивый коричневый цвет (полученный быстрым замораживанием расплава) плавится при+ 14°С. Ки в ы д#3 ы <т я… [… I-о-CI-а2.35 А!•• ! — Ки «•!* «Я-ДИ— Эл! Джей, 061 а \ С | у С * а д = 2, х * фи Рисунок VI1-16.Цепочка кристаллов хлорида йода. Кристаллы в форме как Красного (ce), так и коричневого (P) состоят из почти плоских зигзагообразных цепочек, которые отличаются относительным положением разветвленного атома хлора (рис. VII-16).
Молекула 1C1 полярна (q-1.24), а связь I — CI характеризуется длиной 2.32 а, энергией 50 ккал / моль, постоянной силы 2.4.Во время электролиза расплава 101 часть йода смешивается с катодом. Это свидетельствует о наличии равновесия в жидкости по схеме:101 + 101 ** I * + 10 -.Хлорид йода склонен к hypothermia. In жидкое состояние, Кскл можно растворить.
Rbci в данный момент, менты! (За исключением NaCI или LiCl) и хлорида поливалентного элемента (PCI5.Осторожное».АПК и другие).Сам цвет 101 (добавьте 12), как и в случае с йодом. Зависит от природы растворителя: если нет сольватации, то он коричневый (например, CC1″).Если присутствует, желтый (например, воздушно-капельный).
Вода ICI частично гидролизуется(по формуле 5101 +ЗН, 0 = 5НС1 + 2 \ g+ Нуа).Но желтый раствор в соляной кислоте стабилен (так как равновесие смещено вправо по схеме 101 + 01 ′ * * * — lClJ). Хлорид иода широко использован как хлорированный йод эля в органическом синтезе. ВХ-и7. Конструкция 1as1v. Вещество. Преобладание определенных химических функций зависит от conditions. So 101 сам будет хлорировать фенол, но в растворе нитробензола он будет йодирован, и в CC1 обе реакции (2-е первенство) будут протекать параллельно.
Вероятно, различие в таком химическом действии зависит от основной формы присутствия самого хлорида йода при других условиях. Раствор нитробензола) йодат. 31) твердое и о д и Р и Х Л О Р И Д образующее тепло от элементов составляет 21 ккал / моль. Его кристалл состоит из молекулы IjCU и показан на рисунке. VII-17 плоская конструкция.
Проводимость расплавленного трихлорида(101 и др.) вполне good. In пар, равновесие * 101 +С12 как 1С13* * смещается почти полностью вправо. Раствор IClj в сильной соляной кислоте * Николаев II. S .. Ы м х о д ы р х О П В. Ф.. Шишков Ю. Д.. Л ленчиков » И. Ф. Химия галогенированных соединений фтора. М » Наука. 348 С. Лот характеризуется равновесием, смешанным справа по схеме: HCI-r Yu «* * HICI » * * * H * * * f 1C1 ^.
Они используются в органическом синтезе и анализе сульфидов minerals. In более разбавленные кислоты, реакция 21С1+ЗН20 = ну » + — f hlclj-F 4hci происходит. 32) теплота образования ИБР из элемента составляет всего 2 ккал / моль, и термическая диссоциация его паров очень важна(почти при нормальных условиях).Бромид йода частично диссоциирует в жидком состоянии.
Муфта I-Br характеризуется длиной 2,52 а, энергией 43 ккал/ моль, постоянной силы 2.0.In различные растворители, норбромид производит красный или желто-оранжевый раствор. 33) синтез HBr из элементов протекает при 200-300°C со скоростью, которую можно измерить по следующему уравнению: Br?-Ф-46 ккал = 2 спальнями (начальное возбуждение), ВГ + Н2 = Евр.-ф. Н. тогда Р + Бр= Евр. + БР и др.
В отличие от синтеза HCl (§ 2), 2-я реакция более сложна из-за ее эндотермичности (17 kx, моль), а обратная реакция H + HBr = H2-f Br легче. Реакция I-fH2 = si = HI + H является далее эндотермической (33 ккал.\ b), поэтому синтез HI протекает как нормальная, а не цепная реакция. Норма двухмолекулярного типа (IV§ 2 перм.3). 34) энергии связи H_Br и I_I составляют 87 и 71 КСИ / моль соответственно.
Константы их сил равны 3,8 и 2,9. Биполярные моменты молекул HBg и HI составляют 0,83 и 0,45.А его ионизационный потенциал-11,6 и 10,4 вв. Жидкий галогенид водорода характеризуется температурами кипения 2,2 (HBg) и 2,8 (HI) г / см3, теплотой испарения 4,2 и 4,7 ккал / mol. As растворитель, они подобны HCI(§ 2 add.24).
Энергии диссоциации молекул NG в свободные газы, отличающиеся от ионов H *и G, составляют 363(HF), 325(HCI), 315 (HBr) и 307 (HI) ккал / моль. Теплота образования Ат от элемента оценивается в −25 ккал / моль. 35) судя по характеру Терро-изменений в образовании Галогенида водорода( галогенида водорода), их термическая стабильность должна быть значительно снижена от фтора до iodine.
In дело в том, что разложение HF на элементы становится заметным только выше 3500 ° С, в то время как в других галогенидах водорода оно составляет 1000 см3 со степенью диссоциации 0,0014(HCI). 0.5(HBR) и 33% (привет).Органический растворитель (бензол n. L. In) весь галогенированный водород гораздо менее растворим, чем Уилл. 36) как и в случае хлористого водорода, HBg и HI составляют 47% HBg (mp.126°C) и 57% HI (mp. Образуют азеотропную смесь с водой, содержащей 127°C).
Для обоих галогенидов водорода известны кристаллогидраты, содержащие 2, 3 и 4 молекулы воды. Как для брома, так и для йода было получено нестабильное производное типа INRHTHT, аналогичное соответствующему хлориду (§ 2, дополнение 34).Где r-органический радикал. 37) увеличение электролитической диссоциации при переходе от HF к HI, вероятно, связано с уменьшением поверхностной плотности отрицательного заряда галогена вследствие увеличения ионного радиуса (v§ 5).7).
В неводных растворителях галогениды водорода обычно ведут себя как неэлектролиты или слабые electrolytes. In в этом случае обычно наблюдается более быстрое увеличение ионизации за счет увеличения содержания ртути в атомном числе галогенов, чем в водной среде solutions.
So, в пиридине константа диссоциации Галогенида водорода имеет следующее значение: 3-10 9 (HF). 4 * 10 «(HCI). Я * 10 «(Евр.). 3-10 «(привет). 38) пропуская HjS через водную суспензию йода, удобно приготовить раствор гидрокарбонатной кислоты (концентрация до 50%).
Реакция протекает по следующей схеме: Ij-f-H2S = 2HI + S. свободный йод, образующийся при окислении, немедленно превращается обратно в HI. 39) свободный йод, выделяющийся при частичном окислении гидроиодной кислоты, не осаждается, а остается в растворе за счет взаимодействия с избытком G-ионов по схеме: i ’ + Ia = — f 4 ккал / моль.
Точно так же ничего не происходит. Br, Clj и Ион Г образуются различными галогенами (кроме фтора).Ионный Г, образующийся в растворе, находится в равновесии с продуктами его распада: Г, 7 ″ * * Г24-Г ’.Стабильность ионов Гd зависит от природы галогена n и характеризуется следующими константами равновесия. М г г С1, ВГ и Cusp до 0,2 16 700 Как видно из представленных данных, в серии CI-Br-I стабильность Т ^Иона быстро возрастает.
Разбавление и нагревание раствора способствует перемешиванию равновесного справа и большей концентрации G слева. Результатом наличия такого равновесия является более высокая растворимость свободных галогенов в растворе галогенидов по сравнению с чистой водой. 40) система 3G 1e + 2e часто служит в качестве рабочей среды для химического и электрохимического оборудования для работы со слабым током.
VII-I8, простейший хемотрон, изображенный на рисунке, представляет собой небольшой герметичный контейнер, заполненный раствором Ki с добавлением небольшого количества свободного йода (то есть содержит много ионов Vp и небольшое количество ионов 13).
Из 2-х платиновых электродов припаяны линейные (.4) рабочая поверхность мала, и рабочая поверхность сетки (B) большая. Если вы включите ток с такой настройкой, reactin будет работать с 3L ’ — 2e-I, — анодами и+ — катодами. Электрод а поется, и электрод а поется. А если катод B, то рядом с первым(из-за высокой концентрации в растворе) находится много ионов I, а рядом со вторым электродом(из-за его большой поверхности) также много ионов, и ток течет свободно.
Напротив, небольшой запас ионов 1e вблизи катода а исчерпывается практически мгновенно, и ток практически отключается off. So, рассматриваемое оборудование служит выпрямителем слабого переменного тока малой мощности frequency. In в целом, различные типы хемотронов находят самое разнообразное техническое применение (например, системы управления ракетными двигателями). 41) » алонда.»
Значение константы равновесия гидролиза заключается в следующем: Я s. u-1® В щелочной среде эффективны различные интерпретации гидролиза свободных галогенов. То есть, согласно схеме, Г,+ОН ’ног + г’. 42) возможно, реакция по схеме могла бы быть удобным способом получения Бром-статиновой кислоты. Ag2SO + Br2 4-Ba (OH),= 2AgBr | + BaSO»| — f 2HOBr. Перегонка раствора новг(к = 2-10?) Может выполняться только при пониженном давлении (4-30 см3 или менее).
Хой не дистиллируется вообще без разрушения. Обе кислоты известны только в растворе (новг-до 30% концентрации).Особенно нестабильная йодная кислота может быть стабилизирована в некоторой степени добавлением йода(результат равновесия HOI 4-b * * I13). Константа диссоциации кислотного типа (/(=2-10″) в HOI даже меньше основной константы диссоциации (3-10-10). в реакции по формуле H * 0 4-H2OI ’ * * — f HOI была получена константа равновесия. / С = * 3-10-2.Это означает, что (в HjO’j-1 (и отсутствие ions-ионов), форма hjoj-Иона (т. е. I*) составляет более 3 мин 1 от общего объема растворенного HOI.
Необходимо учитывать n, а также основную диссоциацию NOVg, и даже FNL(§ 2 add.39). Диаграмма VII 18.Схема jgiocttrftui » РО hsmo * Трой *. IH1 [П | ноги]_ » г сі ВГ IIJ Д К З-ю-4 4!0-9. Из солей обеих кислот в твердом состоянии выделяли только kovg•ZN20 N кристаллический гидрат N’aobr, содержащий 5 и 7 молекул воды. Все эти бледно-желтые соли очень неустойчивы, и при нагревании(или подкислении раствора) они быстро разлагаются на соответствующие бромиды и броматы. 43) L при 200°C.
В результате термического разложения iBr03 был получен бромид лития-LiBr02.Это белый порошок, уже в присутствии следовых количеств воды, формула 3LiBr02 = 2l. разложите согласно iBr-f NWrOe. At при температуре плавления (225°С) он разлагается на LiBr n 02.Свойства Ba (Br2)2, полученные аналогичным образом, также характерны для диалогических характеристик.
44) при низкой температуре (порядка −50°С) бром окисляется озоном по реакции:403 + 3Br} = 6BrOj полученный бром (теплота, выделяемая из элемента— 13 ккал ’ мил) стабилен только при следующем: −40°С. 1. одним из продуктов термического разложения в вакууме является оксид брома (Br20), который плавится при температуре −17°С(разложение) и образует воду и новг. СС1 подвеса.«Он только стабилен ниже-404С. подобный оксид йода известен только в виде двойных соединений оранжево-красного цвета с пиридином-120•4C3II5N.
45) со скоростью реакции ZNOG-2NG-4-NG03, переходом от хлора к Брому и даже более so. As для брома экспериментально установлено, что он будет максимизирован при равных концентрациях Hg ’и HOBg. Это предполагает активное участие в процессе молекулы нзобромосульфатной кислоты-HBrO (см. Приложение 2 к§ 42). С II бромом и йодом реакция, вероятно, протекает через промежуточное образование ионов GO, но производные обоих элементов, подобные хлоридам кислоты и хлорита, неизвестны.
Взаимодействие NG и IG сильно накладывается на основной процесс, описанный выше. Таким образом, общая формула для разложения бромированной и йодированной кислот принимает вид приблизительно 5NOG = NGO » 4- + 2G2 + 21LO. 46) особенно при следующих реакциях может быть получен раствор бромата: 5AgBrOa + 3Br2-fЗН20 = 5agbrj-f ghbroj.
Их можно концентрировать до 50% содержания(то есть в составе почти HBr (3)•7H20).И окисление. Кислотные свойства PVYU3 почти такие же. Например, PSYU3. Для ионов VU-1,78 л n /(BrO) дается. Овго 112°. 47) в частности, в реакции Li-5SC + 6HjO e 2HIOj + IOHCl, когда хлор действует на водную суспензию йода, йодная кислота является formed.
So, если вы добавите избыток хлорированной воды к раствору йодистой соли, цвет йода, который впервые появился, снова исчезнет. Для получения НУ3 (/(=2-10′), обычно используют взаимодействие йода с сильной азотной кислотой: i2 + iohno3-2НУ3 + I0NO * — f4н20.Закись азота удаляется путем пропускания струн воздуха через жидкость.
Кристалл 浮遊3, плавающий в н0вс (происходит переход к hi03-i205), если молекула HiQ*, 4( 10)=!。Он задается 80 A (2 связи) и 1.90 A (1 связь) r0—98′, а для времени IOJ значения</(10)= 1.82 A и ZOJO = 97 e. In раствор йодной кислоты, равновесие pN 10 $(HU3) N. здесь n 2 или 3. 48) CI_Bg_I растворимость солей, полученных из ряда NG03 кислот обычно decreases.
An примером могут служить следующие данные(20 молей на литр H20 при 20°C): N’acioj XaHrOj NalOj | KSU3 KBrOj KJOj 9.2 2.3 0.46 I 0.58 0.41 0.38 В отличие от HSCiS и HBrO3, йодная кислота характеризуется совместной кристаллизацией со своими солями. Известен Ка10з * 2нюз. KY3-UY3. K / 0 $ — 2H10j и так далее. Некоторые продукты были также получены с добавлением ангидрида йода к йодиду, например, КУ31гО $ (MP 316 с).
Такие соли иногда считают производным «трийодоксовой» кислоты-N1D. аргументом в пользу такой интерпретации является возможность получения свободного HIjOe, как путем частичного пиролиза NU*.Причем, путем перекристаллизации из концентрированного HN’OJ. Однако «молекула HLO» состоит из отдельных молекул IHOj и атомов йода и атомов кислорода Существует только сильное межмолекулярное взаимодействие.
49) в отличие от других оксидов галогена, 120 долларов-это экзотермическое соединение(образующее тепло 44 ккалиола).Факт получается при постепенном нагревании H105 до 120°C и длительном твердении при этой температуре. Безводные кристаллы йода состоят из < /(01)〜1.77-g 1.83 a 021-0-10 молекул со значением. Z010 = 93-102°концевых частей и</(10)= 1.92-g 1.95 A,£101139е-для центральной части.
Безрецептурные препараты обычно имеют розоватый или желтоватый оттенок (из-за наличия следовых количеств свободного йода).Ангидрид йодистой кислоты разлагается постепенно на свету и очень сильно нагревается. hygroscopic. It главным образом использован для того чтобы определить окись углерода в анализе газа(основанном на реакции 120 & -f5C0=-5С02-F12).
50) бром под действием тлеющего разряда на смеси пара и избыточного охлаждающего кислорода образуется триоксид бром-бром-бром-Бро3 (возможно, двумерная форма-Br2Ob).Этот оксид (ранее ему приписывалась формула Br * Ov) представляет собой бесцветное кристаллическое вещество, которое устойчиво только при температуре ниже −70°.
Как HBrOj и PVr04, он, кажется, образует воду и 2 кислоты. Последние быстро разлагаются на HBrOj и кислород. Взаимодействие между Br *и избыточным озоном привело к образованию Br3Oe и Br2Os , но Br20 не удалось. Поэтому проблема более высокого бромата остается. Двусмысленный.
51) известен пятикратный оксофторид йода и брома. Когда раствор 1205 охлаждают кипячением IF, бесцветные кристаллы 10Fj являются released. In кроме того, если ток фтора прикладывается к раствору 120 *в жидком HF, получается белый порошок i02f. Вблизи POSC (в сухом азоте) равновесие 2IOF3 ** IFs 4-I02F устанавливается между обоими оксо-фторидами, и при нагревании оно перемещается в правую сторону и в левую сторону при охлаждении.
Молекулы масла имеют искаженную трехбуквенную пирамидную структуру, содержащую О. I, атом F в основании, 2 атома F в вершине 1 < / (10)= 1.82,d(IF)* = 1.74. 1.83. 1.90 а].При взаимодействии озона с раствором брома Брфс при −5°С образуется бесцветный Бром(Мп.- 9°C) полученные BRF, бром и кислород уже разлагаются при температуре 50°C и выше. Более или менее интенсивное взаимодействие всех 3 оксо фторидов с водой образует HF и соответствующую кислоту IGO
52) k10j может получить композицию солей kiojfj путем обработки концентрированным HF. Ионы 10aF7 имеют треугольную b-пирамидную структуру, в которой 1 в направлении основания треугольника замыкается свободной электронной парой атомов йода (рис. VI1-19). 53) несмотря на неоднократные попытки, бромистую кислоту впервые получили в 1968 году.
В нормальных условиях его бесцветный раствор стабилен примерно до концентрации GM (55%).Более сильный раствор желтеет во время хранения(поскольку HBrO восстанавливается до свободного брома).в качестве окислителя бромная кислота намного сильнее хлорной кислоты, но она окисляется медленно(например, хлорная кислота). «Растворимость KBrO при комнатной температуре составляет около 0,2 м. То есть она несколько выше, чем растворимость KC10″(рисунок VII-5). Бро Иона] » РФ (Бро) −1.61 л тетраэдра.
Пероксид калия термически стабилен при температуре 280°C (против 610°C в КСК).Канавки и аммониевые супербайки-это KH BrO. Пи: С. В | М9.Здания 54) в качестве кислоты NU «(K-3-I0» 2) слабее йода. Напротив, он более активен (но меньше, чем HOI), чем HlOj в качестве окислителя. Отношение » ну » к воде очень интересно. В этих условиях соединения общей формулы (НУ.)* * •НГО) могут быть получены очень мало.
Со всеми такими соединениями водород воды может быть заменен металлом таким же образом, как и сам водород IE. И присвоить им следующую формулу: «» (/i 1., n = 0).Из 1С), (==I. m = I).Il4lj09 (n-2,m = 1)!Хьо (Л. И.) 2).Например, были получены K «ljO *и следующие соли серебра: оранжевый AglO», красный AgjIHOs. Агджой Ин black. AG $ IO в зеленовато-желтом AggHjIOe и черном цвете.»2) как показано в виде h5yu <5 основной кислоты (Ki = 3•10kg-o-10 A Kg-1-10!Я.)
Молекула H * 10 ′ представляет собой слегка искаженный октаэдр(5 < / (J)■= 1,98 и!< / (IO)= 1,78 D1.In в кристалле водородные связи реализуются между такими молекулами (2 < / (00)= 2.60 и 3 < / (00)»= 2.78 Д].При нагревании HslO (mp 80 с деградацией до HgO, IjO и Og) в вакууме до 4 дает Н «1А (подозрительно), до 100NU».Бесплатно P3105 выделяться не будет. Структура Иона IOj представляет собой октаэдр с ПОДом в центре[rf (IO)= 1.85 A. J. соответствует не-ю-тетраэдру [</(10) 1.79 A] с йодом в центре.
Силовые константы соединения I-O равны соответственно 3,7 и 5,7. 55)с взаимодействием университета и 65%Олеумом образуется оранжевое твердое вещество. Судя по результатам работы ayaln. It нредставляется сам ангидрид-1рог. Его свойства до сих пор не изучены. Двойное подключение по мод*~!^ );; Вероятно, желтый продукт пиролиза H & U в вакууме 110cc.
56) йодат, как правило, слабо растворим в воде. Некоторые из них очень термически устойчивы(например, Найлоф. Выдерживают до 800°C без разборки).Пери-иодат обычно получают действием хлора в щелочных средах на соли йодной кислоты (например, реакцией NalOj-4NaOH + Clj = Na3H} I06 / + 2NaCl + HiO) или электролизом раствора солей HO.
57) сообщалось, что пиролиз Магк «образует CAG при температуре около 200°C».Магнитные свойства препарата, по-видимому, подтверждают, что это вещество является производным и » Т » валентностью iodine. It стабилен до 370°C и быстро разлагается в воде до йодированной и Т-фазы. Таким же образом были получены и некоторые другие соли, возможно производные 6-валентного йода.
Есть обзорная статья о кислородных соединениях этого элемента. • 58) пентафторированный йод оксо-фтор (FIO3) получают с безводным IG по следующей реакции:2НУ » + 2fj — = * 2hf + 2fioj + 02.Его высоколетучий аналог бромида, FBrOj, был получен путем взаимодействия KBrO и SbFj в безводном i1f. Fluorobromotrio trioxide, FCIOj (§ 2 ext. C8) и характеристики аналогичны. Но он более химически активен. 59) Еще один оксо-фторид йода за полцены-Олфс, и это бесцветная жидкость (Мп. Около-15°С). Он был приобретен, если взаимодействие.
Использовать Сиот. Пентафторидная молекула оксо-йода имеет слегка искаженную октаэдрическую структуру. Известен также состав ОКСОФТОРИДА io3f3 (mp 41 eC). HOIOF4 (Мп.3GrC) получают из полураспада йода-Окси-фтор, который является очень сильной кислотой. Имеются также указания на то, что при взаимодействии F202 с BrFj может образовываться оксофторид (FjBrOj)*, аналогичный соответствующему соединению хлора(§ 2add.69).
60) кроме вышеупомянутых соединений оксигенации брома и йода известно еще несколько. Из них наиболее интересными являются производные трехвалентного йода, которые играют роль металла. Например, стабильный желтый 1 (N03) 3 был получен только при температуре менее 0°C. желтый 1РО».Желто-зеленый 1 (СУ») 3 * 2}} 0 и бесцветный * Дрогвок и М » Пачи совель.
Успехи в химии. 1968, Nt 1, 537. I (CHjCOO) j. при электролизе последнего енола из катода выделяется йод, что доказывает его положительный заряд. Бесцветный Br (N03) 3 известен из аналогичных производных брома. Солеподобные производные одновалентного йода и брома сами по себе очень нестабильны, но некоторые из них очень стабильны в виде бинарных соединений с пиридином.
Например, желтый 1N03 разлагается при −5°C и выше, в то время как бесцветный 1N03-2QHsN плавится при 138°C. желтый BrNOj(mp.-42 * C) и бесцветный BrN03-2C5H5N (mp.80 CC) также имеют аналогичные characteristics. In известны также некоторые органические кислоты, перхлораты, сходные по составу с солями, полученными из нитратов и одновалентного йода.
Наиболее интересным из этих производных Бр *является хлорная кислота бром, который получается по реакции Бк2-Ф-2C1Ciu = Сl2-Ф 2BrCiu при −45°C и представляет собой красную жидкость, которая разлагается медленно, без заморозки при температуре −78°C, уже при −20°С; озонирование Brn03, в результате чего получается очень неустойчивый оранжевый цвет.
Растворение смеси 2l3-f 31 * 0 $ (эквивалентно 51203) в концентрированном H2SO образует» желтые (10) 2SO » кристаллы, которые распространяются в воздухе. Ч? Когда так дымится, он » обрабатывается и, по-видимому, отбеливается переходом на (IO) HSO.«Лечение с помощью сульфата йода воды! А и желтый малорастворимый порошок, сопровождающийся выделением композиции 120».
Этот оксид, который разлагается при 100 ° С и выше 1205, следует рассматривать как основной йодат трехвалентного йода — (10) 10 * При обработке йода озоном желтоватый порошок растворяется (разлагается)в воздухе состава I4O9.По-видимому, это средняя йодная соль трехвалентного йода-1 (103) 3. При температуре 75 ° С и выше йодат трииодит разлагается с выделением йода. 61) астат немного менее летуч, чем йод.
Из разбавленного раствора азотной кислоты не перегоняют (в отличие от йода). в солянокислых средах он осаждается с Bi2S3 и Sb2S±, а при обработке осадка сульфидом аммония Ат частично переходит в раствор. Состав полученного соединения не установлен. Наиболее концентрированным раствором испытуемого соединения астатина было 10 С. М. Самый мощный окислитель (особенно HOC1) астатин окисляется до Иона AU^.
Известь и другие более низкие положительные валентности Ат, возникающие в результате обработки более слабым окислителем (Br2, HN03 и др.).Очевидно, что в этих условиях не овес является formed. It также было установлено, что астатом (At*) может замещать йод в производных типа IX•2CjHjN (X = N03 или СУ4).
Раствор FeSO восстанавливает состояние окисления Ат до его основного состояния. Действие sncl-1-astat в Zn (или щелочи) в кислой среде может быть дополнительно уменьшено до at-ионов. Последний легко окисляется до элемента Ат. У Мот Астату есть обзорная статья. •
Смотрите также:
| Хлор | Окислительно-восстановительные реакции |
| Адсорбция | Подгруппа марганца |
