Оглавление:

















Хлор
- Хлор хлор в природе близок к фтору, процентное содержание которого составляет 0,02% от общего числа атомов в земной коре, а в организме человека содержится 0,25% хлора. Основные формы хлора, присутствующие на поверхности Земли, соответствуют экстремальным atomization.
- As в результате работы воды, которая в течение миллионов лет разрушала горные породы и вымывала из них все растворимые компоненты, в океанах накапливались соединения хлора. Хлор, наиболее практически важный из всех галогенов, используется в больших количествах при отбеливании ткани и бумажной массы, обеззараживании питьевой воды (1 м3 на 1,5 г) и других технических областях.
Сушка последних привела к образованию сильных отложений NaCl, которые во многих местах по всему миру служат сырьем для всех соединений хлора. Людмила Фирмаль
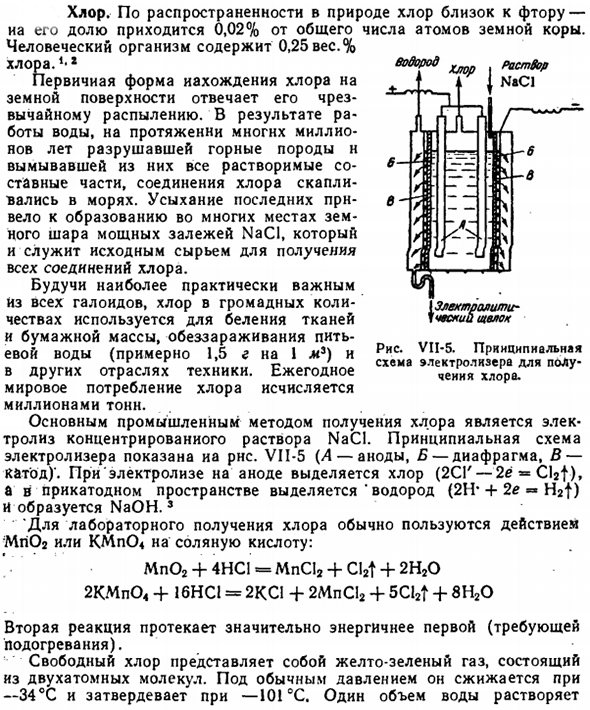
Ежегодное потребление хлора в мире составляет несколько миллионов тонн. Основным промышленным способом получения хлора является электролиз концентрированных растворов NaCl. Принципиальная схема электролизного бака показана радаром. VI1-5(L-анод, B-диафрагма, C-катод)’.При электролизе из анода выделяется хлор(2СГ-2ё «CIST»), а из катодного пространства выделяется» водород (2Н * + 2е » h2t)», образуя NaOH. «
При производстве хлора в лаборатории мы обычно используем действие Mn02 или KMpO *на соляную кислоту. Mp02 +4НС1=МпС12+ Cl2t +2Н202КМп04+16НС1=2КС1+2МпС12+ 5Cl2t +8Н20 Вторая реакция протекает гораздо более энергично, чем первая(требует нагрева). Свободный хлор-это желто-зеленый газ, состоящий из двухатомных молекул. При нормальном давлении он разжижается при −34°C и затвердевает при −101°C. 1 емкость воды растворяется Раствор NaCl {Электролит-Рожь Диаграмма VII-5.Схематический вид электролизера для получения хлора. Около 2 объема хлора.
Полученный желтоватый раствор часто называют «хлорированной водой».4-11 Хлор имеет резкий запах. Вдыхание вызывает воспаление дыхательных путей tract. As применяется первая помощь при остром отравлении хлором, вдыхание паров смеси спирта и эфира. Вдыхание паров аммиака также помогает 12 В своей характерной химической функции хлор подобен фтору-он также является металлоид одноатомных.
Но его активность ниже, чем у фтора. Таким образом, последний может вытеснять хлор из соединения. Несмотря на это, химическая активность хлора очень высока, он сочетается практически со всеми металлами (только в присутствии следовых количеств воды или при нагревании) и всеми полуметаллическими элементами, за исключением C, N, O. на железе. Это позволяет хранить его в стальном цилиндре. H2 + CI2 =2НС1 + 44 ккал реакция хлора и водорода В нормальных условиях она протекает очень медленно, но при нагревании смешанного газа или его сильном освещении (прямые солнечные лучи, горение магния и др.) сопровождается взрывом.
Детальное изучение этой реакции позволило выявить сущность отдельных этапов. Во-первых, с энергией ультрафиолета (или нагревания) (hx) молекула хлора диссоциирует на атомы и вступает в реакцию с молекулами водорода с образованием HCI и атомов водорода. Последние, в свою очередь, вступают в реакцию с молекулами хлора с образованием NS! Атом хлора и др.: 1) CI2 + ftv = Cl + CI (начальное возбуждение) 2)…….. CI +Н2=НС1 + Н 3)……………. Н + С12 = ХК! + Сі д.
Таким образом, получается серия последовательных реакций, в результате которых на основе каждой молекулы С12, возбужденной в первую очередь, образуется в среднем 10 миллионов молекул HCl. Этот тип реакции называется цепной реакцией. Они играют важную роль во многих химических процессах. 8 и 19 Массивный ХК! Технически он получается как побочный продукт хлорирования органических соединений (схема RH + C12 = RCI + HC1, где R-органический радикал).Но прямой синтез наиболее важен для получения чистой соляной кислоты. acid.
In в этом случае хлор и водород, которые выделяются одновременно при электролизе раствора NaCl, выступают в качестве сырья material. By смешивая оба газа только в момент взаимодействия, обеспечивается щадящий процесс, основанный на взаимодействии NaCl и концентрированной H2S04 в реакции 20 NaC! + H2S04 = NaHS04 + HCIf NaCl + NaHS04 = Na2S04 + HCIf Первый из них протекает в значительной степени даже в нормальных условиях, почти полностью-при слабом нагреве.
2-й выполняется только при более высоких температурах. Для этого процесса используются специальные механизированные печи с высокой производительностью. 21-22 Хлористый водород (гидрохлорид) представляет собой бесцветный газ. Если нет влаги, это не повлияет на нормальную температуру Большинство металлов и их оксидов. Газообразный кислород окисляется только при нагревании.
В воздухе хлористый водород дымится из-за образования капелек водяного пара и тумана. Его растворимость очень высока, и в нормальных условиях 1 объем воды может поглотить около 450 объемов хлористого водорода. Водный раствор HCl называется соляной кислотой (также известной как соляная кислота).это одна из самых мощных кислот. Обычно плотность реактивной соляной кислоты составляет 1,19 г! В см3 он содержит около 37% хлористого водорода.
Его состав близок к формуле NS13. 5N20. 27-ЗЗ Как и другие сильные кислоты, HCl бурно взаимодействует со многими металлами, оксидами металлов и т. д. Его соли называются хлоридами или хлоридами. Большинство из них очень хорошо растворимы в воде. Среди наиболее распространенных производных металлов хлорид серебра и хлорид свинца практически нерастворимы. Мировое годовое потребление соляной кислоты составляет несколько миллионов тонн.
Многие из его солей также широко используются 34 Прямое взаимодействие хлора с кислородом не приводит к образованию кислородсодержащих соединений chlorine. It можно получить только косвенным путем way. To рассмотрим способы их образования, рекомендуется исходить из обратимой реакции между хлором и водой: Cl2-fH20+ G ккал = r = * НС1-fнсо! В нормальных условиях примерно через 3 минуты 1 часть общего растворенного хлора гидролизуется в насыщенном растворе.
Тридцать пять 2 кислоты образуются при гидролизе хлора-соляная кислота и хлорноватистая кислота (HOCI) — первая кислота очень сильная, а вторая кислота очень слабая (слабее угля).Эта резкая разница в силе обеих кислот может быть использована для их разделения. Когда порошок мела(CaCO3) встряхивают с водой и затем пропускают хлор, образующаяся соляная кислота вступает в реакцию с мелом (по формуле: CaCO3 + 2HCI = CaCl2 + CO2f + H20), а затем в растворе накапливается хлорноватая кислота.
После перегонки реакционной смеси, вы можете воспользоваться специальным! Разбавленный раствор получают в приемнике. Будучи нестабильной связью, нос! Он медленно разлагается даже в таком разбавленном растворе. Гипохлорит называют м и или Г и Поль р и т и М и называют хлором. Сам HOCI и его соли являются очень сильными окислителями. 36-39 Практический способ получения гипохлорита основан на использовании описанной выше обратимой реакции хлора и его взаимодействия с водой.
Поскольку оба вещества(HCl и HOC1) в правой части уравнения производят в растворе не Н1, а оба исходных продукта (С12 и Н20) не образуют таких ионов (точнее, они почти не образуются), можно сдвинуть равновесие вправо, объединив ионы Н. Самый простой способ добиться этого-добавить в реакционную смесь какую-нибудь щелочь. Когда образуется Ион H, равновесие смещается почти полностью вправо, потому что Ион OH связывается с недиссоциированными молекулами воды.
Например, если вы используете KOH、 С12 + Н20 нос! + На! HOCI-f NSC-2KON-CBS! + Копы! + 2H, 0 или вообще: Cl2-f 2KOH = CBS! — Ф коп! + Н20 Так, в результате взаимодействия хлора и щелочных растворов получается смесь гипохлорита и соляной кислоты.Полученный раствор гипохлорита обладает сильными окислительными свойствами и широко применяется при отбеливании тканей (хлопка и льна) и бумаги, поэтому этот процесс имеет большое техническое значение.
Дешевая щелочь с хлором-Ca (OH) 2 («гашеная.Лайм>) — о R во взаимодействии с xl и я лайм.Реакция может быть приблизительно выражена формулой: C1 С12 + Са (он) 2 = Са / + Н20 \ ) С1 В зависимости от того, какой отбеливатель представляет собой смешанную соль соляной кислоты и хлорноватой кислоты.Белый порошок с сильными окисляющими свойствами, в основном используется для дезинфекции. Свободную хлорноватую кислоту называют параллельной реакцией, так как она претерпевает в растворе 3 вида превращений, но они происходят независимо друг от друга.
1) нос! = На! + 0 2)2H0CI = H20 + C120 3)3H0CI =2НС1 + НСУз Все эти процессы могут протекать одновременно, но их относительная скорость во многом зависит от существующих условий.Изменяя последнее, вы можете осознать, что трансформация идет почти полностью в одном направлении.
Под воздействием прямых солнечных лучей разложение хлорноватой кислоты протекает вдоль первого из them.It также протекает в присутствии кислорода и веществ, которые можно легко добавлять в некоторые катализаторы (например, соли кобальта).Сорок шесть При распаде по 2-му типу получается газообразный продукт-оксид хлора (С120).Эта реакция протекает в присутствии водосодержащих веществ (например, CaCl2).Оксид хлора-это взрывоопасный газ желтого цвета, который имеет запах, схожий с запахом хлора.
Благодаря действию C120 на воду образуется HOCI.То есть оксид хлора представляет собой гипохлорит безводный 47 Коллапс Н0С1 по третьему типу особенно легко происходит, когда heated.So, влияние хлора на термический щелочной раствор выражается следующим уравнением суммы: 3CI2 + 6KOH = KSU3 4-5KCI + знание Продуктами реакции являются KCl и калиевая соль хлорной кислоты (HC103).Эта соль слегка растворяется в холодной воде, поэтому при охлаждении раствора она выпадает в осадок.
Свободный NSSC может существовать только в пределах solution.It имеет сильную кислоту(HC!И HNO3 почти таким же образом диссоциирует) и является сильным окислителем.Соответствующий ангидрид неизвестен. В отличие от свободного НСК, окислительные свойства раствора нехарактерны для его солей (хлорат-токсичен или хлорат).Большинство из них бесцветны(как и сам HC103) и легко растворимы в воде.
Они все очень токсичны. Осторожно восстанавливая хлорат, можно получить диоксид хлора (ClOj) — взрывоопасный желтый газ с ярко выраженными окислительными свойствами. Взаимодействие между СУ2 и раствором Koh происходит медленно в соответствии со следующим уравнением: 2С102 + 2КОН = КСЮЗ +102102+Н20 Образование 2 кислых солей-хлора и хлорида. Сама хлорная кислота (HCL2) нестабильна.
Прочность и окислительная активность являются промежуточными между HOC1 и HSC. Его соли (хлорная кислота или хлорит) используются для отбеливания тканей 57 При нагревании Ксю3 плавится, около 400°С начинает разлагаться, и разложение может протекать в 2 основных направлениях. 1)4КСЮ3 + 4КС1 + 602-Ф 43 ккал 2)4КСЮ3-КС1 + Зксю4 + 41 ккал Реакция протекает преимущественно в первом типе в присутствии катализатора (MnO2 и др.), а во 2-м типе-в отсутствии.
Перхлорат калия (или перхлорат калия), который образуется при разложении 2-го типа, очень плохо растворим в воде, поэтому легко отделяется от растворимого хлорида калия. Под действием концентрированного сернокислого перхлората калия свободная хлорная кислота (HCl4) может быть obtained. It представляет собой бесцветную, сильно дымящуюся жидкость в воздухе. * khso4 + hcio4 KSU4 + H2SO、 При пониженном давлении, HCl4 перегоняется без разложения, поэтому его легко отделить от реакционной смеси. Безводный НСУ4 неустойчив и может даже просто взорваться во время хранения, но его водный раствор очень stable.
As окислитель, НСУ * гораздо менее активен, чем нсуз, и в разбавленных растворах он практически не окисляется. Напротив, природа ее кислоты очень заметна в ней: по-видимому, она самая сильная из всех кислот. За редким исключением соль НСУ4 (рис. VII-6) легко растворима в воде. Многие из них также хорошо растворяются в органических растворителях (таких как спирт).Сама кислота, как и болячка, у большинства перхлоратов бесцветна.
Когда смесь безводного HCl4 и безводной фосфорной кислоты (P205) нагревается при пониженном давлении, в результате реакции образуется бесцветная маслянистая жидкость, представляющая собой безводный хлор. 2NSSU4 + P2O5 =2НР03 + С1207 Сильный нагрев (и удар) от C120?Он взрывается, но более стабилен, чем C120 или SJ2.При взаимодействии с водой хлорная кислота медленно образует 70 — ’ 2 О 20 40 и 30 АРК Диаграмма VII-6.Растворимость некоторых перхлоратов(моль / .Т} 0).
Название хлорного кислорода и его солей уже дано выше, но полезно сравнить эти названия: Кислота формула название солей Хлорирование. 。 HOC1 гипохлорита и гипохлорит Хлорид…..Она, хлорид,>хлорит Хлорирование. 。 。Она, хлорная кислота, «хлорат» Хлор…..Она, х л лорнок И Л Е,>перхлорат Структурная формула всех 4 кислот показана ниже. Да. старпом второй H-O-CI H-O-CI = 0 H-0-C \£H-O-C1 = 0 ^ o II О
Как видно из этих формул, валентность хлора рассматриваемой кислоты изменяется в ряду:+ 1,-f-3, — f5,-f-7. Если сравнить кислород-хлорную кислоту между собой в соответствии с наиболее важными химическими свойствами-кислотностью и окислительной активностью, то можно получить следующую схему: Повышенную кислотность NOS1НСЮ2НСю3нсю4<- Повышенный окислительный стресс
Так, изменяется кислотность-противоположность окислительной активности. Последнее, в общем, больше, чем менее стабильное acid. In дело в том, что хлорная и соляная кислоты несколько стабильны только в разбавленных растворах, а концентрация гипохлорита может достигать 40%, в то время как хлорная кислота известна в безводном состоянии.
Первые 3 кислоты в растворе постепенно разлагаются, и хлорная кислота может длиться в течение любого времени. Обычно соответствующая соль гораздо более стабильна, чем свободная кислота. Но их относительная стабильность почти одинакова 71 < Добавь 1) природный хлор состоит из смеси 2 изотопов — * ®С1(75,5%) и а7С1 (24,5%). Впервые он был получен в 1774 году (под действием МНО»соляная кислота»), но установление свойств элемента продолжилось только в 1810 году (см. и§ 5).
2) как фтор (§ 1 дополнение.2).Большая часть хлора попала на поверхность Земли из горячего ядра Земли. Даже сейчас, миллионы тонн HCl и HF выпускаются каждый год вместе с вулканическими газами. Еще важнее был такой выбор прошлых эпох. 3) при фактическом осуществлении электролиза раствора NaCl расход энергии на получение хлора 1 г составляет около 2700 Кет•ч, а полученный хлор будет конденсироваться даже при нормальной температуре и становиться желтой жидкостью.
Они хранят его в стальном цилиндре и транспортируют. Там он герметизируется под давлением около 6 атмосфер. Эти цилиндры должны иметь защитный цвет с зеленой горизонтальной полосой наверху. 4) хлор имеет критическую температуру 144°C и критическое давление 76 атмосфер. при температуре кнпэии плотность жидкого хлора составляет 1,6 г / см9,а теплота испарения-4,9 ккал / моль. Плотность твердого хлора составляет 2,0 г / см*, а теплота плавления-1,5 ккал / моль.
Его кристаллы образованы отдельными молекулами Clj (самое короткое расстояние между ними-3,34 а). 5) связи C1-C1 характеризуются ядерным расстоянием 1,98 А и постоянной силы 3,2.Термическая диссоциация молекулярного хлора с формулой Cls + 68 ккал * * 2C1 становится заметной примерно при 1000°C. потенциал ионизации молекулы C12 составляет 11,5 В, а сродство к электронам оценивается в 56 ккал / моль.
в) атом хлора в основном состоянии имеет структуру внешнего электронного слоя 3s * 3p и является одновалентным. Возбуждение до ближайшего 3-валентного уровня 3sJ3p44s требует затрат 205 ккал / г атомов. Непрерывная энергия ионизации атомов хлора имеет следующее значение (эВ): I и lit IV v VI VII (3.01 23.80 39.90 L3 07 M 96.7 114.77 7)энергия присоединения электрона к нейтральному атому оценивается в 85 ккал / г-АГ.
Электронное сродство хлора (как и других галогенов) может быть рассчитано с учетом реакций, в которых хлоридные соли образуются в отдельные стадии. Например, для NaCl: 1) N»(t) N»(g) −26 ккал) 2) / jC12 (g)=С1 ( g) — 29 ккал (теплота диссоциации) 3) На (г) — н (Г)+ Е-118 ккал (энергии шума) 4) С1 (g) — fеСГ (G) — 4-x ккал (средства, необходимые для электронов) 5) Na * (G) + CG (G) NaCl (T) + 186 ккал (энергия кристаллической решетки) всего: Na (T)+’/, CL, (G) — NaCl (T) + (X +186-1188-29-26)
С другой стороны, теплота образования NaCl из элемента экспериментально становится равной Na ®+ VaCla ®= NaCl (T)+ 98 ккал. Следовательно, по закону Гесса. Х-ф 186-118-29-26 «98.Здесь х = 85 ккал. 8) Ионы С1 характеризуются эффективным радиусом 1,81 а и энергией гидратации 84 ккал / г ионов. C1 для общего радиуса хлора? Используйте запаздывание ядерного расстояния молекулы, то есть 0.99 А.
9) растворимость хлора в воде зависит от температуры: Температура,°C. 。 …….. 9 10 ИТ. 20 25 30 40 50 60 Рустия ольмосто. IA объем I объем воды……………. 4.6 3.1 2.7 2Д 2.0 1.8 г. 4 1.2 1.0 Кристаллогидраты хлора Clj-bHaO и Cli * 8HiO 2 являются described. In дело в том, что они относятся к классу латаминов, поэтому состав может меняться(v§ 2 add.4). 10) хлор значительно хуже воды (примерно в 4 раза), поэтому хлор растворяется в насыщенном растворе NaCl, поэтому его удобно использовать при сборе хлора в жидкости.
Наиболее подходящим органическим растворителем для его обработки является четыреххлористый углерод (CC14), 1 объем которого растворяет около 50 объемов хлора в нормальных условиях. 11) основными потребителями хлора являются органическая технология (производство хлорированных синтетических промежуточных тел) и целлюлозно-бумажная промышленность (отбелка).
Значительно меньше хлора потребляется в неорганической технике, сантехнике и других областях. Интересно применение хлора, который недавно был предложен для обработки металлов. На хорошо нагретой (инфракрасным излучателем) поверхности под его действием вся шероховатость удаляется в виде летучих хлоридов. Этот способ химического измельчения может быть применен, особенно для изделий со сложным составом profile.
It также было показано, что поток хлора легко разрезает лист хорошо нагретого жаропрочного сплава. 12) предельно допустимой концентрацией свободного хлора в воздухе производственных помещений считается 0,001 мг / л. Если вы находитесь в атмосфере с 0,01% высоким содержанием хлора n, то вскоре получите тяжелое заболевание. Признаком острого отравления является появление болезненного кашля.
Пострадавший должен прежде всего обеспечить полное спокойствие, вдыхание кислорода также полезно. 13) Взаимодействие фтора с хлором при нагревании смеси сухих газов происходит не выше 270°С. В этих условиях выделение тепла(12 ккал! Моль), бесцветный хлорид фтора-C1F (температура плавления-156.Температура плавления-100 ° С) образуется. Его числители линейны (d = 1.63 A) и полярны (q = 0.65). Связь CI-F характеризуется энергией 60 ккал / моль и постоянной силы k = 4,3.Газообразный Киф имеет сильный специфический запах (отличный от запаха хлора и фтора).
Его критическая температура Плотность в жидком состоянии равна −14°С 1,6 г / см}, а теплота испарения 4,8 ккал / моль. Взаимодействие фторида и фторида Cs. RB и K под высоким давлением, полученные MClFi тип бесцветный низким содержанием соли сопротивления с линейной CIFJ Анон в состав. При нагревании он разлагается при температуре около 250°C с высокой температурой. 14) при нагревании C1F с избытком фтора получается бледно-зеленоватый хлортранфлуордин-ClFs(mp.-76, депутат.+ 12°С).Это соединение также экзотермично (тепло, получаемое от элемента, составляет 38 ккал / моль), оно пахнет CIF.
Молекула c1f3 является полярной(q = 0.55), и она показана на рисунке 1. VII-7 плоская конструкция. Последний генерируется из 3-го гона бипрамнда(III§ 6 add.5).2 направления треугольной оси замкнуты свободными электронными парами атомов хлора. Критическая температура ClFj составляет 154 ° С, а плотность жидкого состояния-1,8 г / с.* 3, теплота испарения-6,6 ккал / моль. Вблизи точки кипения 3 пары хлора несколько связаны по схеме:2ClFs * *(ClFj) i + 3 ккал.
Структура моста соответствующа для димера (типа FiCIFJCIFJ). 15) жидкий ClFj можно смешивать с жидким HF в любом соотношении, и происходит слабое взаимодействие по схеме: HF + ClFj HC1F <-f 4 ккал. Полученный аминохлортетрафторид не выделяли, но соли типа Mcifa (M-Cs, Rb, K), полученные из него, известны.
Очевидно, что масло получают не только прямыми комбинациями MF и ClFj, но и фторированием соответствующего хлорида(3000 Ат, 300 ° С). 16) нагреванием смеси CIFS под высоким давлением с избытком фтора, бесцветного хлорпентафторида-C1F $(mp.-93, депутат.-13°C) абсорбируется. Теплота образования от элемента составляет 60 ккал / моль. Молекулы CIF имеют структуру четырехугольной пирамиды атома фтора, рядом с которой находится хлор atoms.
In отсутствие влаги, этот газ стабилизирован в нормальных условиях и разлагает с water. It это фторирующий агент с энергией, но он менее агрессивен к металлам. Еще от ClFj. 17) фторид хлора характеризуется исключительной реакционной способностью. Например, в паре CIF3 стеклянная вата самопроизвольно воспламеняется. Очень стабильные вещества, такие как MgO, CaO и A1A, почти одинаково активно взаимодействуют с IM.
Потому что ClFj разжижает на комнатной температуре, оно может легко отрезать фтор на низком давлении, удобном для перевозки fluorine. In помимо различных реакций фторирования отмечена возможность использования этого вещества в качестве окислителя реактивных топлив и аннигилирующего агента для военной техники. Есть обзорная статья о трифториде хлора. •
18) фотохимическая диссоциация молекул хлора на атомы вызывается светом с длиной волны менее 550 ММК. Обе стадии цепной реакции образования хлоридов Восемьдесят семь » СНЗ K 60 A 170 A Рисунок VII.7. Структура молекулы CIF3. * Ш я направляюсь к О С Ю. I960. 6.780. Водороду соответствует следующая термохимическая формула: С14-Н2-f1kka.1= HCI +Н И Н+С= HCI + CI + 45 ккал.
Энергия активации этих первых реакций составляет 6, 2, 2 ккал! Это человек письма. 。Потому что значение этих энергий невелико, и контур развивается стремительно. Очевидно, что цепь может разорваться по мере протекания реакции: H + C1 = IS1.Такая возможность не исключена, но концентрация атома ничтожна по сравнению с концентрацией молекулы, поэтому вероятность этой реакции очень мала, и поэтому каждый атом гораздо чаще сталкивается с молекулами элементов, которые отличаются друг от друга, чем атомы.
С другой стороны, расчеты, основанные на экспериментальных данных, показывают, что даже если оба атома сталкиваются, связи между атомами не всегда имеют место. Ф «ИТЦ. VII-С. Схема установки для синтеза Хо. Рисунок VI1-9.Схемы механизации печей Вы получите УБ. Напротив, процент успешных встреч очень мал. По этой же причине маловероятно, что цепь разорвется в результате реакции: CI + C1 = C12 и H + lleHj.
So последний из них происходит в газовой фазе, при столкновении 100 с 1 млн. 19)»большая часть реакции от углубленного исследования-это цепная реакция» (И. Н. Семенов).Это часто приводит к отклонению фактической численности от соответствующего простейшего уравнения суммы (IV§ 2, 3). в частности, бимолекулярные свойства, наблюдаемые экспериментально в реакции образования воды из элементов, обусловлены природой цепи: начало цепи образуется (при энергии активации 45 ккал! Дают реакцию Н2+ 02 =20Н, после чего цепь разветвляется по схеме: H + Oa = OH + O, 0 + H * = OH + H, etc.
As видно из этих схем. Количество активных участников реакции (OH, H, O) постепенно увеличивается, в результате чего процесс протекает с самоускорением. Это также является особенностью разветвленной цепной реакции, в отличие от разветвленной reaction. An примером этого является синтез хлористого водорода, который рассматривается в тексте. 20).Максимальная температура пламени хлора водопода около 2200℃.
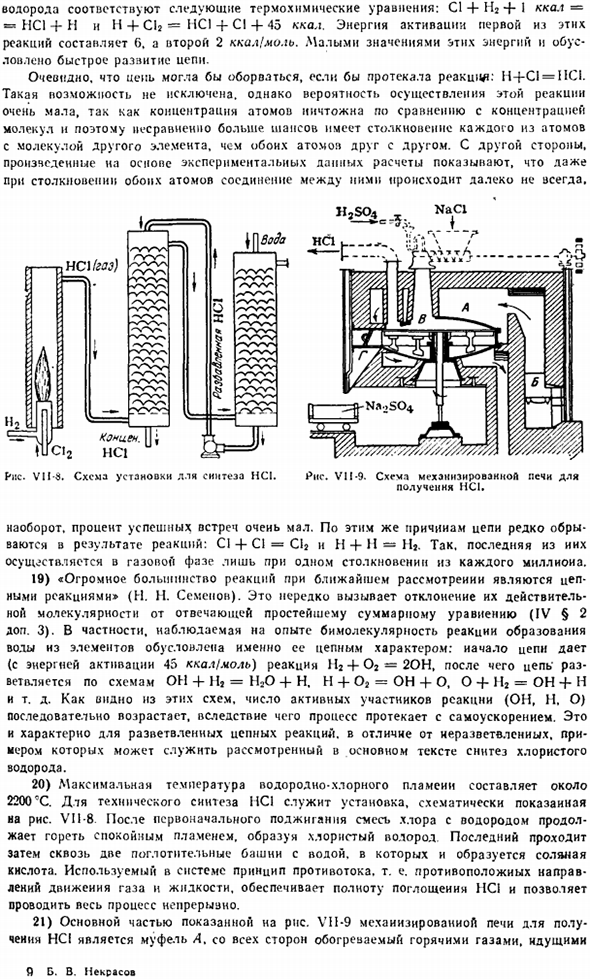
Для технического синтеза НС1, Рис. 1 ВИ1-8.После первого воспламенения смесь хлора и водорода будет продолжать гореть мягким пламенем, образуя хлористый водород. Последний проходит через 2 абсорбционные колонны, после чего образуется соляная кислота. Принцип обратного потока, используемый в системе, то есть противоположное направление движения газа и жидкости, обеспечивает полное поглощение HCl и позволяет всему процессу работать непрерывно.
- 21) основная часть, показанная на диаграмме VII-9 механизации топки для изготовления HCI является муфельная А. она нагревается со всех сторон горячими газами, которые приходят в. Я-Б. В. Некрасов. Б из печи.Мешалка в медленно вращается в муфеле, и ее ход устроен таким образом, что реакционная масса движется от центра муфеля (куда подается исходный материал) к краю.Хлористый водород, выделяющийся после удаления пыли и охлаждения, улавливается в воде, а образующийся Na2SO выгружается » из бункера G (откуда он был загружен в тележку).
Печь работает непрерывно и перерабатывает несколько тонн NaCl в течение 1 дня. 22) смесь хлора и водяного пара из теоретического голона и целомудренного метода, который производит хлористый водород, пропуская его через слой горячего угля.Уголь удерживается в раскаленном состоянии за счет его heat.
Реакцию в этих условиях проводят по формуле: 20j-f 2I2 (> 4-С024-4NO + G7 ккал.Потому что он очень пирогенный. Людмила Фирмаль
In на практике этот метод не применяется(в результате влажный хлористый водород сильно разъедает летное оборудование). 23) молекула HCI характеризуется ядерным расстоянием rf (HCl) 1,28 л, энергией связи 103 ккал,постоянной силы 5,2 и довольно значительной полярностью (q = 1,08). 12.8 потенциал ионизации емкости.Хлористый водород плавится при -114°C и кипит при -85 ° C критическая температура Loro составляет+5!
Распад но на 82°с критическое давление атм, плотность жидкого состояния 1,2 г / см, теплота испарения 3,9 ккал / моль элементов становится заметным примерно с 1500 ° С. 24) под давлением около 70 атмосфер хлористый водород разжижается даже при комнатной температуре.Как хлор, его можно транспортировать к месту потребления стального цилиндра.Жидкий хлористый водород имеет низкую диэлектрическую постоянную (4,6 при комнатной температуре) и является плохим растворителем для большинства неорганических веществ. compounds.
It растворяется в нем.Например.Хлорид олова и фосфора.Интересно, что PF3 растворим в жидком HO.Однако АЧС и Сбф подвергаются полной сольватации по схеме 3F-f ZNC1 = 3HF-f ESC, но взаимодействуют с it.In темно-красный, йод растворяется.Жидкий HO смешивается с жидким CO2 и H * S. 25) предельно допустимой концентрацией хлористого водорода в воздухе производственной камеры считается уже 0,005 мг / л. 0,05 мг!
При наличии L сразу же появляется раздражение в носу и гортани, жжение в груди, охриплость и ощущение удушья.При хроническом отравлении из-за низких концентраций но особенно страдают зубы, а их эмаль быстро разрушается. 26) реакция в фазе газона по формуле 02 4-4НО-2! L0 + 2Cb + 28 ккал обратимо. Ниже 000 куб. см его равновесие смещается вправо, а выше 600 куб. см-влево.
Этот реагент основан на методе, который часто используется в техническом производстве хлора:пропуская смесь воздуха и 11CI к катализатору, нагретому до 450 ° C (пропитанному раствором CuO *асбеста), можно было получить хлор с выходом около 70% от теоретического значения.Благодаря характерной продолжительности предыдущего времени-дефициту хлора, такой способ может вновь приобрести промышленное значение. 27) растворимость в воде но зависит от температуры:
Температура°C…………. 0!0 15 20 25 30 40 5E 6) Растворимость в объеме воды на i объем……………… 507 474 459 442 426 426 412 386 362 339 Растворение сопровождается выделением тепла (до 18 ккал / моль HO). Давление хлористого водорода на сильную соляную кислоту при 20°С составляет: Концентрация HCI. К………. 24 26 28 30 32 34 36 3С Давление, мм рт ……….. 1.0 2.2 4.9 10.6 23.5 50.5 105210 Температура резко падает, если смешать концентрированное тесто со снегом. 25 мас.
Водный раствор, содержащий %HO, замерзает только при -86°C 28) органические жидкости поглощают хлористый водород, который намного хуже воды.Например, при нормальных условиях эфир растворится примерно в 3,5 раза, а бензол-в 50 раз меньше воды. 29) хлористый водород образует анизотропную смесь с водой (II§ 6 доп.7). Он кипит при стандартном давлении 109°C и содержит 20,2% HCl.
При изменении давления его состав изменяется следующим образом: Давление, мм РГ. с…………. 50150500760 1000 25Q0 Я был доволен.%…………. 23.4 22.5 20.9 20.2 19.7 18.0 30) 6. 3. 2 кристаллогидрат 1101, содержащий молекулы n I H20, соответственно, может быть отделен охлаждением концентрированного раствора йода хлористого водорода, разложиться и расплавиться (-70, соответственно). — 25. −18. −15 * 0.Последняя структура-хлорид сксонни (11 ″ 0 * C1).
Катионы HsOj с очень короткими водородными связями [ 400 мм рт. ст.).Образуется хлорид катионов других элементов аналогичных соединений, но получено и показано аналогичное производное катионов[N(CH3)4]*. Ионы HCIJ подобны ионам HF.«В отличие от HF, образование таких ионов[rf (CICI) −3.14 A) не является характеристикой HC1. 35) константа равновесия гидролиза хлора Ke =1НОС1 [11 -) (СГ1 / (с1г1) имеет различные температуры со следующими значениями.
Температура………….10 » 30 40 50 60 Кг-10 * ………………> .б 2.6 4.1 5.6 7.2 8.5 9.8 Взаимодействие хлора и перекиси водорода первоначально протекает в соответствии с равенством Cl2 + HjOj =2НСО1.Однако избыток H2Oa, хлорноватой кислоты уменьшается: HOC1 + HjOt = HCI + NaO + O * 36) наиболее концентрированный раствор HOCI образуется при взаимодействии жидкого CljO с холодной водой (обе жидкости слабо растворяются друг с другом).для получения раствора с прочностью до 5 м удобно обрабатывать суспензию оксида ртути в четыреххлористом углероде хлором (не избытком).
Далее образовавшийся в растворе ClgO экстрагируют холодом water. It также возможно получение раствора хлорноватой кислоты по следующей реакции: 2C12-f Bi * 03 + H20 = 2BiOCl | + 2HOCI. 37) молекула hoci имеет угловую структуру с параметром 4 (BUT)= 0.97, d(OCI)= 1.69 L. ZHOC! = 103°. Константы прочности сцепления для H-O и O-C1 имеют значения 7.4 и 3.9. 38) хлорноватая кислота имеет характерный запах. Разбавленный раствор почти бесцветен, а сильный раствор желтого цвета.
Константа диссоциации HOCI кислоты в нормальных условиях составляет 4-10″*.Его фундаментальная диссоциация (т. е. HOCI ^ TP * » HO ’-f-CP) не была обнаружена экспериментально. Однако есть косвенные признаки его потенциала. Например. Органическое соединение нос! Может реагировать по схеме (R-органический радикал) RH + HOCI = ROH + HCI и RH + HOCl-H, 0 + RC1, то есть как окислители, так и хлориды. 39) основные возможности гермафродитной диссоциации HOCI выводятся из общетеоретических соображений (v§ 5).
Однако, если SG присутствует, CI *не может быть непосредственно обнаружен(из-за реакции по схеме CI * — f, SG•- = Cl2-aq). Поскольку переход из номера в нос! Отрицательные свойства кислорода ослабляются. Относительная вероятность введения протонов уменьшается.
Таким образом, OH J + HOCI7 ″ * * Н20+Н2ОСР (или, учитывая неопределенный состав обоих ионов, Н — F-нос!* * * Н20+СР) равновесие должно быть сильно смещено влево, но с увеличением концентрации Н возможно, что возможность основной диссоциации Loc может быть экспериментально доказана!
Возможно, при электролизе вновь приготовленного раствора 30 * 0 в холодной серной кислоте положительные ионы хлора, возникающие из вышеуказанного равновесия, следует смешать с катодом. 40) воздух частично освобождается от раствора хлорной кислоты, так как под действием углекислого газа хлорная кислота становится слабой: NaOC! CO2 4-НПО ** NaHCOb + HOCl.
Отбеливание основано на окислении хлорной кислотой различных тканевых загрязнений. Присутствие NaCl не вредит отбеливанию, поэтому непосредственно применяют раствор, полученный в результате реакции хлора и щелочи. Этот раствор часто называют «водой копья». на текстильных и бумажных фабриках он может быть получен электролизом раствора NaCl без diaphragm.
In в этом случае NaOH и C12 образуются первыми, взаимодействуя и производя «воду копья».После отбеливания необходимо очень тщательно промыть ткани, так как избыток NaOCl будет постепенно разъедать их. 4!Путем дистилляции воды из раствора при пониженном давлении можно получить кристаллический хлорид натрия. NaOCl-5H20 выделяется в виде кристаллогидрата (mp 45°C).
Легко конвертировать в NaOCl•H20.Последняя соль неустойчива, при нагревании до 70°С она взрывается и разлагается. Он значительно более стабилен, чем LiOCI H20.В нормальных условиях он выдерживает длительное хранение. 42) опыт показал, что окислительная активность гипохлоритов максимальна при таком значении рН (близком к 7).
Вероятно, это связано с равновесием по схеме OS G + HOCl < — * OS1H + OSG. It должен быть сильно смещен влево, но его наличие обеспечивает определенную возможность преходящего появления нестабильных молекул хлорноватой кислоты(H: C1:b:).Его структура говорит о том, что тенденция к отсечению активных атомов кислорода усиливается.
43) Формула Ca (C1) OS! Отражают основной состав отбеливателя (иначе-белнл-11 он) извести только схематично. Хлорирование продуктов Ca (OH) 2 Это смесь различных бинарных и тройных соединений, образованных молекулами Ca(OCI) 2, Ca (OH)*. CaCl2 и кристальная вода. 44) отбеливатель постепенно разлагается на воздухе, в основном по следующей схеме: 2Ca (CI) OCI-fCO * -сас12 + сасоз4-С120.
При действии соляной кислоты выделяется хлор: Ca (CI) OCI +2НС1 = сас144-П20+С12.Это иногда используется для его получения-отбеленная известь смешивается с гипсом, и из полученной массы формируются кубики, которые заряжают устройство для создания газа. Качество отбеливателя обычно оценивается по количеству хлора, полученного под действием соляной кислоты.
Отличный уровень продаж почти соответствует конфигурации ОС ZSa (C1). * Ca (OH) 2 * nNGO и около 35 мас.%»Активного» (то есть выделяющегося при действии соляной кислоты) содержит хлор. 43) получают более высокий процент отбеливателя, состоящий в основном из Ca (OC1) 2.Невысыхающие Са (он) 2 является хлорированной.
Суспендированный в небольшом количестве воды при 30°C, реакция протекает в основном с формулой 2cas (OM) 2 4-2CI * Ca(OC1) 2 + CaCl2 + 2I20, и большая часть образовавшегося Ca (OC1) 2 выпадает в виде мелкокристаллического осадка. При сушке технический продукт содержит 45-70% активного ч. Ю. содержит и почти полностью растворяется при взаимодействии с водой, а обычный отбеливатель образует большое количество осадка Ca(0H).
46) при нагревании сильного раствора отбеливателя в присутствии солей кобальта происходит разложение по следующей формуле: 2Са (С1) ОС1 = 2сас12 + 02 + 22 ккал. Эта реакция иногда используется для производства кислорода в лаборатории.
47) молекула CI/) неполярна (q = 0,78) и имеет треугольную структуру [[[/(СУ) = 1,70 л. а = 111*]. Энергия связи O-C1 оценивается в 49 ккал} моль, а ее силовая постоянная равна k = 2.9.Оксид хлора (дихлоромонос окись) легко конденсируется и превращается в красно-коричневую жидкость(т.-121.Т. Кипячение.+ 2°с).
Он может храниться длительное время при температуре −78°С, но при нормальных условиях несколько быстро разлагается (в основном по схеме 4C120 =-•2СУ2+ЗС12).свежеосажденный высушенный оксид ртути удобно охлаждать хлором. 2hgo-f 2CI2 = s CliigOHgCl-f C120 4-19 ккал взрыв жидкого оксида хлора может произойти, когда он находится в контакте со многими веществами, которые могут быть нагреты или окислены, когда он переливается из одного сосуда в другой и становится газообразным.
Согласно уравнению 2×120=2Х124-02 4- 36 энергия активации этой реакции составляет 25 ккал [моль. Двуокись хлора легко растворима в CC1.«Еще лучше, C120 растворяется в воде при взаимодействии реакции 4-H20 ** 2POS1, и его равновесие сильно смещается вправо(K» =(CljOMllOCl) 2 =■1•10 9 при 0°C). Путем охлаждения концентрированного водного раствора C120, вы можете получить хлорноватистая кислота кристаллический гидрат закиси азота состав! *
21ЛО (Мп.-36 УК). 48) переход от гипохлорита к хлорату, вероятно, осуществляется с участием изохлор-новататоновой кислоты (дополнительно 42), но по схеме: HC | 0 4-CU «- HC1 4-C | 0 — и HClO-f 4-CU » = HCI 4-CLO. Анион ClOJ имеет структуру треугольной пирамиды с вершиной хлора (rf (CIO) −1.45 A. < £ОСУ = 106Е].
Сродство радикалов СУ к электронам оценивается в 91 ккал / моль. 49) из перхлоратов, KSYU3 является фактически самым важным(mp. 3€8CC). он получается электролизом термического раствора KCI. Хлорат калия используется в производстве спичек, сигнальных ракет и других изделий. Подводный Lacustrarastnum NaClOj(Мп.262SS) — отличный инструмент для уничтожения сорняков тигров (железнодорожные пути и др.).
Энергия активации пиролиза чистого KCIOj составляет 54 ккал / моль(заметим, что этот процесс может сопровождаться взрывом). Расплавленный KCIOj поддерживает энергию сгорания. Смеси с веществами, которые легко окисляются (сера, фосфор, сахар и др.), взрываются от удара. 50) раствор хлорной кислоты обычно получают действием серной кислоты на Ba (CIOj) 2(mp.414 УК).
Осадки BaSO можно фильтровать через испарение. При низких температурах (вакуум) концентрируют раствор примерно до 40% от содержания НСС. Примерный состав НСЮз * 7н?0. она превращается в густую бесцветную жидкость. Такой раствор характеризуется такими ярко выраженными окислительными свойствами, что он воспламеняется при соприкосновении с бумагой, ватой и др.
Более разбавленный раствор NSSC в нормальных условиях достаточно стабилен. При сильном охлаждении они становятся густыми и вязкими, но не кристаллизуются. 5!Длительное совместное нагревание фторида и хлората двухвалентного металла в присутствии уксусной кислоты приводит к образованию и взаимодействию соответствующих солей хлорной кислоты (h2ci03f) по схеме MF2 +М (СЮз) 2 2mci03f.
In таким образом, существует много двухвалентных металлов (например, CuCIO ^ F: 5Н?0) синтезирован высокорастворимый фторхлорит. Под влиянием не-Ca растворов на раствор осадок CaF2 начинает медленно выделяться только при кипячении. То есть, OO3F ионов, похоже, очень устойчив к гидролизу. Некоторые другие производные фторсодержащих хлорит готовы.
52) также сообщается о получении соли цезия d и csciojfj из фторированного смешанного диоксида хлора(за счет взаимодействия FC10 и микродисперсного CsF). При температуре 25 ° С он термически стабилен, испаряется в воздухе и бурно реагирует с водой. Иона СЮ.. Для FJ задаются следующие значения силовой постоянной: k (CU)= 8.3 и* c(CIF)= 1.6.
53) в лабораторных условиях CU является»реакцией 2KCIOj-f H? Удобно добираться по CrO » = r = s = K2C. f-f HjO + 2CIO? f. увлажненную смесь KCO3 и щавелевой кислоты (Н2С2О4) нагревают до 60°C. другим удобным методом лабораторного получения СУ2 является реакция, которая протекает при 90°с с полностью сухим хлором согласно уравнению. СБ + 2agc103 ■ = «2agcl + 2ciq2 F + 02 f. при охлаждении ниже + 10 ° C диоксид хлора концентрируется в красно-коричневой жидкости, поэтому его можно отделить от углекислого газа или кислорода.
Молекула СУ2 полярна (Q = 1.78) и характеризуется треугольной структурой F < /(CIO)= 1.47 A. A= P8 ′ 1.Энергия связи C1-C) составляет 60 ккал / моль, а постоянная силы k равна 7,4.Сродство молекулы СУ2 к электронам оценивается в 79 ккал / моль. В твердом состоянии диоксид хлора (хлорхлорид) представляет собой желто-красный кристалл (Мп.-59°с).
Плотность его паров соответствует простой формуле, но для раствора со наличие частичной полимеризации было подтверждено по схемам 2СУ, С1 * 04 (константа равновесия равна 0,18 prn25 ° с). Запах СУ2 похож на запах хлора и азотной кислоты одновременно. Вы начинаете чувствовать, что содержание SJ будет 0.002%?В том, что air.
In темный, чистый диоксид хлора стабилен, но даже в светлых местах и в присутствии следовых количеств хлоридов диоксид хлора постепенно разлагается. Является эндотермической(теплота образования-25 ккал / моль) и неустойчивых соединений, СД? Он может взорваться при нагревании или контакте с окисляющим веществом.
Диоксид хлора представляет собой желто-оранжевую жидкость, которая легко растворяется в воде (по объему при 4°C в соотношении 20: 1).Разведения(до 8 г / л) стабильны в темноте и медленно разлагаются на свету (с образованием PSU3 и HCl).он известен как кристаллическая Гидра. К2 главным образом использовано для отбеливания или стерилизации различных материалов(бумажной пульпы, муки, ЕТК.).
С его помощью установлено, что можно проводить обеззараживание сточных вод с химических предприятий. В связи с быстрым ростом потребления СУ2, в технических целях было разработано множество способов его промышленного производства. proposed. An пример — это как экзотермическая реакция основана на 2N’acioj + SO? + H2soa=2nahsoa + 2CIOt, осуществляемый в серной кислоте (содержащей значительную смесь ионов хлора) около 4 м.
54) довольно сложным образом, начиная с SJ, он приобрел стабильность при −78°C. Однако уже при −45°C он начинает разлагаться, что является темно-коричневым веществом на основе железа, состав которого соответствует формуле CI * Oj. Is это действительно оксид Трехвалентный хлор (nln представляет собой смесь других оксидов) пока не ясен.
55) когда ток фтора медленно течет по поверхности диоксида хлора, охлажденного до −50°С, он фторируется и диоксид хлора (FC10?) Формируется. Это вещество представляет собой бесцветный газ (mp. −115. Mp.-6°C). очень устойчив к нагреву, но очень гигроскопичен. Его гидролиз протекает по схеме: FCIO + HgO + HF + I South Oz. Взаимодействие FCI02 с HCI (с-HO’C) протекает по формуле 2CIO * + 2HCI «21 IF + CI * + 2C10».То есть, CIClOj полностью unstable.
At в то же время были поражены некоторые жироподобные производные C | Ot. Пример: Кло.&БФТ(Мп 235°с). 56) Еще один пятивалентный хлор-оксо-фторид, полученный под действием ультрафиолетового света по реакции:2ClFj + Of: 2 = CIF $ + OCIFj. Оксо трифторид-бесцветное вещество (Мп.-41, депутат.27°C) и просто быть демонтированным в CIF и O*.
57) хлорной кислоты(к = I * 10) получают по следующей реакции: Ва02+ +2СУ =Ва(С102)2-ф 02 И Ва(С102)2-е H2SO <== Басо»| + 2HCIO,.Она известна только в разбавленных растворах, а при хранении он разлагается очень быстро, в основном по следующей схеме:4НСЮ2 = 2су » + нсюз+УБ + н20. Ионы ClOj имеют треугольную структуру ( г / л), он хорошо растворяется в воде 1.
В отличие от гипохлорита. Они » проявляют сильные окислительные свойства только в кислых средах. С другой стороны, хлорит йода » 0 ″ под действием см окисляется и становится хлоратом. Имеются признаки того, что при непосредственном взаимодействии раствора С2 с соответствующим металлом (например, Ni) некоторые хлоритные камни могут form. In твердое состояние, много солей UHF взрывает легко должное к топлению или удару.
Большинство практически значимых хлорит камень NaClOj. Эта соль получена реакцией 2CIO * + PbO + 2NaOH = PbQ2i + 2NaC102-f H20. В 100 Эк и выше он разлагается в основном по следующей схеме: 3 \ aCCO2 = 2NaClOj + NaCl. Есть обзорная статья о хлоритном камне. 58) хлорат карнипеля используется при приготовлении некоторых взрывчатых веществ.
При температуре 010 ° C он плавится в основном по следующей формуле и одновременно начинает разлагаться: KCIO «= KCIO » = KC1 4-202.KC104 обычно получают электролизом раствора KCIQj. Реакция протекает по схеме: КСУЭ + Н20=Н2 (катод) + кс104(анод). 59) при перегонке разбавленного раствора} 1C10″ сначала отгоняют воду, а затем разбавленную кислоту.
Наконец, при 203°с начинается перегонка азеотропной смеси, содержащей 72% HC10(близкой к составу HCL4-2H20, она замерзает только при −18°С).Поскольку кипячение последнего сопровождается частичным разложением, отгонку HC10 лучше всего проводить при пониженном давлении(при 20 мм рт. ст.
Концентрированные кислоты(72%) дымятся в воздухе и очень гигроскопичны, но они стабильны при хранении и не разлагаются под воздействием света. Промышленность обычно производит 30-70% HC10.Есть обзорная статья о перхлорате* * и специальная монография****. 80) молекула НСУ4 имеет форму пирамиды с 3 атомами кислорода в основании / < / (с10) » 1.41 å), гидроксильными группами на вершине (RF (CLO) = 1.64 Å) и углом о-С1 = о, равным 106? 。
Безводный перхлорат(Мп.-101, депутат.+ 16°C, 18 мм рт. ст.) является очень жидким, но его хрупкий водный раствор имеет маслянистый характер. consistency. By охлаждая их, получают кристаллогидраты HCIOt-HaO, которые плавятся только при+ 50°C. * Чернышев А. Е. Союз В. В. Семенова г. успех. Химия. 195 век NV 1.91.* * Зиновьев А. А.. Достижения в области химии. СТ 5. УЛ. •* * П Росоловский И. Я.
Современный перхлорат. М » Наука. 19G6. (40 секунд Является перхлорат оксония-[краны закрепительных втулок H30] C104. Частичное образование последнего по схеме ZNSYu4 **(Н40) СУ4+ cljoj + 3 ккал (константа равновесия k〜i•10-4) также происходит с безводным перхлоратом. =4СЮ2-fзог-F 28 кка. г) нестабильность безводного перхлората, вероятно, обусловлена очень сильным взрывом, который может вызвать контакт с окисляющими веществами. 。
61) в разбавленном водном растворе NSLO не восстанавливается сильными восстановителями, такими как HI. Нјѕбыл. S02 и водород при высвобождении. Даже концентрированные кислоты становятся очень активными окислителями только при температуре кипения(особенно если специальные стали легко растворяются). 62) HCIO *является самой мощной из известных кислот, но наличие несвязанных молекул в ее растворе установлено несколькими methods. As вы можете видеть из рисунка VII-10.It будет заметно только при достаточно мощном решении.
Для константы равновесия HCIO4 * * Н ’-fC104 получено значение K = 38.По другим данным, хлорная кислота дополнительно ионизируется в растворе, чем показано на рисунке. ВИ МО. ^ −1— ’ ^ ’D-l-J 63) Анон C10J, входящий в состав перхлората» концентрация, моль / л, представляет собой тетраэдр, содержащий хлор центра fd (CIO)= 1,44 а) и константу силы связи k = 8,2. ?Это » a » soyai1G}?Электронное сродство радикала Sy1ICHESKEY C104 является、 134 ккал’, моль. 64) безводного перхлората, только UCIO4 плавится(без разложения) (mp.236°с).
В общем случае их пиролиз может протекать по 2 схемам: образование хлоридов металлов и кислорода или оксидов металлов, хлора и кислорода. Для CS, для соли RB. Первый этап-это свойства солей Na, Li и Ba. Старший СА в основном такой же. А для солей Mg и большинства других металлов 2-й путь ослабления будет основным. 65) сравните растворимость некоторых перхлоратов (25 г на 100 г растворителя при 100°С) в воде, спирте и ацетоне: Xu4 CaCO4 L1CIO4 мг(Cl04) Дж Калифорния (ШОС), 2 Ба (C104) Дж Н2О….. 60210 2.1 100189198 C2HsOH … J52 15 0.01 24 166 125 (СН3) 2СО… 137 52 0.16 43 150125
Безводный перхлорат лития также растворен в эфире (образовании решения 6 / и), кристаллическом гидрате Ликл04-3хдж0 очень soluble. It следует отметить, что раствор перхлоратов в органических жидкостях обычно взрывоопасен. Некоторые перхлораты (особенно NH, CI04) используются в струйной технике.
Из смешанных производных интересна соль ксенона-GCeSU4.Существует монография по перхлоратам*. 66) взаимодействие 72% НСУ4 с фтором привело к получению невесомого фторперхлората-fc104.Это нестабильное соединение (Мп.- 167.Т. Кипячение.-16°С) имеет резкий запах и очень сильно реагирует. И в газообразном состоянии, в жидком состоянии, он может быть разложен взрывом. *
Шумферы и перхлораты (собственность, производство и использование).На английский, пос Курица Л. С. Гайниф. М.. Госхимнсдат, 1963. 2G4 S. 67) хлорированный хлорат С1С104 был получен длительным взаимодействием clsojf с избытком Cscioa (VIII§ I добавление.83).Это вещество представляет собой ярко-желтую жидкость(mp. It описывается как стабильная при −117°C).Давление пара экстраполируется до температуры кипения 45 ° С.
В соответствии со схемой» HCI + SCHC » -С12+НСЮ4 и AGCI + + ciocio3 =сы-/ gclo4 реакция, протекающая при −78 ° С, вызывает присутствие положительно поляризованных атомов хлора в молекулах хлорперхлората. Опасность взрыва С1СЮ4 меньше, чем fci04. 68) если перхлорат фторид является продуктом перхлората вместо фтористого водорода, то фторхлорид («пархлорилфторид»)-FCIO3 можно считать продуктом аналогичного замещения его гидрохлоридом.
Последний образуется при действии фтора на сухой CSJ, бесцветный газ с характерным сладковатым запахом (mp.-148, Мп.-47 ″ C). более удобно получить его согласно MSU44-HSO3F = MHS04 4-FCIO3.Действие смеси хлорсульфоновой кислоты и SbF (играет роль катализатора) на перхлораты. Теплота образования FClOj из отшельника составляет −5 ккал / моль. Для энергии связи приведены 60 (FCI) и 57 (CU) ккал моль.
Имеет слегка искаженную тетраэдрическую структуру с хлором вблизи центра (rf (CIO)= 1.40, rf (FCl) −1.61 A. ^ OSU = M5c. FCIO в 103e]и фактически отсутствует полярность(P = 0.02). Триоксид фторхрото термически стабилен до 400°C. It не гидролизуется горячей водой (и холодной щелочной), нерастворим в жидкой плавиковой кислоте, вызывает привыкание и сам по себе невзрывоопасен(но может производить некоторые органические вещества и взрывчатые смеси).
Потому что критическая температура очень высока(+ 95 * 0.It может храниться и транспортироваться в сжиженном состоянии (при 25 RS давление пара составляет 12 itm).Окислительная активность FC103 мала в нормальных условиях, но быстро возрастает при нагревании. Этот материал очень интересен для реактивной техники и показывает, что он имеет самую высокую диэлектрическую постоянную из всех газонов.
Есть обзорная статья*. 69) взаимодействие F2O2 и CIF привело к образованию фиолетового вещества при −150°C. его состав представлен формулой (FjCI02) N. Это соединение стабильно только при очень низких температурах и обладает высокой реакционной способностью. В то же время time. In другим методом были синтезированы оксо-фториды того же состава, стабильные при 25°C, и молекула f3cio2, как сообщалось, была torinoiyar-by-pyramnd.
Осевое положение занимают 2 атома фтора. Свойства этого интересного соединения пока не описаны. 70) безводный хлор (Мп.-93.ТП.83°C)является сильно эндотермической смеси(тепло от элемента идут икал / моль).Структура его молекулы соответствует формуле O3CI_O_CU3. Угол атома кислорода, соединяющего 2 пирамиды CU3, равен 119 *(d(OC1) −1.71 A], а угол O-C1 = 0 равен 115°(rf (CIO)= 1.41 A].
Молекула имеет разную полярность (с = 0,72). в таких веществах, как сера, фосфор, бумага, опилки и др., CI2O7 не реагирует при комнатной температуре, но контакт с йодом чреват взрывом. Хлор безводный смешивают с четыреххлористым углеродом в произвольном соотношении. В результате пиролиза CljO, основным законом является О-С! Связывание (c-радикал, образующий HUZ и SJ4).Энергия этого соединения оценивается в 48 ккал / мм. 71) из 2 радикалов, возникающих в основном при пиролизе безводного хлора, по-видимому, только СУ3 способен к более или менее стабильному существованию.
Триоксид хлора (chlortrnoxyD) — темно-красное масло (замороженное+ ЗВС), образующееся под действием озона на СУ2.Примерно 99%жидкости состоит из в 2 раза большего количества молекул (охов).С другой стороны, в паровом состоянии можно сказать, что»равновесие CljO»-f 2 ккал ** 2CU3 очень сильно смещается вправо. * Хуторский В. М.. Охлобыстина Л. В.. Файзильберг А. А.. Успехи в химии. 1967, № 3, 377.
Молекулы ClOj постепенно разлагаются при нормальной температуре, в основном при СУ2 и 02 (энергия активации этого распада составляет всего 12 ккал / моль), но жидкое состояние С120 гораздо более стабильно. Относительно высокая температура замерзания указывает на наличие равновесия в жидкости по схеме СУ3 + — f2j * *сю2сю7.
Из всех оксидов хлора триокс сам по себе наименее летуч и наименее взрывоопасен. Взаимодействие с безводным HF происходит по формуле С12Ов + HF = нсю4 + — F FCIOJ. Интенсивная (вплоть до взрыва) реакция протекает с водой по схеме: С120″+НгО = Нсуз-F4.Таким образом, рассматриваемые оксиды представляют собой смешанные кислоты хлорной и хлорной кислот.
72) радикал СУ образуется в качестве промежуточного продукта, особенно при электролизе перхлората. Он тоже такой not. It также ясно, что его размерная форма (CljOe) является стабильным существом. Предыдущее образование пероксидов хлора в растворе эфира по реакции I2 +2agcioa= 2AglJ + — f CI2Oe не было подтверждено.
73) для наиболее стабильного, nc всего хлора кислорода является HC10″.При взаимодействии хлора и щелочи, ожидается, что соль скоро форма. Однако сначала приобретаются менее стабильные соединения. Затем постепенно (быстрее-при нагревании) будет более устойчивым.
Основываясь на изучении многих подобных случаев, Гей-Люссак(1842) уже наметил правила так называемой реакционной стадии: в ходе химических процессов в первой системе обычно образуются не самые устойчивые вещества, а самые неустойчивые.
Во всех случаях дальнейшее превращение продукта реакции с относительно низкой стабильностью происходит очень быстро или, наоборот, очень медленно. вы практически заметите, что это rfk, или вы не думаете, что это промежуточный продукт. Поэтому обобщение, представленное правилами шага реакции, не сразу заметно. С другой стороны, при рассмотрении хода химических процессов это часто бывает очень полезно.
Смотрите также:
| Электронные аналоги | Адсорбция |
| Фтор | Подгруппа брома |
