Оглавление:




Электронные аналоги в химии
- Электронные аналоги. Необходимой предпосылкой для возможности рационального рассмотрения фактического материала обобщения на основе периодических законов является правильный подбор сходных элементов. Это разделение, руководствуясь простой близостью определенных признаков, сделать нельзя, так как не только формальное сходство между ними, но и регулярные различия, отражающие развитие атомной структуры рассматриваемого ряда, служат признаком сходства рассматриваемого ряда. elements.
- It именно эти структуры как детерминанты всего химического поведения элемента лежат в основе правильного подбора аналогов. Если нейтральные и элементарные ионы (ионизированные атомы) представляют собой неструктурированные шары, то их свойства определяются только величиной заряда и радиусом. Как правило, на внешней оболочке играет решающую роль в определении наиболее важных химических свойств.
Но на самом деле, структура электронной оболочки-это очень важно. Людмила Фирмаль
Зависимость свойств атомов и ионов от внешнего 2-го слоя уже менее выражена(влияние их структуры не столь выражено, электронов во внешнем слое больше, а электронов во 2-м рассматриваемом слое меньше).Значение структуры, даже более глубокой, чем лежащий электронный слой (за исключением атомов лантаноидов и актинидов), сводится почти к нулю. Таким образом, при разделении аналогов, в первом приближении, можно рассматривать только внешнюю оболочку, учитывая только особенности (в основном в атомах переходного металла) и 2-й элемент, если это необходимо.
Принимая это во внимание, рассмотрим такие элементы, как Mg, Ca и Zn. Если валентность равна нулю(то есть форма нейтрального атома), то все они имеют по 2 электрона во внешнем shell. So … Атомы Ca и Zn с равными правами(если не принимать во внимание структуру 2-й оболочки) можно считать аналогами атома Mg. Иначе обстоит дело, когда Mg и Ca содержат по 8 электронов во внешней оболочке, причем в 2-валентном состоянии, которым является Zn-18.Вот, только, не зн, это аналог мг.
То же самое относится и к таким элементам, как Na, K и Cu. Единственное отличие состоит в том, что во внешней оболочке нейтрального атома имеется только 1 электрон, поэтому здесь влияние структуры 2-го слоя проявляется не так резко в других группах периодической системы. Таким образом, среди всех атомных аналогов наименьшее сходство наблюдается именно в Na и Cu.
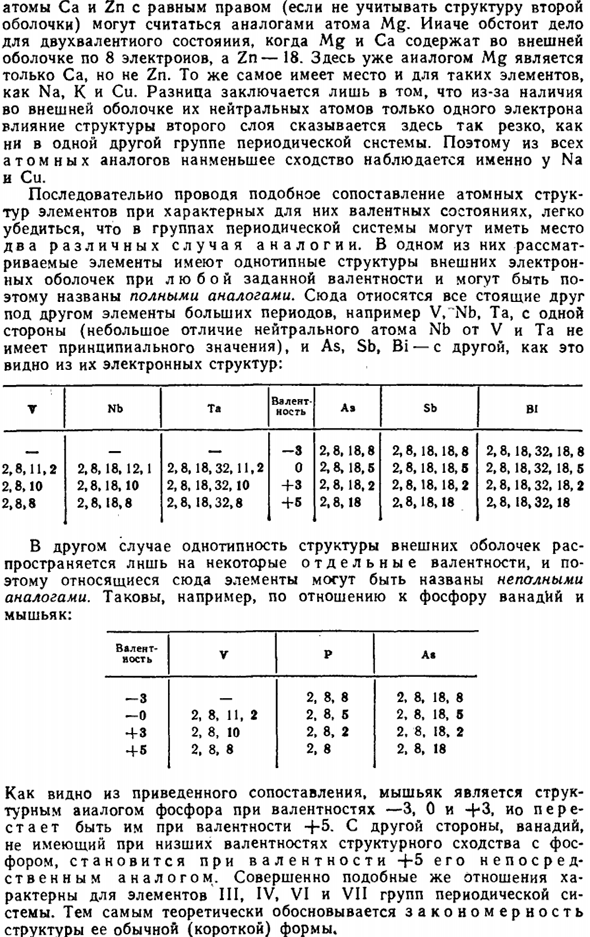
Последовательно проводя такое сравнение атомной структуры элемента в характерном валентном состоянии. In 1 из них рассматриваемый элемент имеет тот же тип строения, что и внешняя электронная оболочка для любой валентности, поэтому его можно назвать полным аналогом. Сюда относятся, например, V, 1Mb.
Легко увидеть, что в группе периодических элементов могут возникать 2 различные аналогии systems. Людмила Фирмаль
Ta (небольшая разница между нейтральными атомами Nb и V и Ta в основном незначительна), а также все элементы большого периода друг под другом, такие как As, Sb, Bi и т. д.: Т НБ Т «валентность Ле-СБ Би _ −3 2.8、18.8 2.8、18.18.8 2.8、18.32、18.8 2,8,11,2 2,8,18,12,1 2,8、18、32,11,2 0 2,8,18,5 2,8,18。 18.5 2.8. 18.32, 18.5 2.8.10 2.8.18.10 2.8、18.32.10 +3 2、8、18.2 2,8,18,18,2 2,8,18,32、18,2 2.8.8 2.8.18.8 2.8、18.32.8 +5 2.8.18 2.8.18.18 2.8、18.32.18
В другом случае однородность структуры внешней оболочки распространяется на индивидуальную валентность, поэтому элементы, связанные здесь, можно назвать несовершенными аналогами. Например, фосфор, ванадий и мышьяк: V P A растяжение позвоночника » −3 _ 2、8、8 2.8、18. Восемь −0 2, 8. 11, 2 и 2. 8. 5-2. 8. 18. Б 43, 2, 8. 10 2, 8, 2, 2. 8. 18, 2 часа дня. Черное и белое 2、8、8 2、8 2、8、18 Как видно из приведенного выше сравнения, мышьяк является структурным аналогом фосфора с валентностью-3, 0, а с валентностью-f-5 фосфор элиминируется.
Ванадий, с другой стороны, имеет низкую валентность и не имеет структурного сходства с фосфором, а с валентностью-f-5 он становится его прямым аналогом. Довольно схожие соотношения характерны для элементов III, IV, VI и VII группы периодической system. So, теоретически, мы продемонстрируем закономерность структуры обычной (короткой) формы. Из вышеизложенного следует, что для всех валентностей, за исключением положительной группы, соответствующей числу (которое можно назвать характеристическим, как правило, максимумом), задан один и тот же ряд сходных элементов (а), а значение характеристики-множество (Б) существенно отличается:
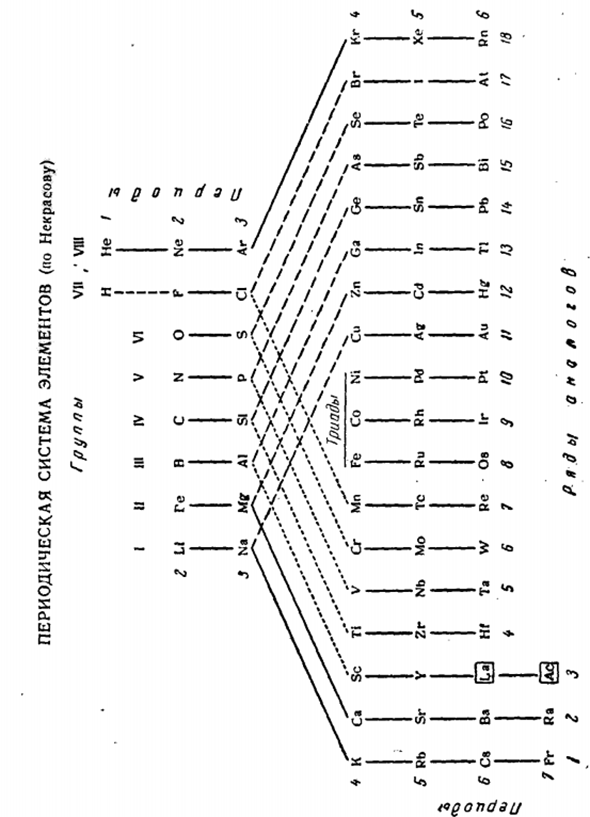
Группа I G1 III IV V VI VI VII Есть ли на Кей Си быть мг Са ЗН Б Ал Ка га с-Си-Ти ГК Н П в Асос СГ ГП ф ки млн Бр B Li Na K Si Be Mg Ca Zn B Al Sc Ga C Si Ti Ge N P V As (0) s Cr Se (F) CI Mn Br Распределение обоих аналогов четко показано следующими изменениями в периодической системе (стр. 2. 36).Сплошная линия на нем соединена с полным аналогом. Большая пунктирная линия-это элемент, который подобен всем валентностям, кроме характеристики, а маленькая пунктирная линия-это элемент, который подобен присутствию (и только если есть) характеристической валентности.
Значок|а| актинидов с анемонами | актинидов с фонарем / значок / актинидов с фонарем. Как удобно пользоваться системой, обратите внимание на номер каждой строки аналога (кроме 8, 9 и 10).Прямой или минус 10 соответствует номеру труппы. Например, в 3-й группе левая подгруппа (включая элемент начала периода) и правая подгруппа (включая элемент конца периода) образованы строками 4 и 4, строками 14, строками 3 и 13 соответственно.
Для всех валентных состояний, характерных для них, а также для формы нейтральных атомов, она является оптимальной для классификации химических веществ на ее основе. Добавь 1) определение положения водорода в системе требует дополнительного discussion. In при формальном подходе к строению своих атомов водород становится аналогом лития.
Однако природа внешней электронной оболочки определяет аналогии элементов не сами по себе, а лишь в свете общих закономерностей развития структуры. По последним миграциям периода 2!С подобным элементом положительный заряд ядра и количество внешних электронов уменьшаются на 8 единиц (Ne — » — He). так, по сути, нейтральный атом водорода является аналогом атома фтора.
С отрицательной валентностью водород также относится к фтору, как гелий к неону. От Li до Na и так далее. Кроме того, если он положительный(если это голый Протон), он не имеет аналогов с другими элементами、 Стоя полностью away. So, водород является несовершенным аналогом фтора. Близость к семейству галонов совпадает со всей совокупностью физических свойств водорода. 2) рассмотренная выше структура внешней электронной оболочки помимо формального сходства щелочных металлов и водорода, ее размещение в первой группе часто мотивируется it.
In химические взаимодействия, водород обычно ведет себя как металл. Однако в большинстве случаев поведение такого водорода упускается из виду, что характерно только для реакций, протекающих в водной среде solutions. In дело в том, что наиболее частой встречей является реакция такого водорода, но если характеризовать его как элемент, то нельзя отводить ему решающую роль, так как химическая функция атома сильно искажается здесь особыми свойствами положительных не (голых протонов).
Степень металличности элемента оценивается по легкости расщепления электронов его атомов. С этой точки зрения сравните натрий, водород и хлор. На + 118 ккал на * + е сі + 300 ккал СГ + е H + 315 ккал H * + e Как показывают эти данные, энергия ионизации водорода не только резко превышает энергию ионизации удара, но и несколько превышает энергию ионизации хлора. Поэтому нет вопроса о том, какова специфика функций металла для свободных атомов водорода.
В присутствии воды появляется дополнительный эффект-гидратация как о, так и О, где среди интересующих количеств не-С1 * энергия гидратации неизвестна, но в этом приближенном расчете она может быть равна энергии гидратации Ионов Na4.Тогда у нас есть: На * + р-р = » = * НВ-101 ккал Ф СГ + СГ с AQ + 101 ккал H * + aq H * + 265 ккал Суммируя все уравнения трн для каждого из предыдущих уравнений и членов, мы получаем сводку поведения атомов в водной среде.
Na + aq-f 17 ккал Na * + e CI + aq + 199 ккал CV + e Н-ф р-р + 50 ккал ч ’+ е Как видно из этих результатов, водород во входной среде очень близок к Na. Чем C1, то есть в этих условиях он действительно напоминает металл. Однако это сходство не присуще самому атому, и поэтому оно не может служить основанием для определения местоположения водорода в периодической системе. Структурная однородность атома и атомов элементов 1-й группы имеет те же формальные свойства, что и однородность атома гелия и атомов элементов 2-й группы.
Смотрите также:
| Развитие периодического закона | Фтор |
| Структура периодической системы | Хлор |
