Оглавление:




Развитие периодического закона
- Регулярное развитие законодательства. «Регулярное законодательство ждет не только новых применений, но и доработок, детального развития и свежих сил. Д. И. Менделеев отмечал в 1889 году. Первым серьезным испытанием, которое пришлось выдержать этому закону, как только он получил всеобщее признание, был аргон 1893 года.
- Из-за атомного веса (39,9) новый элемент должен был находиться в периодической системе между калием (39,1) и кальцием (40,1), в которой не было свободного пространства. Т So, угроза самому существованию периодического закона, возникшая в результате открытия аргона и других инертных газов, стала противоположной-периодическая система элементов стала более полной и законченной.
олько после открытия гелия на Земле и других инертных газов стало ясно, что все они являются членами специальной группы, которая будет размещена в системе после 7th. Людмила Фирмаль
«По-видимому, будущему не будет угрожать регулярное законодательство разрушением, а только надстройка и обещания развития», — писал Д. И. Менделеев в 1905 году. Следующий важный этап в развитии периодического закона (1912 г.) связан с исследованием Мосли (III§ 3), который показал, что истинной осью этого закона является не атомный вес, а положительный заряд атомного ядра, который представлен числовым значением атомного числа (^ед.).Как правило, такое изменение в трактовке периодического закона не вызывает никаких возражений. Потому что совершенствование общей формулировки, основанной на новых экспериментальных данных, является необходимым условием развития науки.
Работа Мосли подтвердила правильность расположения в системе элементов, находящихся не в тех местах, с точки зрения атомного веса. Кроме ОС, ИК, ПТ и Ас, затем атомные данные корректировались, но даже если отображалась сама система, то наблюдались следующие 2 случая: кобальт (58,9) был Д. И. раньше йода (58, 7)-никеля (127,6), а теллур (126,9) — Менделеева. Это отклонение от общего принципа распределения атомных масс определялось характеристиками рассматриваемого элемента, например, теллур очень похож на селен, но совершенно отличается от брома, а йод очень похож на Бром, но не на селен.
- После обнаружения инертного газа была добавлена третья неудача. Аргон (39,9) был впереди калия (39,1).С точки зрения нового фундамента-ядерного заряда-все эти проблемы исчезли: оказывается, кобальт действительно соответствует месту. Е27, никель — № 28 и так далее. В то же время была выявлена очень важная проблема-количество элементов, которые еще не были обнаружены.
Принятая в то время форма периодической системы позволяла предположить, с одной стороны, наличие элементов, переходящих между водородом (находящимся в группе I) и гелием, а с другой-Ба и то. Таким образом, Валиум (jYs 56) и тантал («V? Если число элементов между 73») было полностью определено, то их расположение в системе оставалось неизвестным.
Исследование Мосли ясно установило, что между водородом и гелием нет никаких новых элементов, и что общее число Ba и Ta равно 16. Людмила Фирмаль
Решение этой задачи было дано теорией строения атома. Можно представить себе, что переход от легкого атома к тяжелому происходит путем непрерывного введения протонов в атомное ядро и последовательного введения соответствующего количества электронов в экзосферу атома.
Это ставит вопрос о том, будут ли вновь добавленные электроны образовывать новый слой или будут включены в 1 из существующих ones. It решается, с одной стороны, общими соображениями о сравнительной устойчивости различных возможных структур, а с другой-сходством спектров. Это было сделано буром (1921).
Например, переход от аргона (- N9 18) к калию (L®19) связан с появлением нового электронного слоя, а переход от калия к кальцию (. Е 20) связано с включением дополнительных электронов в существующие внешние электроны и переходом от скундия(L?21) является наиболее устойчивой структурой 2, 8, 9, 2, соответствующей включению вновь осажденных электронов во внешний слой 2-го слоя.
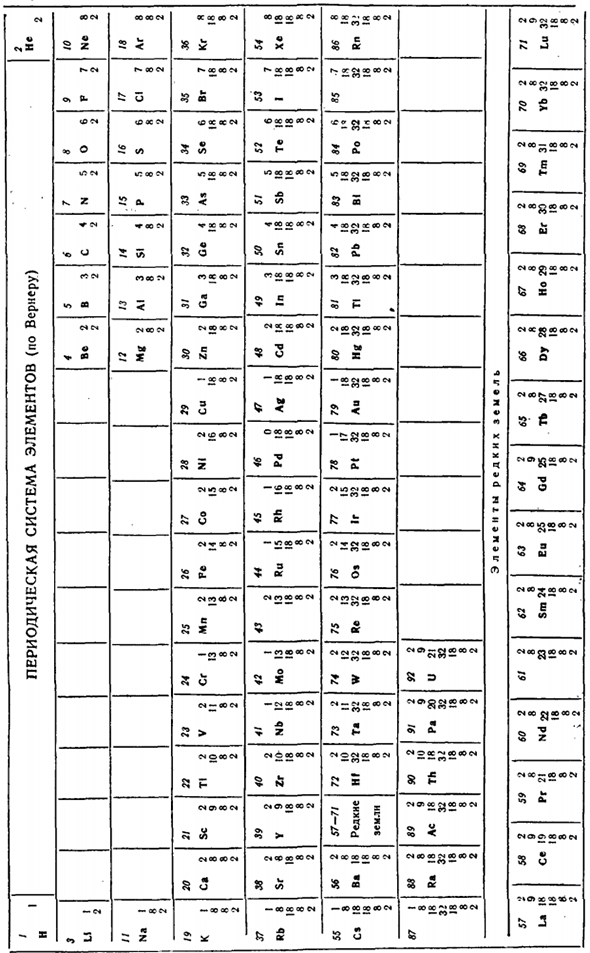
Среди элементов, следующих за скандием, структура Титана составляет 2, 8, 10, 2, ванадия-2,8, 11, 2 и др. Дальнейшее заполнение наружного 2-го слоя производится медью (СП?), атомы которого имеют структуру.29). 2, 8, 18, 1.In кроме того, распределение электронов по слоям в атомах тяжелых элементов показано в таблице ниже. Это периодическая система элементов в форме, предложенной Вернером. Валиум.(2、8、18、18、8、2) в следующем элементе, исследуя фонарь (. в случае (Ns 57), мы обнаружили, что 2-й слой снаружи и атом лантини L содержали Новый электрон. 58, 59 и так далее-снаружи.
Больший размер Однако стабильность этого слоя отвечает за заполнение только до определенных пределов. Таким ограничением является наличие в нем 32 электронов, что соответствует номеру элемента 71. Следующий элемент-нет. На 72, Новый электрон уже содержится во 2-ом слое от outside. So этот элемент является、2、8、18、32、10、2 имеет структуру, и с химической стороны является аналогом циркония, а не предшествующего ему лантаноида(2、8、18、10、2)вы должны быть членом группы.
Поэтому необходимо было искать лантаноиды в циркониевых минералах, а не в тех рудах, которые обычно находят (и на протяжении многих лет элемент 72 искали напрасно).на самом деле, элемент № 72 (Hf) был идеей циркониевой руды (1923). Открытие гафния позволило установить положение лантаноидов в периодической системе.
Все они отнесены к одной, то есть 3-й группе, так как характеризуются совершенством глубоко залегающего электронного слоя. Точно так же актинид, или актиний (делать?89) в настоящее время классифицируется как 3-й Group. At в то же время, как лайтаиды, так и актиниды размещаются на отдельных линиях (что предотвращает чрезмерную длину периодической табличной формы).
Однако основной смысл теории атомной структуры периодического метода заключается не в уточнении положения некоторых элементов. Д. I. As как отмечал сам Менделеев (1889),»мы понимаем причины периодического закона», давая картину последовательного развития атомной структуры и сопровождаемого периодическим возвратом аналогичного образования электронов, теория строения атома тем самым раскрывала физический смысл периодического закона. method. It можно сказать, что только с развитием этой теории стали понимать ее не формально, а по существу.
Смотрите также:
| Химия и электрический ток | Структура периодической системы |
| Работы Менделеева | Электронные аналоги |
