Оглавление:












Химия и электрический ток
- Химия и электрический ток. Реакции замещения принципиально отличаются от реакций ионного обмена, рассмотренных в предыдущем параграфе. Если при ионном обмене происходят сокращения в различных комбинациях существующих ионов, то при вытеснении 1 Ион становится нейтральным атомом, и в то же время образуется новый. Таким образом, реакция смещения связана с переходом электронов. >
- Из простейших процессов такого типа мы чаще всего сталкиваемся со случаями взаимодействия металлов с acids. An примером может служить реакция, обычно используемая для получения водорода. Zn + 2CH1 = ZnCl2 + H2 Поскольку HC1 и ZnCl2 являются мощными электролитами, а молекулы H2 не разлагаются на ионы, приведенные выше уравнения в ионной форме принимают вид: ЗН + 2Н * + 2CG = ЗН- + 2С1 ′ + Н2 Или после редукции инвариантной составляющей: ЗН + 2он = ЗН «+ Н2
Таким образом, нейтральный атом цинка превращается в Ион, а ион водорода становится нейтральным атомом(он связывается с молекулой). Людмила Фирмаль
Очевидно, что этот процесс сводится к переносу электронов от цинка к ионам водорода. Последняя формула показывает, что характер реакции напрямую зависит от свойств металла и концентрации ионов водорода. Концентрация ионов H * определяет скорость рассматриваемой реакции, но другой фактор-химические свойства металла-определяет вероятность того, что она действительно произойдет. Дело в том, что переход от электронов к ионам водорода происходит только тогда, когда металл очень легко испускает эти электроны.
Поэтому при взаимодействии с кислотами не все металлы замещаются водородом, а только те, которые достаточно химичны, замещаются водородом Он очень активен. Например, цинк и железо заменяют водород из кислот, а медь и серебро. Еще более наглядно, чем при взаимодействии с кислотами, активность металлов (т. е. легкость переноса ими электронов) можно сравнить, например, по реакции, наблюдая замещение другими металлами из раствора солей И Zn + CiT * = Zn Zn-f CuSO < = ZnSO < — f Cu Cu
Итак, суть реакции замещения другого металла одним металлом заключается в переносе электронов от атома 2-го металла к 1-му металлу. Например, многие металлы-Zn, в- Fe, Cu, Ag-предыдущая соль соответственно вытесняет следующую из своих солей, но обратного замещения не наблюдается. Это свидетельствует о том что прочность связи электронов в металле возрастает от Zn до Ag 1 процесс взаимодействия цинка и меди по приведенной выше схеме можно разделить В 2 этапа:^ ЗН = ЗН Г 2Е + с » = с
Очевидно, что если можно осуществлять движение электронов по металлической проволоке, а не непосредственно, то поток электронов, т. е. ток, течет к меди, а затем к цинку. На рисунке V-29 показана схема гальванического элемента, то есть установки, позволяющей перемещать такие электроны по проводу. Контейнер A и трубка B, которые соединяют оба контейнера, заполнены раствором ZnS04, а контейнер B заполнен раствором CuS04.Первая цинковая пластина опущена, вторая медная пластина опущена.
Если соединить обе пластины проводами, то ток будет течь по направлению, указанному стрелкой. Возникновение электрического тока имеет тенденцию к выравниванию в момент контакта, так как концентрация свободных электронов отдельных металлов различна (III§ 8). на границе раздела между раствором металла и его солями одновременно происходит равновесие (в случае одновалентного Иона) + Кубический Ионный.
Один g4ts Си + 2е Да.; Рисунок V-29.Схема гальванических элементов. М * + ах * = Решение е + м * Слева. М Или, в общем: М + ах г + м ’ * Уменьшение концентрации свободных электронов в металле (ниже обычного значения) способствует правому сдвигу равновесия, то есть развитию дополнительных положительных ионов и их переходу в раствор.
Увеличение концентрации свободных электронов, наоборот, способствует сдвигу равновесия влево, то есть превращению положительных ионов в нейтральные атомы (выход последних на поверхность металла). Концентрация свободных электронов в цинке выше, чем в меди, поэтому цинковый электрод показан отрицательно, а медленный электрод показан положительно.
Если оба электрода соединены проводами, то часть электронов переходит от цинка к меди, тем самым положительно заряжая цинковую пластину и отрицательно заряжая медную пластину. Положительный заряд цинка немедленно нейтрализуется путем перемещения положительных ионов Zn в раствор, а отрицательный заряд меди немедленно нейтрализуется путем осаждения положительных ионов Cu на электрод (преобразуется в нейтральные атомы).
От контейнера а к контейнеру В. Все рассматриваемые процессы протекают непрерывно (до полного растворения цинка или полного разложения соли меди). Кэл ток. Два Пара Zn-Cu не является исключением. Поэтому при выборе состояния гальванического элемента можно использовать одно из следующих условий для получения тока: Чем больше разница в концентрации свободных электронов, тем интенсивнее движение от одного металла к другому.
Это означает, что напряжение, приложенное к гальваническому элементу, увеличивается. Зная знак заряда каждой пластины и измеряя напряжение, можно оценить сравнительную активность различных металлов и на этой основе расположить их в так называемые ряды напряжений. Основной формой последнего термина является: … К… Около.. Мг. .. Цинк… Фе… Ст…. Х… Cu… АГ. .. АС. .•
Ниже приводятся наиболее существенные последствия ряда напряжений. 1) каждый металл может быть вытеснен из соли всеми другими металлами, находящимися в ряду напряжений на его правой стороне. 2) Все металлы на левой стороне водорода могут заменить водород из кислоты на правой стороне-не заменяют. 3) Чем дальше 2 металла находятся друг от друга, тем больше напряжение, которое дают гальванические элементы, построенные из nnh.
Получение тока путем химических реакций в гальванических элементах различных типов действительно широко распространено. Однако еще чаще для этой цели используются такие генераторы, как насосы, которые посылают электроны из одной части сети в другую. Как видно из рисунка, поток электронов, называемый током, формально аналогичен потоку воды. В-30.Подобно насосу, генератор посылает электроны из одной части системы в другую.
Напряжение (аналогичное давлению воды) измеряется вольтметром, количество протекшей электроэнергии (аналогичное количеству утечки воды) измеряется амперметром, а выключатель (выключатель) играет роль водопроводного крана. Когда сосуд, содержащий раствор электролита, такого как HC1, включен в цепь тока, происходит явление, называемое электролизом (рис. V-31).
Работа источника тока позволяет откачивать электрон q 1 электрода (анода) 、 Вождение Сиэль куггин Амперметр реакции смещения. 1 Спсоо’пор Иономер нога. ос РНС. В-30.Аналогично для водных и электрических систем. Еще 1 (катод) возбуждается. Поэтому в аноде наблюдается дефицит электронов, а в катоде-избыток электронов. Ионы C1 ’в растворе отталкиваются отрицательным электродом и притягиваются к положительному электроду. H * ион-это reverse.
So, первый движется к аноду, а второй-к cathode. In в связи с этим отрицательно заряженные ионы обычно называют анионами(движущимися к аноду), а положительно заряженные ионы-катионами (движущимися к катоду). Источник тока откачивает электроны от анода, так что из ионов С1, которые приходят к последнему Иону, 1 электрон отнимается и становится нейтральным атомом.
Затем 2 таких атома объединяются и превращаются в молекулы, которые выделяются в виде хлора gas. At в то же время катод (включая избыточные электроны) отдает электроны приближающимся Н-ионам и преобразует их в нейтральный атом водорода. Такие 2 атома образуют молекулу, и газообразный водород вытекает из контейнера.
Итак, при пропускании электрического тока через электролит в электродах происходит следующее: а) на аноде-превращение аниона с испусканием электронов в нейтральный атом (или группу атомов). б) в катоде катион превращается в нейтральный атом (или группу атомов) Получают электроны. И то и другое прекратится только тогда, когда все электролиты будут consumed.
So, суть процесса электролиза заключается в проведении химических реакций электрическим током. \ Измените предыдущий пример немного и используйте вместо него HCI, например CuCI, процесс на аноде, а не на меди, останется прежним, но с катодом будет высвобождена металлическая медь. Поэтому, выбирая условия (силу тока, состав раствора и др.), можно понять, что медь осаждается в еще более плотном слое.
Метод электролитического покрытия одного металла слоем другого широко используется в современных технологиях (никелирование, золочение и др.). Если электролиз CuCl2 происходит на медном аноде, процесс немного отличается. Поскольку атомы Cu легче теряют электроны, чем атомы без SG, в этом случае вместо появления хлора анод переходит в раствор ионов Cu. Металл может быть очищен электролизом.
Как уже говорилось выше, в зависимости от химической активности элемента происходит переход из атомного состояния в ионное simply. As в результате и наоборот-напряжение, необходимое для превращения различных ионов в нейтральные атомы, должно быть различным. Дело в том, что чем больше металла находится в диапазоне напряжений, тем сложнее отделить металл от раствора при электролизе.
Исходя из различий в напряжениях, необходимых для осаждения отдельных металлов, можно выделить несколько важных методов их разделения. Например, если есть раствор смеси caiefi Zn и Cu, то при правильном регулировании напряжения медь осядет на электродах, а цинк останется в растворе. Анод Катод В ЛН-НСГ Ди©1 т т Рисунок V-31.Схема электролиза.
При электролизе, например, Na2SC> 4, в катоде образуется водород (по Н ионам воды), в аноде-кислород (по схеме: 20Н ’ — 2e = Н20-f0), поскольку разряд самого Иона воды протекает легче, чем ионов многих других металлов. electrolytes. As в результате катодное пространство упрочняется ионами Na и OH ’, а анодное пространство накапливается в SO /и Н\ионах, то есть накапливается первая свободная щелочь, а вторая кислота.
Именно поэтому для превращения отдельных ионов в нейтральные атомы требуется различное напряжение, величина которого зависит от химических свойств ионов. Соотношение, наблюдаемое для количества электроэнергии, потребляемой при электролизе, гораздо проще. Каждый одноатомных ионов, независимо от его химических свойств, получает 1 Электрон,2 тяжелых-2, и так далее.
Поэтому, чтобы разрядить и отделить 1 грамм 1 валентности элемента в базовом состоянии, необходимо потреблять такое же количество электроэнергии. Ион 2-валентности в 2 раза больше размера such. In в этом случае отношение становится еще более общим, когда оно является отношением эквивалентности, поскольку нет никакой разницы, связанной с зарядом Иона.
Для всех электролитов действует закон электролиза (Фарадей, 1834).Такое же количество электричества выпустит такой же вес element. At в то же время 96 487 кулонов(26,8 ампер) испускают любой элемент, эквивалентный 1 грамму. Закон Фарадея позволяет производить различные расчеты, связанные с электролизом. Восемнадцать Образцы.
Соедините серию решений Agn’OJ, CuSOпоследовательноAuCU непрерывно к цепи DC и побегите течение 5 A для 10 minutes. It необходимо определить, сколько серебра, меди и золота осядет на катоде за это время. Сила тока в 1 Ампер соответствует проходу 1 кулона/сек, поэтому в ходе эксперимента 5-60•10 = 3000 К пропускается через раствор, поэтому 107,9-3000 заметно. 63.5-3000 польск г 196.0-3000 ол, а 1-96 487 ″ 3 ’35г АГ 2-96 487 — *’ 3-96487 -!Вт * Ас Если рассматривать электролиз, то раскрывается сущность проводимости раствора. См. диаграмму еще раз.
Легко видеть, что V-31, ток через жидкость (то есть поток электронов) не течет вообще. Однако число электронов, получаемых анодом, равно числу одновременно получаемых катодом, поэтому ток во внешней цепи такой же, как если бы электрон проходил непосредственно через жидкость. Поэтому они говорят об «электрической проводимости» раствора.
Естественно, раствор, не содержащий ионов, то есть неэлектролитный раствор, вообще не может пропускать электрический ток. Электропроводность электролита зависит главным образом от концентрации ионов. Чем она больше, тем больше электропроводность. Вторым фактором, влияющим на электропроводность, является ионный заряд. Очевидно, что ceterris Paribus дает (или получает) 2 электрона каждый из первых, так что, например, ионы 2 валентности больше, чем ионы 1 валентности могут «переносить» больше electricity.
In для исключения влияния ионных титров в сравнительных исследованиях электрохимических свойств используют раствор нормальной концентрации conductivity. In в этом случае больший заряд Иона компенсируется его меньшим содержанием. Наконец, 3-й важный фактор-подвижность ионов, которая характеризует скорость, с которой ионы движутся Создатель.
Чем быстрее движутся ионы, тем больше ионов испускается за единицу времени как на аноде, так и на катоде, что увеличивает проводимость раствора. Фактическая скорость отдельных ионов близка друг к другу, и при нормальном напряжении тока она очень мала(порядка 1 сантиметра в час). Ионы OH (около 2 ′ / g раз), особенно ионы H *(около 5 раз), значительно легче перемещать, чем другие движущиеся объекты.
Поэтому растворы сильных оснований и кислот одинаковой стандартной концентрации пропускают токи лучше, чем соли solutions. As концентрация раствора увеличивается, подвижность ионов уменьшается. Напротив того.、 Температура, она значительно возрастает и увеличивается по отношению к/ р \ ш, чем обычно, а электрический проводник Растворимость раствора 10 ′ 20(0 ^ ^ ^ (p)
Очень малая абсолютная скорость ионов ( \ ) Qj Главным образом из-за их гидратов-^^^^^^^^^^в зависимости от реакции, например: vj / \ l) vj? Na * — f aq = Na * — f-101 ккал Q Q q ^ С кДж CI-f aq = SG-f 84 ккал ^ ^ Энергия, выделяемая в этом случае, называется-^(I)^ Энергия гидратации. Вы можете увидеть Rns. В. 32.Схема гидратации уже из приведенного выше примера и очень H0Ia Это важно. Четкое представление о гидратирующих ионах дает рис. В-32.
Молекулы воды вблизи ионов вращаются в направлении ионов на противоположно заряженной стороне диполя.2-й слой, например молекулы, притягивается к свободному краю последнего до тех пор, пока сила притяжения к ионам не станет меньше энергии молекулярного движения в слое. solution.
So, вокруг ионов образуется» шуба » молекул воды, которые движутся вместе по мере движения ионов к электродам, тем самым значительно замедляя это движение. Добавь 1) в связи с тем, что атомы и ионы различных полуметаллов также характеризуются прочностью связи различных электронов, для них также происходят реакции замещения.
Например, когда атом хлора взаимодействует с ионами йода, электроны из последнего переходят в хлор. 2KI + С12 2KS1 4-1, нлн 2Г + С1,= » 2CG + г、 Поскольку активность металлоида определяется энергией присоединения электронов, можно сказать, что более активный металлоид замещает менее активный металлоид из соли nx. Однако это явление встречается сравнительно редко, поскольку при взаимодействии металлоидов гораздо чаще происходят различные более сложные реакции.
2) если положить кусочек корицы в раствор соли меди, то частицы металлической меди сразу же осядут на ее поверхности. Такой «медный» цинк капает в гальванический раствор кислоты и реагирует гораздо более энергично, чем Р, чистый. Электроны от цинка переходят к меди, а от последнего-к ионам водорода в растворе(рис. V-33).Поэтому газообразный водород не выделяется.* E во время цикла.
То же самое, что есть на меди и не мешает дальнейшему переходу Zn-ноннона в раствор * кислота происходит постоянно, когда она действует на металл в контакте с другими металлами, которые меньше active. In по сравнению с обычным, он содержит меньше примесей активных металлов. 3) при изоляции половины установки рис. V-29, например, в том месте, где находится чашка а, то электрод(цинковая пластина) вступает в контакт с раствором ZnSO, «устанавливается равновесие между атомами Znns и не-ZNS ^ z±Zn» -+■.
Положительные ионы находятся в растворе, электроны, в результате чего слой раствора, прилегающий к электроду, положительно заряжен, а сам электрод В отрицательном случае между ними устанавливается разность потенциалов. Аналогичное явление происходит и в одном стекле В, но с той лишь разницей, что разность потенциалов разная.
Очевидно, что если мы сможем измерить его, то количественно охарактеризуем тенденцию nln другого металла переходить в раствор в виде ионов. Однако прямого способа измерить эти потенциальные различия не существует. Поэтому для получения цифровых данных необходимо использовать косвенный метод, основанный на том, что суммарное максимальное напряжение.
- Создаваемое гальваническим элементом, равно алгебраической сумме всех разностей потенциалов в элементе. Когда платиновый электрод опускают в раствор, содержащий H *(например, HjSO»), и вокруг него проходит газообразный водород, последний покрывает платину, и на поверхности такого водородного электрода устанавливается равновесие между молекулой водорода, его Атомом и неоном: Hj» *2Н2Н * + 2c.
Предположим, что разность потенциалов между водородным электродом и кислотным раствором равна нулю, и с этим электродом, например цинком(rns. V-34), и можно видеть, что разность потенциалов между Zn и его солнечным раствором (потенциал цинкового электрода) прямо равна максимальному напряжению, возникшему на его элементе.
Аналогичным образом можно определить относительный электродный потенциал большинства других металлов. Людмила Фирмаль
Заряд исследуемого электрода отрицательный в активном металле, положительный, если он менее активен, чем водород. Ниже приведены данные, относящиеся к молярному раствору (для соответствующих ионов), давлению водорода, равному комнатной температуре, 1 атм (0 фунтов в Вольте).Если nln изменяется вне этих условий, то потенциал электрода изменяется от равновесного потенциала M. M * + B и Hj «* 2H ^ ZST 2H * + 2 * или H, » * H * 4-e) смещаются соответственно.
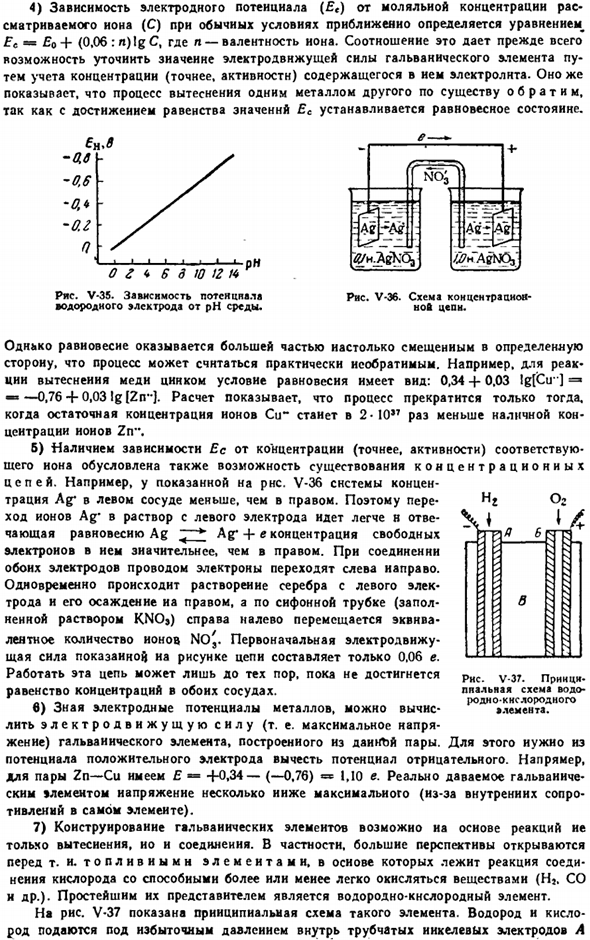
Например, с увеличением рН среды электродный потенциал водорода становится все более отрицательным (рисунок V-35).Поскольку наиболее активные металлы (особенно К и СА) бурно взаимодействуют с водой, электродный потенциал был установлен путем последовательного изучения системы металл-его разбавленная амальгама (в неводной среде) и разбавленная амальгама-золь.
Электродный потенциал некоторых металлов Ионы металлов так. * ион металла i Bq. In К К * −2.93 ЗП » −0.14 Ца-ца «±-2.87 Привет \ 1Н ’ 0.00 Мг Мг »-2.37 КР КР КР» +0.34 ЗН ЗН » −0.76 АК АГ — + о. АО Ре Фе «-0.44 Ау Ау» + 1.45 Рисунок V-34.Схема * определение электродного потенциала * цинк. 4) зависимость электродного потенциала (£e) в нормальных условиях от молярной концентрации рассматриваемого Иона © определяется приблизительно по Формуле^£е=£0 — |- (0.06: n) logC.
Где N является валентностью. Это соотношение, прежде всего, позволяет уточнить величину электродвижущей силы гальванического элемента с учетом концентрации содержащегося электролита (точнее, активности), а также показывает, что процесс замены одного металла другим носит обратимый характер, так как равновесное состояние устанавливается при равных значениях Эк. Ряса.
В-35.Зависимость потенциального показателя V-36.Схема обогащения * равномерный электрод между pH. отсутствие цепи. Однако этот процесс можно считать практически необратимым, поскольку равновесие почти всегда смещено в определенном направлении. Например, в случае замещения меди цинковой реакцией условие равновесия равно 0.34-f 0.03 IgfCu») = «-0.76 + 0.03 IglZn»).
Расчеты показывают, что процесс прекращается только тогда, когда остаточная концентрация ионов Cu становится»в 2-10″ раз ниже текущей концентрации ионов Zn. б) наличие зависимости от концентрации (или, скорее, активности) соответствующих ионов также определяет вероятность наличия концентрационной цепи. Например, он появляется в rns.
In в системе V-36 концентрация Ag в левом сосуде ниже, чем в правом сосуде. Поэтому переход от левого электрода к раствору Иона Ag *легче, чем концентрация свободных электронов, соответствующих равновесию Ag * +ε в нем. Если оба электрода соединены проводами, то электроны переходят слева направо. В то же время, серебро растворяется с левого электрода и осаждаются на электрод, такое же количество нет, ионы движутся справа налево по сифонной трубке(она заполняется раствором КНО).
Начальная электродвижущая сила схемы, показанной на рисунке, составляет всего 0,06 е, и эта схема работает только до тех пор, пока концентрация обоих контейнеров не станет равной. 6) Если вы знаете потенциал металлического электрода, вы можете рассчитать электродвижущую силу (то есть максимальное напряжение) гальванического элемента, состоящего из определенного pair.
To сделайте это, вычтите потенциал отрицательного электрода из потенциала положительного электрода. Например, для пар Zn-Cu、£-+ 0.34—(-0.76)»1.10 это е. напряжение, фактически подаваемое гальваническим элементом, несколько ниже максимального (из-за внутреннего сопротивления самого элемента). 7) конструкция гальванического элемента возможна не только на основе смещения, но и на основе реакции connection. In в частности, открывается большое будущее.
Топливные элементы основаны на реакции соединений кислорода с веществами, которые более или менее легко окисляются (H}, CO и др.).Простейшим представителем является водородно-кислородный элемент. На рисунке V-37 показана принципиальная схема такого элемента. Водород и кислород подаются на трубчатый никелевый электрод а под давлением РНС. В-37.
Нет принцип-palyaya загрязнения схеме о водно-дисперсионных Предмет. К B. газ сообщается через тонкую пористую стенку с центральным пространством, заполненным сильным раствором KOH (b).Работа элементов основана на реакции: Отрицательный электрод (а) 2Н,+40Н ’ =4Н, 0 +4е Положительный электрод (B) 4е+ 03 + + 2Н, 0-40Н ’ Максимально возможное напряжение такой системы составляет около 1,2 В. основная трудность при проектировании топливных элементов заключается в обеспечении достаточной скорости электродного процесса.
8) большое напряжение нельзя считать абсолютной характеристикой свойств металлов. Например, в нейтральной среде водород помещается с левой стороны, а не с правой стороны олова. Некоторые растворенные вещества вызывают сильный стресс и существенно его меняют. Например, решение KCN, как ясно объяснено ниже (10°С), значительно отличается от обычного решения. Обычная серия: Zn Ft Sn Cu Ag Ai 0.6 th KC. ВЗН Ку СН А? ZOM-IOM KCN Au Fe: Zn Cu Au Ag Sn Fe В среде ледяной воды может возникать совсем другое напряжение.
Несмотря на свою относительную природу, это действительно важно. Это неудивительно, ведь в большинстве случаев можно правильно ориентироваться в характере взаимодействия металла с раствором 1 или другого электролита. j) в случае металлоидов реакция с электродами, состоящими из металлических электродов, обычно более сложна, поэтому серия напряжений не так полностью установлена, как в случае metals.
In сравнение некоторых отрицательных ионов показано ниже, последний держит электроны более плотно и тем больше вы идете вправо… С.» ..Г…- Я не знаю, что делать… СГ… Ф’.Отображаемое значение потенциала электрода показывает молярную долю. Гора ионов(кислотная среда): Я’vv’С’С Альф * Я, (телевизор) б р (г) с! А (Р «Е) Ф (Р»)+0.54 +1.09 +1.36 + 2.87 Джоуи….. Чего следует опасаться при использовании данного препарата? Уравнение…..
10) в единицу электрической массы обычно берется кулон(К), который равен 6,25-10-му заряду электрона. В случае тока 1 ампер (а), 1 кулон проходит через провод за 1 секунду (то есть I a = I k / s, или 1 k = » 1 a-sec).Единица измерения мощности-Ватт (Ватт) и определяется как 1 джоуль в секунду (Ватт= » I Дж / с).Сила тока равна напряжению этого тока (вольт (в)), умноженному на его интенсивность. То есть, 1 in-1 A = * 1 болт.
Клетка V-29 показанная в диаграмме производит напряжение тока около 1.1 V, обычно 127 nln 220 V в освещении network. In в электротехнике принято указывать движение тока от положительного к отрицательному(то есть возвращаться к движению реального электрона).Это сохранилось с тех времен, когда природа течения еще не была известна.
11) минимальное напряжение, необходимое для разложения электролита(так называемый потенциал разложения), определяется путем вычитания соответствующего электродного значения катиона из электродного потенциала аниона. Например, потенциал разложения хлорида цинка Z = — 1.36 — (-0.76) 2.12 in. In в случае хлор-меди Z = 1,36 — (+0,34) 1,02 дюйма из этого видно, что именно медь должна выделяться из раствора солевой смеси, а цинк только после ее осаждения.
Однако, поскольку электродный потенциал изменяется по мере изменения соответствующей концентрации ионов, обычно можно инициировать высвобождение высокоактивных металлов даже до полного осаждения менее активных металлов. Это особенно верно, если электродный потенциал обоих металлов близок. 12) сам потенциал разложения можно определить приблизительно в то же время, непрерывно увеличивая напряжение на электроде. Марсуния течения, проходящего через electrolyte.
As это видно из рисунка V-38, когда достигается такая возможность за счет предстоящей разгрузки активов. Сила тока начинает резко возрастать. 13) стандартное значение потенциала электрода соответствует очень низкой плотности и оси тока (то есть интенсивности тока на 1 см2).С другой стороны, при электролизе он обычно значительно больше, но в связи с этим фактический потенциал, необходимый для разложения электролита, часто превышает теоретическое значение.
14) разница между экспериментальным и теоретическим значениями потенциала разложения называется перенапряжением. Особенно это характерно для водорода. И его размер. В дополнение к плотности тока, она также зависит от многих других факторов (природы катода, чистоты его поверхности, природы и концентрации электролита, температуры и т. д.).
В частности, для катодов из различных металлов, перенапряжения водорода при той же плотности тока непрерывно увеличиваться, так как в Пт — о — АГ — Фе — КР — рт. ст. — ПБ. В случае платины(то есть гладкой Пт покрытые Пт мелкодисперсным методом электролиза), он близок к нулю, а в случае С Пб, также около 1 при низкой плотности тока. В качестве плотности тока возрастает, увеличивается перенапряжения, а при повышении температуры она уменьшается.
Водородное перенапряжение играет важную роль в некоторых электрохимических процессах. Например, в серии напряжений свинец находится на левой стороне водорода. То есть при электролизе раствора, который одновременно содержит H и Pb, должен выделяться водород. С другой стороны, из-за наличия значительных перенапряжений водорода свинец фактически высвобождается на свинцовом катоде.
Это позволяет проводить очистку с помощью электролиза. 15) довольно распространенный способ распознавания полюсов цепи постоянного тока с помощью листа бумаги, смоченного в растворе смеси этого солнечного и фенолфталеинового раствора, основан на электролизе Na * S04.Когда концы проволоки прикладывают к такой бумаге на определенном расстоянии друг от друга, в результате взаимодействия щелочи и фенолфталеина, образующегося при электролизе, малиновое пятно появляется вблизи того, что является отрицательным полюсом.
16) электролизу часто подвергаются не растворы, а вещества в расплавленном состоянии(в основном соли).Электролиз такого расплава имеет большое техническое значение. Достаточно сказать, что с его помощью ежегодно добываются миллионы тонн различных металлов. Большинство солей характеризуется ионной структурой, поэтому расплавы вблизи температуры плавления в основном состоят из отдельных ионов.
Возможность выделения последних, как правило, практически зависит от природы противоположно заряженных ионов и не совпадает с измеренными в водном растворе. Имеется монография*о свойствах расплавленных солей. 17) закон электролиза обеспечивает удобный путь определить efficiency. It необходимо только знать вес элементов, выделяемых известным количеством электричества. Образцы.
Ток пропускают через раствор соли кадмия силой 1 а в течение 1 минуты, высвобождая 0,524 г металлического кадмия. Основанный на законе электролиза, ЭСЛ=(0.524•96 487):(15 −60-1)= 56.2。 18) предполагая, что заряд электрона является абсолютной электростатической единицей (III§ 2 дополнение 2) 4,80-KN0, или 1,602-I0-1 * k, можно вычислить число Авогадро на основе закона электролиза:96 487 / 1.602•10- «®» 6.02-10 ″ Беляев А. И.. Жемчужина Е. А.. Фирсанова Л. А. физическая химия расплавленных солей рапса. М.. Металлурги. 1957 год. 3S9P.
Строение расплавленных солей. На Английском Языке. Е. А. Укше. Москва, Мир, 1966.43!И 2.12 напряжение、 Рисунок V-38.Приведена схема приближенного определения потенциала разложения. 19) очень высокая подвижность ионов Н и OH обусловлена возможностью взаимодействия с соседними молекулами воды по схеме. Ч, 0 + ч 04 ю * + Н20 и ох-ах «- о» + о、 Такой протонный обмен всегда происходит с раствором кислоты и щелочи.
Средняя продолжительность жизни физического лица-краны закрепительных втулок H30 *была рассчитана только 10_ секунд. При отсутствии тока протонный обмен происходит случайным образом во всех направлениях. Наоборот, когда ток включен, этот обмен происходит несколько более упорядоченно. Протоны движутся в 8-м направлении от частицы, главным образом от анода к частице. cathode.
As для внешнего эффекта, это Это соответствует движению H ’или OH7 от анода к катоду, но на самом деле сопротивление среды, которое все остальные ионы должны преодолеть во время движения, исчезает в этом case. In в неполной среде (кроме спирта) подвижность ионов водорода и гидроксила существенно не отличается от всех остальных. 20) быстрые ионы могут передавать больше электроэнергии в единицу времени, чем низкоскоростные ионы.
Транспортное число данного Иона означает отношение его подвижности к общей подвижности всех ионов рассматриваемого электролита. Например, КС! Мобильность обоих ioi примерно одинакова, и количество переводов для каждого составляет 0,5.Напротив, в растворе HCl ионы H * движутся гораздо быстрее ионов SG, а число их переноса равно 0,84 и 0,16 соответственно в случае i N solution.
An увеличение концентрации в сильном растворе электролита двух компонентов обычно способствует дальнейшему увеличению числа переносов ионов, которые являются более подвижными. 21) сравните энергию гидратации некоторых ионов(точнее, тепла) со следующей (Ical / g-ion): Н * И * Н * К * РБ * Ца4 быть * * Ка «* Ср » * Бау ЗН * * Фе * * ФА «АИС * 265 127 101 81 75 67 601 467 386 353 320 406 430 467 1056 1125 NHJ АГ + Тл * Е „С Р Бр“ 1 „СИЭН“ НК » Ш » О «нет,» CIO7>; — да 06 78 117 82 116 84 76 67 83 74 82115 74 54 26S 332
Как видно из приведенных выше данных, энергия гидратации H значительно больше, чем у всех других не заряженных не заряженных energies. It можно разделить энергию образования h»0 *(169 ккал) и дальнейшую энергию гидратации последней (96 ккал).Среднее время пребывания молекул воды в гидратационной оболочке отдельного негидрата различно, но обычно очень мало. 22) на рисунке V-39 показано, что энергия гидратации аниона выше, чем у катиона при той же абсолютной силе и радиусах заряда.
Это связано с различными типами ориентации молекул воды в обоих случаях (рисунок V-40).Вода притягивается к катионам кислородом, который находится почти в середине молекулы. А к аниону относится 1 водорода, который находится в periphery. In в последнем случае возможен более близкий подход, который влияет на величину энергии гидратации.
23) полная энергия гидратации состоит из энергии, которую небольшое число молекул 1НЗО присоединяют непосредственно к определенному Иону, и энергии взаимодействия таких первичных гидратированных ионов с окружающей водой. Если мы попытаемся оценить обе эти энергии в общем виде, мы получим приблизительную эквивалентность. То есть на каждый из них приходится около половины всей энергии гидратации、 Рисунок V-30.
Энергия гидратации катионов и анионов(ккал / моль). /.1, г, г Ионный Радиус, 4 0 ® УО Рисунок V-40.Схема ориентирования молекул воды. По-видимому, первичная гидратация ионов щелочных металлов и галонов осуществляется 4 молекулами воды, а средняя Энергия 1 связи составляет около 10-15 ккал / моль. при увеличении заряда Ноны (и уменьшении радиуса) эта энергия возрастает, а для Al (OHj) g *составляет уже около 100 ккал / mol.
It соответствует сильной химической связи в порядке magnitude. At в то же время было установлено, что непрерывный обмен этой неводной молекулы на другую молекулу воды в гидратационной оболочке осуществляется очень интенсивно(уже наполовину за 10 минут 1 секунду). 24) классическая интерпретация гидратации вышеупомянутого ИА была сформулирована на основе концепции самой воды как жидкости, состоящей из независимых независимых молекул.
С другой точки зрения, если предположить, что вода имеет упорядоченную внутреннюю структуру за счет водородной связи(IV§ 3 add.32), ионы должны сначала заполнить свои пустоты. Возникающее при этом более или менее искажение исходной структуры требует энергозатрат, которые компенсируются энергией взаимодействия ионов с молекулами воды. Существует монография, посвященная интерпретации раствора электролита с этих позиций. * Самойлов О. Я. Структура водного раствора электролита■гидратация конуса. М^ Издательство Академии Наук СССР. 1957, 1 и 2 секунды、
Смотрите также:
| Ионные реакции | Работы Менделеева |
| Гидролиз | Развитие периодического закона |
