Оглавление:







Работы Менделеева
- Работа Менделеева.1. одной из древнейших теоретических концепций современной химии является представление о молекулярно-атомной структуре вещества. matter. In некоторые страны Азии существовали уже более 1000 лет до нашей эры. влияние этих идей, возможно, достигло Европы и повлияло на греческого философа Роя Каппса(500-428 до н. э.) и его ученика Демокрита (460-370 до н. э.).
- Представительство по атомной атомной 2 Убедительным контрразведчиком этих идей был Аристотель. Под влиянием его естественнонаучных идей, господствовавших около 2000 лет, идея молекулярного атомизма была забыта. Они возродились только в 17 веке. Его молекулярно-атомная теория значительно предшествовала своей эпохе в плане интерпретации.
Среди ученых, развивавших эти идеи на ранних этапах научного развития, особо следует отметить М. В. Ломоносова (1711-1765). Людмила Фирмаль
Заслуга введения в науку понятия атомов на основе экспериментов принадлежит прежде всего Дальтону. Используя результаты других и своих собственных исследований, он сформулировал закон долей и множественных отношений(1§ 2) и объяснил их наличием атомов реагирующих элементов. Сразу же после того, как наука овладела понятием атомов, начались попытки создать систему химических элементов.
Начиная с Деберейнера(1817), многие ученые работали над этим важным вопросом химии. Однако решающий успех был у Ди-Джея. В кабинете И. Менделеева было всего 6. В работах его предшественников не было главного-единого теоретического обобщения. Все они искали и находили только варианты более или менее удачной таксономии.
Напротив, Д. И. Менделеев (1834-1907) исследовал законы природы и открыл их. 1869-2, дек. И. Менделеев представил нижеприведенную таблицу. Сопровождающий его текст содержал все важнейшие моменты содержания периодического закона, которые были подробно раскрыты уже через 1 год.
К ним в основном относятся следующие положения: в) » элементы, расположенные по величине атомной массы, представляют собой кажущуюся периодичность свойства.」 б) » размер частиц определяет свойства комплекса, поэтому размер атомной массы определяет природу элементов. Потому что Например, соединения S и Te, C1 и 1, если они похожи, представляют собой очень отчетливые различия.
В) » следует ожидать открытия все более и более неизвестных простых объектов, таких как 65-75 единиц А1 и аналогичные элементы Си」 d) » значение атомного веса элемента иногда может быть скорректировано, если вы его знаете «’Ш’ д) » сходство некоторых элементов ярла обнаруживается по величине веса атома. На следующий год, в 1870 году, появился ЗФ. Статья Мейера. Он имеет в виду «^ ^ ^ NK I V».
Дайте систему к работе Менделеева Элемент, в виде^^^^ hmlmp ^^ ^ немного отличается, но » по существу идентичен 1 Завершая свою статью, Мейер писал: «я не собираюсь сдаваться. Полностью подошел к вопросу Суд. И. Менделеев Я глубоко убежден Он важен тем, что открыл Менделеева, один из важнейших законов природы Д-Менделеев (1869) смело принял его за основу для оценки имеющихся экспериментальных data.
To чтобы выявить все периодические законы, необходимо было разместить несколько элементов-Os, Ir, Pt, Au, Te, I, N4, Co. Опыт применения системы elbution、 B Btct>и химическое СХ0ДСП на их основе и количество& Ти 7т −50 ′ 90? −180. V-51 Nb-4 Ta-182 СГ = 52 МО-96 Вт-18С МН = 55 РЗ » К) 4.4 Пт-197.4 Фе-56 Ру-У4. 4 ИК-198 НЛ » со * 59 ПИ-У6. 6 ОС-199 Н » 1 кр-63.4 АГ-СЕ НД-200 Быть-914 Мг-24 ЛН *(я \ л КД-1″2 Б-II Аль-27.4?- 63 УР? Hl6 Au-197? С-12 ГУ » 2fi?-70 СН-ложь N-14 С-3) Ас-7С СБ-122 Би-210? 0-16 с −32 Се-79.1 их«И2&? Ф-i9 не сл-35.3 Бр * ФИО я■f27 L «-7№= 23 K −39 Rb» 85 4CS-ШTr = 2o4 Ca-40 Sr-87.6 Da » 137 PD-207 ? −45 Се » 92?Э-56 Ла ’ 94?Yt-60 Di » 95?ЛН-75.6 м-118?
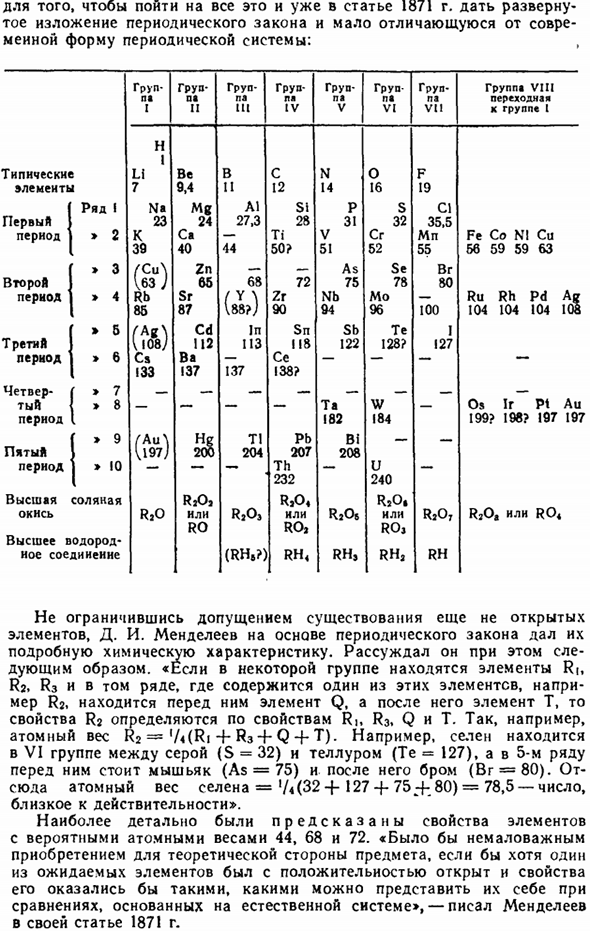
В отличие от известных значений атомных весов, последние из других элементов (In, La, V, Er, Ce, Tb, U) изменились (см. 1§ 5) и, наконец, позволили присутствие многих элементов, которые еще не были обнаружены. Мне нужен был гений Менделеева. Для изучения всего этого и уже в статье 1871 года проведено подробное описание периодического закона, который мало чем отличается от современной формы периодической системы.
Группа I группа II группа III группа IV группа V группа VI группа VI группа VII группа VIII переход к группе I Типичные элементы H 1 Li 7 Be 9.4 V 11 C 12 N 14 O 16 F 19 Первый столбец период 1 на 23 К 39 мг 24 Ка-40 Л1 27.3 44 28 Си Ти 50? P 31 V 51 S 32 Cr 52 CI 35,5 Mn 55 Fe Co N1 Cu 56 59 59 63 2-й период » 3 ″ 4(S) Rb 85 Zn 65 Sr 87 68 (88?)) 72 Zr 90 As 75 Mb 94 Se 78 Mo 96 Br 80100 Ru Rh AG 10410410108 3-й период » 5 ″ 6 (враг) Ca 133 Cd 112 Ba 137 In 113 137 Sn 118 Ce 138? СБ 122 их 128? Я 127- 4-й ’7 1′ 8—- Ta 182 W 184-Os Ir Pt Au 199? 196? 197, 197 5-й Г, » 10 (ФК) T1 204 Pb 207 Th 232 Bi 208 U 240-
Чем выше оксид соляной кислоты, тем выше водородное соединение RaO RaO, или RO RaO, (RHe? Р> 04 или РО, rh4 r2o8 резус, РАО, или РО, РЗ, РАО. RH R2Oa или R04 Не ограничиваясь предположением о существовании элементов, которые еще не были открыты. И. И. Менделеев провел детальную химическую характеристику, основанную на периодическом законе. Он рассуждал так: «если в группе есть элемент R(RJ, R3 и ряд yum, содержащий 1 из этих элементов, например Rs), то если перед ним есть элемент Q, то свойство Rj определяется свойством Rb R3.
Например, атомный вес R2=ЛA (Ri + R3-Q-f T).Например, селен относится к семейству VI между серой (S = 32) и теллуром (Te = 127), а на 5-й строке перед ним находится мышьяк (As = 75), а затем бром (Br = 80), поэтому атомная масса Селена= * L(32-f-127-F 75-80) = 78,5 близка к действительному числу.」 Свойства элемента, чей расчетный атомный вес составляет 44, 68 и 72, были наиболее точно предсказаны.
Сравнение, основанное на естественной системе», — писал Менделеев в статье 1871 года. В 1875 году Лскок де Буа Бодран открыл новый элемент под названием галлий (Ga) с атомным весом 69,7. Через 4 года Нильсон и Клив отделили элементы с атомным весом 45,1 и назвали их скандием (Sc).Наконец, в 1886 году Винклер открыл Германий (Ge), который показал свой атомный вес в 72,6. Детальное изучение всех трех элементов и их наиболее важных соединений выявило идеальное совпадение между предсказанными Менделеевым свойствами и найденными experimentally.
An пример-немецкие данные: Презмере Менделеева(1871) Винклер открыл(1836) Атомный вес-72 удельный вес-5,5 Металлы не заменяют водород. NZ Knell EO oxide formula ^ оксид удельный вес оксида-4,7 оксида очень легко сводится к металлу основные свойства гидрата оксида Хлорид формулы ES становится жидкостью с температурой около 90°C и удельным весом около 1,9.
- Атомный вес 72,6, удельный вес 5,35. Металл не растворяется в HCl и разбавляют H2S04 Гео-оксид формула * удельный вес оксида 4.70 GeOj уменьшается до металла Он нагревается в потоке водорода. Основными свойствами Ge (OH) являются Немецкая соль легко разлагается водой GeCl4-это жидкость с температурой кипения 83 * C и удельным весом 1,887.
«Нет никаких сомнений в том, что вновь обнаруженный элемент — это не что иное, как экасилиция, предсказанная 15 лет назад Mendeleev. It вряд ли можно найти другие, более замечательные свидетельства обоснованности учения о периодичности, такие как внедрение виртуальной экасилиции на вновь открытые элементы. Здесь мы видим очевидное расширение химического горизонта, мощный шаг в области знаний», — писал в своей статье Вийклер. Д. И. по определению самого Менделеева, периодический закон»свойства элементов (и, следовательно, простых тел и образованных ими комплексов) периодически зависят от атомного веса«.
Это не просто подтверждение смелой теории. Людмила Фирмаль
Поначалу это было очень хладнокровно воспринято большинством современных людей. «Я видел, что эта великая идея, вероятно, была проигнорирована, потому что она принадлежала русскому химику», — так описывал то время великий чешский ученый Богуслав Браунер. Последующее подтверждение числа атомных весов, скорректированных Менделеевым, в частности открытие Ga, Sc, Ge и только совпадение их характеристик с предсказанными характеристиками, проложило путь к всеобщему признанию периодического закона.
Наконец, это общее признание периодического закона было получено им около 1890 года. Д. И. общенаучное значение работы Менделеева характеризуется словами Энгельса.»Менделеев добился научного feat. In сама химия, периодический закон создает новую эру, и ее ценность для этой науки совершенно исключительна. Добавь, 1) атомистические идеи, по-видимому, имеют гораздо более древнее происхождение, чем считалось ранее.
Есть признаки того, что уже 1200 лет назад мох был представлен Сндонскнм (1 из древних месопотамских ученых). е. китайский ученый Ван Ван Ван «Король перемен» — это противоположный Принцип(1§ 1 дополнение.4) одновременно включается учение о первичном материнстве и его мельчайшей частице («ТСН»). По мнению Ван Вана, существуют частицы положительного («яй-ЦН») и отрицательного («инь-Ци»), сочетание которых образует все вещества в разных proportions.
It следует отметить, что плюсы и минусы были осмыслены Беном Вангом абстрактно-мистическим образом. В индийской философии общая космология(Kapnla. As Часть VI века до н. э.), атомно-молекулярное представление было затронуто в перчинской колеснице. Последняя включала в себя большое количество интересных научных идей, которые отчасти напоминали современные идеи (например, принцип сохранения материнства и энергии).
Согласно учению Каньяды (3 век до н. э.), атомы имеют 4 основных типа (соответствующие мельчайшим частям Земли, Воды, Огня и воздуха), и каждый тип обладает определенным набором свойств. Различные вещества строятся путем размещения этих атомов в различных пропорциях и размещения их друг в друге. 2) сочинения Левкнппа не сохранились, но суть его учения описана в 1 из сочинений Аристотеля («небеса»). Левкнпп считал, что частицы » движутся в пустоте n, обгоняя и сталкиваясь друг с другом.»
Некоторые из них разбегаются в случайных направлениях, в то время как другие соединены друг с другом в разных пропорциях из-за симметрии изображения. Согласно учению Демокрита, мир состоит из бесконечного числа атомов, движущихся по небу, отличающихся друг от друга только формой и размером. Разница между веществами обусловлена различными формами, порядком и расположением атомов, образующих эти вещества. Неравномерность массы отдельных атомов впервые была отмечена последователями греческого философа Эпикура (341-270 гг. до н. э.), лоикампа и Демокрита.
3) атомно-молекулярная теория получила развитие в работах М. В. Ломоносова»десенсибилизированные физические частицы, составляющие тело природы, составляющие достаточную основу определенных свойств»и»элементы математической химии«. Рукописи обеих работ датируются 1741 годом B. N. It был обнаружен Меншуткнным в архиве Академии наук и впервые опубликован в 1904 году.
4) теория Дальтона наиболее полно была развита в эссе «новая философская система тмина» (1808).Его первые положения были просты, с одной стороны, закон множественных отношений, а с другой стороны, наиболее устойчивым сочетанием этих 2 элементов был простейший состав, то есть допущение, что каждый содержит 1 атом. Оба эти пункта далеко не всегда совпадают true.
In дело в том, что простой закон множественных соотношений часто не применим, например, к гомологичным последовательностям органических соединений или к тем же оксидам азота (i§ 2), когда расчет выполняется в нижней части* > веса кислорода, а не nitrogen. In в частности, предположения об определенной стабильности бинарного соединения вызвали чрезвычайный хаос в экономике (например, они позволили приписать формулу только воде) и в течение 50 лет препятствовали установлению правильного атомного веса и общепринятой формулы.
Таким образом, теория Дальтона, принятая современниками в целом, одновременно опережала науку (в экспериментальной проверке атомных идей) и значительно замедляла ее развитие. 5) окончательный результат работы Доберейнера был опубликован в 1829 году табличкой «триада». Л! I 1 1 P 1 I S 1 CI Н-Я Как ГП, 1-Комн. К 1 В. СБ И Тэ И В каждой из этих триад, как отмечает Доберейнер, помимо химического сходства, существует закономерность по атомному весу: значение промежуточного элемента (например, Na) приблизительно равно среднему арифметическому двух крайних значений (Li и K).
После Доберейера многие другие исследователи работали в том же направлении, но они не достигли значительных результатов в течение следующих 30 лет. В 1858 году Канниццаро опубликовал свое эссе «курс химической философии».Это служит главным толчком к возрождению гипотезы Авогадро, к четкому разграничению понятий атомов и молекул, к установлению единого взгляда на атомный вес и формулу соединений.
Почти сразу же после этого продвинулись и исследования по систематизации химических элементов. В 1862 году шанкулуй расположил их в порядке возрастания атомного веса по спирали, нарисованной вокруг cylinder. In в большинстве случаев элементы со схожими свойствами располагались друг под другом (но была и большая разница). В 1864 году Мейер и о’Донохью восхищались этой работой.
Первая их комбинация-это » 6 групп элементов, взаимосвязанных и хорошо охарактеризованных.» —- Ли (быть) Н О Ф НЛ М」 С1 П С С1 К Са А * ГП ВГ Ср РБ Sn Sb Te I Cs Wa РЬ-В1—(ти)- Одлинг пересмотрел предыдущую (1857) систему эквивалентных Весов и дал следующую таблицу с содержательным объяснением, озаглавленную » атомные веса и знаки элементов.»
Шестьдесят пять Семьдесят пять 79.5 Восемьдесят 85 Ср РБ ЗР 87.5 89.5 Белый 184 АУ 196.5 Пт 197 Ему 200 лет. TI 203 ПБ-207 Би 210 МО ПД £5 Sa Sb Te Один Ct. Бар 106.5 108 112 118 122 129 127 Сто тридцать три Сто тридцать семь Сто тридцать восемь Рибе. В с Н О Ф На Мг А1 Si P S Ct К Это было. Ти СГ Mp Двадцать три 24 27.5 28 Тридцать одна 32, 35.5 Тридцать девять Сорок Сорок восемь 52.5 55 Н Зо Как ГП БР Эт(Fe. Nl. Co КР)
В 18G5 Ньюленд отметил, что если химические элементы были расположены в порядке увеличения атомного веса nx, то в 8-м элементе, отсчитываемом от первого элемента, наблюдалось приблизительное характерное повторение. Он назвал эту правильность «законом эктаве».»
Пронумеровав все известные в то время элементы по порядку, Ньюлендс свел их к следующей таблице. Л 1 Ф а КТ Со и N1 22 Бр 29 ОП Е6 я 42 Пт ИК-6 Ли 2 на 9 К 16 КР 23 РБ 30 АГ 37 КТ 44 часов, 51 Быть 3 мг Са 10 17 24 31 Ср 2а кд 38 Ба я в 45 НД 62 Б 4 на II СГ (9 г 25 Калифорния и Ла-33 у.40 ОП 46 Ти 53 С.5 12 18 ти си Ла. 26 Zr 32 Sn 39 W 47 Pb 54: N 6 П 13 20 млн на 27 Ди и МО ШБ НБ 34 41 48 55 Би 43 0 7 14 21 28 С па ЮВ РБ и Ру 35 та Ау 49-й 65
Как видно из таблицы, многие элементы (Mn, Fe и др.) классифицируются в совершенно разных местах. Принцип непрерывной нумерации без утечек исключал возможность нахождения новых elements. At при этом допускалась неоправданная»двуличность»элементов в некоторых помещениях. Мейер и Одлнг пытались найти конкретную связь между атомными весами различных элементов.
Ни один из них не был успешным, но оба чувствовали присутствие некоторой регулярности. «Нет никаких сомнений в том, что существует закономерность в численных значениях атомных весов», — писал Мейер. Оддлнг представил его еще более ясно.»Некоторые из арифметических соотношений, показанных в предыдущей таблице, конечно, просто случайны, но общие так многочисленны и так ясно выражены, что они еще не зависят от законов неизвестного.»Этот закон-Д. I.
It был обнаружен отдельно от работ своих предшественников Менделеевым. в)A. V. As Раковский правильно указал (1027), что научный подвиг Менделеева на самом деле важнее открытия рубели (и Адамса в то же время).Широко признанный закон. Ньютон. Менделеев открыл элемент и предсказал его характеристики, далеко не общепризнанные, опираясь на пустые ячейки в созданной системе Нм и открывая Нм на основе метода.
7) после окончательного признания периодического закона с разных сторон были предприняты неоднократные попытки оспорить честь его открытия в пользу 1 человека или другого ученого. По этому поводу сам Д. И. Менделеев писал в 1906 году: «утверждение закона невозможно без него, а без него возможно только выведение неожиданных результатов и обоснование этих результатов экспериментальными проверками.
Вот почему я посмотрел на периодический закон в своем законе (1860-1871) и получил логический результат, который указывает, является ли он истинным или нет. Без таких методов проверки законы природы не могут быть установлены. Франция имеет право открыть закон о цикле. И Мейер тоже.
Те, кого другие называют основателями периодического закона. — Не было никакого риска предсказывать свойства элементов, которые не были открыты, они изменили «атомный вес атомов, которые разрешены» и вообще рассматривали периодический закон как наивно установленный строго естественным законом.
Смотрите также:
| Гидролиз | Развитие периодического закона |
| Химия и электрический ток | Структура периодической системы |
