Оглавление:










Структура периодической системы
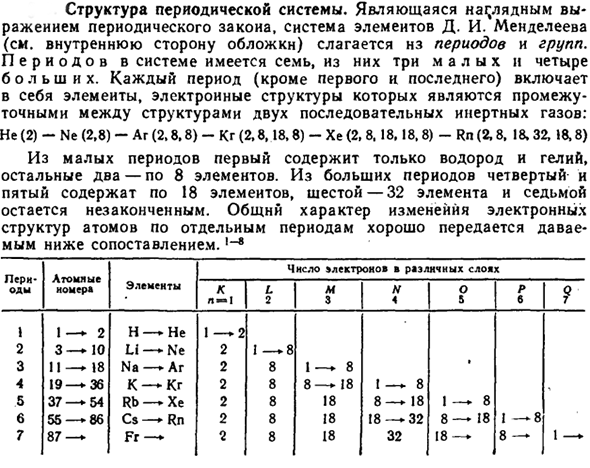
- Структура системы цикла. D, что является четким выражением периодического закона. I. система элементов Менделеева(см. Внутри обложки) состоит из периодов и групп. Система имеет 7 периодов, из которых 3 меньше, а 4 больше. Каждый период(кроме первого и последнего) включает в себя элементы электронной структуры, находящиеся в середине структуры из 2 последовательных инертных газов: He (2)-Ne (2,8)-Ar (2,8,8)-Kr (2,8. 8.18.8)-Хе (2, 8.18.8)-РН (2.8, 18.32, 18.8.8.8.8).)
- Из малых периодов только водород и гелий входят в первый период, а остальные 2 периода, соответственно, содержат 8 элементов. Общие особенности изменения электронной структуры атома в отдельные периоды хорошо иллюстрируются приведенным ниже сравнением.
Из больших периодов 4-й и 5-й содержат по 18 элементов, а 6-й и 32-й элементы и 7-й остаются незавершенными. Людмила Фирмаль
Периодический атомный номер число электронов в разных слоях Элемент K l-1 L 2 m 3 N 4 o&r 6 9 Не 1 1-2 Н-1-2 Линия 2 3-10 2 1-8 3 11-18 Na-Ar 2 8 1-8• 4 19-36 К-Кг 2 8-18 1-8 5 37-54 Rb-Xe 2 8 18 8-18 1-8 6 55-86 Cs-Rn 2 8 18 18-32 8-18 I −8 7 87-фр-2 8 18 32 18-8-1- Группа периодических систем объединяет элементы по химическому сходству. Из них 8-я содержит инертные газы, а триада содержит только те элементы, которые относятся к большой period.
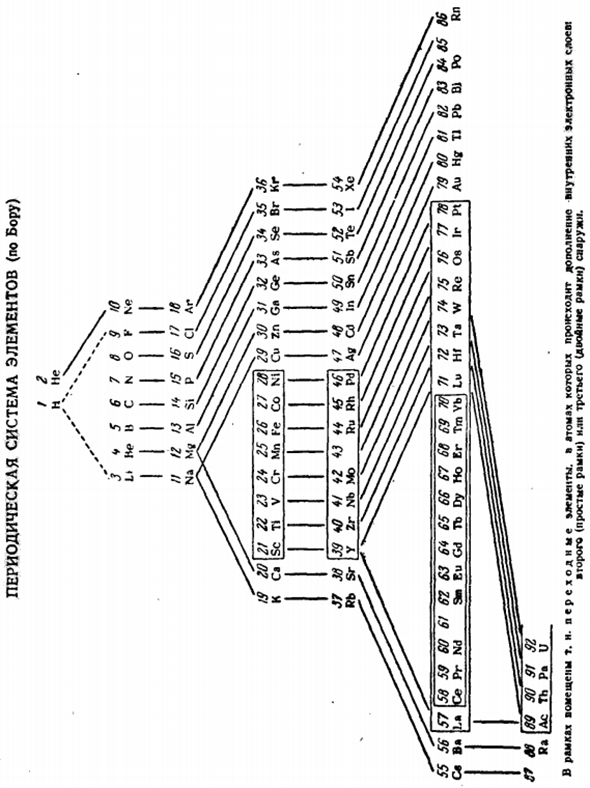
In за каждой оставшейся группой элементов, относящихся к малому периоду (Д. И. Менделеев называет их «типичными»), следуют 2 подгруппы элементов для большого периода. Существенным недостатком обычного варианта периодической системы было то, что она не раскрывала взаимосвязи между типичными элементами каждой группы и членами ее левой и правой частей subgroups.
So например, в группе V сурьма является аналогом мышьяка, ниобий-аналогом ванадия, а фосфор-аналогом азота. Однако оставалось неясным, как ванадий и мышьяк связаны с фосфором. При решении этой задачи долгое время они руководствовались индивидуальными особенностями наиболее ярких элементов, которые были выбраны случайным путем nature.
So что касается V группы, то она началась с присутствия водородных соединений типа EI3 как в фосфоре, так и в мышьяке, при отсутствии таких соединений в ванадии. Исходя из этого, подгруппа мышьяка считалась»основной«подгруппой группы V. Это прямое продолжение ее типичных элементов. Напротив, подгруппа ванадия считалась «побочной» и полностью оторванной от фосфора и железа. nitrogen. As в результате размещение элементов из ванадиевой подгруппы в V группу уже не оправдано.
Поскольку то же самое происходило и в других группах, казалось гораздо более правильным оправдать сложившуюся ситуацию, особенно при правильной перестройке циклической системы, предложенной Вернером (1905). После выяснения электронной структуры атома и ее решающего влияния на свойства элемента стало ясно, что эти структуры являются определяющими признаками, лежащими в основе химической систематики.
Это основано на сходстве электронной структуры нейтральных атомов с Боровской (С. 223) найденной выражением в виде периодической системы, принятой by. As как видно из самой системы (см. линии связи), разделение на»основную»и»боковую» подгруппы сохраняется. Поэтому под спонтанно сформировавшейся идеей он как бы подводил теоретические основы. Однако подход Бора к интерпретации периодической системы элементов весьма односторонен.
Действительно, структура нейтральных атомов может иметь решающее значение только для свойств простых веществ и реакций, возникающих в результате их участия. Напротив, свойства сложных веществ и реакции между ними определяются строением соответствующих атомов их баритовых состояний, которые соответствуют рассматриваемым соединениям.
Таким образом, достаточно детальная интерпретация периодической системы элементов будет возможна только при учете структурных особенностей атома не только в нейтральном состоянии атома, но и во всей его валентности. • * 10 Добавь 1) электрон имеет 3 степени свободы перемещения в пространстве (3 координатных оси соответственно) и дополнительные степени свободы за счет собственной rotation.
So, чтобы полностью охарактеризовать электрон, достаточно иметь 4 квантовых числа. Для детального описания структуры атома были разработаны 4 квантовых элемента системы счисления f, mi, m$.Из них основное квантовое число сохрани сохранило свое первоначальное значение и / было введено вместо 2-го квантового числа k, связанного простым соотношением L = K-1.
Первый суб-квантовым числом является серия K = 1, 2, 3,… все целочисленные значения ряда/ = 0, 1, 2 возможны для/ (который содержит имя субквантового числа), поскольку он может принимать все целочисленные значения i. …(Я-1).Так называемое магнитное квантовое число mi связано с магнитным моментом электрона, обусловленным его движением по орбите.
Величина таких орбитальных магнитных моментов зависит от характера орбит и определяется соотношением/(/ + 1).Где 1со) — единица измерения магнитного момента (то есть Магнетон). как видно из квантовой теории, под действием внешнего магнитного поля электронные орбитали необходимо размещать в пространстве только таким образом, чтобы проекция орбитального магнитного момента в направлении магнитного поля выражалась в целом numbers.
In в этом отношении mt может принимать все целочисленные значения от—I до+/.То есть он может иметь разные значения 21-f 1.Например, если/ = 3, то возможными значениями для mt являются −3, −2. −1, 0.+ 1. +2. 4-3.In в этом случае соответствующий орбитальный магнитный момент «разрешен»: направление схематично показано на рисунке. VI-1 стрелка.
Так называемое спиновое квантовое число m также связано с магнитным моментом электрона, но оно связано со спином, а не с орбитой. То есть, при правильном вращении электрона, его фосфор. Величина спинового магнитного момента одинакова для всех электронов: [μ.] = 1.73 [00]само спиновое квантовое число может принимать только 2 значения:+ Vi и-V.
Существует и другая система квантовых чисел, в которой Монетный Двор заменяется»внутренним»квантовым числом (/) и соответствующим магнитным числом (mj).Из них/ = = / ± ’/ a. и T}могут принимать все значения, отличающиеся на −1 от -/ ’ до+/. 2) существование электронного спина было впервые установлено в экспериментах с атомами серебра (1922).Схема, используемая для этой установки, показана на рисунке. VI-2 (K-источник серебра vapor. BB-diaphragm. Sn N-полюс электромагнита.
PP-коллекторная пластина).Тонкий пучок атома Ag, выбранный диафрагмой, проходит через магнитное поле и затем оседает на пластине коллектора. Согласно классической теории, в этом случае(например, при отсутствии магнитного поля) необходимо получить относительно широкую полосу осажденного серебра, но на практике при включении поля появляется узкая полоса, которая расположена симметрично относительно центра пучка (соответствует значению спинового’/’) квантового числа.
3) принцип несовместимости, являющийся важным физическим обобщением (Паули, 1925), гласит, что все электроны в атоме могут существовать одновременно, что характеризуется одинаковым значением квантового числа. 1. принцип несовместимости, согласно которому электронный слой, соответствующий тому или иному квантовому числу, может содержать как можно больше электронов, зависит от того, сколько различных комбинаций дают остальные квантовые числа-I, mi и M.
Расчет этих комбинаций упрощен, учитывая, что m может принимать только 2 значения(+ Va и — ’ / a). Количество комбинаций /и W / всегда умножается на 2.А вот кружка Рис. VI I. схема квантования орбитального магнитного момента. Диаграмма VI-2.Экспериментальная схема атомов серебра. Квантовое число напрямую зависит от квадратичного, принимая значение 2 / + I.
Таким образом, максимально допустимое количество электронов в слое равно 2-кратному числу возможных значений р. Ниже приведена графическая диаграмма первых 4 слоев. 2, 3, 4. «0 1 0 1» °i * 3 −3 −2_о −2 Т.、0 0 0 0 0 0 0•0 0 0 + 1 +1 + 1 + 1 + 1 + 1 +2 +2 +2 +3 Емкость слоя 2 8 18 32 Таким образом, число-2, 8, 18, 32-характерное для периодической системы элементов, обязательно вытекает из теории строения atom.
At при этом мы видим, что общее число возможных значений m, равное aa, и теоретически допустимое максимальное число электронов в слое равно 2π. Сравнение между конечным результатом и данными в сводной таблице тела отражает фактическое заполнение слоя, указывая, что 1-й и 2-й слои уже заполнены до максимума в периодах 1 и 2 соответственно, в то время как 3-й слой получил полностью завершенную структуру только в 4-м и 4-м периодах. только.
Такая «задержка» обусловлена сильным взаимным отталкиванием электронов в многоэлектронном слое, которое преодолевается только при достаточном увеличении положительного заряда ядра. 4) при классификации спектра принято разложение электронов каждого слоя, определяемого главным квантовым числом л, на другую подгруппу или соответствующее ей квадратичное квантовое число/.
Последние числа обычно заменяются условными знаками в соответствии со следующей серией. Значение И………….. O 1 2 3 4 Спецификация узкого места спектроскопа. 。 С П Д ф г г 5) легко установить максимальную емкость подгрупп определенного слоя на основе возможных значений mt, соответствующих различным I. эта емкость часто представлена числом независимых ячеек, каждая из которых может вместить 1 электронную пару.
Подгруппы………. С П Д ф г г Максимальная мощность… 2 b 10 14 — это число ячеек……… I3 5 7 9 При характеристике определенной подгруппы электронов ее основное квантовое число обозначается сначала цифрами, а затем буквами-второго порядка. Например, знак 3d означает, что речь идет о подгруппе электронов, которые расположены в 3-м слое и характеризуются значением/ = 2.Количество электронов в таких подгруппах указывается путем набора в виде более высокого индекса с соответствующей буквой.
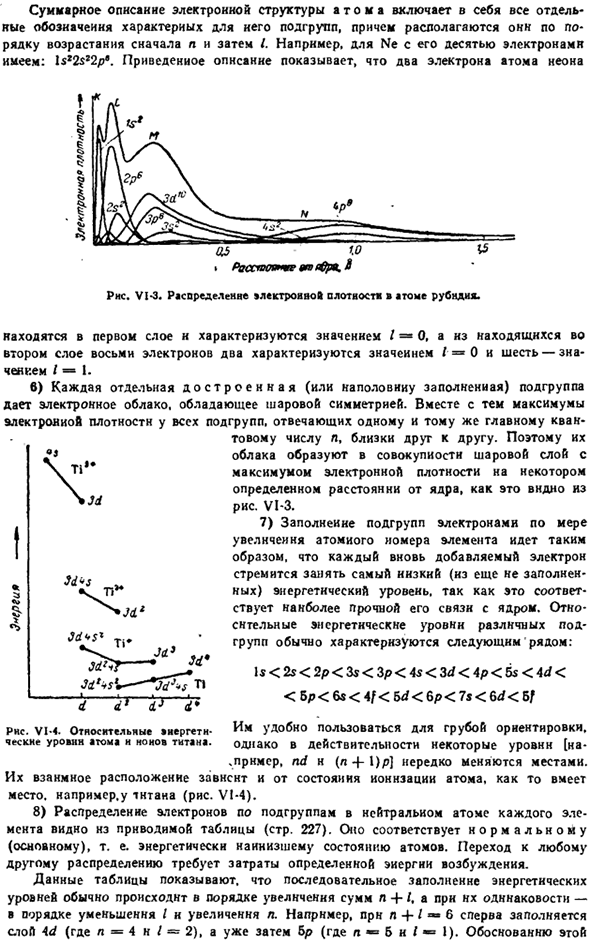
Например, символ 3di9 означает, что подгруппа 3D содержит 10 электронов. 8 Б, В. Некрасов Общее описание электронной структуры атома включает все отдельные обозначения его характерных подгрупп, сначала n, затем I. Например, для Ne с 10 электронами: ls * 2 $ 22pe. Приведенное выше описание предполагает, что 2 электрона атома неона Диаграмма VI-3. распределение плотности света в атомах rubndn*. «Rassgoo» СЧР 0В(совет *.&
Он находится в 1-м слое и характеризуется значением/ = 0,2 из 8 электронов во 2-м слое характеризуются значением 1 = 0, а 6-значением/ = I. в) Каждая завершенная (или наполовину заполненная) подгруппа дает сферически симметричный электрон cloud. At при этом максимальные значения электронных плотностей всех подгрупп, соответствующих одному и тому же основному квантовому числу I, близки друг к другу other.
- So как видно из диаграммы, их облака вместе образуют сферический слой с максимальной электронной плотностью на определенном расстоянии от ядра. VI-3. 7) При увеличении атомного номера элемента подгруппа заполняется электронами. Это происходит потому, что каждый вновь добавленный электрон стремится занять самый низкий энергетический уровень (который еще не заполнен).
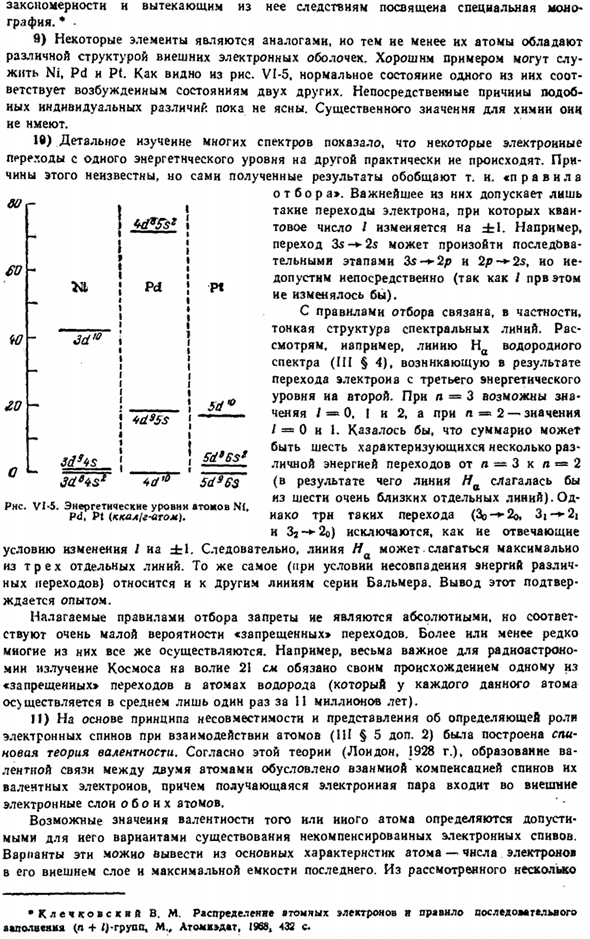
Относительные энергетические уровни различных подгрупп обычно характеризуются следующими рядами: ЛС <2 $ <2р <ЗС <3Р <4S в < 3Р < 4S с < в 3D <4Р <СС < и 4D< 5р < с <4Ф <5д <6р <7С <6д <5Ф Его удобно использовать для грубой ориентации, но на практике некоторые уровни[например, nd и(l-f 1) p] часто меняются местами. Их взаимное расположение также зависит от состояния атомной ионизации, как, например, титана (рис. VI-4). оно соответствует обычному (основному) состоянию, то есть энергетически низшему состоянию атома.
8) распределение электронов по подгруппе нейтральных атомов каждого элемента показано в таблице ниже (стр. 227). Людмила Фирмаль
Переход к другим распределениям требует специфического возбуждения энергии. Данные таблицы показывают, что непрерывное заполнение энергетических уровней обычно происходит в порядке возрастания общего n+/, а в случае nx-уменьшается в I и увеличивается в n. например, при n + / — 6 сначала заполняется слой D(где n = 4 n /®2), затем только bp(l » b n /» » I).Причина этого Ti1 3д Джейди * Юд * $ * Диаграмма VI-4.
Относительные энергетические уровни атомов и не-титана. Закон и вытекающие из него последствия относятся к специальным монографиям. *• ft) некоторые элементы аналогичны, но все же атомы различаются по структуре внешней электронной оболочки. Хорошим примером являются Ni, Pd и Pt. As как видно из рисунка VI-5, их 1 нормальное состояние соответствует 2 другим возбужденным состояниям.
Непосредственная причина таких индивидуальных различий пока не ясна. Они не имеют никакого значения для химии. 18) детальное изучение многих спектров показало, что электронный переход с одного энергетического уровня на другой фактически не происходит. Причина этого неизвестна, но сам результат обобщает Т. «Правила Выбирать.«»Самое главное, только электронный переход, при котором квантовое число/изменяется на±1.
Например, переход 3s — + 2s может происходить в последовательных шагах Zs — + 2p и 2p — * — 2s, но они не допускаются непосредственно(чтобы изменить это напрямую). Правила выбора специально связаны с тонкой структурой спектральной линии. Например, рассмотрим НВ-линию водородного спектра (III§ 3), возникающую при переходе электронов с 3-го энергетического уровня на 2-й энергетический уровень.
Если n = 3,то возможны значения f = 0, I и 2, а если n = *«2, то значения f = 0 и 1.In итого, кажется, что есть от 3 до 6 переходов, которые характеризуются немного отличной энергией» от 2(в результате линия Ja состоит из 6 отдельных линий, которые очень близки).Однако такие переходы trn 3 |- «- 2i n 3r — » — 2o) исключаются как изменения, не удовлетворяющие условию change / a±1.
Таким образом, строка / / ln может состоять не более чем из 3 отдельных строк. То же самое относится и к другим линиям серии Балмера(при условии, что энергии различных переходов не совпадают).Этот вывод подтверждается опытом. {Запреты, налагаемые правилами отбора, абсолютны, но соответствуют очень низкой возможности»запрещенного» перехода. Более или менее, многие из них все еще реализуются.
Например, космическое излучение волны 2, что очень важно для радиоастрономии! см обязана своим происхождением 1 из «запрещенных» переходов атомов водорода (в среднем для каждого атома они происходят всего 1100 раз за 1 миллион лет). II) на основе принципа несовместимости и идеи решающей роли электронного спина во взаимодействии атомов (111§ 5 add.2) построена теория спиновой валентности.
Согласно этой теории(Лондон, 1928), образование валентной электронной связи между двумя атомами происходит за счет взаимной компенсации спина его валентных электронов, и образующаяся электрическая пара содержится в электронном слоне вне обоих атомов. Возможное значение валентности конкретного атома определяется приемлемым вариантом наличия некомпенсированной электронной шпоры.
Эти параметры можно вывести из основных свойств атома-количества электронов во внешнем слое и максимальной емкости последнего. Некоторые считают Л / РНС. VI-5.Энергетические уровни в тоне N1, Pd, Pt (KKOAftHtTOM). Да. Иди. •Kle i / s o I s k k K y V. M. » распределение тусклых электронов I регулярное」 авполенва(n + / Jrpyuo. М. АТО * * » Д» т, 1968, 432 с. Таким образом, общее число ячеек в слое должно быть равно мощности 2 его основного кванта number.
In в частности, полуметаллические атомы во 2-м периоде характеризуются наличием 2 клеток в 1 и 2 клеток в 3 клетках 4. Допустимые валентности в спиновой теории этих атомов получены из схемы рисунка. VI-6.7 собственных электронов атома фтора могут быть помещены в 1 ячейку в 4 ways. In в этом случае внешний слой может вместить только 1 электрон.
Поэтому фторид должен быть только одновалентным. Для атомов кислорода уже существуют 2 различных распределения электронов в клетке possible. In в первом из них все спины взаимно компенсированы, а валентность атома равна нулю. Во 2-м есть 2 некомпенсированных спина, и поэтому валентность равна 2.Из этих 2 вариантов, нормальное состояние Примерно 1 2 3 4 г 0 Из ее семян Джесси 0ИД Использование поля 0EEA OffiG Диаграмма VI-6.
Возможна валентность металлоидов во втором триместре. Атом кислорода соответствует 2-му атому. Это происходит потому, что внутри каждой подгруппы электроны, принадлежащие к ней, стремятся заполнить максимальное число квантовых ячеек («правило Гунда»).Состояние нулевой валентности имеет запас энергии в 45 ккал / г атомов больше, чем двухвалентное состояние.
Согласно спиновой теории, более высокая валентность кислорода считается невозможной(поскольку она требует использования высокого уровня энергии 3s). Аналогично для атомов азота показана эффективность только 1 валентного и 3 валентных состояний 2.Первый из них не выгоден энергетически(при 55 ккал / г атомов) и нехарактерен для азота.
Напротив, характерное для него пятивалентное состояние воспринимается как невозможное с точки зрения теории спинов (в чистом виде). Этого противоречия опыту можно избежать, если допустить наличие 1 5-валентного производного азота ионной связи, образующейся вследствие потери электронов атомом азота. Затем 4 электрона положительных ионов N * помещаются в 4 ячейки, и в дополнение к ионам образуются еще 4 ковалентные связи. N (2s * 2p») + 335 ккал-N + (&*2p *) + e и M *(2 $ r2p»)+ 135 ккал-N ’(2s2 /> 5).
Таким образом, при стоимости атомов 470 ккал / г азот оказывается в сумме 5-валентным. Но его валентности больше не являются чистыми ковалентными связями, но mixed. It считается, что спиновая теория образует только ковалентные связи, поэтому в ее терминологии подобный азот называется tetravalent. It правильнее назвать ее 4-вареной.
Такой четырехвалентный азот реализуется, например, с помощью солей аммония. Трехвалентный кислород Иона Оксона подобен ему. Образование из нейтральных атомов описывается схемой: 0 (2 $ * 2p4) — f 314 ккал = O *(2sl2p *)+ E. Для атомов углерода рисунок VI-6 имеет валентность 0,2 n 4.Основным условием для изолированного атома углерода является двухвалентное состояние.
Переход к нулевой валентности от него требует 29 ккал / г атомов, а переход к обычной 4валентности-96 ккал / г атомов. 12) Как уже было видно на примере углерода, возбуждалась обычная валентность к этому элементу другого элемента, а не основная (обычная) Состояние его atoms. In дана общая оценка потенциала использования валентности возбужденных состояний, так называемого октетного правила теории спинов (Льюис, 1916).
Благодаря этому валентный слой атома в соединении полностью заполнен 8 электронами. Изначально это правило формулировалось как гипотеза. Например, относительно азота Льюис(1923) писал: «атом азота, кажется, никогда не связывается с другим атомом с более чем 4 связями. Он также признал существование исключений из правила октета. (Основатели научной теории были лучше своих последователей и комментаторов, но знали все слабости и недостатки своих теорий.
Со временем их оговорки были постепенно забыты. А и ф е е е). До тех пор, пока правило октета не стало общепризнанным (в начале 1920-х годов), экспериментальных данных о внутренней структуре молекул не существовало. Поэтому невозможно проверить правильность его основных положений(например, равенством длины простой связи и двойной связи), а его широта утвердилась как увлекательная с чисто умозрительными обобщениями.
Многие уже считают это аксиомой, потому что за 50 лет они очень привыкли к правилам октета. „Привычка к мнению часто вызывает полное убеждение в этом justice. It скрывает свои слабости и мешает человеку оценить доказательства против него“ (Берцлинский). На самом деле, есть много исключений из правила октета. Теория атомов Дальтона (§ 1 ext.4), она способствовала развитию теоретической химии в целом, но в то же время препятствовала правильной интерпретации многих отдельных problems.
In в частности, октетное правило может попытаться „оправдать“ невозможность существования четырехвалентного кислорода и пентетального азота. Возбуждение нейтрального атома кислорода до 4-валентного состояния описывается схемой 2 $ g2rk- * * 2s * 2p * 3s и требует затрат 211 ккал / г атомов (значительно ниже энергии возбуждения 3-валентного состояния). фактически оно реализуется в Озоне.
Структура молекулы OJ представляет собой равнобедренный треугольник, характеризующийся углом вершины a = 117°, ядерным расстоянием d (OO) 1.28 A (средняя энергия связи 72 ккал / моль) и постоянной силы k = 5.7.Полярность выражена слабо (q = 0,53). Малые ядерные расстояния, близкие к 120°a (по сравнению с 1.48 A простой O-O связи HjOa).Характер низк-полярности. Сходство спектров и спектров N0 » и озона общего эндотермического-все это поддерживает электронную структуру молекул типа O_O_O с 4-валентными атомами кислорода в центре.
Энергия возбуждения нейтрального атома азота до пикобалентного состояния напрямую не определяется, но ясно, что перенос электронов на уровень 3s требует меньше энергии, чем полная десорбция. Разница между этими энергиями в данном случае составляет 97 ккал / г atoms. So, для энергии возбуждения по схеме N (2s * 2p3) N(2s2 / ^ 3s), 470-97 = 373 ккал! Получены атомы G. Таким образом, общее состояние атома азота намного легче, чем 4-валентное one.
In практика, она реализуется, например, в HNOj. Структура HONO * соответствует молекуле азотной кислоты. Значение D (NO) связи с гидроксильным кислородом составляет 1,405 дБ 0,005 А. остальные 2 также составляют 1,206 дБ 0,005 а каждый. Эта разница в ядерном расстоянии указывает на наличие средней длины связи C-C (1,54 А) и C-C (1,34 а), а также 2 двойных связей в молекуле HONOj, то есть пятивалентного азота.
Этот вывод совпадает с другими свойствами азотной кислоты (совершенно отличными от свойств соединений NOI-солей аммония). В случае большого количества соединений элементов 3-го периода (PF$ и др.) и последующие правила октета, правила очень явно нарушаются. Наложенные им запреты можно руководствоваться описанием формулы определенных кислородных соединений. И вся имеющаяся структурная информация противоречит правильности такого подхода.
С точки зрения спиновой теории,»исключение»из октета правила, наблюдаемое в 3-м и последующих периодах, связано с наличием вакантного энергетического уровня, близкого к основному состоянию(обычно атом находится гораздо дальше следующего, но это означает ближайший свободный 4-стержень) 5, и даже р-уровня. Есть отличия от 2-го периода в этом отношении и есть основные особенности.
Например, для атомов азота и фосфора аналогичное суммирование возбуждений 2s * 2p * 2sl2pl3s и 3s* 3p * 3Ps * 3p4s требует расходования 238 и 160 ккал / г атомов соответственно (возбуждение 3S * 3pChr и 3s * 3pl3d до p атомов и 190 и 202 ккал / г атомов соответственно). Отсутствие NF4 (иногда интерпретируемое как»доказательство»невозможности получения 5-валентного азота) явно связано с трудностью возбуждения атома азота до 5-валентного состояния и неблагоприятным соотношением объема.
Очень маленький атом азота помещается близко к компактному(из-за возможности образования сильных значений связей).Подтверждением решающей роли валентных и объемных коэффициентов в данном случае является наличие газообразного ONF3(IX§ 3 add.63).Таким образом, потенциал азота для проявления пяти валентностей ограничен октетом электрона и квадруплексом атома.
Из-за подобных ограниченных возможностей образования соединений роль объемного соотношения приходится очень часто встречать в неорганической химии. 13) поэтому под давлением фактов (и вопреки правилам октета-ом) теория спина теперь признает, что фосфор-это пятивалентность, сера и шестивалентность. Хлора семь валентных.
Как для самих этих элементов, так и для их аналогов в конце больших циклов увеличение валентного состояния связано с частичным или полным спариванием электронов в подгруппах p и s. Таким образом, изменение валентности происходит сразу, 2 единицы должны характеризоваться четным числом атомов и нечетным числом других.
Как этот, так и другие результаты обычно кажутся правильными. иначе обстоит дело в отиошее и др. Переход элементов в середине большого периода (атом характеризуется завершением d-подгруппы).Часто четкий результат получается при попытке предсказать характеристическую валентность на основе электронной структуры атома.
Например, следующее распределение внешних электронов (подгруппы 3d и 4s) соответствует атомам Cr, Mn и Fe. Т-МН / ф / ф / т / т | | / т / Фе | у / ф / » | ф | т / / р | Рассмотрите возможность повышения стабильности и целостности готовой подгруппы D. Теоретически можно ожидать, что Fe, Mn и Cr имеют 3 -, 2-и 1-валентные состояния, respectively. As для железа и марганца такой прогноз в принципе оправдан, а вот для Хрома одновалентное состояние не очень characteristic.
At в то же время характеристика трехвалентного и марганцевого хрома (с экстремальными свойствами Пента по отношению к железу) в четырехвалентном состоянии не оправдывает этих схем. В совокупности основная идея спиновой теории валентностей, связанных с ковалентными связями (расположение электронов в квантовой ячейке, величина их спаривания), несомненно, верна.
Однако совместные указания, данные в современной форме теорией, часто противоречат опыту. Такая полнота теории, Прежде всего, явно обусловлена ею. Квантовый уровень атома в молекуле идентифицируется на квантовом уровне соответствующего изолированного атома. 14) в принципе, молекулярно-орбитальный метод (LJ) не имеет этого недостатка.
Его идея состоит в том, чтобы»социализировать» электроны отдельных генераторов. СГ Распределение этих электронов в молекулах и орбиталях атома(точнее, реакция с энергией*).Характеристики всей молекулы. Такие типы орбит задаются квантовыми числами n, I и X, которые могут принимать следующие значения: n = I, 2, 3…; / = 0, 1, 2…(l-1); X = 0, dbl,±2… …±(Н-1).
В зависимости от величины X орбита подразделяется на oo(для X- » 0) и n(для X =±1). 6 (для X =±2),(Нью-Йорк)4(ой *)4 с Здесь буква CC указывает на то, что слои IS * обоих атомов участвуют в образовании молекулярных орбиталей. Для молекул, образованных различными химическими элементами (гетероауксами), конструкция системы молекулярных орбиталей требует детализации W®EB 0 W0®W grgrr ® ® 62p 0 gr GR GR GR grr ®6 ′ 2С В 2S в QZs©?С 0, 0. 1С© ЕТС Ф п Рисунок Vf-7.
Атомная схема Молекулярная орбиталь Фторид. ОГЭ с учетом особенностей исходного атомарного orbitals. In на практике линейное их сочетание считается возможным только при наличии достаточной энергетической близости и некоторого пространственного соответствия.
Например, когда молекулы HF образуются из атомов H и F, водородные электромагниты взаимодействуют с 2P-электрофторированным фтором. Ч(это) — Ф [/искусство C2S’2pe] = ХФ [K2sia12pi] Оставшиеся электроны во внешнем слое образовавшейся молекулы HF являются «самозванцами». Молекулярно-орбитальный метод не противоречит рассмотренному выше методу валентных связей, но дополняет его it.
To для интерпретации некоторых свойств молекул (например, их пространственной структуры) более подходит метод валентных связей, в то время как другие (например, электронный спектр) более подходят для молекулярных орбиталей. Последнее не является наглядным, но его легче обрабатывать математически, поэтому удобнее при попытке теоретически рассчитать свойства всей молекулы (например, энергию возбуждения).
В то же время » одним из главных недостатков орбитальной модели является невозможность количественно предсказать прочность химических связей (U o l).Молекулярно-орбитальный метод является более гибким в том смысле, что он может ввести 1 или другое специальное предположение (например, 3 центральные орбиты), предназначенное для интерпретации определенных особенностей конкретной молекулярной структуры.
Однако общей теоретической основой химической практики является метод валентных связей, наглядным выражением которого является структурная формула вещества. Только с их помощью можно было успешно решить проблему целенаправленного хемосинтеза.
Смотрите также:
| Работы Менделеева | Электронные аналоги |
| Развитие периодического закона | Фтор |
