Оглавление:

































Подгруппа меди
- Подгруппы меди. Из-за разброса в природе элементы этой подгруппы значительно отстают от соответствующих щелочных металлов. Если содержание самой меди в земной коре по-прежнему оценивается достаточно большим-0,003%, то процентное содержание серебра составляет уже всего 2 * 10 «В%, а золота-5 * 10» в 8%. — С Рисунок XIII-29.Древний основной твердый материал. Медь и серебро в основном встречаются в виде соединений серы, чаще всего вместе с серными рудами других металлов.
- Среди отдельных медных минералов наиболее важными являются халькопирит (CuFeS2) и халькозин (C112S).Промышленная ценность кислородсодержащих минералов значительно меньше-например, (Cu20), Малахит! (CuON) 2C03]и так далее. Напротив, это очень распространено, чтобы найти Ag2S в виде примесей к сульфидной руде Pb, Zn, Cu.
Сера серебряная (серебро и серебро) как еще один минерал встречается относительно редко. Людмила Фирмаль
Из природных соединений с золотом и другими элементами наиболее характерны теллурифицированные минералы-ка Ла верят (AuTeg)и др. Значительная масса.1 из самых богатых стран с золотыми месторождениями-СССР. Как и золото, серебро и медь также иногда встречаются в родных Штатах. Возможно, именно поэтому все 3 элемента были известны человечеству в самые древние времена. Из них медь явно была первым металлом, который широко использовался при изготовлении инструментов (рис. XIII-29).6-14) u, Ag и Aa являются красными, белыми и желтыми металлами соответственно.
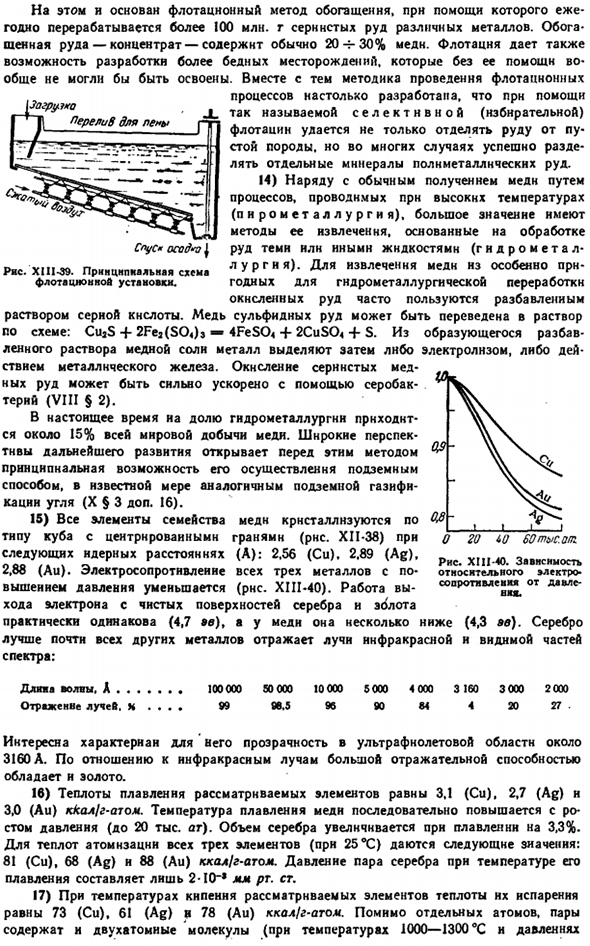
Вы можете сравнить наиболее важные константы в таблице ниже и увидеть характер изменений свойств подгрупп на диаграмме. X111-30: Ши-АК-Ай 10.5 19.3 2.7 2.5 Электропроводность(НД = » я). 。 57 59 40 Теплопроводность (Hg = 1). 。 。 51 57 39 Температура Плавления,°C. 。 1085 962 1064 Температура кипения, ° С. 。 。 2160 2850 3000 2800 2600 карат.00 2200 (’00 Да 900. / РФи здж ру » Си Любовь х Рисунок XIII-30. Физические свойства Cu, Ag, Au.
Основное состояние с Все 3 металла характеризуются достаточно высокой плотностью, достаточно высокой температурой плавления и относительно низкой твердостью. Их пластичность и пластичность очень высока. Из любого металла нарисуйте проволоку диаметром 0,001 мм (примерно в 50 раз тоньше человеческого волоса), ковкой или прокаткой Аи можно получить листовку («позолоту») толщиной до 0,0001 мм. Отраженный свет имеет желтый цвет, а проходящий свет-зеленый color.
In с точки зрения теплопроводности, элементы подгруппы меди лучше всех других металлов. Друг с другом, и с много других металлов, форма Cu, Ag, и Au alloys. In в частности, все они сплавлены с ртутью (более твердой, чем остальная часть с).Метод, иногда используемый для извлечения золота из пород, содержащих его, основан на легком образовании амальгамы. 22-25 Химическая активность меди и ее аналогов низка, и для многих Cu-Ag-Au она быстро снижается.
Золото и серебро не меняются в воздухе, а медь постепенно покрывается темно-зеленовато-серой пленкой основного карбоната. Только медь (при нагревании) связывается непосредственно с кислородом при нормальном давлении, и не только Cu, но и Ag непосредственно с серой. Кубический., Ag, Au не реагируют с водородом, азотом и углеродом даже при высоких температурах. Гораздо проще, чем у других элементов, происходит взаимодействие меди с ее аналогами и свободными хлором, бромом, йодом.
Медь и серебро соединяются медленно даже при нормальной температуре. Золото также относится к Брому, но реагирует только с сухим хлором и йодом, когда heated. In водный раствор хлора («хлорная вода»), золото легко растворяется. В этих условиях на поверхности образуется слой нерастворимого AgCl, поэтому реакция протекает наиболее медленно в серебре. В серии напряжений все 3 элемента расположены справа от водорода, медь находится почти рядом с ним, а золото дальше всех остальных metals.
So, в растворах кислот, таких как HC1, H2SO4, даже медь не растворяется без oxidant. At в то же время окислитель, кислота(HN03, высокотемпературная концентрированная H2SO4 и др.), медь и серебро легко растворяются, золото только тогда, когда окислительные свойства кислоты особенно заметны (например, золото растворяется в горячем безводном bbSeO*).Императорская водка растопит его well. It был уже известен алхимикам (рис. XIII-31).
Оптимальный растворитель для АС насыщен хлор-соляной кислотой, которая взаимодействует с золотом по следующей формуле: 2Au-fЗС12-f2нс1 = 2H [AUCI «L В связи с сильной щелочью элементы подгруппы меди устойчивы. 31 * 32 В своих соединениях серебро в основном одновалентно. Наоборот, CU и Ас форма достаточно хорошо изучен ряд производных 2: кр-одновалентных и двухвалентных, Ас-одновалентного и трехвалентного-Элек- РНС.
XIII-31.Лев, пожирающий солнце, является символом растворения золота в царской воде (1572). Cops. In в большинстве случаев производные 2-валентной меди и 3-валентного золота более стабильны и действительно важны. Растворимые соединения Cu, Ag, Au токсичны. Наиболее характерной особенностью большинства соединений рассматриваемых элементов является легкость восстановления до металла.
В зависимости от ситуации с серией напряжений наиболее легко восстанавливаются производные Au, а наиболее сложным является Cu. Еще одной очень отличительной особенностью является s. It есть тенденция комплексного сообразования 33-42. Теплота образования одновалентных соединений Cu, Ag и Au сравнивается на рисунке 1. XIII-32.As из этого видно, что при переходе от С К Аи она уменьшается во всех случаях.
Оксиды типа Е20 называются закисью азота (Ag20 также можно назвать оксидом серебра).Все они окрашены в отличительные цвета: Cu20-красный, Ag20-темно-коричневый, Au20-серый фиолетовый. В воде оксид E20 почти нерастворим и лишь незначительно прилипает к образованию гидроксида EON. Напротив, осажденный гидроксид, образующийся под действием щелочи на солях одновалентных Cu, Ag и Au, легко разлагает воду и частично переходит в соответствующую закись азота.
Гидроксид Эона является основой средней прочности. Поэтому, если Ag20 влажный, лакмусовая бумажка будет четко * окрашена * в синий цвет W. С другой стороны, все рассмотренные окиси азота несколько растворяются в сильно щелочных растворах, что свидетельствует о наличии в них признаков обоих полов. Однако кислотная функция Эона по сравнению с основной функцией слабее, и соответствующая соль не отделяется 45-49 。
В отличие от производных щелочных металлов, многие соли с катионами Cu+, Ag, Au окрашиваются, даже если в молекуле присутствуют бесцветные анионы. Это особенно верно для производных Au , где желтый цвет является characteristic. In вода, соли Cu и Au * почти нерастворимы, а при увлажнении они оба становятся нестабильными. Учитывая это, с ними редко приходится иметь дело. Напротив, соединения Ag * имеют различное применение.
Большинство солей Ag * слабо растворимы в воде, но в серебре много высокорастворимых солей known. In водные растворы, как правило, имеют нейтральную реакцию на лакмусовую бумажку. Наиболее практически важным является нитрат серебра, который получают реакцией 3Ag-f 4HN03 = 3AgN03 + NO + 2H20 Эта бесцветная соль, легко растворимая в воде, является одним из наиболее часто используемых реагентов и является общим исходным материалом для получения остальных соединений серебра.
Из последних очень важны те, которые практически нерастворимы в воде-галогенированные солнечные AgCl, желтоватые AgBr и желтые Agl, так как их распад под действием света с испусканием металла Ag лежит в основе фотографического процесса. Как и галоидные соли, большинство других соединений серебра постепенно распадаются при воздействии света. Поэтому они (и их раствор) обычно хранятся в темной стеклянной банке. Рисунок XIII-32.
Образование соединений тепла Cu, Ag и Au *(ккал / г-экв). С большим количеством молекул и ионов (NH3, CN_, S2Oj〜 и др.), соли одновалентных Cu, Ag и Au образуют комплексные соединения. Последние в большинстве своем очень растворимы, поэтому их образование требует растворения многих исходных водонерастворимых солей. Например, из-за сложности схемы AgCI-f 2NH3 = [Ag (NH3) 2lCI Нерастворимый в воде AgCl растворим в NH4OH.
В производных Cu +и Au* комплексообразование часто сопровождается не только их растворением, но и повышением стабильности. Из соединений, в которых элементы подгруппы меди являются двухвалентными, достаточно изучены только производные самой меди, что имеет практическое значение. Черная окись (CuO) может быть найдена в природе и может легко быть получена путем нагревать Cu внутри air.
It не растворяется в воде, а растворяется в кислотах, образуя соответствующие соли. Соответствующий оксид меди, гидроксид меди (OH) a, выделяется в виде синего осадка, когда избыток щелочи действует на раствор Cu2 +salt. It почти нерастворим в воде и легко переходит в CuO при нагревании. Этот переход происходит даже тогда, когда жидкость, содержащая Cu (OH) 2, кипит. Гидроксид меди характеризуется достаточно слабо выраженными основными свойствами.
При использовании кислот получают соли, большинство из которых образуют кристаллогидраты и легко растворяются в воде (рис. XII1-33). в хорошо разбавленном растворе цвет соли всех двухвалентных медных и бесцветных сине-сине-голубых ионов (цвет полностью гидратированных ионов Cu), напротив, цвет твердых солей Cu2 * отличается. 。 Комплексообразование двухвалентной меди очень characteristic.
In соответствующие соли щелочных металлов, соли Cu2*, образуют 2-компонентные соединения (такие как[CuClJ2 -]), которые содержат медь в составе комплексных анионов. Однако большинство последних неустойчивы, и в растворе они делятся на составные части. Синий композитный катион [Cu (NH3) 4J〜очень характерен для 2-валентной меди и образуется при добавлении избытка аммиака в раствор соли Cu2 *
По реакции. CuS04 + 4NH4OH = [CU (NH3) JS04 + 4H20 Этот комплекс имеет темный цвет, поэтому в качестве реагента для меди можно использовать аммиак. 20 — > 57 Из соединений трехвалентных элементов подгруппы меди хорошо изучено только производное AU. Обычным исходным материалом для их изготовления является красно-коричневое хлорное золото (AuCl3), которое образуется при температуре около 200°С под действием избытка хлора на порошок Au. Оксид золота (Au203) доступен только indirectly.
It представляет собой водонерастворимый коричневый порошок, который легко разлагает кислород при нагревании. Красно-коричневый гидроксид Au (OH) 3 осаждается, когда сильная щелочь действует на сильный раствор AuCl3.It является амфотерным, кроме того, его кислотная функция более выражена, чем основная. Рисунок XIII-33.
Растворимость в солях меди имеет важное значение (моль / л ч, 0). Соли Au(OH) 3 и основания (а также соли мочевой кислоты) образуются при растворении в сильной щелочи и комплексной кислоте H [Au (OH).Соли, соответствующие основной функции Au (OH) 3, получают растворением в сильной кислоте. Большинство производных трехвалентного золота окрашены и в большинстве случаев имеют желтоватый оттенок. Отличительной особенностью Au3 *является тенденция к образованию комплексных анионов. Например, взаимодействие AuCl с водой по схеме 20+ AuCl3 = H2Three)
Получается, что кислота образуется за счет сложного присоединения воды к нейтральному (то есть красно-коричневому раствору вода-кислота Желтый осадок плохо растворимой соли серебра-Ag2 [OAuCl3]. Наиболее распространенными трехвалентными соединениями являются хлорид золота, соляная кислота, и когда раствор золота в насыщенной хлором соляной кислоте испаряется, он выделяется в виде кристаллогидрата H [AuCU] −4H20.Среди его солей наиболее важным является желтый хлор-хлорат натрия-Na [AuC!4] — это 2H20 («золотая соль»).
Сама кислота и многие ее соли очень хорошо растворяются не только в воде, но и в некоторых органических растворителях(спирте, эфире).Для нахождения этого элемента иногда используется очень низкая растворимость хлорогеновой кислоты цезия (рис. XIII-34). Если сравнить элементы обеих подгрупп группы I с элементами других подгрупп, то можно лишь наметить некоторые особенности similarity. In в частности, все металлы группы I обладают высокой электропроводностью и образуют одновалентные соединения.
Однако Li и его аналоги являются только одновалентными, а элементы подгруппы меди способны проявлять более высокую валентность (что еще более предпочтительно для Cu и Au).в этом отношении серебро несколько ближе к другим элементам подгруппы меди по отношению к щелочным металлам. Сто восемьдесят Добавь 1) натуральная медь состоит из изотопа Cu (69,1%) и Cu (30,9%).Серебро состоит из изотопов 07Ag(51,35%) и MAg (48,65%), в то время как золото является»чистым»элементом (wAu). 2) в основном состоянии элементы подгруппы меди имеют структуру внешней электронной оболочки 3d, 04s(Cu), Adl0os(Ag), 5d, 06s(Au) и являются одновалентными.
Для возбуждения ближайших потенциально трехвалентных состояний Cu (3d»4s4p), Ag (4d * 5s5p) и Au (5d®6s6p), стоимость атомов 111, 161 и 120 ккал / г соответственно. Непрерывная энергия ионизации Cu составляет 7,72. 20.29; 36.83 эВ; АГ;7.57; 21.48; 34.82 эВ; Ау −9.22; 20.5; (30.5) эВ. Сродство атома к электрону составляет 35 (Cu). 46 (Ag), 65 (Au) ккал / г-атом, то есть золото в этом отношении мало чем отличается от галогена(VII§ 4). 3) медь относится к биологически интересным elements. It является, по-видимому, катализатором внутриклеточного процесса окисления. Рисунок XSh-34.Растворите мостик соляной кислоты (моль / л H20).
Установлено, что небольшое количество мела необходимо для нормального развития растений, а удобрение почв (особенно болотистых и песчаных) их соединениями часто сопровождается резким увеличением productivity. In связь с избыточным содержанием меди, резистентность растительных организмов очень разная. Среди животных организмов наиболее распространенными являются некоторые моллюски (осьминоги, устрицы). у высших животных он накапливается преимущественно в ядрах клеток печени и других тканей. Недостаточное поступление Cu в организм(норма за 1 день у человека составляет около 5 мг) приводит к снижению гемоглобина новообразований и развитию анемии.
Это можно вылечить путем введения соединений меди в пищу. Среди отдельных видов последних молоко и дрожжи наиболее богаты мелом. Интересно, что в крови беременных женщин содержалось в 2 раза больше нормального содержания меди. 4) следовые количества серебра (около 0,02 мг Ag и 100 г сухого вещества) обнаружены во всех организмах млекопитающих, но их биологическая роль не ясна. У человека повышенным содержанием серебра(0,03 мг на 100 г свежей ткани, или 0,002 вес с зольностью.% ) ’. Для него характерен мозг.
Интересно то, что изолированное ядро этой нервной клетки-нейрон (число людей составляет около 150 миллиардов) — имеет больше серебра (0,08 Мас.% в золе). в рационе человек принимает в среднем около 1 мг Ag в день, около 0,1 мг. Относительно многие содержат яичные желтки (100 мг на 0,2 г).Серебро в основном выводится из организма с калом. 6) Что касается содержания в организме и биологической роли золота, то ничего ясного не известно. Отмечено его присутствие в зернах злаков, листьях и стеблях кукурузы. Морская вода содержит разное количество золота(от следовых количеств до 65 мг / Т).
8) вес самых крупных самородков золота, серебра и меди составлял 112 кг, 13,5 т, 420 т соответственно, но интересно, что в некоторых крупных самородках меди все выступающие части были растресканы каменными топорами. 7) Египет был самой богатой золотой страной в древнем мире (самая крупная добыча-до 50 г в год-по-видимому, произошла около 1500 года до н. э.).Главным поставщиком золота в прошлом из европейских стран был Пиренейский полуостров. 8) в древности и в прошлом веке добыча золота велась почти исключительно из россыпей, образованных выветриванием и эрозией естественными водами горных пород, в том числе Ас.
Довольно много золота сейчас добывается непосредственно из таких пород, которые ранее подвергались дроблению и дроблению. Средний сорт золота используемых в настоящее время месторождений составляет всего 0,001%, и метод промывки водой (рис. XIII-35) будет неэкономичным, если его отделить от старого Ганга и гангского камня на основе разницы в плотности. Вместо этого используйте 2 метода ртути и цианида. Первый из них основан на образовании Амальгамов Au при обработке металлов водой-измельченной ртутью. Растворимость золота в самой ртути не так велика.
В нормальных условиях, только 0,13 Ат.%(И серебра и меди соответственно на 0,07 n 0,006.Это то же время, помимо растворенного Аи амальгамы Он также содержит соединения обоих металлов (auhgs, AujHg и Au * Hg известны), и самое главное, цельнозерновую суспензию золота (из-за влажного). Полученную амальгаму отжимают через замшу, а жидкую часть используют снова(потому что она лучше фитилит золото, чем чистая ртуть), твердое вещество отгоняют, ртуть отгоняют, а золото остается в перегонном аппарате.
Наиболее важным недостатком ртутного метода является неполное выделение золота. Это связано с тем, что его мельчайшие частицы недостаточно смачиваются ртутью, а значит, и не сливаются. В отличие от ртутного метода, цианидный метод позволяет почти полностью отделить золото даже от очень бедных сортов. Для извлечения Au измельченную золотосодержащую породу обрабатывают очень разбавленным (0,03-0,2%) раствором NaCN, который касается воздуха.
Например, золото на основе формулы 4Au-f 8NaCN-f 2H * 0-f 02-4NalAu (CN) a) — f 4NaOH выделяется под действием металлического цинка, из которого 2Na [Au (CN) a] -f Zn-Naj [Zn [CN) J-2Au. Очистка («очищение») золота, полученного от примесей тем или иным способом, чаще всего осуществляется путем обработки»или электролитически»высокотемпературным концентрированным H2SO. •) Большая часть добываемого в настоящее время серебра получается путем обработки примесей AG, содержащих сернистую руду Pb, Zn и Cu, а не соответствующую серебряную руду.
Сосуществование со свинцом особенно характерно для серебра. Состав часто встречающихся серебряно-свинцово-цинковых руд варьируется в зависимости от месторождения. Например, руда может содержать is-20%Zn, 10-16%Pb и 0,15-0,25% Ag. Взаимная растворимость расплавленных Zn и Pb быстро уменьшается с уменьшением temperature. So, жидкий металл, полученный восстановлением серебряно-свинцово-цинковой руды при разделении, разделяется на 2 слоя (рис. XIII-36).
Нижняя часть-свинец и цинк вряд ли останутся. Там почти нет верхнего цинка-свинца. Поскольку растворимость цинка в серебре значительно больше, чем в свинце, почти все, что присутствовало в исходном сплаве Ag, остается в слое цинка, от которого его отделяют перегонкой цинка (и окислением свинца).в случае руд, бедных другими металлами, Ag часто получают обработкой их раствором NaCN, который подвергается воздействию воздуха, но в то же время серебро (как и золото) переходит в раствор, который может быть отделен действием металлического цинка.
Окончательная очистка Ag чаще всего осуществляется электролизом. Раствор Агноя действует как электролит, а пластины, отлитые из грубого серебра, действуют как анод. При подаче тока на катод осаждается чистое серебро, а примеси (Cu, Pb, Zn), содержащиеся в сыром металле, удерживаются в растворе. Обычно Au, который также содержится в виде примесей, не растворяется и собирается в аноде на дне контейнера. 10)выплавка меди из сернистых руд состоит из нескольких этапов. Во-первых, руда обжигается на воздухе для удаления основной серы, содержащейся в руде.
Эта операция проводится в специальной механической печи или псевдоожиженном слое (рис. VIII-24), в которой прокаленная руда с добавлением флюса выплавляется в отражательной печи (рис. XII1-37).в этом случае часть отходов камня и железа поступает в шлак, а Cuis, FeS и небольшое количество других примесей сливаются в»мат«(собранный на дне печи).Последний направляется в специальный конвертер, где сера и железо удаляются из меди путем продувки расплавленной воздушной массы. Горение серы и железа сопровождается выделением большого количества тепла, поэтому этот процесс требует затрат топлива.
Блистерная медь, полученная вышеуказанным способом, обычно содержит 95-98% Cu. Повторное растворение в нижней части отражающей печи позволяет удалить большую часть примесей, присутствующих в ней, и это приводит к созданию «штыковой меди». i00 — / _I_i. i Около 80 ЗН РГО [Цинк.]% Рисунок XI11-36.Все решение. Цинк и свинец MOvTk. До 99,7%.Переплав для очистки меди уже описан в книге Bellingcat (рис. XIII-38). Промывка («очистка») меди электролизом обходится дороже, поэтому ее применяют только тогда, когда необходимо получить особо чистый металл.
Электролит в этом случае обычно представляет собой раствор CuSO. При электролизе медь Fe и Zn остаются в растворе, содержащемся в виде примесей. Ag и Au (и Pt) располагаются на дне контейнера. Стоимость драгоценных металлов, полученных таким способом, играет важную роль в обслуживании затрат на электролиз. II) в качестве побочного продукта расплава получают большое количество сернистого газа.
Поэтому вполне разумно объединить плавильные заводы и фабрики по производству серной кислоты. Такой завод, объединяющий металлургию и химию, является синтетическим РНС. XI11-37.Схема отражательной печи. Рисунок XSh-38.Переплав меди(16 век). Использование сырья для извлечения всех ценных компонентов. Например, если медный пирит используется в полной сложности, то вместе с медью получается большое количество железа и серной кислоты, наряду с мышьяком, цинком, свинцом, сурьмой, висмутом, серебром и золотом (из примесей исходного пирита).
12) выплавка меди из окисленной руды в основном снижается для облегчения восстановления углем, поэтому сравнение меди из серной руды не так просто compare. In таким способом, по-видимому, медь добывали еще в древности. Развитие в Египте достигло значительных масштабов уже 3000 лет назад. е. 13) содержание Cu в добываемой руде обычно не превышает 1%, поэтому предварительная обработка требует предварительного обогащения, то есть увеличения доли металла в руде за счет отделения соединения от Ганга.
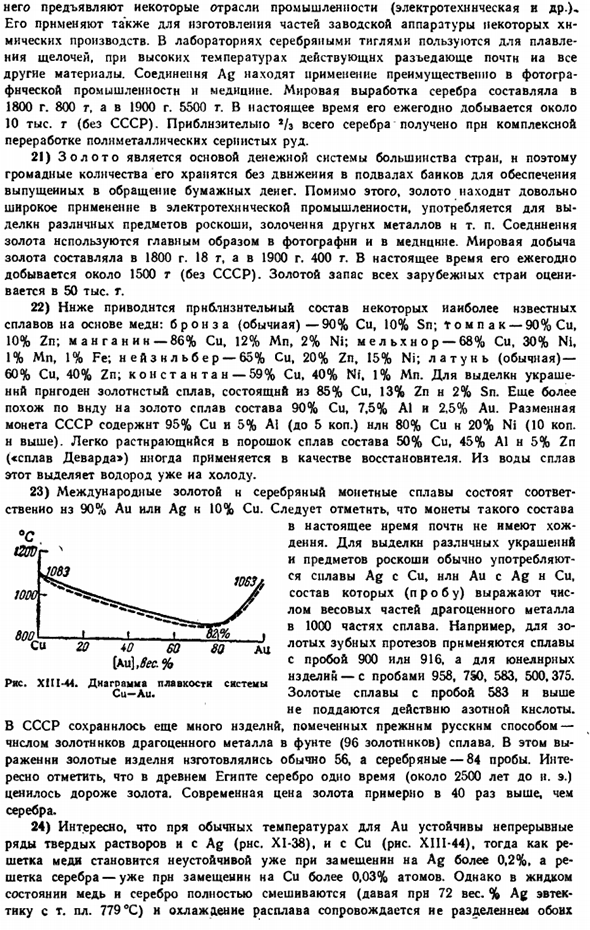
Это достигается с помощью метода флотации руды, основанного на различных адсорбционных свойствах частиц сернистого металла и поверхности окружающей силикатной породы. Когда смесь металлического порошка силиката и серы помещают в водный раствор низкополярного органического вещества, на первой поверхности адсорбируются почти исключительно молекулы воды, а на второй поверхности адсорбируются низкополярные молекулы растворенного органического вещества.
С другой стороны, если пузырь проходит через такой раствор, то последний также адсорбирует на поверхности почти исключительно низкополярные молекулы. Частицы металла серы, которые покрыты таким же адсорбционным слоем и распылены в раствор пузырьков воздуха, легко слипаются. Наоборот, частицы силикатов не прилипают к пузырькам.
Когда в воде, содержащей небольшую смесь низкополярных органических веществ (например, сосновое масло), мелкоизмельченный порошок медной руды встряхивают и вдувают воздух во всю систему (рис. XIII-39), частицы сульфида меди поднимаются и текут вместе с пузырьками за край емкости в виде пузырьков, а частицы силиката оседают на дно. Это основа флотационно-обогатительного метода, с его помощью перерабатываются Серные руды различных металлов, которые ежегодно превышают 1 млрд. тонн. Концентрат руды-концентрат-обычно содержит 20 ~ ^ 30%copper.
In кроме того, флотация дает возможность разрабатывать бедное месторождение. Но технология флотации Этот процесс настолько развит, что так называемая селективная (селективная) флотация может быть использована не только для отделения руды от пустой породы, но и во многих случаях успешно для отделения отдельных минералов от полиметаллической руды.
14) помимо производства обычной меди (пирометаллургия) за счет процессов, протекающих при высоких температурах, очень важным является способ ее извлечения (гидрометаллургия), который основан на переработке руд той или иной жидкостью. Для извлечения меди из окисленных руд, которая особенно пригодна для металлургической переработки, часто используют разбавленные растворы серной кислоты. Сульфидные медные руды могут быть превращены в растворы по следующей схеме: CuaS-f 2Fea (S04b-4FeS04-f 2CuS04-f S.
Из разбавленного раствора полученной соли меди отделяют металл либо электролизом, либо действием металлического железа. Ускоряется бактериями сыворотки крови (VIII§ 2). В настоящее время гидрометаллургия составляет около 15% мирового производства меди. Подземная газификация угля (x§ 3 add.16), а также широкие перспективы дальнейшего развития открываются основными возможностями реализации подземным способом.
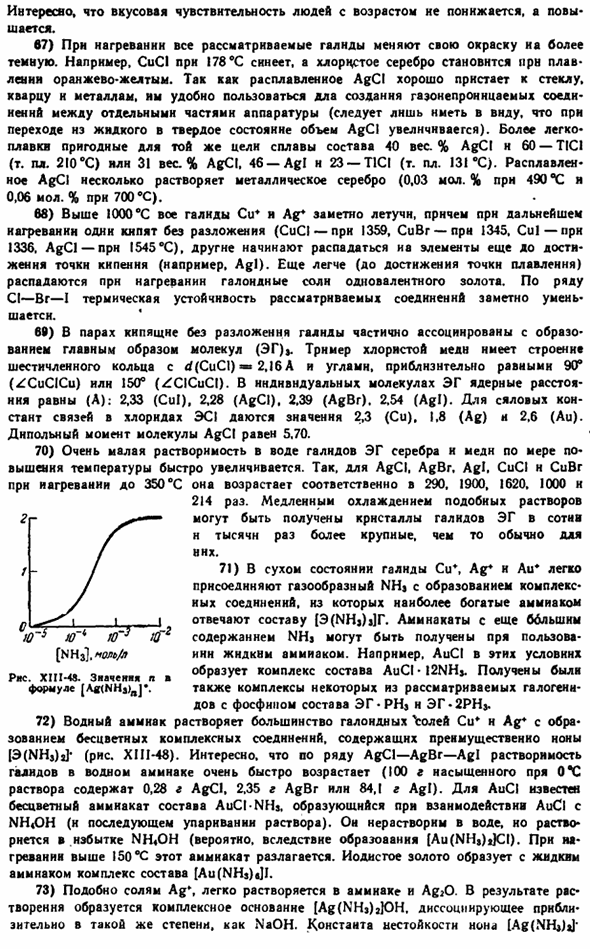
15) все элементы семейства меди имеют центральную поверхность (rns) на следующем ядерном расстоянии (A). она кристаллизуется как куб с кубом (XI1-38): 2.56 (Cu), 2.89 (Ag), 2.88(Au). Электрическое сопротивление всех 3 металлов уменьшается с увеличением давления(rns. XIII-40).Функция работы электронов от чистой поверхности серебра и золота Примерно столько же (4,7 дюйма), чуть ниже (4,3 века) в меди. Серебро лучше почти всех других металлов и отражает лучи инфракрасной и видимой частей спектра. \ Zagru, 1 Кор. нэ * б > переполнение Сус » ocod <я J Это хорошее место для начала. XI11-39.Схематичный вид флотационной установки. Около 6 миллионов Рисунок XIII-40.
Относительное электрическое сопротивление против давления Далкит волны, А. К.. 。 , Отражение луча, к 10 000 96 100,000, 99. 50,000 96,5 5000 90 4000 84. 3, 160, 4. 3000 20. 2000 27-27• Прозрачность ультрафиолетовой области около 3160 а характерна, и золото имеет высокую отражательную способность к инфракрасному излучению.
16) теплота плавления рассматриваемых элементов составляет 3,1 (Cu), 2,7 (Ag) и 3,0 (Au) ккал / г атомов. Температура плавления меди постепенно повышается с увеличением давления (до 2 млн арг).Количество серебра при выплавке увеличивается на 3.3%.In теплота атомного заряда всех 3-х элементов (25 ° С), приведены следующие значения: 81 (Cu), 68 (Ag) и 88 (Au) ккал / г атомов. Давление паров в точке плавления серебра составляет всего 2-10 ″ * мм рт.
17) при температуре кипения рассматриваемого элемента теплота испарения составляет 73 (Cu), 61 (Ag) и 78 (Au) ккал / г atoms. In помимо отдельных атомов, пара содержит двухатомные молекулы (pr 1000-1300°С и давление 10 ^ −10 ″ * мл РТ. Соотношение E*:.E О I. 1000) и доступны следующие данные: 2 Лига Ядерная дистанция, л……. 2.22 2.53 Энергия диссоциации, кал / м о Л. 。 46 40 S3 Сравнение с аналогичными значениями щелочных металлов (дополнение 21§
I) подразумевает в данном случае малое ядерное расстояние и большую энергию диссоциации(см. III§ 5 дополнение 11).Игнорируя золото (особое положение из-за сжатия лантана), данные меди, серебра (rf (AgAg) rf (AuAu)) и щелочных металлов очень хорошо вписываются в кривую 1 зависимости энергии диссоциации от ядерного расстояния. Один и тот же тип валентных (а) связей между атомами элементов обеих подгрупп первой group.
In в отличие от производных AG и AU, летучие соединения Cu окрашивают горелку несветящимся пламенем (сине-зеленым). 18) летучесть серебра при высокой температуре ракеты составляет used. Technique. As это видно из рисунка. Графитовая футеровка (а) внутри XIII-41, самой горячей зоны сопловой схемы, защищена от горения пластиной (5) из вольфрама высокой плотности с внутренней полостью (Б), заполненной пористым вольфрамом, пропитанным серебром. Испарение последнего позволяет вольфраму охлаждаться и выдерживать действие быстрого потока газа, нагретого примерно до 3000°С.
19) основными потребителями меди являются электротехника и Metallurgy. In в первом из них медь используется в основном для изготовления электрических проводов, а во втором-для изготовления различных сплавов с другими металлами. Медь, предназначенная для электрических целей, должна быть достаточно чистой, так как большинство примесей уменьшают проводимость (рис. XIII-42).Объединенный. Около 42 а * Содержание примесей、% Гонка XIII-42. «влияние прнмесая на Лек-тропроаодводность меда. Рже. XII1-43.
Обработка серебра(из книги Агрхода). Медь Nennya используется для борьбы с вредителями в сельском хозяйстве, горнодобывающей, стекольной и других отраслях промышленности. Мировое производство этого металла составило 1800 млн г, в 1900 году-50 млн. В настоящее время около 1000 добывается в год. 500 миллионов граммов меди (без учета Советского Союза). 20) серебро в основном использовалось при изготовлении кошельков, предметов домашнего обихода и ювелирных украшений(рисунок XH-43 ^.Текущий、 Ряса. XI 11 * 41.
Схема сопла ракетного двигателя Он представлен несколькими отраслями промышленности(электротехника и т. д.). Он также используется при изготовлении деталей заводского оборудования в некоторых химических plants. In в лаборатории серебряные тигли используются для растворения щелочи, а при высоких температурах почти все остальные материалы подвергаются коррозии. АГ соединений главным образом использован в фотографической промышленности и медицине. Мировое производство серебра в 1800 г составляло 800, а в 1900-5500 гг. В настоящее время добывается около 1 млн г в год(за исключением СССР).
Почти все серебро получают при комплексной переработке полиметаллических сернистых руд. 21) золото является основой большинства национальных денежных систем, поэтому для обеспечения выпуска банкнот большое количество золота хранится без перемещения в подвал банка. bank. In кроме того, золото очень широко используется в электротехнической промышленности, его используют для выделки различных предметов роскоши, золочения других металлов и т. д. Соединения золота в основном используются в фотографии и медицине.
Производство золота в мире составляло 1800 г в 18 лет, 1900 400 г. В настоящее время добывается около 1500 тонн в год (за исключением Советского Союза).Все золотовалютные резервы оцениваются в 5 миллионов тонн. 22) примерный состав некоторых наиболее известных сплавов на основе меди приведен ниже. Бронза (нормальная) — Cu 90%, Sn 10%. T о m p a—90%Cu, 10%Zn. Марганец-86% Cu, 12% Mn, 2%Ni; мельхиор-68%Si. 30%Н1, 1%марганца, 1%железа; nainberve-65%меди, 20%цинка. 15% Ni; латунь (нормальная) — Cu 60%, Zn 40%; 59% константана-Si. 40%N1, 1% MP.
Золотой сплав, состоящий из 85% Cu, 13% Zn и 2% Sn, подходит для украшения одежды. Сплавы с составом 90% Cu, 7,5% A1 и 2,5% Au еще больше похожи на золото по внешнему виду. Свободные изменения в СССР включают 95% Cu и 5% A1 (до 5 копеек) или 80% Cu и 20% Ni (более 10 копеек). 50%Cu, 45% A1 n 5% ZN сплав («сплав Деварда») иногда используется в качестве восстановителя, потому что его можно легко измельчить в порошок. Этот сплав уже выделял водород из воды даже на морозе.
23) международный сплав золота и серебра состоит из 90% Au или 10%Cu от Ag, соответственно. Монеты этого состава являются цувр 4 Ряса. XII1-44. Схема синтеза системы Cu-Au. (АС Пн.% В настоящее время они редко ходят пешком. Сплавы Ag и Si, NL Au, Ag и Si обычно используются при изготовлении различных драгоценных камней и предметов роскоши. Его состав (образец) представлен числом частей по весу драгоценных металлов в сплаве 1000 частей. Например, сплав с пробоем 900 или 916 используется для золотых зубных протезов и для изделий из сплава с образцами 958, 7S0, 583 и 500.375. Сплавы золота с пробоями 583 и более не подвержены воздействию азотной кислоты.
В Советском Союзе было еще много изделий, маркированных по старорусскому методу-количество катушек драгоценного металла на фунт (96 золотых) золота. alloy. In в этом представлении золотой предмет обычно составлял 56 штук, а серебряный образец-84 pieces. In в Древнем Египте серебро когда-то ценилось выше золота (около 2500 г. до н. э.).Текущая цена на золото примерно в 40 раз выше, чем на серебро.
24) интересно, что при нормальной температуре Au, Ag(рис. XI-38) и Cu(ПК. XI1I-44) заключается в том, что непрерывный твердый раствор стабилен в обоих случаях, и медная решетка становится нестабильной, когда Ag заменяется на 0 или более. , 2%, и серебряная решетка уже была заменена Cu с более чем 0,03% атомами.
Однако в жидком состоянии медь и серебро тщательно перемешивают(температура плавления 779 ° С при Pr 72 мас. Получают%Ag эвтектики), охлаждение расплава не предполагает разделения Затвердевание элементов и теоретически неустойчивый»пересыщенный» твердый раствор. Превращение твердых сплавов происходит крайне медленно, поэтому такое состояние пересыщения практически полностью стабильно. 25) сплав АГ 25%Аи зелен, сплав АИ ни 20% бел. Более 50 сплавов золота и серебра, в том числе Ат.%
Искусственный интеллект. Не влияет на HNO.«При низком содержании золота серебро растворяется и тем самым отделяется от золота. Это было известно алхимикам. Так, в 13 веке (и приписываемом Богу Гермесу) сочинении «Царь квинтэссенции» даны следующие указания: Если вы хотите отвлечь от одного к другому, положите их в крепкую воду, сделанную из купороса и нитратов. Серебро будет растворяться, но золота не будет. И еще: «а если вы хотите расплавить золото, положите его в крепкую воду и добавьте в нее нашатырь: эта жидкость обязательно расплавит золото.
«Сильная вода» здесь означает азотную кислоту (которая образует аммиак и царскую водку). 26) нормальное изменение поверхности меди и воздуха происходит в основном по следующей формуле: 2Cu-f 03-f HjO-f COj — (CuOH) jCOj. Если воздух содержит смесь диоксида серы, то процесс может протекать параллельно по следующей схеме:^ 8Cu-f 50j-f 6HjO + + 2S02 2 [CuS (V3c u (OH) 2]. 。 27) замечательное взаимодействие меди и кислорода происходит примерно при 200°С.
Согласно схеме Cu SiO CuO, оксид меди начинает образовываться только после того, как слой оксида меди достигает достаточной толщины(2500 а и более).Это в основном связано с тем, что атом меди диффундирует в кислород (через оксидную пленку), и процесс окисления протекает последовательно, и наоборот. Поэтому медная поверхность окисляются Сио включает в себя промежуточный слой «Куджо». Отметим, что Куджо мало отличается по цвету от меди, поэтому начальная стадия окисления практически не заметна.
Отдельные поверхности монокристаллов Cu незначительно (до 20%) окисляются с разной скоростью. 28) при нормальном давлении кислорода серебро практически не реагирует, но и почти не растворяется. Жидкое серебро, напротив, очень хорошо растворяет кислород(рис. XSh-45). Так, при твердении NN Ag выделяется газообразный кислород, который в ряде случаев сопровождается распылением металла.
Что касается золота, то есть признаки противоположного поведения. Таким образом, установлено, что объемная растворимость кислорода в жидком Au составляет около 0,2, а твердый Au способен поглощать до 450°С до 48 объемов кислорода. Если это так, то подобное различие между Ag и Au очень интересно.
29) оптические исследования подтвердили, что поверхность золота в воздухе обладает самой тонкой адсорбцией кислорода layer. In серебром, аналогичным методом установлено наличие оксидной пленки толщиной до 12 А. При нагревании металла (300-400°С) в атмосфере Оа образуется более толстая оксидная пленка, а серебро окисляется при избыточном давлении кислорода (20 ат).Даже полностью. Золото не связывается напрямую не только с кислородом, но и с серой и селеном. Но жидкий теллур растворяет его и образует теллур.
30) взаимодействие элементов подгруппы меди с галогеном значительно ускоряется в присутствии влаги при нагревании и под воздействием света. Продуктом взаимодействия меди и серебра (избыток галогена) является соответствующий Caddy Cu и Ag1 (кроме AgFj), и поведение золота интересно. I-J 8b0 ’050′ с Wj Ряса. КСИИМС. Растворимость кислорода в серебре (c * 3 02l * Ag). Даже при температуре 300-400°c фтор реагирует очень медленно. Диапазон температур 150-300°C наиболее подходит для реакции с chlorine. In кроме того, вблизи его нижней границы образуется преимущественно AuClj. И рядом с топ-AuCl.
Бром-единственный галоген, который взаимодействует с золотом даже при комнатной температуре. В этих условиях образуется смесь AuBr и AuBr. И выше 60°C, только AuBr. Интервал 50-110 благоприятен для взаимодействия с йодом, получается только Аул. 31) если медь взаимодействует с высокотемпературной концентрированной серной кислотой в основном процессе (Cu + 2HaSO <Cu CuSO + + SO * + 2H20), то 5Cu + 4H2SO + + 3CuSO <+ Cu2S + 4HjO. Его относительное значение составляет около 100°C, а при дальнейшем повышении температуры температура снижается и падает более чем до 270°C.
32) при нагревании металлического серебра в атмосфере хлористого водорода происходит обратимая реакция: 2Ag + 2HCI 2AgCl +Н2+ 17 ккал. Равновесие уже установлено на 200°C немедленно. Если процесс осуществляется в закрытом сосуде при атмосферном давлении, то газовая смесь prn 600 ° С содержит 92,8% НС1 и 7,2% Н2 в объеме, а PRN 700 ° с95% и 5% соответственно. Взаимодействие происходит аналогично при тех же условиях, что и в случае Cu.
33) наиболее характерными для элементов валентного перехода подгруппы меди являются обычные окислительно-восстановительные потенциалы(первый показатель соответствует кислой среде, второй-щелочной): Cu * * + 2e = Arl + * = Ag(+0.80 n +0.34 v); Au * » +be= W Au (+1.45 N +0.7 inch).Для непрерывного перехода КР * 1 + е «Cu4 *и Кр * 1 + е» КР в кислой среде, значений+ 0.16 до 0.52 вольт даются. 34) следует подчеркнуть, что в связи с тенденцией элементов с учетом образования комплексов их окислительно-восстановительный потенциал сильно зависит от природы отрицательных ионов, присутствующих при этом(VII§ 5 add.15).
Например. Для перехода Cu41 + e Cu°в кислой среде (e) i Сюй, си’вг’г скн’к’ы* +0.52 +0.14 +0.03 −0.18 −0.27 −0.43 −0.93 Аналогично, для Ag * 1 + e *и Ag° действительна серия ©. так…. +0.65 +0.22 +0.09 +0.07 −0.02 −0.15 −0.71 Указанное значение указывает на равновесие типа EC + e * * E | + X’.При добавлении дополнительных анионов потенциал смещается еще больше. Например, для равновесия Ag (CN) существует+ e Ag | + 2CN » £e = −0.31 дюйма. 35) схема Агцл + е АГ | + СГ-работа может быть использована в качестве электрода для электродов из хлористого серебра. Раствор состоит из полисмена смоченного!
Пластины из металлического серебра, покрытые слоем AgCl, n имеют стандартный потенциал+0,22 В. 36) при восстановлении соединений золота они часто не осаждаются, образуя коллоидный раствор(отрицательный заряд частиц).Эти золи-красивые цвета и интересные, они меняются, когда размер частиц увеличивается со многими цветами, такими как бледно-розовый, красный, фиолетовый, синий, фиолетовый, коричневый черный и т. д.
Очень разбавляют (до 0,01 мг! L) образование фиолетового Золя под действием SnCl2 на раствор иногда используется в анализе, чтобы найти этот элемент. Золотой соль был известен в 17 веке. 37) тонкоизмельченное серебро, полученное реставрацией, находит интересные применения в сантехнике и медицине. medicine. As опыт показывает, что non-Ag *очень сильно представляет стерилизационные (стерилизационные) свойства.
Например, он некоторое время созревал в столовом серебре Вода уже достаточно стерилизована незначительной концентрацией ионов Ag, образующихся при контакте с металлическим серебром, так что она остается в контакте с воздухом, не разлагаясь бесконечно. Это было известно с древних времен. Именно поэтому около 2500 лет назад персидский царь Кир использовал серебряный сосуд во время военных действий для хранения питьевой воды. 38) накопленные не-Ag * ионы текут быстрее по мере контакта поверхности металла с водой increases.
To максимизируя эту поверхность с минимальным расходом металла, рекомендуется фильтровать воду через слой такого серебристого песка, нанося последний очень тонким слоем на обычный песок grains. In таким образом, вы можете создать удобный полевой фильтр для обеззараживания воды. С другой стороны, повязка (порошок, содержащий порошок коллоидного серебра) с»серебряной марлей»или»серебряной ватой«, полученная таким же способом, пригодна для лечения некоторых кожных заболеваний. Такие как жесткий ulcer.
It это уже делалось в Древнем Египте, чтобы покрыть поверхностные раны серебряными пластинами. 39) «серебряная вода» может быть использована для дезинфекции и консервирования некоторых пищевых продуктов. Более быстрый и удобный способ получить его-это привести воду в контакт с хлоридом серебра, а не с металлом Ag.
Концентрация Ag *, создаваемая насыщенным раствором этой соли, оценивается примерно в 1 мг / л, а нижний предел бактерицидного действия серебра оценивается примерно в 10 ″ * мг / л. Таким образом, насыщенный раствор AgCl, не теряющий своего бактерицидного действия, может быть разбавлен более чем в 100 раз. 。 40) очистка больших объемов воды, основанная на бактерицидном действии Ag-ионов, осуществляется электрохимически, особенно conveniently.
To для этого достаточно иметь небольшой источник питания постоянного тока и 2 серебряные пластины в качестве электродов. Ток 10 месяцев (при напряжении около 1,5 В) позволяет стерилизовать 1 литр воды за 4000 часов. 41) проблема потенциальной токсичности серебра крупного рогатого скота несколько неясна. Прямых указаний на это нет, но согласно санитарным нормам США содержание Ag в питьевой воде не должно превышать 0,05 мг / л. очевидно, что это означает постоянное ее употребление.
42) Если вы принимаете чрезмерное количество серебра в течение длительного времени, то возникает аргиния. Аргинин экспрессируется преимущественно экстракорпорально за счет серости слизистых оболочек и кожи за счет отложения восстановленных частиц серебра. Дискомфорт при заболевании альгурин наблюдается. Далеко не обычный. Обратите внимание, что это не суб-1 в то же время.■я&а- » Джей 0_0 Легко заразиться. Рис htchv > elemenpr 43) оксид меди существует в природе, и когда CU нагревается с ограниченным доступом к CujO, кристаллическая ячейка не получается.
Воздух. Теплота образования от элементов составляет В 40 ккал / молярном Кристалле Cu20 каждый атом кислорода тетраэдрически окружен 4 атомами меди, и каждый атом меди имеет 2 соседних атома кислорода(pc. X1I1-46).с точки зрения нагрева, оксид меди очень стабилен и плавится при 1236°C без растрескивания. Напротив того. Ag ^(7 ккал / моль теплоты образования) и AujO начинают распадаться, и элемент составляет уже около 100°C.
Давление диссоциации AgjO достигает 182 атм при 1°C. 44) Если имеется незначительный избыток кислорода (относительно формулы Cu20), то оксид меди является Р-типом semiconductor. In его кристаллические, основные свойства электрон-нейтрального возбуждения (например, под действием света), которое происходит от полупроводников до диэлектриков, так называемых экентонов. Последняя интерпретируется как модель, способная перемещать объем Кристалла. Это ближе к меньшей комбинации электронов и «дырок» (III§ 8 add.9). 9 Б. В. Некрасов
45) интересным применением Куджо является использование в сочетании с металлом меди при изготовлении выпрямителей переменного тока» Купрокс».Работа основана на нем. Поток электронов от Cu к Cu? Я не собираюсь возвращаться. 46) при восстановлении производного двухвалентной меди в щелочной среде образуется желтый осадок, который явно не является основным CuOH. И коллоид Cu} 0.As частицы расширяются довольно быстро, цвет меняется на красный. Для продукта растворимости CuOH указывается значение от 2 до 10.
47) в индивидуальном состоянии, в некотором смысле, Белый Агох может быть очень ненормальным. −50°С, полученная взаимодействием спиртового раствора AgNOs и Кон prn растворимость в воде AgOH при нормальных условиях составляет около 2-10-4 моль / л. осаждение из раствора происходит около рН = 9.Следующие константы соответствуют основному и кислотному типам диссоциации AgOH:/С-б-Ю — *и/С-8-10-я не уверен. Следовательно, для всех молекул AgOH. Для каждого типа кислоты существует диссоциация, и для каждого типа основания существуют миллиарды диссоциаций.
48) растворимость AgOH в сильном растворе сильной щелочи значительно выше, чем в дикой природе. Раствор содержит препарат типа M [Ag (OH)»]. он не подбирается для отдельных состояний. Получают композицию Наджагоа сухим способом. На AgjOs ^ и NaaAg » 03.Однако на практике они, скорее всего, представляют собой сплав оксидов(см. IX§ 3 additional 51). Напротив, продукты состава моэ(м-щелочной металл, е-элемент подгруппы медь) также синтезируются сухим способом и являются индивидуальными соединениями. Кристаллы этих бесцветных (KOCu, KOAg) или желтых (CsOAg, CsOAu) веществ состоят из тетрамеров (MLE4O4).
49) темно-фиолетовый AuO получают слабым нагреванием суспензий Au и Br в растворе KOH. Избыток щелочного Аиона образует синий золь и в то же время частично растворяется. Последнее, вероятно, связано с образованием в урне m [Au (OH) e].в твердом состоянии он не отделяется. Осторожном нагревании (до 200°C) позволяет полному переходу из окисленного золота гидратов для Aigo. 50) во влажном состоянии соль Cu * постепенно окисляется кислородом воздуха, и большинство соединений Au * довольно быстро разлагаются на 3-валентное золото и соответствующие производные металла Au(по схеме Zai * «Au * * + 2»).Аналогичное разложение (по схеме 2Cu * — Cu1 * + Cu) происходит в некоторых производных одновалентной меди.
5!) Радиус ионов Cu *. Ag * n Au * составляет 0,98 каждый. 1.13 N 1.37 A. из галогенидных производных относительно хорошо изучены соли меди и серебра, а некоторые их свойства сравниваются ниже. Цуй бромида вырезать » Р Агцл АФ Б г АГЛ Тепло образования. ккал / моль……. 32 25 16 49 30 34 1″ Цвет………..Белый белый белый желтый желтый Хлопок Типы кристаллов Структура……. ZnS ZnS d (например). Один…….. 234 2.46 2.62 2.46 2.77 2.88 2.99 Энергетический кристалл 219217204 Сетка, ккал / моль. 。
Двести тридцать два миллиарда двести двадцать шесть миллионов двести двадцать девять тысяч двести одиннадцать Температура плавления. * Используйте G………. 430 488 688 435 457 430 6S8 Растворимость, моль / л 1-10 3 7-10-5 M0-e 15 MO «®5.10 »* 7 6-IO » e Для галогенида желтого одновалентного золота приведены следующие значения теплоты, выделяемой из элементов, и энергии кристаллической решетки (ккал / моль): 8 и 247 (С1). 4 и 243 (Br), 0 и 241(I). Кристаллы AUL образованы бесконечной цепью Au-I-Ai-I с очень малым ядерным расстоянием 2.62 a 4(AuI).
52) производные Cu и Au не были получены из фторида 3F. Видимо, они могут существовать только при высоких температурах. В этих условиях молекула CuF и AgF характеризовались ядерным расстоянием 1.75 n 1.98 A, двуногим моментом 5.77 и 6.22 d, энергией диссоциации 103 и 90 ккал / моль. Фторид серебра получают взаимодействием AggCO с HF. It удобно быстро попасть в агбф » ry 200CC пиролиз (по схеме AgBF * = BFjf-AgF), в безводный state. It обладает светочувствительностью (против ультрафиолетовых лучей), высокой гигроскопичностью, хорошо растворим в воде и умеренно (15 г / л) содержится в метиловом спирте.
Электролитическая диссоциация AgF, растворенного в воде, очень важна(v§ 5 add.19).Фторид серебра отделяют от водного раствора в виде бесцветных кристаллогидратов AgF-4HjO или AgF * 2H * 0, а в виде кристаллов сильных растворов HF-AgFUF или AgF-3HF(см. добавление VII§ 1 к 28).Константа диссоциации AgF для жидкого HF имеет значение 9-10″*. в системе NaF— AgF — HjO бинарные соединения не образуются. Для фторирования органических соединений используют фторид серебра.
53) путем взаимодействия избыточного насыщенного раствора AgF при 50-90 ° С мелкодисперсным металлическим серебром (или электролизом такого раствора с использованием серебряного анода) можно получить фосфатированное серебро— AgjF (теплота образования от 50 ккал / моль элемента), представляющее собой зеленовато-бронзовый кристалл с ламеллярной структурой с параметрами J (AgF)= 2,46 и D (AgAg)= 2,86 а, Aggag (Cdl-тип).
Dnargentomoyofluoride не реагирует на свет и устойчив в контакте с сухим воздухом или насыщенным раствором AgF, но медленно разлагается в воде по схеме AgjF-AgF + Ag, или при нагревании выше 100°C он отлично проводит ток, поэтому его структура, вероятно, соответствует схеме e * Ag F ^ F-Ag * — f. подобных производных других галогенов, по-видимому, не существует. 54) из-за низкой растворимости солей хлорида серебра, бромида серебра и йодида, если раствор содержит одновременно АГ и негалогениды, во всех случаях из них образуется их творожистый осадок.
Для меди ситуация сложнее, и медь не дает легкорастворимой соли железа. Здесь нужно начинать с производных меди с 2-валентностью и нагревать с металлом Cu для их восстановления (например, схема: CuCli-f Cu 2CiC1). 55) при умеренном нагревании соответствующих производных 3-валентного Au (по схеме AIG-AiG-f Ha) или при тщательном их восстановлении удобно получать Галоидные соли 1-валентности AU. In в присутствии воды эти почти нерастворимые 4 галогениды подвергают воздействию днсмутацина согласно Zaig AuG + 2Ai scheme. In в холодную погоду процесс протекает медленно, но при нагревании (под воздействием света) он значительно ускоряется.
В серии AuCl-AuBr-Aul тенденция dnsmutacin уменьшается, и зеленовато-желтый йод(полученный даже при незначительном нагревании по схеме 2Au + I -2AuI) начинает разлагаться непосредственно на элементы свыше 100°С. 56) твердое йодное серебро известно для 4 кристаллических форм, и в нормальном состоянии оно может существовать 2-более стабильных (менее+ 137°C) Куба (тип ZnS, rf (Agl)-2.80 A, плотность 5.71] менее стабильных(тип ZnO,.Кубики и лишние г-шестиугольники. Последний, при нормальных условиях, может быть преобразован в куб путем измельчения осадка.
57) стабильная область йодида серебра показана на рисунке. XIII-47 имеет букву A. более 146 будет стабильным. Форма С-в примерно на 5% меньше по сравнению с обычным объемом и сложными кристаллическими структурами, а атомы йода занимают узлы объемно-центрированной кубической решетки. Стоящий твердый АГЛ. Атом серебра (не) статистически заполняет часть различных пустот в структуре и получает координационное число 2(d(Agl)= 2.52 A), 3(2.67 A) или 4 (2.86 A).Структура типа NaCl.
58) из-за наличия избыточных структурных пустот в форме B относительно небольшой (содержащий йод) не-Ag *может легко перемещаться по кристаллу. Это связано с его очень высокой проводимостью. Последний примерно в 2 раза больше максимального проводящего водного раствора, а вблизи точки перехода он почти в 4000 раз больше проводимости формы Agl, которая стабильна при нормальных условиях conditions.
It интересно также, что проводимость твердого Ag1 при температуре плавления (558°с) несколько выше, чем у расплава, но практически со всеми другими солями плавление сопровождается резким увеличением(например, в 3000 раз в случае NaCl). Перенос тока ионами Ag * также является характеристикой твердых AgBr и AgCI, но относительная проводимость проволоки при температуре плавления следует общему правилу (solid AgCI = 1), как показано в приведенных ниже данных.
Информацию agci Агбр АГЛ сплошной• * * * я 4.4 22.0 * в роспуск………. 31.2 23Л> 19.7 При повышении внешнего давления температура плавления всех 3 желез увеличивается. 59) мелкодисперсный АГЛ, полученный быстрым охлаждением метастабильного гексагонального пара, является наиболее эффективным зародышевым агентом при кристаллизации переохлажденной воды (X§ 1 add.40).Это связано с тем, что структура кристаллов льда и АГЛ этой формы очень схожа.
60) очень важным свойством плохо растворимого галогенида серебра является то, что он разлагается на металлическое серебро под действием света в соответствии со схемой 2Agr * 2Ag-f-Г*, чтобы стать свободными галлонами. Большинство неактивно. Светочувствительность галогенида серебра зависит от серии AgBr> AgCI> Agl. При охлаждении он уменьшается significantly.
So при температуре жидкого воздуха чистый AgCI не разрушается даже в результате длительного осаждения. Кристаллы AgCI хорошо передают инфракрасное излучение (особенно в диапазоне-более 80%-5 до 20 мкм). 61) химические процессы, происходящие под воздействием света, называются фотохимическими реакциями.
В зависимости от того, является ли рассматриваемый процесс лихорадкой или эндотермией, значение световых лучей в этом процессе варьируется significantly. In в первом случае (например, при образовании элемента НС1нз-VII§ 2) свет необходим только при первом возникновении процесса, а затем естественным образом становится темным. Напротив, во 2-м случае(когда речь идет о затухании Галогенида Ag) процесс протекает только в той степени, в какой затрачивается энергия лучей, и прекращается, когда отсутствует освещение.
62) фотохимическая чувствительность серебра g была особенно использована при создании фоточувствительного стекла. Мельчайшие частицы Agr, окруженные массой стекла, разлагаются под воздействием интенсивного света с образованием металлического серебра (n свободных галогенов), что делает стекло темнее. Серебро и галлоны не разделены пространственно, поэтому, если свет слабый, произойдет обратная реакция, и стекло снова станет прозрачным.
Такое фоточувствительное стекло явно перспективно для использования в электронно-вычислительной технике. 63) фоточувствительность галогенированной соли серебра основана на ее использовании. Фотопленка в основном состоит из фоточувствительного слоя тонкой суспензии AGR(чаще всего AgBr) в желатине, нанесенном на целлулоид.
Нормальная толщина такого слоя составляет около 20 мкм, а диаметр частиц Agf-0,1-2 мкм. Освещение пленки приводит к разложению содержащихся в ней галогенидов серебра, кроме того, галогены химически связываются желатином, а серебро образует мелкие эмбриональные кристаллы. Последняя из этих областей поверхности кажется более сильной, и эта область более сильно подвергается воздействию. Поэтому, несмотря на нынешнюю однородность пленки под кратковременным воздействием света, она уже содержит в себе «скрытое изображение» предмета.
Чтобы сделать его видимым. Пленку подвергают операции проренирования, состоящей в дальнейшем восстановлении свободного серебра из галогенида серебра химическими средствами. Разработчики обычно используют какой-то органический восстановитель. Очень важным для процесса проявления является тот факт, что восстановление галогенидов серебра протекает наиболее быстро в непосредственной близости от зародышевых кристаллов существующего металлического серебра. Это ясно объясняется ролью ядра, с одной стороны, адсорбцией на проявителе ЖСК, а с другой стороны, как центра кристаллизации выделяемого металлического серебра. 。 。
Пленка, достигаемая достаточной прозрачностью видимого изображения, фиксируется для разрушения чувствительности к дальнейшему действию света. Фиксация производится путем удаления оставшегося галогенида серебра из фоточувствительного элемента layer.
As в качестве фиксатора обычно используют следующий раствор сульфита. Раствор гипосульфита легко растворяет галогенид серебра комплексообразованием в зависимости от структуры: 2NajSjO«+ AgF- «Naj(Ag (SjO$) t} + Nar (нестабильная константа комплексных ионов lAg (SiOj) i) 4» 10〜»).
- То, что можно получить, развивая и корректируя устойчивое изображение видимого света (негатив), называется противоположностью истинной картине. Это связано с тем, что темный Восток * Id * m соответствует светлому расположению объекта taken. To чтобы получить истинное изображение, негатив наносится на другую пленку или бумагу с фоточувствительным слоем и подвергается воздействию света.
Отношение между светом и тенью изменяется во время»печати«фотографии на противоположную сторону соответствующего сфотографированного объекта, потому что свет проходит через темное место, как он проходит через более яркие и более сложные места негатива. Затем печатное изображение-posmtn B — подвергается проявке и фиксации(или только последней, если сверхчувствительный слой предназначен для получения прямого видимого изображения фотохимическим способом).
Фото есть монография * по химии процесса. 」 Людмила Фирмаль
64) недавно было предложено создать фоточувствительный слой путем осаждения паров AgBr на стекло в вакууме. Толщина распыленного слоя Не более 4 мл. И его детализация на самом деле не влияет на увеличение. Для последующей обработки негативов (например, манифестов) вычислите только * секунды.
65) путем введения специальных добавок в фоточувствительный слой может быть резко повышена общая чувствительность (до 10- «сек экзоцина) или селективная чувствительность к отдельным лучам спектра (ТФ +ом, включая инфракрасный), а также приобретение слонов под воздействием света и последующее проникновение определенных цветов. воспользуйтесь возможностью получения любого цвета, объединив красный-основной цвет зеленого и синего.」
66) таким же образом, наше предпочтение с frontsn относительно этих сцен также интересно. Язык содержит 4 основных типа рецепторов, которые соответствуют сладкому, соленому, кислому и горькому. Эти различные сочетания землистых ароматов создают целый спектр восстановления вкуса для человека(XII§ 2 add.34). * Markhls » Г-Жа К. И.. Ystold Govorko В. А. Фото hmmka. М..«Искусство.» 1966.175 п.
Интересно, что вкусовая чувствительность людей с возрастом не снижается, а повышается. 67) при нагревании цвет всех желез, которые считаются темными, темнеет. Например. CuCI становится синим при 178 ° C, а хлорид серебра становится оранжево-желтым, когда он плавится.
Плавка AgCI хорошо прилипает к стеклу, кварцу и металлам, что делает удобным создание герметичных соединений между отдельными частями устройства (имейте в виду, что AgCI увеличивается в объеме при переходе из жидкого состояния в твердое).Легкий сплав подходит для той же цели сплав состава 40 вес.%AgCI и 60-TICI(mp.210°C) или 31 мас.%AgCI, 46-Agl и 23-TICI(mp 131°C).
Расплавленный AgCI слегка растворяет металлическое серебро(при 490 ° C 0,03 моль%, при 700°C 0,06 моль%). 68) при 1000°C весь галлон Cu * n Ag заметно улетучивается, а при дальнейшем нагревании он несколько кипит без разложения(CuCl при 1359, CuBr при 1345, Cul при 1336).AgCI при 145 ° C).Элемент до достижения температуры кипения(например, Agl).Еще легче (до достижения температуры плавления) распадается при нагревании золь галогенида одновалентного золота.
В серии CI-Br-I термическая стабильность рассматриваемых соединений значительно снижается 60) в паре без разложения железа в основном частично связана с образованием молекулы (например). Хлорид меди Trnmer имеет D (CuCl) 2.16 A и угол около 90 «(ZCuCICu) или 150°(ZCICuCI) 6-членная кольцевая структура. Для отдельных молекул ЭГ ядерные расстояния равны (а): 2,33(Cul), 2,28(AgCI), 2,39(AgBr), 2,54(Agl) для константы сильной связи хлорида ES1 указаны значения 2,3(Cu), 1,8(Ag) и 2,6(Au). AgCI составляет 5,70.
70) очень низкая растворимость в воде, например, серебра n меди Галланд быстро увеличивается с увеличением temperature. So для AgCI, AgBr, Agl, CuCI и CuBr, при нагревании до 350°C, он увеличивается на 290, 1900, 1620 и 1000 Н соответственно 214 times. By медленно охлаждая такие растворы, например галогенидные кристаллы получают в их обычных сотнях тысяч раз больших размерах.
71) в сухом состоянии железы Cu, Ag, Au * легко присоединяют газ NH за счет образования комплексных соединений, среди которых наиболее обильному аммиаку соответствует состав (3 (NHj) s) R. например, AuCl при этих условиях образует комплекс состава AuCl•12NH. It также был получен » комплекс галогенидов с фосфоновой кислотой состава EG-PH5 и EG-2RH.» 72) аммиачная вода растворяет большинство галогенов \ juli Cu * n Ag * и образует бесцветное комплексное соединение, содержащее в основном non [3 (NH5) j] ’(рис. XIII-48).
Интересно, что в серии AgCI-AgBr-Agl растворимость галогенидов в аммиачной воде увеличивается очень быстро (100 г насыщенного прямого 0C раствора содержит 0,28 г AgCl, 2,35 г AgBr или 84,1 г Agl). Для AuCl известен бесцветный аммиак в составе AuCl NHs. Он образуется при взаимодействии AuCl и NH Ohh (и последующем испарении раствора). он нерастворим в воде, но растворяется в избытке (за счет образования (Au (NH.)) I) CI). При нагревании выше 150°C этот аммиак разлагается. Йодированная золото образует комплекс состава [Аи (НСЗ) со.
73) как и соль, Ag \легко растворяется в аммиаке и Ag * 0.As в результате растворения образуется комплексное основание IAg (NHj) a] OH. Диссоциирует примерно в той же степени, что и NaOH. Не [АГ (.NHjJa) ’ Уик. XIII-48. значение n и выражение [Ae (NHj) nJ *. 6-10-равно.Моновалентный медеподобный комплекс сам по себе еще более стабилен (/C-MO«), но легко окисляется атмосферным кислородом. Раствор аммиачных комплексов серебра хранить нельзя (из-за выделения очень взрывоопасного осадка).
74) поддерживая восстановление аммиачного раствора солей серебра, тонкая пленка металла Ag прочно прилипает к стеклу. Это основа производства зеркал. Глянцевая серебряная пленка, прикрепленная к стеклу, покрыта лаком для защиты его от внешних воздействий. Обычно для серебрения стекла используют 2 свежеприготовленных раствора, примерный рецепт приведен ниже.
(L) к раствору, в который входит bg AgNOj 100 мл воды, растворяют осадок, образовавшийся сначала с добавлением аммиачной воды, затем 70 мл 3% раствора NaOH, и снова с аммиачной водой, разбавляют последний водой до 500 мл, пока раствор не станет полностью прозрачным(не чрезмерным). (B) 25 мл воды с 1 г концентрированного HNOj плюс 1,3 г раствора глюкозы кипятят в течение 2 минут, охлаждают и разбавляют равным количеством спирта. Перед использованием смешайте раствор А и в в соотношении 10: 1.1.На стекло наносится плотная серебряная пленка (после обработки горячей смесью HNOj-f KjCr20 его обрабатывают дистиллированной водой и, наконец, спиртом).Один или два раза.
Полученный осадок серебра промывают водой и спиртом. 75) раствор Агно, растворенный в аммиачной воде, иногда используют для нанесения несмываемых этикеток при стирке одежды. Индикация и фиксация меток достигается путем немедленного проглаживания отмеченных мест утюгом. Если вам нужно удалить такую метку, вы можете сделать это, обработав метку сильным раствором KI, а затем промыв ее водой.
76) слаборастворимая электролитическая диссоциация ювелирной серебряной железы: для константы диссоциации молекул AgCl и AgBr приведены значения 2-10-и 7-10 секунд соответственно. При достаточно сильном растворе соляной кислоты и ее щелочных солей галлий Cu, Ag * n Au * заметно растворяется(особенно при нагревании).Например, в насыщенном растворе NaCl растворимость AgCl в нормальных условиях составляет 7-10 ″ моль / л (L0〜* моль / л для воды).в производных серебра было показано, что растворимость незначительно возрастает с увеличением радиуса e *щелочных металлов.
Из-за образования сложных кислот или их щелочных солей многие из них были выделены в твердом состоянии, например, перламутровые серые иглы H [CuCl], бесцветные кристаллы KfAglt), K ^ AglJ, Na (AuCls).Тип нестабильности соединения ионов[EGa ^по сравнению с приводной пластиной(s) Си * Ма 2.!<Р $ 2 ″ 10 * е-в Br.10 «Ин-ю» т 4. / 0-и Я б-10〜#
Как видно из этих данных, в серии Cu * — Ag * — Au * n CI-Br повышается стабильность аналогичных комплексов. Интересно, что тенденция увеличения координационного числа CI-Br-I ряда Ag (AG^, AGL,’, последовательное образование комплексов типа Agr4) не уменьшается, а увеличивается. 77) система Ag * — Br также была исследована при эквимолярном плавлении NaNOj-KNOj pr 280°C (§ 1 add. См. 105).Установлено, что продукт растворимости бромида серебра составляет 310 -\, а константа диссоциации AgBr и константа нестабильности AgBrJ дают значения 4-10 — *и 4• соответственно.
78) галлий серебра растворяется незначительно, растворяется в Ферротермическом растворе агной(и AgC10 до AgF).От таких растворов можно отделиться Характеризующаяся удельной температурой плавления (°с), соответствующая гирлянда Ag double solar AgNO » n: AgNOs> AgCl Agn’OJ-AgBr AgNOj-Agl 2AgNOfAgI 160182105 Комплексообразователь рассматриваемого бинарного соединения не является галогеном. структура nx соответствует выражениям (rAgi) NOj и (rAg$] (NOs). П0-9 (ИЦ), 9-10 «*и 7 значения i0 — *(Бр), МО — » и 2-10 — «(я). 79) бесцветный аммиачный раствор соляной кислоты CuCl в воздухе постепенно переходит из окисленного Cu в Cu*, поэтому он сразу окрашивается (синий или зеленый соответственно). в газовом анализе эти растворы часто используются для улавливания окиси углерода.
Последние впитываются в холод, а при нагревании снова высвобождаются. Бесцветное соединение композиции CuCICO-2HjO можно выделить из раствора, насыщенного монооксидом углерода. Соответствующий безводный продукт соединения (CuCI-CO) образуется только при высоких температурах. pressure. It представляет собой рыхлый белый порошок, а давление CO, которое уже составляет prn 0 * C, составляет 67 мм рт. ст. Аналогичные производные CuBr и Cul еще более нестабильны. Бесцветные соединения золота с аналогичным составом (AuCI * CO) образуются в результате взаимодействия AuCI и CO при 90°С. карбонильное производное серебра не получено. 80) их галогенные соли Cu*, Ag * N Au * тесно примыкают к цианиду: Белый CuCN и AgCN и желтый AuCN.
Температура плавления CuCN составляет 473°C (азотная атмосфера), а цианид серебра и цианид серебра разлагаются до его достижения. При давлении около 73 000 атмосфер температура плавления AgCN составляет 443°C (а экстраполяция на нормальное давление приводит к 346°C).В отличие от галогенидов серебра, AgCN темнеет при воздействии света. Его кристаллы состоят из бесконечных линейных цепей следующих типов:•АГ-•с »» н-•*аг «•- С» Н- * что серебро связывается как цианистый углерод и цианид-анионов. Аналогичная структура была установлена для одновалентного цианида. Интересно, что расстояние между соседними атомами Au в таких цепочках(5.09 A) намного меньше, чем расстояние между соседними атомами Ag (5.26 A).
Частота растягивающих колебаний связи C N-N AgCN (2178 hedges-1) значительно выше, чем у ионной структуры NaCN (2080 cmx). 81) все 3 соли почти нерастворимы в воде и разбавленных кислотах, но более или менее растворимы в веществах, образующих ионы и комплексные соединения рассматриваемых элементов(NHS, NajSjO и др.).
Особенно легко растворяется в присутствии щелочного металла cyanide. In в этом случае очень стабильный бесцветный комплексный золь [3 (CN) j) М-типа легко растворим в воде. Константы неустойчивости соответствующих комплексных анионов, соответствующие им, различаются в ряду МО «(Cu), 8-10«(Ag), 5-10 «(Au).Чернила (3 (CN).] кристаллические, не (Ag(CN), J) и (Au (CN) aJ линейны (константы силы связывания EC характеризуются в 1,8 и 2,7 соответственно), ионы [Cu(CN) i) слегка изогнуты(tfccuc134eprn (TFCC) −1 A).
Это связано с близостью атома Cu одного из N атомов соседних анионов[c /(CuN)= 2.05 A]. 82) комплексы MJ {3 (CN) s]и MJ3 (CN) с высоким координационным числом типа J известны также для меди и некоторого количества серебра. Тетраэдрический Ион[Cu(CN) 4p, константа прочности связи Cu — C равна 1,3.Когда CuCN (PR ЗХX 10») нагревается с раствором fecb, его можно использовать в качестве метода для получения Cyan: 2cucn + 2fech * » 2cuci + 2feci, + (CN) t. 83) процесс с-ф ^ Н ’^fSfCNJtJ’-нормальный потенциал системы Fe © равна −0.43(КР), −0.31(АГ) Н-0.61(Ас).То есть близко к потенциалу водородного электрода (рисунок V-35).Схема E + H* ** 3 * -несмотря на первичную обратимость в этих условиях реакции с f-H, замещение водорода наблюдается только в случае меди (легко образуются ионы (Cu(CN)»} «и| Cu (CN) 4]’»).
Однако, при наличии сепаратора, достаточно быстро Создание также является серебром и золотом, потому что равновесие E-f-H * E * смешивается прямо в связи, а также E*.Водород также (путем окисления в воду).Когда кислород в воздухе становится доступным, золото и серебро растворяются в NaCN в соответствии с общей формулой. 4E + 8NaCN + 2HtO + Oj = — 4Na(3 (CN) 2] — f 4NaOH. По-видимому, перекись водорода образуется как промежуточный продукт, который расходуется на последующее окисление. Комплексные растворы цианидов Ag и Au часто используются для электролитического серебрения и золочения других металлов (в основном меди). 84) Cu * n в случае родинидных производных его аналогов катионы связываются с анионами через серу.
Но кристаллы AgSCN состоят из бесконечной зигзагообразной цепочки TNPS.. .AgSCN … AgSCN …(Под углом 104°к атому серы), Ag * — это не только сера(d (AgS) −2.43 A), но и азот[rf (AgN)= 2.22 A] соседних молекул. Простой родинд Cu * n Ag представляет собой белое вещество, которое почти нерастворимо в воде, но при растворении избыточных ионов SCN они образуют комплексные соединения. Из них тип M(Ag (SCN) a) известен серебром. MJAg (СКС) и МДЖ (АГ(СКС)»). (NН4) ОКГ (ТВН) я).
Для меди, КН (ТС(СКС) J)и на}(Кр(ТВН)))•4HjO был получен. Последняя соль интересна всем them. In концентрированный раствор, фильтровальная бумага сильно набухает, после чего при нагревании образуется прозрачный раствор, который при охлаждении растворяется в геле. значение константы неустойчивости non (E (SCN) jJ ’задается как 1•10 «» (Cu), 3•10 «(Ag) n I * 10-„(Au).Производные Родена Au * нестабильны и постепенно деградируют с их высвобождением. Металлическое золото. 85) из других солей Cu. Ag и Au * должны иметь дело практически только с производными серебра.
Данные о растворимости (моль / л H | 0) для конкретной соли Ag в нормальных условиях сравниваются ниже. Сы; сы N07; CHjCOO „сы; сор нет; ВГО; соб 27-ЭТО 5.10-1 7- НГ * 3.(3.Значения i0 — * 3.Значения i0- * 9-10 — “ 1-10- “ sorC ,rocrof „N7,0грорcn-SCN“ S2- 1-С-4 7. ИГ * 2. С — » 2.10- $2.I0 — ®S0-」 Как видно из приведенного выше сравнения, большинство солей серебра слабо растворяются в воде. 8c) в сильном растворе соответствующей соли щелочного металла нерастворимые соли Ag обычно растворяются более или менее легко из-за образования комплексных соединений.
Последний характеризуется различной стабильностью (например, non (Ag (NOj) J’N (Ag (SOj) j) «равен 6-10-’и 2-10 — * соответственно) неустойчивых констант. Соль Cs3BalAg является интересным комплексным производным серебра. (Нет.)»]•2НаОн (Нью-Хэмпшир«) ОКГ (Sa03) 4хј] (х-хлор, бром, или SCN -).АГ, очевидно, имеет координационное число 6. 87) нитрат серебра (Мп.209,6°с) широко применяется при изготовлении зеркал и в медицине (часто в виде сплава под названием «Ляпис» с Агной 1 мас. ч. и КНО * 2 мас. ч.).Расплавленная Агноя выступает в качестве среды для криоскопии (постоянная наблюдения зеркала 26,5 град/моль).
Пиролиз этой соли происходит только при 350°С и выше в системе Агной-Кной, подтверждено наличие эвтектического плавления при 25°С (55,6 моль% Агной).Нитрат серебра также растворим в некоторых органических жидкостях. Примером могут служить следующие данные (моль Агноя на растворитель 100 молей при нормальных условиях). HjO CH » OH CjHbOH CHjCOCHJ CHJCOOCHJ CeHeNHj C5H5N CHjCN 27 0.68 0.57 0.2! 1.4 9.8 21.3 41.6 Как видно из этих данных, азотсодержащие органические соединения являются особенно отличными растворителями для Агноя. Нитрат Cu * n Au * не был получен(но известны комплексы, полученные из CuNOj).
88) пропускание этилена при 0 * c i в насыщенном водном растворе нитрата серебра сопровождается осаждением Белого комплекса C * H4 * AgNOj. In индивидуальные условия, оно стабилизирован только под −30°C (или если давление этилена поднимает). 89) перхлорат энергия кристаллической решетки серебра оценивается в 165 ккал / моль. При нагревании эта бесцветная соль не растворяется, а разлагается примерно при 500°С. Она легко растворяется не только в воде, но и во многих органических жидкостях. Твердая фаза обычно содержит сольваты из растворителей, таких как AgCYu4 * lPl(R1-молекула растворителя). Некоторые численные данные при 25°C приведены ниже(растворимость agc100 в моле растворителя 10). Растворитель.: 。 。
Растворимость Hjo C * H5N C * H5Ncg C» H » SvN9SNv…. 48 10.0 2.4 2.0 42 п……….. 1 4 b 1 0 Сольват AgC10″ * C «hschj стабилен только при 22,6 * C. обращает на себя внимание почти идентичная растворимость AgCIO’ в анилиновом n-бензоле и его очень высокая растворимость в толуоле (для неорганических соединений).было отмечено, что при добавлении небольшого количества воды он все еще увеличивается. Перхлорат серебра также легко растворим в глицерине, уксусной кислоте, нитробензоле и хлорбензоле. Свое разрешение в нитрометане имеет хорошее электрическое conductivity. In разбавленный (0,0002 м) бензольный раствор хлорной кислоты представляет собой МО-иомер серебра, указывающий на дипольный момент 10,7.Но по мере увеличения концентрации этот момент уменьшается (до 0,005 м в растворе 4,7).
Это, вероятно, связано с частичной обработкой AgCl04.It следует отметить, что это сочетание Солнца и большинства органических молекул может взорваться (при нагревании или попадании). 90) согласно данным рентгеновской дифракции, Монокристалл AgdO C H H Hлаг состоит из-AG * — cihe•••AG * — CFH $ — цепи и расположен в интервале между ионами cio7 nnm. Расстояние от номера-АГ до ближайшей облигаций СС из 2-х колец-это не то же самое(2.50 и 2,63 а).Интересно искажение бензольного кольца. Ближайшая связь< / (SS) к Agсоставляет 1,35 А. остальное-1,43 А. 2 ZCCC составляет 116°, остальное-122°.
Еще большее искажение бензольного кольца наблюдается в кристаллах SbH3 * CuAICU-атома меди complex. It регулируется 3 атомами хлора и 1 связью CC (от атомов на расстоянии 2,15 и 2,30 а).Длина этого соединения составляет 1.27 а, а оставшаяся длина(1.41-1.25-1.37-1.29-1.40)он явно чередуется. •I) как с AgCI04, хорошая растворимость в некоторых органических растворителях agbfa и Ag3Fe (E, P, As, Sb. It характерно, что они лучше растворяются в бензоле, чем в толуоле.
Для большинства из них выделяют кристаллический сольват. Например, в случае типа Ag3Fe-2C * H * тот факт, что AgBF4 плохо растворим в циклогексане и нерастворим в циклогексане, непосредственно указывает на наличие взаимодействия Ag *с связ связью молекулы растворителя (см. x§ 2 из 26). 92) желтовато-серебристые т и Т отчетливо присутствуют в 2 формах Ag-ONO и Ag-NOj (кроме того, обычно получается смесь).Именно поэтому при взаимодействии с CjHsl образуется примерно одинаковое количество этилнитрита и нсгроэтана(в то время как KNOj производит только этилнитрит).Пиролиз нитрита серебра происходит уже при 128 * С и above.
In в водных растворах эта соль умеренно диссоциирует (K «■2-10» 2). на воздухе она медленно окисляется и становится нитратом. 93) в частности, бесцветный AgCIOj (mp 230°C) может быть получен взаимодействием тонкоизмельченного порошкообразного серебра с хлорной кислотой по схеме 6Ag + 6HCIOj-AgCl + 5AgCIO «» f3HaO. AgBrO *гораздо более устойчив в их отношении, и AglOj не разрушается даже горячей серой Азотная кислота. Возможно, серебро этих солей непосредственно связано с галогеном. 94) белый сульфат серебра (Мп.660°с)устойчив в атмосфере, только около 1000°С начинает разлагаться по схеме AgaS04 = + SO * +О.
Растворимость в серной кислоте значительно выше, чем в воде (за счет образования более растворимого бисульфата-Агсо).И наоборот, K * SO » указывает на то, что раствор ниже, чем в воде, и что non-Ag *менее вероятно будет комплексоваться с non-SOJ.«Для константы dnocociac non-AgSO задается значение 0,59. 95) при нагревании до 100°C или более желтоватое углекислое серебро начинает разлагаться в соответствии с AgjCOj.
C) интересно, что структура намного лучше, чем растворимый смешанный золь KAgCOj. Его кристаллы состоят из з ионов в цепи K * n, образованной неназванным AgCO- 96) из других солей серебра производные типа AgOT известны только в растворе, они меньше разлагаются в соответствии со схемой 3AgOT = „2Agr + AgrOj“ (I> Br> CI).Бесцветный AgN (mp 252°C)с желтым AgClOj взрывно. Для электролитического доноконасина CHjCOOAg приведено значение K = 0,18, для ионов AgSOj и AgSjOj-соответственно 4-10-4 и 2-10-9. И Ag, S03 и AgaSa03 бесцветны и немножко soluble в воде.
97) помимо довольно высокой стоимости серебра, соединения после его использования обычно собирают в специальные banks. To регенерируют Ag из таких остатков, их кипятят с гранулированным цинком в присутствии HCl. Это сопровождается осаждением порошкообразного серебра. Последний отделяют от избытка 2 р, термически обрабатывают разбавленной соляной кислотой и промывают водой. При необходимости, после растворения в HNOj, полученное серебро дополнительно тщательно очищают. Отделен как AgCI. Смешать хлорид серебра с раствором NaOH и добавляют формалин.
При нагревании на водяной бане Ag быстро выделяется в виде рыхлого черного порошка, который отделяется от жидкости и непрерывно промывается разбавленной водой HjSO, раствором NH4OH и снова водой. Хлорид серебра также может быть разрушен путем слияния с содой. Реакция протекает по следующей формуле: 4AgCl+ 2Na » COj-4NaCl + 2COa + O,+ 4Ag. 98) ближе всего к соли С находится вышеупомянутая железа. Цианид и тиоцианат — это азид-Кунж. Этот бледно-зеленый кристалл солнца практически нерастворим в воде (растворимость 5-10 — * моль / л) и разлагается под воздействием света на элементы. 99) одновалентный сульфат меди получают при 200 ° с реакцией 2Cu + 2HtS04 Cu * S04 + S02 +2HaO.
It бесцветный кристалл, стабилизированный в сухом воздухе, но он разложен в Кусо н Си водой. Эта соль является сильным восстановителем(например, гондроксилан, который количественно превращается в аммиак). 100) могу ли я получить одновалентные сульфиты под действием SO? Для концентрированных растворов Cu (CH»COO) t в уксусной кислоте. Реакция протекает по формуле 3Cu (CH3COO) a + 2SO * +ЗН, 0 = cus04-f cu, so, + 6сн, COOH I, и сульфит осаждается в виде белого кристаллогидрата cujsoj-Hao. Имеются указания на то, что возможность получения красного восьмидесятилетнего этого вещества также есть(CutSO, — HtO).
При нагревании на воздухе, серная кислота dimen входит в CutO. Слабо растворим в воде, но в растворе сульфита щелочного металла образует растворимый комплексный сульфит (РН только стабильный рН = 7 ~ ^ 8). CuSO ,, Cu (S03) «n CufSO.) «„для константы неустойчивости ионов приведено значение 1•10“ c. Три• Н 4•!Интересным производным не-CuSO является красная соль Cu (CuSOi) » * 2нао, осажденная пропусканием тока so в 10% раствор cusoi. 101) нейтральный сульфат медине получен. Для ионов CuS20 ^приведено значение константы нестабильности cu (S, 0.) «’■Cu (S, o») «»S-IO «11, 6-10-» n 2 * DO*.
102) при действии NOj на мелкодисперсную медь, полученную восстановлением при 25-30°с, образуются соединения Cujной композиции. Это явно следует считать солью Нитро азотной кислоты (IX§ 3 add. 36). это коричневое вещество, стабильное в сухом воздухе, но быстро разлагающееся водой при удалении NO. 103) Что касается Cu, то весьма характерно, что он сочетается с ацетоном. Распространенным методом формирования таких комплексов является воздействие медного порошка на раствор ch3cn соответствующего солнечного cu1.Интересно, что их состав (свойства) сильно зависит от природы Анона.
Таким образом, в случае C1-nBr комплекс соответствует формуле CHjCN-CuT(n явно не является электролитом), а в случае NOJ формула C107 и Bf ^(CU (NCCH3)] X (и разлагается в растворе ацетона) хлорной кислоты плавится при 175°C и разлагается только при 205°C (сопровождается взрывом).Все этнические комплексы разлагаются водой. 104) производные Au, помимо рассмотренных выше, известны лишь немногие. Ближе всего к его Галоиду. cnandu и тиоцианат имеют значение-AuN3(теплота, получаемая от элемента, составляет 67 ккал / моль).Эта бесцветная соль готовится по схеме: AuCl3 + 3Na. It получается в соответствии с N3 = 3NaCl + AuN3-f 3N2.
It растворяется в воде и очень взрывоопасен (даже в растворе).Одновалентный тиосульфат золота неизвестен, но по схеме Aul-f 2NaaSa03 = Nal-f NaJAu (S203h) получается тоносульфатный комплекс, который выделяют из раствора бесцветных кристаллогидратов (содержащих 2NgO).Получен состав кристаллического комплекса (Au (NCCH3) jJCIOi).Интересно разложение в растворе 2 noi состава AusIP (C $ H5) 3] Красного комплекса C1.Структура этого катиона, вероятно, является формулой (Au’F ^ PfCtHsh). 105) сульфид cu. Ag и Au в воде и разбавленных кислотах практически нерастворимы.
Темно-серый Cu2S (mp 1130°С) встречается в природе и является важной рудой меди. Интересным свойством Cu2S является резкое снижение электрического сопротивления при увеличении давления: pr 12 000 атм составляет всего 0,1%от его значения в нормальных условиях. Ку? Взаимодействие между S и раствором AgN03 протекает по следующему уравнению: CuaS-f 4AgN03 = AgjS-f 2Ag-f 2Cu(N03). 108) черный AgjS(Мп.825°С) — это особенно плохо растворимая соль. Поэтому он осаждается S-ионами из раствора всех соединений серебра.
Образование AgjS происходит даже под влиянием H * S (в присутствии влаги и кислорода) реакции с металлическим серебром уравнения: 4Ag-f 2H * S-f-Oj = » 2AgjS + 2HjO уже медленно при нормальных условиях, с постепенным потемнением серебряных предметов быта. Как правило, взаимодействие AG и H2S также происходит за счет замещения водорода. Это связано с тем, что растворимость AgjS настолько низка, что потенциал серебра падает до −0.7. в (ср. VII§ 5 add.15).Однако в отсутствие кислорода образование Ag * S происходит относительно медленно. При контакте с алюминием в разбавленном растворе соды сульфид серебра легко восстанавливается до металла.
107) при нагревании до 240°с одновалентное золото темно-коричневого цвета (влажное состояние-серое) разлагается на elements. It получают путем воздействия H2S на подкисленный раствор K [Au (CN) 2].Реакция, образованная по схеме 2 {Au (CN) J’-f-S «Au»s + 4CN’ обратима, поэтому требуется сильное насыщение. Раствор сероводорода. Метод, иногда используемый для извлечения серебра из сернистых руд, также основан на обратимости подобных реакций AgjS. In в этом случае, чтобы сдвинуть равновесие влево, S, so; ’n SCN’. 108) одновалентные сульфиды Cu, Ag и Au частично растворяются в растворе сульфида щелочного металла за счет образования тонозолей. Простой способ В случае АС-растворение.
Для тоснолов, типы которых являются M [AuS]и MJAuSj].Свободные высококислотные участки, высвобождаемые Соединенными растворами, нестабильны и быстро разлагаются на Ауас и Хас. Для меди описано несколько полных сульфидных производных, а для серебра — тип токалидов AgjST (Γ-Br, 1). 109) для всех элементов подгруппы меди известны общие формулы 32Se и Å2Te, селенанда и Теллурида. Наиболее хорошо изученные производные серебра могут быть получены взаимодействием Селена NLN теллура (Е) с горячим раствором нитрата серебра, особенно в соответствии со схемой 4AgNOj +ЗЭ+зн, 0 = 2AG»3-fн 2э03+ 4hnoj. Черный АГ; ГП(Мп.880 ° С) n голубовато-серый Ag, Te (mp.959 ° С) устойчив на воздухе и практически не растворяется в воде.
Теллурид серебра является эндотермическим соединением (тепло, получаемое от элемента, составляет 7 ккал / моль). По) сульфиды, селениды и Теллурид серебра растворимы в сильных растворах Агноя. Растворимость увеличивается в S-Se-Te с увеличением концентрации HX. Это вызвано образованием комплекса AgjS nAgNOj состава, комплексным атомом которого является атом E. In в частности, SAgj) NOj и lTeAg»»были разделены.
Рентгеноструктурные исследования кристаллов первых нанокристаллов этих соединений показали, что катионы образовались в бесконечной цепи типа SagiSAgj с 6-координационной конфигурацией серы, а N0 располагался в пустотах между наночастицами. Тип[АГ, с) р( г-ВР нлн я).Бромиды (к AgjS и AgBr) растворены на 430°C и nodnd стабилизировано до 550°C. Второй! Когда водный раствор CuSO <фосфорной кислоты (HjPOj) нагревают до 50°C, из него медленно выделяется яркий красно-коричневый осадок. Здесь соотношение меди и водорода близко соответствует простейшей формуле CuN.
В результате реакции с 4CuI +Liaiha= L1AII4 4-4cuh из среды pnrndino-тетрагидрофурайоэфира осаждается более чистая (и безводная) гидрированная медь. Для теплоты образования элемента NS значение −5 ккал / моль равно given. In его кристаллы, rf (CuH)= 1.73 n d (CuCu)= 2.89 A(2.56 A для металлической меди).Гидрированная медь устойчива как на воздухе, так и по отношению к разбавленным кислотам, но взаимодействует с концентрированной соляной кислотой следующим образом: CuH + HCI = Na-CuCl. Нагревание (сухое состояние, превышающее 60°C. В результате влажного состояния (выше 45°C) материал разлагается на элементы. в pnrndnne кровь жидкости растворяется в красном красителе.
112) для нестабильных молекул Ен в газовой фазе найдены следующие значения ядерного расстояния (а) и энергии диссоциации (ккал / моль): 1,46 n 66 (Cu). 1.62 Н 53 (АГ), 1.52 Н 74(Ас).Интересно, что ядерное расстояние AH значительно короче, чем ядерное расстояние AgH. А энергия диссоциации гораздо больше. Это связано с очевидным увеличением сродства Au к электронам при сжатии лантана (дополнительно 2). 113) некоторые из неустойчивых донных гидридов известны как Cu * n Ag *(в скобках они разлагаются при более высокой температуре): Белый CuBH «(-12°C) и AgBH»(-30°C).Желтый CuA1H4 (-70°С) и Agaiha (-50°С), оранжевый AgGaH < (-75°С).Подобных производных золота не получают. Стабильность рассматриваемого гидрида может быть значительно улучшена комплексообразованием. Например. AgBH » * 2P (C» H)) 3 является гладким только при 133°C
114)элементы подгруппы меди не связаны непосредственно с азотом. Темно-зеленая медь NTNRN (Cu»N) является эндотермическим соединением (теплота образования от элемента составляет 18 ккал / моль), которое получают нагреванием CuO до 270 * C с помощью mnak current. It устойчив в воздухе при нормальных условиях, но разлагается разбавленными кислотами. При нагревании до более чем 300°C Cu » N разлагается на элементы.
115) нитрид серебра аналогичного состава еще более высокоэндотермичен(теплота образования нанокристаллов составляет 61 ккал / моль).Его коричневые кристаллы получают путем введения ацетона (nl спирта) в раствор аммиака AgjO. Наличие аммиачного раствора солей серебра AgjN делает его очень легким для сбора в виде черного осадка на дне емкости, который во влажном состоянии также очень склонен к разрыву.
Возможно, этот осадок также содержит N m n D silver-AgyNH. Белый (чернеющий на свету) осадок Амида серебра получают действием KNHi на раствор соли Ag * в жидком аммиаке. Как и черный имид, AgNHj очень взрывоопасен. Под действием аммиака на водную суспензию 0 ″ Au) образуется нитридное производное композиции AujN-NH. После промывки разбавленной кислотой добавьте Au3N•aq. It когда он высохнет, оба соединения взорвутся. 117) подгруппа медных элементов фосфора-Cu * P, CuPj, AgP и др. AgP3 n AuaP | — может быть получен взаимодействием элементов. Cu3P изучался лучше других (теплота образования из элемента 36 ккал / моль).
Это светло-серое вещество обладает металлической проводимостью, оно плавится только при 1022°C (разложение) и не растворяется в кислотах(сильных окислителях).Проводимость металла характеристика AujP, и CuPj и AgP полупроводники (тип hall). 118) медь и ее аналоги не связаны непосредственно с углеродом. Однако карбид является Cu. АГ * Н Ау *получена косвенным образом под действием ацетилена на раствор раствора аммиака или тиосульфата комплекс Ас * КР н аг соль. Полученные карбиды (точнее, ацетилиды)-чай красный CuiCfc Белый AgjCj n желтый Au3C) — практически нерастворимы в воде, очень сухи в сухом состоянии. Известен также ацетилид двухвалентной меди-CuSg. есть обзорная статья по acetnldam меди Н серебра
119) взаимодействие AgjCj с CSFCH в жидком аммиаке привело к образованию соединения ацетилида K [Ag (CCH)}]. это бесцветный кристалл Чувствителен к свету и влаге. Бесцветный Клау (CCH) j), близкий по своей природе, также известен. 120) для золота было получено циклопайтадиенильное производное CjH ^ Au. Желтый порошок, неустойчивый даже при нормальной температуре. 121) Cu-f * * * * нормальный потенциал реакции по схеме Cu * * составляет+0,15, и фактически, из-за его сильной зависимости от окружающей среды, пиридин смешивает равновесие в сторону Cu1, и потенциал повышается до+0,30 В. в направлении этлендиамина-Cu11 потенциал снижается до −0,35 inches.
In в первом случае Cu11 действует как окислитель, во втором случае Cu1 действует как восстановитель. (Например, NO;, SOj J стабилизирует Cu.«Радиус Cu3 задается величиной 0,80 А.* 122) теплота образования CuO из элемента составляет 37 clal / mol. In его кристалл, d (CuO)-Г, 95 A, каждый атом координирован на противоположной стороне 4, дальнейшая координация Cu плоская, О-тетраэдрическая(рис. XIII-49).
123) что касается нагрева, оксид меди очень стабилен. Разложение до Cu20 и кислорода начинается примерно при 800 ° С(при 1110 ° С оно достигает давления кислорода 1 атм).Когда давление кислорода увеличивается, CuO плавится при температуре 1335°C. In водородная атмосфера, prn 250°C легко падает и легко восстанавливается до металлов, даже если она блестит углем. 124) если имеется незначительный избыток кислорода (относительно формулы CuO), то оксид меди является полупроводником Р-типа. Составленный из расплавленного cic, NaOH 20%раствора и сжатого CuO, элемент Zn / NaOH / CuO работает по схеме Zn + CuO + 2NaOH-fH20= » NaJZn (OH)»] + Cu и генерирует электродвижущую силу 1,15. (Низкое внутреннее сопротивление.)
Порошок оксида меди и паста фосфорной кислоты служат отличным быстротвердеющим цементом для склеивания металлических или стеклянных деталей друг с другом. 125) в процессе нейтрализации кислотного раствора соли CU (OH)} выпадает в осадок вблизи рН-5.Осаждение раствора CuSO «(NH4) щелочью в присутствии SO»、 Диаграмма XIII-49. Схема координации кристаллов CuO. * Сладко» а м ^ Ухай л, Юи Успей Hamvya, I9M, М 10, 1780. Получают кристаллический гидроксид меди (PR = 2-10 «1*).Вода в таком виде начинает шептать примерно при 150°С. электролитическая диссоциация Ионов CuOH * характеризуется величиной K = 3-10 » T. 126)в концентрированном растворе избытка сильной щелочи гидроксид меди растворяется за счет образования бронзовых руд (NaHCuOj, Na, CuO и др.).
Но последний очень нестабилен, и при разбавлении раствора он распадается с выделением Cu (OH)*.Это свидетельствует о том, что кислотные свойства гидроксида меди выражены очень слабо(по грубым оценкам, K \ = 10- | b и K * — 10-u). в твердом состоянии медной руды НК были получены только некоторые производные щелочных и щелочноземельных металлов. Судя по количеству молекул в кристаллической воде, они имеют сложную структуру. Например, формула Na ^ CufOH)*] соответствует голубой натриевой медной руде, а Ba *(Cu (OH)] соответствует светло-голубой бариевой медной руде. Такая интерпретация косвенно подтверждается трудностью обезвоживания рассматриваемого соединения. 180°C.
Только при превышении 2-го-250°C 127) — под действием спиртового раствора KOH и HjOj к спиртовому раствору CuCli-2HaO, охлажденному до 50 * С, образуется черно-коричневый осадок, в котором молярное соотношение меди, активного кислорода и воды составляет 1: 1: 1.It пока не ясно, является ли это соединение пероксидным производным меди[CuO * * NZO или Cu(OH) UN]или продуктом добавления HjOj к оксиду меди (CuO HjOa).Описан аналогичный продукт, который образуется при взаимодействии основного карбоната меди с эфирным раствором HjOj или системой Cu (OH)*-HjO *-H20 при низких температурах, но его структура также не ясна.
Пероксидные производные серебра и золота не известны. 128) ИонCu (NH«) «p-квадрат tf (CuN)= 2.05 A. его константа нестабильности равна 1•I0» 11.In в дополнение к различным солям этого комплексного катиона были также выделены основания кристаллического гидрата fCu(NH3) 4l(OH) * ЗН} 0.При нагревании соли до 150-250° часть аммиака испаряется, образуя соответствующую катионную соль (Cu (NHj) aJ»*»).Последний является линейным, d (CuN) A (in (Cu (NH3) i) Br)или 1,98 A(in (Cu(NH3)a 2). в то же время образование ионов(Cu(NH») 3J«и[Cu(NH|) e].«
Некоторые из этих комплексов, например (Cu (NH3) s) S04 и[Cu (MH»)«] Gg(G_CI, Br. I) получается в твердом состоянии. Из-за образования аммиачных комплексов, при воздействии воздуха, металлическая медь постепенно растворяется в NH4OH. Раствор соли меди с добавлением аммиака был уже известен ривабиусу(!§ 1). 129) комплексы CU * * образуются также во многих других (в том числе преимущественно S или N) молекулах.
Например. Нестабильная константа ioia [Cu (H2NCHsCH * NHe)s] «равна 3-10» 11.То есть этот комплекс еще более стабилен, чем аммиак. 130) для теплоты получения галогенидов CuH из одного вещества, 128 (F), 41(C! Значение дано). При 32 (Vg) и 2 (I) ккал / моль белых кристаллов CuF *(mp 770°С) координация атомов меди 6-тяжелая, но неравномерная (1,93-4F на расстоянии a, 2,27 2F).Безводный CuCI(mp.436°C) окрашен в желтый цвет. И CuVg » — черный.
Последняя соль легко диссоциируется по схеме 2CuBr * = » * 2CuBr-} Br (при 290 ° c она уже достигла давления диссоциации 1 атм).Йодида меди (Cul) не получают. Взаимодействие Cu и G сопровождается образованием йодида меди (Cul)и одновременным выделением свободного йода по схеме 2Ci — + 4G 2Cul + Is. Эта реакция иногда используется для определения меди. 131) растворимость галоида cucl в воде составляет около 45 (F).
Для константы диссоциации 75 (CI) и 120 (Vg) г / л Ионов CuH*, 0,14(F, q-1), 0,2(CI. И-2) и 0,3 (Бр. Q » 2) показаны значения. Кристаллогидрат отделяют от раствора-синего CuFs * 2H(0.Зеленый (в присутствии адсорбированной голубой воды) КУБР} из CuCls-2HiO и коричневато-зеленый-2NgO (или 4HaO). [4 (CuCl) ■= 2.26 а]и 2 молекулы воды[d (CuO)= 2.01 а], поэтому в общем случае в октаэдрической координации меди образуется бесконечная цепь(рис. XIII-50).Обе молекулы воды расщепляются при 132°C 132) если растворить куклу в очень небольшом количестве воды, то получается раствор темно-коричневого цвета. Его разбавление сопровождается изменением цвета на зеленый сначала и синий в конце.
Хлорная медь растворяется не только в воде, но и во многих органических растворителях, как видно из представленных данных (в нормальных условиях она растворяется в миллимолях CuClj на 1 моль растворителя).): НПО CHzon C * H5OH h-CjHtOH i-C4H * OH CH «COCHj 0 (C» H5) j 103135185190 98 12 0.5 133) с соответствующих галогеноводородных кислот и их щелочных солей, КР * галогениды образуют комплексные соединения, чаще всего м(византийским]и М ^ византийским типом.
Многие из них в твердом состоянии также содержат кристаллическую воду. Их цвета различны, например: KCuF «KCuClj Kcubrj LlCuClj-2HaO CsjCuCU CsjCuBr4 CsjCuCI» * 2HjO бесцветный красный черный красный желтый черный синий зеленый Следует отметить, что растворимость бледно-голубых комплексов (NH) в воде очень низкая. jCuF• * 2HjO. 134) kcucl3 кристаллы состоят из ионов K * и димерных анионов Cu, ClJ〜и связаны друг с другом так, что координация меди добавляется к октаэдру.
Желтые кристаллы (MN ^ gcuci cuclj анионы имеют слегка искаженную квадратную структуру[2.30 при 2.30 A и 2 при 2rf (CuC1)] и дополняются окт 2 более удаленными атомами хлора соседних анионов (d (CuCI)= 2 Интересно, что в Kjcuffi с аналогичной структурой добавляются 2″CUF[CUF [CUF]] чужеродные ионы). расстояние до []) «= 1.95 a] меньше, чем 4 «правильных» FD (CUF)* = 2.08 a]. 135) комплекс CUH-no образуется при взаимодействии CuH-галогенидов с NO в CrClO на других неводных средах. Отдельно выделяют черную куклу-нет и CuBrj-NO.
In спиртовой раствор, он диссоциирует по схеме CuGa-NO * * NO * + CuI’7. CuCla-нет констант диссоциации конечно, много алкоголя и интересные: СНзОНCjHsOH -СЭН, ОН-С4Н»ОНк-С$НцОНgrlNcNON 2.Значения i0 — * 4-10 «» * МО «5 1-значения i0 — * 4-значения i0 »» 4 МТФ » Аналогично, константа диссоциации CuBr2 ″ нет » changes. In также была получена ацетониевая среда, нестабильный CuIj-NO (аналогичные производные цианида меди и родинида).
136) подобно йодиду, желтый цианид[Cu (CN) 2]и черный тиоцианат[Cu(SCN) a) двухвалентная медь/обе соли нестабильны/обе соли осаждаются при взаимодействии ионов Cu с CN ’или SCN’ ионами. Уже при нормальной температуре он постепенно разлагается (медленнее, чем культ) с образованием соответствующего производного 1-валентной меди. Когда Cu (CN) a нагревается 2Cu (CN) a-2CuCN-f (CN) и быстро затухает, схема может быть использована для получения Cyan (это фактически делается постепенно), и раствор KCN добавляется к раствору cuso концентрированного<).
137)в отличие от самого цианида меди, некоторые из его комплексных производных являются stable. So под действием избытка соли KCN Cu1 * образуется соль состава Ka (Cu(CN)]], которая может быть выделена в виде бесцветного кристалла, который легко растворяется в воде. РНС. XSh-50. Схема координации кристаллов Cucla * 2hjo. О-КР О-Ди© — Н2О Медь имеет высокое координационное число, фиолетовый комплекс cyanide. An интересным производным как одновалентной, так и двухвалентной меди является[Cu(NH«) sUCu (CN) 4].Это вещество представляет собой зеленый кристалл, имеет металлический блеск, устойчиво в воздухе и почти не растворяется в воде.
При разложении Cu (CN) a в нормальных условиях образуются комплексы состава CUJ {CU (CN) 4]•5Н20. Для константы диссоциации Иона CuSCN задается значение 2•10 «.Родановый медный комплекс не был получен, но был получен с ацетонитрильным раствором oii. Четко сформирована. 138) слабо растворимый в воде(0,08 г / л) коричневый азид Cu (N») получают путем замещающего разложения Cu (NO»h и NaN.он очень взрывоопасен(он взрывается в 6 раз больше, чем азид свинца).
Кундж нестабилен. Из-за избытка растворимого азида образуются комплексные ионы Cu (N3)$, Cu(N$) 4 ’и даже Cu(N»)^», которые легко разлагаются водой за счет осаждения Cu(Ns) j. 139) двухвалентный нитрат меди интересен главным образом своей летучестью. Металл меди реагирует со смесью N204 и этилацетата. Состав Cu (nos) образует кристаллический комплекс•Nj04, легко разъединяет N204(уже при 85°C давление диссоциации составляет 1 атм). Сильно разгерметизированный остаточный нитрат меди при 150-200°с возгоняется и конденсируется на низкотемпературных поверхностях в виде сине-зеленого кристаллического вещества (Мп.226°с). Давление паров КР (без*) 2 составляет 1 мм рт. Искусство. При 160°C теплота сублимации составляет 16 ккал / моль.
Пара Cu (NO * h Мономер, кроме того, молекула имеет плоскую структуру с 4 атомами кислорода (по 2 от каждой нитратной группы, is & O), скорректированными атомами меди)= 2.00 A. ZOCuO =70е. ZONO = 120е. д (Цунь)= » 2.30 л). 140) растворимость Cu (NO$) j в воде очень высока (рисунок XII1-33).Синий гексагидрат свободен от раствора ниже 26°C, и синий тригидрат также находится при этой температуре (mp. И5°С).Когда последний растворяется в высокотемпературном концентрированном HNO *и жидкость охлаждается, получается почти бесцветная безводная соль.
Хорошо растворим во многих полярных органических жидкостях, при нагревании разлагается на CuO, NO * n 0|. (Иногда используется для получения S & O). 141) безводный перхлорат меди со свойствами, близкими к нитратам, может быть получен взаимодействием CuO с N0C104 при 200°C в вакууме. Oi представляет собой желто-зеленый кристалл, термостабильный до 130°C, Летучий в вакууме, хорошо растворимый в воде, но также растворимый во многих полярных органических жидкостях.
Синий кристаллогидрат Cu (C104) j•6HjO отделяют от водного раствора solution. It также известно, что йодид меди в составе CusH10 *практически не растворяется в воде. 142) двухвалентный хлорат меди и бромат выделяют из кислой соды геогидроксикислоты. Очень растворим в воде, йодат слабо растворим(1,3 г / л).он выделяется в виде моногидрата и теряет кристаллическую воду примерно при 240 * С. Безводная соль разлагается до CUO только при температуре около 290°C, 12, Oa, но хлорат разлагается медленно, даже при нормальной температуре, быстро при 100 * 0. 143) получен простой нитрит двухвалентной меди, но известны некоторые его комплексные производные.
Из них черный зеленый K » Cu (NOj)$ установлено, что наибольший интерес представляет наличие связей Cu-N, где координационное число меди равно 5. K2Pb [Cu (N02)] в комплексе длина таких связей Cu-N составляет 2,03 А. 144) вследствие взаимодействия Cu «и CO*, нерастворимый основной карбонат, который находится в природе, осаждается в виде очень красивого минерала-зеленого малахита[CuCO, Cu (OH)] и синего азурита(2 CuCos•Cu (OH) 2 |.Двуокись углерода получали при температуре 180°С при давлении 450 бар двуокиси углерода. Обыкновенный карбонат меди-Кукое. Некоторые сложные карбонаты, такие как синий кг (<^и (СОз) 2] — зн20, также являются known.
In большой избыток углекислого газа. 145) сульфат меди является общим исходным материалом для получения остальных соединений. Кристаллический гидрат CuS04-5H, 0 (купорос) использован сразу для борьбы с вредителями в земледелии, минеральных красках, медицинах, etc. It также сообщалось, что добавление в корм для свиней увеличивает массу тела.
Технически сульфат меди получают путем очистки воздуха и обработки медных отходов металлов серной кислотой. В сухом воздухе сульфат меди частично разрушается и поступает в кристаллический гидрат CuS04-3Ha0 (см. XI§ 3).Дальнейшее нагревание приводит к нагреванию Далее, при резке водой сначала образуется CuS04-Ha0, затем безводный сульфат меди (выше 258 ° С).Его пиролиз становится заметным при 650°C и above. It является бесцветным, но притягивает влагу в воздух и синеет за счет образования кристаллогидратов. по мере того как растворимость в воде f | t, CuS04 увеличивает」 50/00/50 200250 ZOOH температура проходит через плоский максимум Ряса. XIII-5J. растворимость CuS04 XSh ’ 51> — ®P™? ™ Умеренно соль И / 1001 HjO).Диссоциация (к-5 «10») и заметно гидролиз Вая (15 ° С в 0,1 м растворе, степень гидролиза 0,05%, рН = 4,2).
Благодаря щелочному металлу и сульфату аммония CuSO образует комплексообразующую соль, большая часть которой соответствует составу MjJCu (S04) j]•6HjO. 145) двухвалентная медь Циануксусная кислота-Cu (CH3COO) j•Н20-твердое состояние, dimer. As как видно из рисунка Хш-52, каждый атом меди имеет 4 атома кислорода[d (CuO)= 1,97 а) из 2 ацетатных групп, 1 молекулу воды[d (CuO)■ = 2,20, еще 1 атом меди (rf (CuCu)= 2,65 а). нагревая кристаллогидрат в вакууме при 100 ° С, можно получить уксусный ангидрид зеленого цвета.
Эта соль растворяется только в воде (25 г! при нормальных условиях.)L), но я растворился во многих органических жидкостях. Cu (CHECOb характеризуется значением ACi = 0.12 и ACj 4 * 10«.«Комплексной интенсивной терапии (CHjCOO) К) и (КР(СН, СОО)» Р неустойчива. 147) оксалат меди бледно-голубого цвета образует моногидрат, который почти нерастворим в воде-CuCj04•HjO. In ИА-гревайни в атмосфере азота, он разлагается на металлы. Многие сложные оксалаты меди также известны как RMS-XI1-52. Структура Dkarmay-главным образом тип M, [Cu(C, 04) h)•2H, 0. Тур Acetvta МВА » 148) черный двухвалентный сульфид меди (CuS) образуется, как только ионы Cu и S взаимодействуют в слабокислой среде.
Для продукта его растворимости значение PR задается как » = 8-10 -«. в воде и разбавленных кислотах сульфиды практически нерастворимы.(NH4) слабо растворим в jS и значительно растворим в растворе полисульфидов щелочных металлов и аммония sulfide. It окисляется на воздухе с образованием медного купороса. 149) сульфид меди, полученный сухим способом (теплота, выделяемая из элемента, составляет 12 моль / моль), очень хорошо проводит ток (менее 1,66 * к делает его сверхпроводником).
Рентгеноструктурные исследования его кристаллов выявили совершенно особую и сложную структуру.3 мин 1 атома меди находится в центре треугольника на атом серы (РФ (КС) 2.19 а], 2/3 находится в центре тетраэдра (РФ(КС) 2.32 а | ;кроме того, 3 мин 2 на атом серы является Си Групп (VIII в§ 1 дополнительные 35), как и в случае с пиритом).В этой связи, структура КС кристалла может быть более точно представлены формулой CuJCuJ ^ С.) Ср около 400°С, разложение сульфида по схеме 2CuS- = CujS + с (давление диссоциации при 450°С составляет 80 мм рт. кар. Он может beCopper КР * ы»(п = 3 ^ 6) полисульфидные производные и селен Кьюз(тепло Элементы от 10 ккал / моль).
За счет взаимодействия CuS04 с насыщенным раствором серы полисульфида получается достаточно стабильная красно-Тиоевая соль типа MCusS4(M — NH4, K, Rb, Cs).Наиболее нерастворимой из них является соль цезия. 150) в отличие от серебряной меди, двухвалентное состояние нехарактерно. Черный оксид состава АГО образуется под действием озона на серебро (Ag + Oj — «АГО + Oj«).2AgNO «4-KiSjOe4-4KOH» = 2AgO | + 2KjS04 + 2KNOj + 2HjO. Структурное исследование его кристалла показало, что половина атомов серебра связана с 2 атомами кислорода в линейной группе{d (AgO)= 2.18 A], а другая половина находится в нескольких искривленных квадратах из 4 атомов кислорода[ d(AgO) −2.01 и 2.05 A].Следовательно, это окись AgnO или OAg-AgO, но как AgIAg, I0 |.
Косвенно это подтверждается следующей реакцией: 2AgaOa-f-6KOH + 4KJO4 = 2K ^ Hj Ag(I06) 2l + Ag20 + H, 0. 151) примерно до 100°C AgjOj стабилен (практически нерастворим) как в своем индивидуальном состоянии, так и при кипячении в воде. water. In разбавленный HaS04, он растворяется при выделении кислорода, а в сильных кислотах становится коричневым (HNOj).Растворы, содержащие зеленовато-черный (H2S04) или розовый (hc104 60% доля).Соответствующие соли двухвалентного серебра четко различимы. Эти растворы характеризуются сильно выраженными антиокислительными свойствами и являются нестабильными-они медленно разлагаются с выделением кислорода и образованием солей Аг1.В отличие от этого, за счет действия озона в кислой среде, АГ соли окисляются и становятся АГН солей.
Предполагается, что процесс протекает в 2 стадии согласно схеме Ag4 +О»-* * * * +Оа (медленная реакция) и назад* + АГ*- f2н * ж * 2agl * +2020 (быстрая реакция). Окислительный потенциал по схеме Ag11 +ea * Ag1 имеет значение+ 1,92 в (кислотная среда) или+0,60 в (щелочная среда). 152) Ag » стабилизация солей достигается комплексообразованием с некоторыми азотсодержащими органическими соединениями(пиридином, дипиридицилом и др.).Типичным примером является производное пиридина-[Ag (NC $ Hs) 4] (NOj) J. Это красно-оранжевое кристаллическое вещество, которое стабильно само по себе и в растворе, но характеризуется очень выраженными окислительными свойствами (2-валентный марганец окисляется до минимума). ジピリジル誘導体-lAgD. py может использоваться в качестве числа 6.
153) из простых солей двухвалентного серебра хорошо изучен только AgF2.Фторсеребро представляет собой темно-коричневое (бесцветное в чистом виде) вещество, которое плавится при температуре около 690°C и получается под действием фтора и мелкодисперсного Ag (или AgCl).Теплота образования от элемента составляет 83 ккал / моль. Вода AgFj разлагается, как только AgF, HF и кислород (включая значительное количество озона) formed.
In помимо окисления, он также обладает сильными фторирующими свойствами (например, вы можете конвертировать CC14 в CF4). Известен комплекс бурых Магф, полученный из AgFj(M-Cs, Rb. К).Комплексы общего типа MuAgF4 и ряда двухвалентных металлов (Ca, Sr. It также можно использовать командную строку. Для плоских ионов[AgF4] ’ — d(AgF)* = 2.05 a дано. 154) описаны также коричневые оттенки Ag (VOj) j, AgCO|, AgSiO, AgCr04. Слияние AgjOj и безводного Н3Р04 привело к получению бесцветного Ags (P04) j, который легко растворим в воде.
Для всех этих веществ пока известен только химический состав, поэтому действительное валентное состояние ионов серебра неизвестно. Напротив, синий отток солей типа Ag (3Fi) (E_5p. Pb, 2r), судя по магнитным данным, фактически является производным двухвалентного серебра. При хранении в воздухе он разлагается. 155) важное место в химии двухвалентного серебра занимает соединение общего типа соединения Ag (Agj04) jX(X NOj, СУ4). Ф. ХСО *.Самый известный уже давно. Первый элемент из этих элементов, который часто описывается в общей формуле AgjNOif. It образуется платиновым анодом при электролизе раствора AgNO » (на катоде осаждается металлическое серебро).
при низкой плотности тока Ag7NOn выделяется в виде почти правильного черного металлического октаэдра. Это соединение также может быть получено путем реакции назад и разбавления HNOj. Согласно рентгеноструктурным исследованиям, Ag, (Ag5, AgJ, 0e) должен быть сформулирован как N03.
При обработке горячей водой oio разлагается по схеме AgrNOu = AgNOj-f 6AgO-fO. 156) используя сильные окислительные свойства AgO, AgO 4-Zn-f 2 krh + — f NaO * * Ag 4-Kj {Zn (OH) 4], мы разработали батареи AgO | KOH | Zn для работы по схеме. Электролит представляет собой очень небольшое количество крепкого раствора кон (плотность 1,40 г / см3). стоит отметить, что такая батарея плотно собрана,-50〜4〜80 смогите быть использовано на температуре ° С. Его рабочее напряжение составляет около 1,5 В и очень постоянно во времени. Пр — та же емкость, в 3 раза меньше свинца, в 5 раз легче.
157) согласно опубликованным данным, при нагревании золотого порошка до 140°С в потоке сухого хлора образуется темно-красное соединение, соответствующее экспериментальной формуле AuCl, формально эквивалентное двухвалентному золоту, но на самом деле все они являются явно комплексными соединениями, содержащими одно и трехвалентное золото: AuI(Aul, lCU).
Реальная проблема существования рассматриваемого производного до сих пор неизвестна, поскольку предметом AuCl — AuCI3 является не соединение, а эвтектика (она может быть 250°C), на что указывает фраза»попытка приобрести AuCl не удалась«, например, Au’lau111©). 158) для теплоты образования Aua03 из элемента приведено значение 1 ккал / моль. Продукт растворимости Au (OH) оценивается как MO-4.Для контовой кислоты Косвенно при диссоциации этого гидроксида(по растворимости щелочи) были найдены следующие значения: K {«=2-10»»*, / C «= 4• / C»= * = 5 * 10〜»。
При воздействии фосфорного ангидрида Di (OH)$становится A & O (OH). 159) соль кислоты золота металла шелка вмеру солубле в воде, щелочной земле(мг1 и Ти), большей части из остатков очень РНС. XIII53. lC1£$в случае подкисления 0 Na [Au (OH) 4]растворов с малыми молекулами осаждение Au (OH) 3 начинается примерно при рН 7. 4-нет. Производные Au1″и многие другие Анионы (NO, SOJ и др.) известны только в виде комплексных соединений. Последнее пользовательское решение содержит очень мало Au* 160) теплота образования AuCl3 и AuBr3 из элементов составляет 28 ккал / моль, respectively. In дело в том, что он соответствует экспрессии димера молекулы AuC13(и Темио-корня AuBr3 и темно-зеленого Aul3), то есть AiG.
Структурно он напоминает молекулу a1agv (рис. XI-21), но все их атомы находятся в одной плоскости. Структурные параметры молекулы Au » C1b обозначены радаром. XII1-53.Растворимость этой соли в воде очень высока (680 г / л при нормальных условиях). Все 3 галогенида характеризуются легким распадом при нагревании по схеме AuG3 ss AuG 4-G2. Для AuC13 он начинается примерно при 150°C, а для AuCr3-около 100 ° C. йодное золото, почти нерастворимое в воде, неустойчиво даже при комнатной температуре.
Под избыточным давлением хлора AuCl3 плавится при 288X. 161) с соответствующей гидрогалогенной кислотой и ее солями Ион галогена Au5 * легко образует комплекс compounds. An примером может служить калиевый ореол: желтый K [AuCI<], красный K(AuBr<] и черный KIAuIJ. Ион[AufJ * d. (AuCl) −2.28 A. Для соединения AIH force-site значения составляют 2.35 (CI), 1.96(Br) и 0.7(I). [AuCl4]константа нестабильности ионов составляет 5-10″». было высказано предположение, что хлорат серебра (AgAuCI4) часто появлялся в качестве»философского камня»алхимиков. 162) координационное число Аоми в галогенидном комплексе может увеличиваться до 6.
So включение [AuBr4] «желтеет из-за образования красного раствора корицы-ионов в нитробензоле или нитрометане в присутствии избытка Br»(AuBrJ’.в структуре CsjAgAuCI*»», состоящей из катионов Cs * и анионов AgAuCl ^ JJj1, октаэдры AuCU соединяются друг с другом атомами серебра по схеме-Cl (AuCI4) ClAgCI (Auciu) CIAg. 163) только около 400°с взаимодействуют с фтором, что позволяет отделить продукты реакции в чистом виде form.
By нагревая золотой порошок с BrFj и затем перегоняя избыток последнего в вакууме, получают оранжевый 3-валентный фторид. Для тепла, полученного от элемента, приведено значение 83 ккал / моль. Должный к своей кристаллической структуре, ОИ цеп-подобный полимер сформированный квадратом фтора atoms. In в каждом таком квадрате есть атом золота, который более тесно связан двумя атомами фтора[d (AuF)= 2.04 A], чем другой[D (AuF)= 1.91 A], который сшит. 184) AuF * вода полностью гидролизуется. Также при использовании BrFj образуются двойные соединения AuBrF®(расчетная структура IBrFj.
Эти соли кислоты фторхинолонов буйвола растворяют легко в воде. Ioi (AuF » j » имеет квадратную структуру. 165) под воздействием KCN раствор AuCU становится бесцветным за счет образования комплексных ионов (AutCN)!! 7 (также в щелочных средах [Au (CN) s] » и (Au (CN)»]«’).Испарение раствора сопровождается выделением кристаллогидратов kiaufcnjjj-HjO. При нагревании до 200°C происходит обезвоживание, а при дальнейшем нагревании цианид расщепляется с образованием K [Au (CN) j]. .).
166) Рентгеноструктурное исследование вышеуказанного кристаллогидрата показало. Обычная квадратная форма производного Аиона[cd(AuC)-«-1.97 A», но угол атома углерода равен 180°(нормальный цианид), а не 140°.Если эти результаты верны, то отклонение координат Au-C » bN от таких линий очень интересно.
Для постоянной силы сцепления приведены значения k (AuC)= 3,0 и k (CN)= 17,4,а для нестабильного цистита ioia [Au(CM) 0 ’- значение 1J0-M. 167) под действием раствора HCN и хлорида золота, свободный сульфат золота может быть получен в виде бесцветного кристаллогидрата HlAu (CN) 4l-3H2O. эта реакция интересна как хороший пример полной переработки из-за комплексообразования направления процесса, которое обычно observed. In в этом случае очень слабая синильная кислота выделяет из своих солей очень сильную соляную кислоту. Подбио HfAuClJ, сульфат золота легко растворим в воде, спирте и эфире.
При прокаливании остается чистое золото. 168) при воздействии избытка AuCU на раствор KNCS 3-валентный тиоцианат золота осаждается в виде красноватого осадка. Красная комплексная кислота, полученная из нее, H [Au (SCN) 4] −2HjO, известны многие соли, например, оранжево-красная K [Au(SCN) 4].Нестабильная константа ioia [Au (SCN) 4r равна L0 ″ 4*. 169) нитраты и сульфаты трехвалентного золота присутствуют только в концентрированных растворах соответствующих кислот.
При разбавлении водой гидролиз происходит за счет осаждения Au(OH).Золото в таком растворе явно содержится в сложных анионах. Это связано с тем, что раствор Au (OH) j в концентрированном HNO *медленно испаряется и、 Соединение кислота желтый кристаллогидрат H (Au (NOj) 4] −3HjO. In наличие соответствующих солей щелочных металлов, в комплексе и солей серной кислоты, например, желтых солей калия-K [Au (NO») » l и K [ Au (SO , бледно-желтая соль состава KjH[Au (N03) el. Квадрат non (AufNOj)*) » анионы нитрата myodentative с rf (AuO).
170)в отличие от сульфатов выделяют селен и трехвалентный т. Его мелкие желтые кристаллы могут быть получены из раствора Au в безводной селеновой кислоте, нагретой выше 200°С. реакция образования этого соединения протекает по формуле: 2Au + 6HiSe04-Aui(SeO») » + 3SeOt + 6H, 0. 171) при действии KiSO *(в присутствии KOH) и HAuCl -, получается бесцветный сульфитный комплекс K * [Au (SOj) 4] −5HjO из 3-валентного золота. Интересным является соединение кислотной соли (HHAuf10e)], известное многим cations.
As как правило, они слегка растворяются в воде. Наиболее важным исключением является NaeH [Au (JuV * l6HtO. 172) за счет действия HsS на 3-валентные соединения в водных средах образуется черно-коричневый осадок AujSj (по схеме 6AuCU + 9H»S + + 4HjO■=«4AujSj-f HjS04 + 24HCl1). однако если обработать безводный эфирный раствор AuCU сероводородом, то можно получить 3-валентный сульфид золота (AusS*). Когда элемент распада нагревается выше 200 ° C, он становится черным порошком. 173) взаимодействие AujS с «раствором NaaS включает образование растворимого тиоцианата: AuiS» — f NasS * * 2NaAuSs.
Последний был выделен в виде бесцветного кристаллогидрата NaAuSi-4H20.Этот тнауаурат обозначается водой: 2NaAuSj +НзО * * AUJS » / + Nash + NaOH. Очевидно, он также имеет тенденцию к разложению по схеме^ NaAuS, — NaAuS +S. желтый полисульфидный состав NH Au AuSs был плохо растворим в воде. 174) при воздействии аммиака на 3-валентные соединения золота образуется грязно-желтый осадок различного состава, который в сухом состоянии очень взрывоопасен («взрывчатое» золото).в присутствии избытка NH4Cl образуется взрывоопасный ангиогенный осадок (NH*) aAuCI.
Наконец, в присутствии избытка NH4NO»образуется бесцветный комплексный катион (Au (LF)«)〜наряду с рядом солей, отличных от азотной кислоты. 175) относительно мало исследований производных трехвалентного серебра и меди. Для перехода от Ag111 +к * * Ag11 в щелочной среде приведено значение потенциала от-f до 0,74 В. Промежуточный продукт Ad * «по схеме S20» + Ag ’2SO * 4-Ag **может отвечать за каталитическую активность
Ag при окислении различных веществ персульфатами (VIII§ 1 дополнительного IZ). 176) оксиды AgjOj в отдельных состояниях не являются assigned. In в частности, при прохождении озона через кислый раствор AgNO образуются осадки, близкие к этому составу. Наиболее чистый AgiO *(содержащий примеси F -) был получен анодным окислением серебра при электролизе сильного раствора AgF. *И P. и остаток устройства содержал строку Ag, 0, n назад.
177) фторид трехвалентного серебра образуется не непосредственно между элементами, а за счет фторирования смеси MCI + AgCl при повышенных температурах, очень чувствительной к влаге комплексной соли типа magfa (M: K, Cs) желтого цвета. Взаимодействие с жидким HF происходит по формуле В Магф,+ HF-M * + HF-4-AgF, n, очень неустойчивый фторид серебра осаждается в виде красновато-коричневого порошка. Желтый BaAgF также известен(при нагревании до 200°C или более в вакууме часть фтора теряется для получения черного BaAgF*).Конюшня до 450 * C).Отчет о поступлениях CsjK [Agfa] (путем прямого фторирования смеси 2C $ C1 KCI + AgNO).
В случае Ag111 очень характерны кислотные соли комплексов С Остео-йодом и ортотеруровой кислотой. Например, коричневый K «H [Ag (IO») a] — IOH3O N бледно-желтый Na7HrfAg (TeOe) a] — 14НаО. Существует обзорная статья о высокой степени окисления серебра. 178) получают оксид трехвалентной меди (CuaOj) и соответствующий гидроксид. Купраты типа M’cioa или mp (CuO>)*производятся из последних и известны для щелочных (Na-Cs) и щелочноземельных металлов.
Популярным способом их формирования является переработка Cu (OH).в условиях высокой щелочности перерабатывается избыток гипохлорита или брома. Например, реакция протекает по следующему уравнению: 2 Cu(OH) a + + Ba(OH) s4-NaOCI = » Ba (CuOa) al + NaCl +ЗНаО. Осадок солей медной кислоты содержит кристаллическую воду, которая имеет различные оттенки красного цвета.
Наиболее стабильной является соль бария, и Накуоа разлагается уже при комнатной температуре в течение 8-10 дней. Безводные соли щелочных металлов медной кислоты, полученные сухим способом (нагревание смеси CuO + M2Oj до 400-600°C в кислородной атмосфере), имеют серо-черный или серо-синий цвет.
179) фторид трехвалентной меди неизвестен, при нагревании смеси KCl и CuCl в атмосфере фтора были получены комплексы kjfcuf * бледно-зеленого цвета. Разложите в воде. Добавьте раствор щелочи NaOCl к раствору CuCla, затем раствор подкисления NaaHsIOc или NaaH TeOe, Na7 (Cu (I04)a] — 16Ha0 и Na9(Cu(Te04) aJ 20H20.Водорастворимый Ион меди[Cu (Yu) aH〜расположен в центре квадрата из 2 х атомов кислорода (d (CuO) −1.93 A), образованного краями октаэдра[10$].Подобный тип кислотной соли также известен в большом количестве. 。
180) интересно, что промежуточные соединения между Ag и конусами щелочных металлов (в основном K и Rb) представляют собой одиночные Ионы Талита. Действительно. По некоторым характеристикам TI * тесно примыкает к Ag.И для многих других, к щелочному металлу ions. So, как и последний гидроксид, Тие очень растворим в воде и является сильным основанием.
Его карбонат (TlaCOj) также очень растворим и похож по свойствам на соду. Ионы T1 в водном растворе не склонны к комплексообразованию с аммиаком. Многие его соли (TltSO .он кристаллизуется изоморфно с соответствующими солями K и Rb.Напротив, многие другие соли T1 \аналогичны соответствующим показаниям солей Ag.Например, очень хорошо сходство галогенидов обоих элементов, их сульфидов и так далее.
Смотрите также:
| Первая группа периодической системы | Поляризация ионов |
| Щелочные металлы | Семейство железа |
