Оглавление:























Щелочные металлы
- Щелочные металлы. Название щелочного металла, которое применяется к элементам серии Li-Cs, связано с тем, что его гидроксид является сильной щелочью. Натрий и калий являются наиболее распространенными элементами, составляя 2,0 и 1,1% от общего числа атомов в земной коре, соответственно. Содержание лития (0,02%), рубидия (0,004%) и цезия (0,00009%) уже значительно меньше, а во Франции ничтожно мало.
- В природе встречаются только соединения щелочных металлов. Важнейший из отдельных минералов натрия-поваренная соль (NaCl), которая входит в состав морской воды и образует огромные залежи каменной соли под отдельными слоями земной поверхности (СССР-Соликамск, Артемовск, иреск и др.).Верхний слой таких отложений может содержать скопления солей калия в виде таких слоев, как Сильвинит (mKCUnNaCl), карналит (KC1•MgCl2•6HjO), которые будут являться основным источником соединений этого элемента.
Натрий и калий являются гомеостатическими компонентами многих силикатов. Людмила Фирмаль
Из промышленно значимых природных скоплений калийных солей известны лишь немногие. Наиболее важным из них является соликамское месторождение. О литии известно очень много минералов, но их накопление происходит редко. Рубидий и цезий встречаются почти исключительно в виде примесей к калию. Следы Франции всегда находят в урановой руде. Соединения натрия необходимы для жизни.
Достаточно вспомнить, что как минимум 1 человек потребляет в среднем 5 кг NaCl в год. Точно так же растению нужен калий salts. In в связи с этим около 90% всех добываемых калийных соединений используется для удобрения почвы. Остальные 10% используются в промышленности, наряду с огромным количеством различного натрия compounds. So до сих пор только относительно небольшой диапазон был использован для производных лития, и он очень ограничен.
В свободном состоянии щелочные металлы могут быть отделены электролизом расплавленной хлоридной соли. Основное практическое значение имеет натрий, годовой объем производства которого в мире составляет более 20 млн. тонн. В отсутствие воздуха литий и его аналоги являются веществами серебристо-белого цвета (за исключением желтоватого цезия) и имеют несколько более сильный металлический блеск.
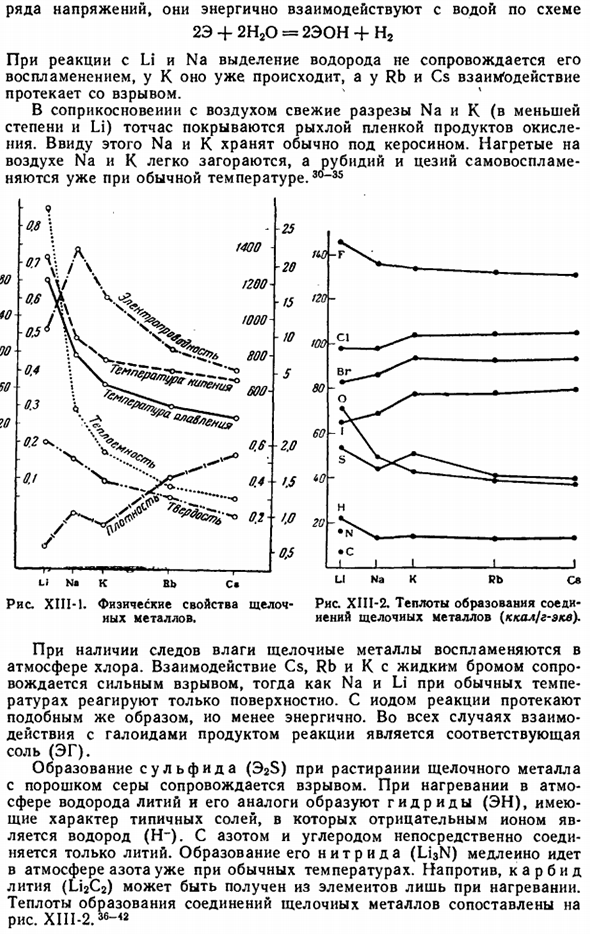
Все щелочные металлы характеризуются низкой плотностью, низкой твердостью, низкой температурой плавления и низкой температурой кипения, а также хорошей проводимостью. Наиболее важные константы из них сравниваются в следующем резюме. Ли на в РБ КС 0.97 0.86 1.53 1.87 Твердость (Алмаз= 10)…… … 0.6 0.5 0.4 0.3 0.2 Теплоемкость (Н201)……. 。 。 0.84 0.29 0.17 0.08 0.05 Электропроводность (Hg-1)…. 。 。Это 21 14 8 5 Температура Плавления,°C. 。 。 … 180 98 63 99 2 *
Температура кипения,°С….. … 1360 900 776 686 670 Ход постоянной смены рядов l-i-Cs можно видеть из рисунка. XIII-1. Франция в стихийном состоянии не бывает половинчатой. Его химические свойства очень похожи на рубидий и цезий. Из-за низкой плотности Li, Na и K плавают на воде(также В Li-керосине).Щелочной металл легко режется ногтем, а самый мягкий цезий не превышает твердости воска.
Несветящееся пламя газовых горелок, щелочные металлы и их летучие соединения окрашены в характерный цвет «наиболее интенсивным является ярко-желтый цвет, присущий натрию». С химической стороны литий и его аналоги являются исключительно реакционноспособными металлами (кроме того, активность в направлении от Li к Cs обычно повышена).во всех его соединениях щелочные металлы моновалентны.
Позиция слева Ряд напряжений, они активно взаимодействуют с водой по схеме 2E-f 2H20 = 2EON-f H2 В реакции с Li и Na развитие водорода не сопровождается его воспламенением, оно происходит уже в K, а в Rb и Cs взаимодействие протекает со взрывом. При контакте с воздухом свежие части Na и K (в меньшей степени Li) немедленно покрываются рыхлой мембраной продукта окисления. По этой причине, Na и K, как правило, хранят под керосином. Нагретый Рисунок XIII-1.
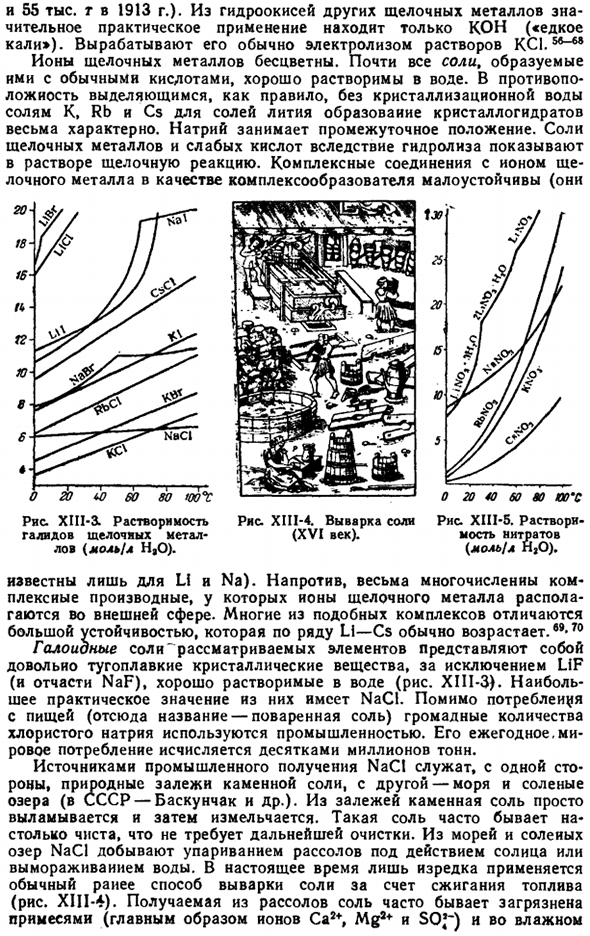
Физические свойства щелочи-рисунок XIII-2.Теплота образования соединений металлов. Щелочной металл иен (ккал / г-экв). Присутствие следовых количеств воды Вызывает воспламенение щелочных металлов в атмосфере хлора. Взаимодействие жидкого брома с Cs, Rb и K сопровождается сильным взрывом, но при нормальной температуре Na и Li реагируют лишь поверхностно. Когда используется йод, реакция протекает аналогично, но энергия decreases.
In во всех случаях взаимодействия с галогенами продуктом реакции является соответствующая соль (например). Взрыв происходит, когда сульфиды(32S) образуются при измельчении щелочных металлов, содержащих порошки серы. При нагревании в атмосфере водорода литий и его аналоги образуют гидриды (EN), которые имеют характеристику типичной соли, в которой водород (H») является отрицательным ионом.
Только литий связывает сразу с азотом и carbon. In в отличие от азота даже при комнатной температуре, карбонизация лития (Li2C2) получается из элементов только при нагревании тепла, выделяемого соединением щелочного металла, сравнивается на рисунке XII1-2. При сгорании щелочного металла с избытком кислорода образуются следующие по составу и цвету соединения: Li20 Na202 K02 Rb02 Cs02 Белый, белый, желтый, желтый.
Из всех этих веществ только L12O является обычным оксидом, а остальное-перекисью. Фактическая польза главным образом найдена в перекиси натрия (Na202).Технически он получается окислением металлического натрия атомизацией при 350°С. 2Na — > −02 = Na202 + 122 ккал Полученный продукт обычно представляет собой желтый порошок или зерно.
Взаимодействие Na202 с водой сопровождается гидролизом. Na202 + 2H20 ^ 2Na0H + H202 + 34 ккал Использование пероксида натрия для отбеливания различных материалов основано на выделении Н2О2 в этой реакции. Взаимодействие диоксида углерода с Na202 по схеме 2Na202 +2С02= 2Na2C03 + 02 + 111 ккал Изолирующие противогазы и служат основой для использования перекиси натрия в качестве источника кислорода на подводных лодках.
Поскольку перекись натрия очень бурно реагирует с веществом, которое бурно окисляется, взрыв может произойти даже при простом контакте. 4а-5С Обычные оксиды щелочных металлов (за исключением Li20) доступны только косвенно. Это следующие цветные твердые тела: U20 Na20 K20 Rb20 CszO Белый, белый, белый, желтый, желтый. Оксид лития гидратируется относительно медленно.
Напротив, оксиды остальных щелочных металлов очень бурно реагируют с водой. Взаимодействие протекает по схеме E20H20=2ЭОН, с большим тепловыделением. Гидроксид щелочного металла (ZON) является бесцветным, очень гигроскопичным веществом, которое разъедает большинство материалов, контактирующих с ним. Поэтому те, которые иногда используются в реальных названиях, являются едкой щелочью.
Все они относительно растворимы и улетучиваются без разложения (за исключением водорастворимого LiOH). В воде гидроксиды щелочных металлов очень растворимы (хуже других-LiOH) и почти полностью диссоциируют на e ’и OH’ — ионы. Эта диссоциация больше, чем у всех других металлов, поэтому едкая щелочь является самым сильным основанием. Гидроксид натрия (также называемый гидроксидом натрия, каустической содой) потребляется во многих отраслях промышленности.
Ежегодное производство в мире оценивается в несколько миллионов тонн, большая часть которых добывается электролизом раствора NaCl. Реже используется метаболический распад гашеной соды. Na2C03 + Ca (OH) j = CaCO3 | + 2NaOH Эта реакция использовалась в Древнем Египте. Производство NaOH в СССР в 1972 году составило 1899 тыс. тонн(против 1940 года 191 тыс. тонн) 1913: 55 000 телевизоров).Из гидроксидов других щелочных металлов практическое значение имеет только кон («гидроксид калия«).
Обычно ККИ. Произведенный электролизом решения 5б-6в, ионы щелочного металла бесцветны. Почти все соли, которые образуются с обычными кислотами, легко растворяются в воде. water. As как правило, образование кристаллогидратов очень характерно для солей лития, в отличие от солей K, Rb и Cs, которые выделяются без кристаллической воды. Натрий является промежуточным продуктом. Щелочной металл гидролизом и соль слабой кислоты показывают щелочную реакцию в растворе.
Комплексные соединения, содержащие ионы щелочных металлов в качестве комплексообразователей, нестабильны (они являются Рисунок XIII-3.Растворимость рисунок XIIM. Рисунок XIII-5, где кипит соль. Раствор галогенида щелочного металла (XVI век).Нитраты Рыбалка (моль / л ч, 0). (мол! л h, 0). Он известен только в Ли и на).Напротив, существует довольно много сложных производных, в которых ионы щелочных металлов находятся в экзосфере. Многие из этих комплексов очень стабильны и обычно увеличиваются в диапазоне Li-Cs.
Галогенидная соль рассматриваемого элемента представляет собой кристаллическое вещество, которое является довольно тугоплавким, за исключением LiF (и некоторых NaF), которые очень растворимы в воде (рис. XIII-3).Большое количество хлорида натрия(соли) используется в промышленности, и его мировое годовое потребление составляет десятки миллионов тонн. Источником промышленного производства NaCl является приток месторождений каменной соли с одной стороны, а также моря и соленых озер (советское, Баскунчак и др.) с другой стороны.
Каменная соль легко удаляется из осадка, а затем измельчается. Такие соли часто бывают очень чистыми, поэтому их не нужно дополнительно очищать. NaCl получают из морских и соленых озер путем испарения рассола под воздействием соли или замораживания воды. В настоящее время редко используются только ранее применявшиеся способы сжигания топлива и кипячения соли (рис. XIII-4).Соли, полученные из соленой воды, часто загрязняются примесями (в основном Ca2+, Mg2 *и SOJ-ионами) и смачиваются Он распадается на air. In напротив, чистая соль негигроскопична.
Из других галогенидов щелочных металлов большое значение имеет KC1, являющийся основой калийных удобрений. Нитраты щелочных металлов относительно растворимы и очень хорошо растворимы в воде (рисунок XSh-5).Из них практически значимыми являются почти исключительно NaN03 и KNO3.Обе соли в основном используются в качестве минералов? Удобрение. Нитрат калия также используется в производстве черного порошка (NaN03 не используется, потому что он гигроскопичен).
С двухосновной точки зрения угольная кислота образует 2 типа солей со щелочными металлами-кислотные (ENSO03) и промежуточные (E2CO3) соли. Кислые карбонаты (бикарбонаты) характерны для всех щелочных металлов, за исключением Li. из раствора они отделяются в виде мелкокристаллического порошка без кристаллической воды. При нормальной температуре бикарбонат стабилен, но при нагревании он очень легко превращается в соответствующую среднюю солнечную угольную кислоту.
2ENC03 = E2CO3 + СО2 + Н2О В серии Na-Cs значительно улучшается термическая стабильность бикарбонатов (рисунок XII1-6). За исключением NaHC03, рассматриваемый бикарбонат хорошо растворим. Вследствие гидролиза их раствор реагирует слабощелочной реакцией. При нагревании этих растворов частично выделяется CO2 (в соответствии с формулой разложения, описанной выше), и реакция становится щелочной.
При контакте с воздухом это образование CO2 из-за раствора бикарбоната происходит очень медленно, даже при комнатной температуре. Практическое применение в основном осуществляется в NaHC03 («пищевая сода»), которая используется в медицинской и кондитерской промышленности. Обычные карбонаты щелочных металлов, за исключением Li2C08, легко растворяются в воде (рис. XIII-7), и в результате гидролиза их растворы проявляют сильную щелочную реакцию.
Наиболее важной является сода (NaaCO). она производится в виде безводного состояния («кальцинированная сода») или кристаллического гидрата Na2CO3-10H20 («кристаллическая Сода»), который выветривается на воздухе. Потребителей соды много industries. It также используется для смягчения воды или для стирки одежды. Производство кальцинированной соды в СССР в 1972 году достигло 3850 тыс. тонн (в 1940 году-536 тыс. тонн, в 1913-16 тыс. тонн). )
Наиболее важным в производстве соды является реакция на основе аммиачного метода NaCl + NH4HC03 ^ NaHC03 / + NH4C1 Равновесие сдвигается почти полностью вправо(из-за очень низкой растворимости NaHC03 в растворе NHC CI).Концентрированный раствор NaCl сначала насыщают аммиаком, а затем обрабатывают 2 С 43 Ц0 Нью-Джерси Т60 с Рисунок XIII-6.Давление диссоциации бикарбоната (mi RT. Art. it это не так. 609C Рисунок XIII-7.Растворимость карбоната (моль! Л Ю).
Окись углерода (полученная прокаливанием CaCO).Высвобожденный NaHC03 фильтруют и переносят в Na2CO путем нагревания (в соответствии с приведенной выше формулой), а полученный COg возвращают в производство. Маточный раствор, содержащий NH4Cl, обрабатывают газообразной известью, а полученный в результате этого процесса аммиак также возвращают в производство. Поэтому единственным отходом является оставшийся CaCU в растворе.
Помимо соды 117-123, поташ (К2СО3) потребляется в больших количествах промышленностью (в основном стекольной).помимо получения химическими методами из природных КС1, отходов некоторых отраслей промышленности (золы растений и др.) широко используются в производстве калийных удобрений. Подобно карбонатам, сульфаты щелочных металлов также являются кислой известью (3HSOi) и средней (32S04).
Оба легко растворяются в воде (рис. XIII-8).Практическое значение имеют в основном Na2S04 (который в технике часто называют просто сульфатом) и K2SO4, особенно первый. Их важнейшим потребителем является стекольная промышленность. Кристаллогидрат o 40 40 60 yo Na2S04-10H20 («мирабилит» или» соль граувера«) используется в медицине в качестве слабительного средства. Или путем обрабатывать соответствуя хлорид с серией acids. In в последнем случае сульфаты являются побочным продуктом производства соляной кислоты.
Вода в карабогазголе содержит большое количество нитратов.’W_M5′ Если сравнить свойства щелочных металлов и их соединений, то можно увидеть, что в ряду Li-Cs они вообще изменяются очень естественно. низкая растворимость соли с aioyi ко?- Поро!〜И ФА, и относительно легкий гидроксид для удаления воды при нагревании, и другие свойства, литий приближается к магнию и кальцию. Но литий, как правило, является типичным щелочным металлом. Добавь 1) О некоторых соединениях Na и K (соль, сода, поташ) сообщалось еще в древности, но впервые различие двух элементов было установлено в начале XVIII века.
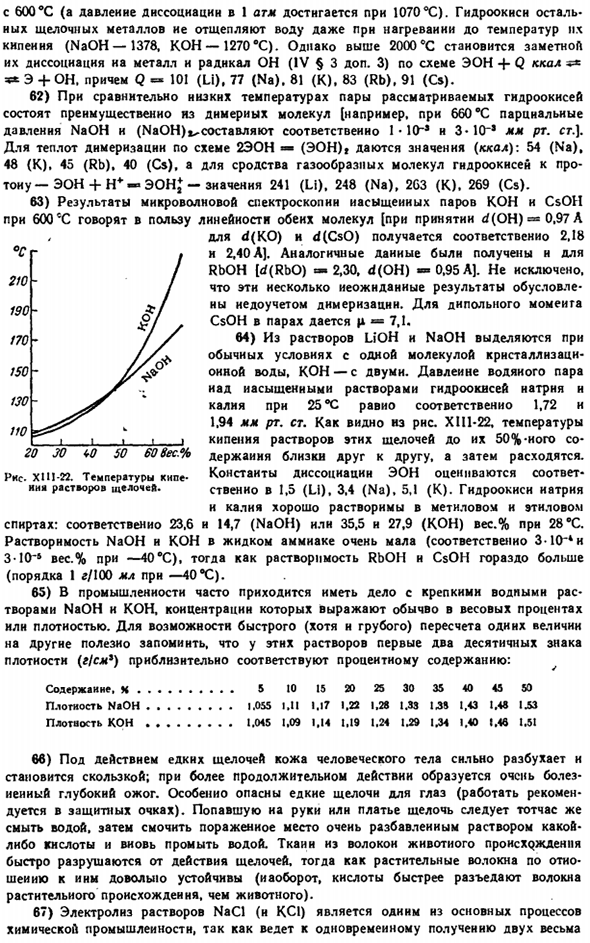
Элемент Na n K был выделен только в 1807 году, литония в 1817 году, цезий N rubndny в i860 и 1861 годах соответственно, элемент № 87-Франция был открыт в 1939 году и получил свое название в 1946 году. Большинство щелочных металлов имеют монографию, а о Франции есть обзорная статья•• Рисунок XIII-8.Растворимость сульфатов(моль! L H, 0). * Ша и Р А М Ф. И. литий-М.. СВУ-Ин АН СССР, 1962.284 С. Острушка о Ю. Я-доктор Ли. М.. Атомздат. 1960.199 п. Синтиг-м-натрий. С английского, Изд. И. А. Реформа. М.. Атомы от даты. 1961.440-е гг. Алабышев А. Ф. и др. Натрий и калий. Л. Госхимиздат, 1969.E91p. Perelmai F. M. рубидий и цезий. Эд. 2-й. М.. Издательство Академии Наук СССР. 1960.139 секунд плюша.
В. Е.. Степи и Б. Д. литий, рубидий, цезий. М..«Химия.» 1970.40 секунд Коган В. И. Казвайоа В. А.. Солодов А. Н. рубидий и цезий. М. «Наука», 197Г. 336 секунд * * Л и в р У Х и А и А. К., успехи химии, 1″8, ю, 1209. 2) природные натрий и цезий состоят из «чистых» элементов («Na n 1MS$»), литий состоит из n-изотопов eLi (7,4%) и 7Li (92,6%), а калий-изотоп ns* » K (93,22%).^ К (0.01%) Н-4, к (6.77%).Рубидий-nz nodotrope wrb (72,2%) n 87Rb(27,8%).Из французских изотопов главное значение, обнаруженное в природе, — » Fr (средняя продолжительность жизни) атома32 минуты).
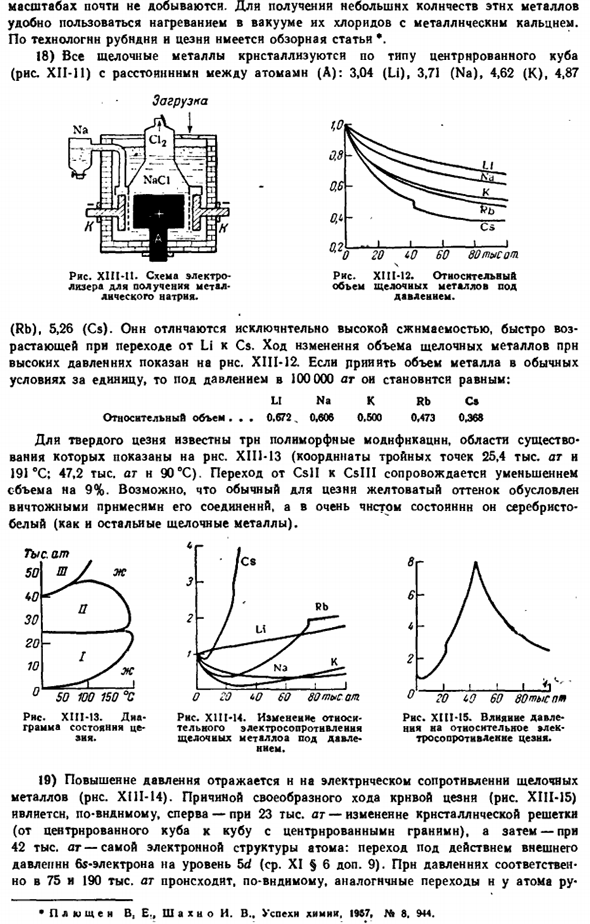
3)атомы щелочных металлов имеют структуру внешней электронной оболочки типа NS (где N-главное квантовое число внешнего слоя), и в основном состоянии они уже однозарядный. Ближайший энергетический уровень этих атомов показан на рисунке. Первый потенциал ионизации © в XIII-9 и nx равен: У Нс К КС РБ 5.39 5.14 4.34 4.18 3.89 «Наиболее вероятное значение потенциала ионизации во Франции-3,83 В. Величина сродства атома к электронам, полученная на основе экспериментальных данных, равна 9 (Li).7 (НС).12 (к).14 (RB и CS) ккал / г-атом.
4) как ядро атома цезия, так и его валентные электроны имеют магнитные моменты. Эти моменты могут быть направлены на взаимно параллельные или антипараллельные линии. Разница в энергии в обоих состояниях определяется строго частотой колебаний и—9 192 631 770 он соответствует излучению sec’1 (то есть длине волны х 3,26 см).На этой основе строятся «атомные часы»
Цезаря, точность которых даже выше, чем у»молекулярных» часов(IX§ 1 add.18). п Я<< / Я 3д 5 секунд до 3 <т 3Р Что? 3S 7С чет / в Для них. 17 ″ 7р ВТ-7Т — От РБ до КС 4 секунды, 5 секунд, 6 секунд. XII1-9.Энергетический уровень атома щелочного металла (Хал / г атом). С0 К 2р Ли 2 секунды Двадцать Фигура Рисунок XI11-10.Примерный Геологический разрез Соликамского месторождения. ШЗ Ши эш (Ш1 она Шшшш Б)в результате медленного высыхания внутренних морей, которые в прошлые эпохи покрывали большую часть Европы и Западной Сибири, на территории СССР образовались естественные залежи легкорастворимых солей. USSR.
As по запасам калия соликамское месторождение превышает сумму всех месторождений других стран мира. Примерный Геологический разрез этого месторождения отображается в RNS. XIII-10(а. а. Иванов). Как видно из рисунка, само месторождение соли скрыто под слоем аллювия (/), известняка (2).В том числе глины (3) и гипса (■/) пород. Само месторождение состоит в основном из каменной соли (5 фунтов с. Средний слой виннитового слоя (6) И карналлт (7). среднее содержание калия в снвлинтовом слое (по общепринятому расчету САО) составляет около 15%.
Плотский свет-о 12%.In в продолжении сильных солевых отложений Соликамска в белезковском районе обнаружено до 35% слоев сильвинитов KjO, а калийные месторождения Южного Урала содержат сульфаты (минералы a и t-KCI * MgS04•3HtO, polnog a l и t-K * S04 * MgSO,• * 2cas•2HjO и др.). в) в отличие от калийных месторождений, во многих странах имеются природные источники натриевых солей (море, соленые озера, каменная соль).Океан содержит 4-15 тонн NaCl(и каждая 1000 тонн морской воды фактически дает около 1,3 г соли).
Огромная мощность некоторых месторождений каменной соли составляет interesting. So в иреску его непрерывное образование было обнаружено на глубине 1,5 километра, и никаких признаков приближения к его нижней границе обнаружено не было. 7)каменная соль не проходит через нерастворитель жидкостей и сжатых газов. После вскрытия скважины в толще месторождения и смыва достаточно большой свободной емкости (откачивается вода, откачивается раствор), ее можно использовать в качестве погреба для газа, нефти и т. д. 8) трассировка NaCl (10 «до 10» 5G! L) всегда содержится в атмосфере.
Они добираются туда с двойным брызгом моря water. It было подсчитано, что с поверхности Каспийского моря только тысячи тонн соли в сутки поступают в океан. atmosphere. At высота> 5 м на высоте >1530% ядра (масса 10*, g-10, E-g) состояли в основном из NaCl. In в кристаллах снега также обнаружены частицы соли. 9) литиевые минералы, например, сподумен (UAI (SiO») s]и репидолит{LijKAl / Si4O, 0 (F, OH)s]}.Часть калия в последнем иногда заменяется рубидием. -Это хороший мусорщик для производства лунадия, — сказал он. said. In технология цезия, CsAI (SiOj), относительно редкий минеральный порцит, является наиболее важной.」
10) животный натрий главным образом использован для сока ткани(lyambhe. Калий концентрируется в самих тканях. Некоторые органы, такие как печень и селезенка, особенно богаты культями и обычно содержат немного больше пней, чем обычно у взрослых животных. Чем натрий (по весу).Напротив, в эмбрионах животных натрия гораздо больше, чем калия, а соотношение 2-х элементов ближе к характерному значению морской воды.
Некоторые ученые считают, что это прямое свидетельство происхождения наземных животных от морских организмов. Рубидий накапливается преимущественно в листьях растений и животных-мышцах, несущих большую нагрузку (в сердце, в груди птиц).Соединения лития и цезия являются toxic. At в то же время появилась возможность эффективного использования соединений лития в лечении некоторых психических заболеваний. 11) в организме взрослого человека имеется около 5 литров крови. Около 0,6%НБКИ включены.
Количество выделяемого за 1 день хлорида натрия в моче обычно составляет около 15 г, и он также выводится из организма потом (содержащим около 0,5% NaCl). для пота и утоления жажды (например, в горячем цехе) рекомендуется газированная вода, содержащая 0,5% NaCl. Напротив, чтобы ограничить потребление кулинарного солнца, рекомендуется prn hypertension (гипертония). Недавно экспериментами на собаках было установлено, что при перегреве организма нарушается естественный баланс между Na ’и K ’ и наступает»калиевое голодание».
По-видимому. Это указывает на возможность засолки потребляемой воды не только хлоридом натрия, но и при повышенной потливости смесью NaCl и KC1 (вероятно, в соотношении около 10: 1). 12) сколько калия потребляется растениями? В качестве примера приведены следующие данные (кг К на тонну). Озимая рожь яровая пшеница картофель мрмо солома зерно выправка клубим топ-оотва 8.3 6л 5.0 5.0 5.0 7.0 2.1 4.1 В результате уборки урожая по всему миру ежегодно из почвы извлекается более 25 миллионов тонн калия, часть из которых вскоре начнет испытывать калийный голод er.
In в таких случаях укрепление почвы калием сопровождается резким повышением урожайности. Калийные удобрения особенно важны для важных культур, таких как картофель и сахарная свекла. Их ежегодное мировое производство (в пересчете на КЗО) составляет около 10 или Г (без СССР).Содержание калия в обычном животном навозе-удобрении-составляет около 6/ г. same. In человеческая моча, 2 г калия выводится ежедневно.
13) В отличие от солей натрия, которые легко смываются с почвы, соединения калия прочно удерживаются почвой(за счет адсорбции глиной).Это обстоятельство очень важно для развития наземных растений. Между тем, глаз вызывает относительную бедность природной воды, содержащей соли калия. Например, вода ниже по течению Волги содержит 25 видов калия, меньше калия, чем на реке Волга. turf.
As в результате судьба обоих элементов на поверхности Земли оказывается совершенно противоположной. Основным направлением в геологической истории калия является рассеивание соединений в почве, тогда как соединения натрия концентрируются в море. 14) по естественному содержанию калия отдельные почвы являются different. In глинистая она сравнительно большая, а в песчаной или торфяной ее не так уж и много.
Из природных форм, в которых встречается этот элемент, основными минералами являются Орто-полевой шпат, мусковит, не-камень и др. Только около 1% всего калия содержится в почве в адсорбированном состоянии, и только 10-1 из него является водорастворимым. Поглощение растениями калия в минерале очень затруднено (особенно в случае Орто-полевого шпата), что несколько облегчается тем, что основным компонентом корневой секреции является со|.
Именно поэтому слой почвы, непосредственно прилегающий к корням, подвергается кислой реакции (рН» 4″).Тем не менее, не минеральный, а сорбционный калий является наиболее важным для питания растений (особенно молодых растений). 15) некоторые виды растений избирательно извлекают соединения других щелочных металлов, в дополнение к potassium. So некоторые солончаки и водоросли содержат большое количество натрия. Литий накапливается в некоторых видах табака, рубидий-в некоторых видах свеклы.
Также рубидий всегда содержит виноградное вино (в среднем: белое-0,5 мг / л, Красное-1,1 мг / л). 18) перед фактическим введением метода электролиза, следующая реакция дала металлический натрий путем нагревания угля и соды: NajCOj-f2C+ 244 ккал-ЗСО + SNA. На рисунке 1 показана установка электролизного производства плавленого NaCl. XIII-11.
Разлом состоит из шамотовой футеровки, графитового анода (а) и стального кожуха с кольцевым железным катодом (к), между которыми расположена сетчатая диафрагма. Электролит обычно представляет собой чистый NaCl(mp.800°C) представляет собой более легкоплавкую смесь приблизительно 40% NaCl и 60% CaCl. It работать можно будет при температуре около 580°С.
Металлический натрий, собранный в верхней части кольцевого катодного пространства и перенесенный в коллектор, содержит небольшое количество (до 5%) примесей кальция. Затем он выделяется почти полностью (растворимость в жидком натрии Ca, температура его плавления составляет всего 0,01%). по мере протекания электролиза в ванну добавляют NaCl. Потребляемая мощность составляет около 1 кВт * ч на каждые 15 кг. 17) производство металла K и LI меньше по сравнению с производством натрия.
Литий получают электролизом расплава licl + KC1 и действием паров натрия на калий-KC1 melt. It отрыгивается в специальной дистилляционной колонне (сверху, куда сбрасывается калиевый газ).Крупномасштабные рубидий и цезий Масштаба почти нет mined. To получая небольшое количество этих металлов, удобно нагревать хлорид и кальций металла в вакууме. О технологии рубндня и цезия есть обзорная статья.
18) все щелочные металлы кристаллизуются как кубики (рисунок-XIM1) с межатомным расстоянием (A) в центре: 3,04 (Li), 3,71 (Na), 4,62 (K), 4,87 Погрузка Рисунок Х1-11п. схема электролизера для получения металлического натрия. Рисунок XI11-12.Относительный объем щелочных металлов под давлением. 02_1-1-1-1-1 Примерно от 20 до 60 80 тыс. \ (РБ), 5.26(КС).Они характеризуются очень высокой степенью сжатия, которая быстро увеличивается при переходе от Li к Cs. В РНС показан ход изменения объема щелочных металлов при высоком давлении. XIII-12.
Если объем металла взять за единицу при нормальных условиях, то под давлением 100 000 бар: РБ с » относительным объемом от Ли На. 。 。 0,672. 0.606 0.600 0.473 0.368 В случае твердого цезия полиморфная модификация trn известна, область ее присутствия указана в rns. XIII-13 (координаты тройных точек 25,4 тыс. и 191 ° С: 47,2 тыс. и 90 ° С). Переход от CslI к CsIII сопровождается уменьшением объема на 9%. Желтоватый оттенок, характерный для Цезона, можно отнести к значительным примесям его соединений, а в очень чистом состоянии (как и в других щелочных металлах) он серебристо-белый. Рисунок XIII-13. диаграмма состояния ce-eai. РНС. X1IM4.
Изменение относительного электрического сопротивления щелочных металлов под давлением. РНС. XSh-15.Влияние давления на относительное сопротивление кессона. И<•/•я Я Я ч 20×60 80 тыс. р * 19) повышение давления вызвано щелочными металлами(RNS. XI1M4).По-видимому, причина своеобразного хода кривой Цезена (рис. XIIM5) вначале 23 000-это изменение кристаллической решетки (от куба центра к кубу с плоскостью центра), а затем 42 000-в структуре самого электрона.
Атом: переход на уровень 5d под влиянием внешнего давления электрона ds (см. XI§ 6 постскриптум 9). при давлении 75 и 19 миллионов атмосфер соответственно, по-видимому, аналогичный переход происходит в атомах py* * Плющен В., Шахн О. И. успехи в химии. 1967, № 8.ЭЙ. Плавление Видий Na и K сопровождается значительным (примерно в 2 раза) увеличением удельного электрического сопротивления.
20) температура плавления щелочных металлов с увеличением внешнего давления постепенно повышается и становится почти равной. Следовательно, 3 миллиона В Li, Na, K и Rb будут равны 234, 248, 251 и 267°С соответственно. Кривая плавления цезия имеет максимальное значение 2: 197°С и 22,5 тыс. (Csl) и при 198°С и 30,5 тыс.(CsII).Другие тепловые свойства рассматриваемого элемента сравниваются со следующими (ккал / г-атом): Ли на в РБ КС Термоядерный Синтез……… 0.69 0.63 0.57 0.53 0.50
Жара распыливания(на 23°к). 。 。 38.4 2С.9 21.4 19.6 18.7 Тепло испарения……… 32.2 21.3 18.5 16.5 15.8 Важным параметрам присваиваются следующие значения: Ли на К РБ с」 Критическая температура,°К. 。 。 3600 2400 2003 1803 171 ″ Критическое давление, бар….. 1000 365 179 124 102 21) в паре щелочные металлы в основном одноатомные (содержание молекул Е * составляет всего несколько процентов).Это связано с малой стабильностью молекулы 2-атома, как видно из сравнения энергии диссоциации (при 25°С). Лис на3 к * РБ * кошка Ядерная дистанция, а…… J. 2.67 3.08 3.93 4.32 4.55
Энергия диссоциации, ккал / моль. 。 25.5 17.3 11.8 10.8 10.4 Подобно Галоиду(VII§ 4), молекула Е2 более стабильна с меньшим ядерным расстоянием. 22) если кристаллическая решетка может быть сформирована из молекул Е , то ее стабильность гарантируется только слабыми межмолекулярными силами. Энергия Синна атома такой решетки(рассчитанная для каждого атома 1 г) не будет сильно отличаться от половины энергии связи самой молекулы.
Сравнение этих величин с фактической атомной энергией лития и его аналогов наглядно показывает, что металлическая структура nnh значительно более энергетически выгодна (примерно в 3 раза), чем молекулярная структура. D (EE) металла намного больше, чем D (EE) молекулы, и отдельные связи E-E соответственно ослабляются, но число связей между атомом и ближайшим соседом металла (8) намного больше, и общая энергия взаимодействия увеличивается.
23) пары щелочных металлов окрашены в характерный цвет Na-пурпурно-красный, K-фиолетовый. РБ-в оранжевом цвете. Коллоидные растворы этих металлов также характерно окрашены(например, Na в эфире колеблется от пурпурно-фиолетового до синего, А K-сине-зеленый). 24) испускание световых лучей нагретыми атомами щелочных металлов, появляющимися снаружи в виде цветов пламени, происходит за счет скачков электронов от высокой энергии к низкой.
Например, когда электроны прыгают с уровня 3p на уровень 35, возникают характерные желтые линии натриевого спектра (состоящие из 5890 и 5896 длинных волн).Электроны к более высокой энергии levels. In в этом случае возбуждение достигается за счет теплоты пламени (требуется расход 48 ккал / г атомов), но в целом, в результате передачи энергии различных типов атому, оно может последовать.
Другие щелочные металлы генерируют следующие цвета пламени (в скобках указаны длины самых ярких линий видимого спектра): L1-карминный красный (6708), K-фиолетовый (4044), Rb-синий красный(4202) и синий(4555 а).) 25) световой спектр ночного неба указывает на то, что в нем всегда присутствует желтое натриевое излучение. Место залегания басоты оценивается в 200-300 км. То есть атмосфера этнической высоты содержит атомы патрона (конечно, это ничтожное количество).
Возникновение излучения объясняется несколькими элементарными процессами (звездочки обозначают возбужденное состояние, которое называется состоянием возбуждения).М 3-й частиц-О», О, Н3 и т. д.).На+О+М-НАО +М, НАО +О-О,+ На•и. Наконец. На• » * Ан + АВ. 26) В лучах солнца атомы натрия подвергаются прямому фотохимическому возбуждению и интенсивно светятся желтым светом, характерным для them. It была использована для создания «искусственной кометы» путем испарения горных пород (за счет тепла горящих термитов) в окружении ракет на высоте 15 миллионов километров от Земли.
Облака паров натрия образовались за 4 минуты, сечение достигло 600 км, и их можно было наблюдать непосредственно. Его характер. — __стнки (светимость, скорость рассеивания、 Они показали значительные признаки некоторого функционирования (высотный воздух). V ^ X 27) так как я Кроме того, поскольку электроны с поверхности металла малы, такие выходы могут происходить под влиянием освещения видимым светом(за счет энергии поглощенного фотона).Это явление, называемое фотоэлектрическим эффектом, основано на работе солнечного элемента (x $ 4).8).
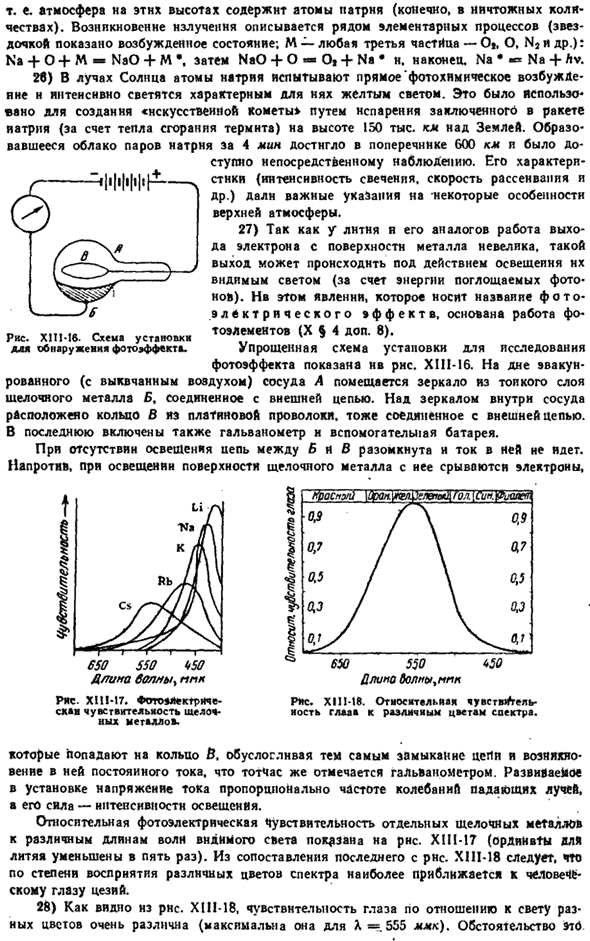
Упрощенная схема установки для исследования фотоэффекта показана на рисунке. XIII-16.At на дне отработанного (удаляемого воздухом) сосуда а помещено зеркало с тонким слоем щелочного металла в, которое подключено к внешней цепи. Над зеркалом в контейнере находится кольцо B из платинового провода, которое также подключено к внешней цепи. Последний также включает в себя гальванометр и вспомогательную батарею.
При отсутствии освещения цепь между бивом разомкнута и тока нет flows. In напротив, когда поверхность щелочного металла освещена, электроны разрываются. Рисунок XIII-16.Схема установки фотоэлектрического детектирования. Рис. 650550 1 * 50 Dlima B & MUU PPK XI11-17.Фотоэлектрическая чувствительность щелочных металлов. 0 олм ^ ли по ПДК W SHE2L H 23223 TiZU Cs&E2 0J3 ДжейТи 0.9 0.7 / 0.7 0,5 Дж \ 6.5 0.3 / \ 0.3 °650 550 <50 Рисунок XIII-16.Относительная чувствительность глаз к различным цветам спектра.
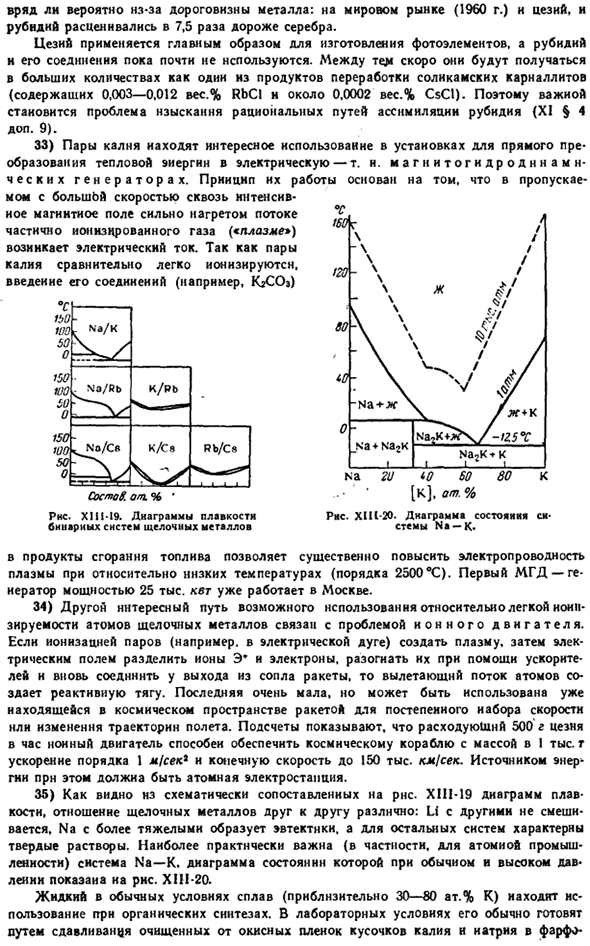
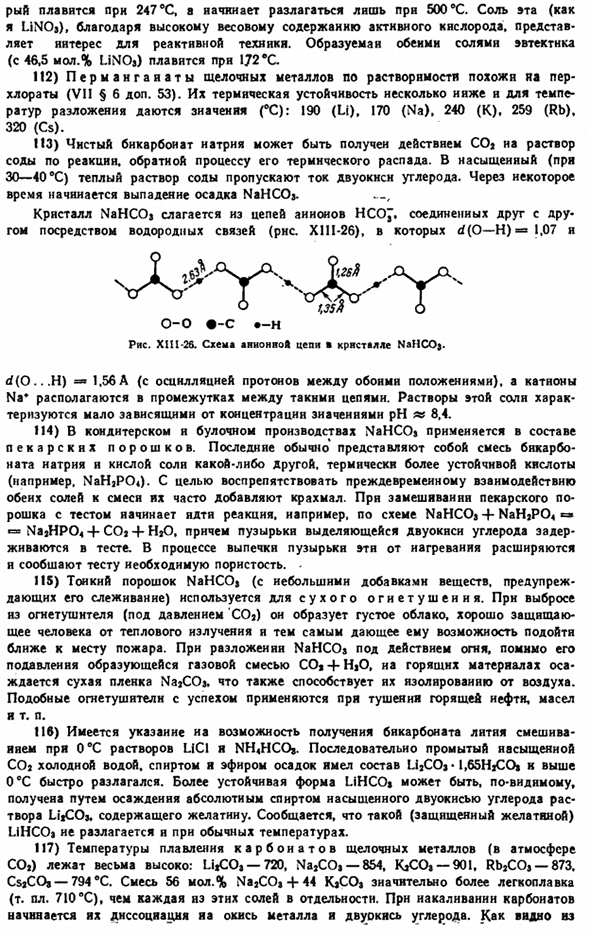
Это падает на кольцо в, тем самым способствуя замыканию цепи и возникновению в ней токов постоянного тока. Постоянный ток сразу распознается гальванометром. Напряжение, генерируемое оборудованием, пропорционально частоте колебаний падающего света, а его интенсивность пропорциональна интенсивности света. Относительная фотоэлектрическая чувствительность отдельных щелочных металлов к видимому свету различных длин волн показана на рисунке.
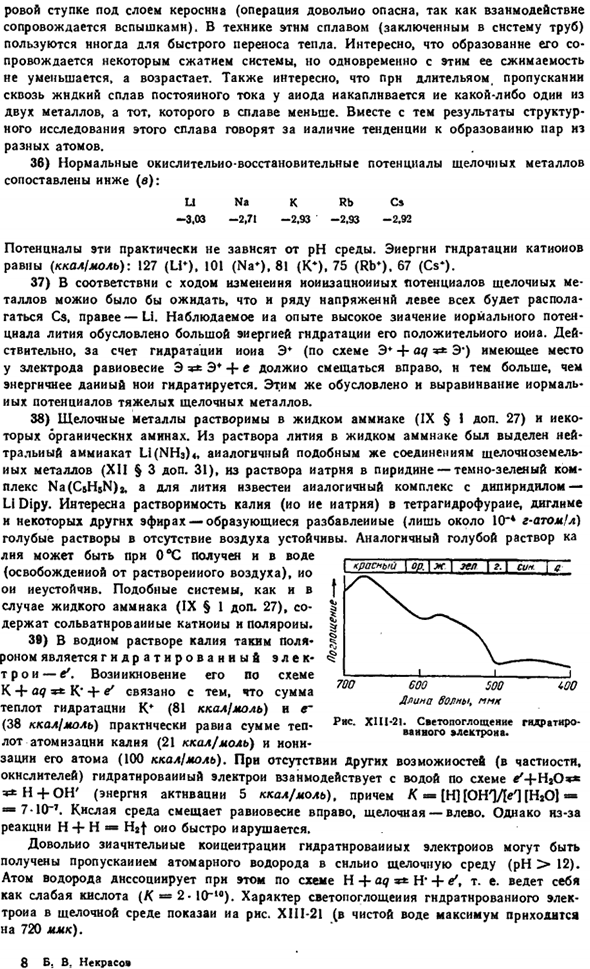
XII1-17 (координаты линьки уменьшились в 5 раз).Из сравнения последнего и РНС. XI1I-18 означает, что цезий наиболее тесно связан с человеческим глазом в степени восприятия различных цветов спектра. 28)Как видно из РНС. X1P-18, чувствительность глаз к свету разных цветов значительно отличается (до Х 555 ММК).Ситуация et6
Это очень важно, потому что более 85% человеческих впечатлений происходит визуально.было подтверждено, что глаз устает гораздо быстрее, когда воспринимает красный и синий цвета, чем зеленый, и что эффект красного повышает внутриглазное давление, а эффект зеленого понижает глаз по сравнению с обычным белым светом, а синий оказывает успокаивающее действие на психически больных(страдающих Манафортом). оказывается, что все предметы выглядят острее при освещении лампочкой, избирательно останавливая желтые лучи света. glass.
It также было показано, что производительность труда повышается до 25%, если стены производственного помещения и различные предметы, содержащиеся в нем, отличаются по цвету. Все эти специфические особенности цветовосприятия человека начинают серьезно учитываться при разработке проблем индустриальной эстетики. 29) область цветовосприятия животных может существенно отличаться от области цветовосприятия человека.
Например, пчелы хорошо выглядят в ультрафиолетовом свете, различают другие цвета спектра, кроме красного (для нее он выглядит черным), кошки вообще не различают цвет а, все они отображаются только в разных оттенках серого, как в обычном телевизоре. Желтый цвет, как сообщается, отпугивает акул. Развитие растений стимулируется красным освещением и подавляется синим lighting.
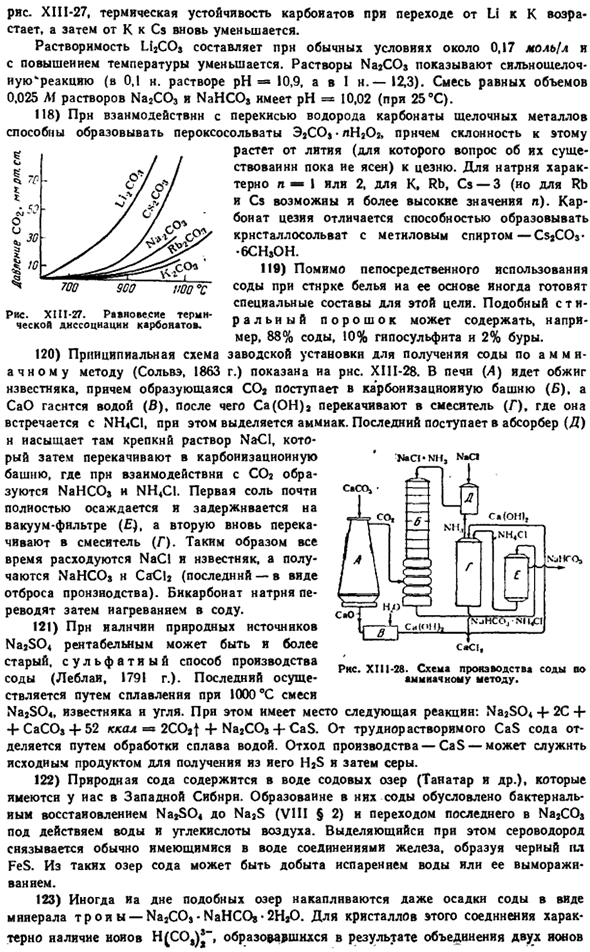
At в то же время интересные наблюдения были сделаны в луковице culture. It было установлено, что красное освещение увеличивает содержание углеводов и увеличивает содержание белков синего цвета. 30) при хранении металлического табурета в контакте с воздухом его поверхность постепенно покрывается тонким слоем перекиси (промежуточным слоем оксида).
Использование такого оксида калия (а также дневного тренияи цезия) может вызвать сильный взрыв из-за возникновения прямого контакта между перекисью и металлом (например, при резке).в случае торфа такая опасность не грозит, так как в нормальных условиях он окисляется только до оксидов. Натрий и калий следует хранить в закрытой емкости под слоем сухого и нейтрального керосина.
Контакт с кислотами, водой, хлорированными органическими соединениями (такими как CC1) и твердым углекислым газом не допускается. Нельзя накапливать мелкие клочки кала, которые особенно подвержены окислению (из-за относительно большой поверхности).Неиспользованные остатки небольшого количества Карони и гидроксида натрия разрушаются при взаимодействии с избытком спирта, а большой еж уничтожается пушечным огнем на угле.
Щелочной металл, который загорелся в помещении, лучше всего тушить, засыпая сухим порошком кальцинированной соды. 31) сплавы натрия со многими металлами (Ag, Au, Cd, Zn, Pb и др.) но не образует сплав с другими (Al, Fe, N1, Cr, Mn и др.) сплавы. Все щелочные металлы растворяются в ртути (хуже, чем другие вещества), и при повышении температуры растворимость увеличивается.
- 32) натрий широко используется в синтезе органических соединений, а в некоторых он используется для получения некоторых из них derivatives. In ядерная технология, она использована как хладоагент. Разряд, который производит яркий желтый свет с парами натрия, является наиболее экономичным из искусственного освещения с эффективностью тока до 70% (однако он неприятен в тени, которая сообщается в Нм окружающих объектов).
Были проведены успешные эксперименты по созданию натриевого электрического кабеля (с полиэтиленовой прокладкой) высокого напряжения current. In форма Амар-гамма, натрия часто используется в качестве восстановителя энергии. In в резиновой промышленности он используется в производстве искусственного каучука (как катализатор полимеризации), в металлургии, как ценная добавка к другим металлам и сплавам.
Литий является наиболее важным для синтеза technology. Людмила Фирмаль
Например, 100% из 1% добавки в литии значительно повышает твердость алюминия и его сплавов, в то время как 0,4% добавки в lntn к свинцу увеличивает твердость почти в 3 раза, не снижая его сопротивления твердости. Имеются признаки того, что подобные случаи применения присадок значительно улучшают механические свойства магния и защищают его от коррозии, однако их применение является Вряд ли из-за высокой стоимости металла: на мировом рынке (I960) было подсчитано, что и цезий, и рубидий стоят в 7,5 раз дороже серебра.
Цезий в основном используется в производстве фотоэлектрических элементов, но рубидий и его соединения используются редко. Среди них в качестве одного из 1 продуктов переработки Соликамского карналита сразу же получают в больших количествах(0,003-0,012 мас.%).%RbCl и около 0,0002 мас.(Включая% CsCl).Поэтому вопрос о нахождении рационального способа усвоения рубидия становится актуальным(X!§ 4 Добавить.9). 33) пары Пара имеют интересное применение в установках для преобразования тепловой энергии непосредственно в электрическую энергию. Магнитный генератор азота.
Принцип их действия основан на том, что электрический ток возникает в сильно нагретом потоке частично ионизированного газа («плазмы»), который проходит через сильное магнитное поле с высокой скоростью. Пары калия ионизируются относительно легко, поэтому введение его соединений (CrCSS и др.) Впрыскивая топливо в продукты сгорания, электрическая проводимость плазмы может быть значительно увеличена при относительно низких температурах (около 2500°C).Первый МГД-генератор мощностью 25000 Кэт уже работает в Москве.
34) Еще один интересный способ использования относительно простых и шумных атомов щелочных металлов связан с проблемой ионного двигателя. Если плазма создается ионизацией пара (например, электрической дугой), то ионы Е * и электроны разделяются электрическим полем, ускоряются ускорителем и вновь соединяются на выходе из сопла ракеты. Последняя очень мала, но ее можно использовать на ракетах уже в космосе, постепенно увеличивая их скорость или изменяя траекторию полета.
Расчеты показывают, что при расходе кессона 1 500 г в час ионный двигатель может обеспечить космический аппарат массой 1000 г с ускорением около 1 м / с и конечной скоростью до 15 млн км / с. источником энергии должна быть атомная электростанция. 35) Как видно, они схематически сопоставлены с RNS. В диаграмме плавления XH-19 соотношение щелочных металлов друг к другу составляет different. Li не смешивается с другими веществами, Na образует более тяжелые и эвтектические, в то время как другие растворы характеризуются твердыми растворами.
Наиболее практически важной (в частности, для атомной промышленности) является система Na-K. Нормальная диаграмма состояния высокого давления отображается в RNS. XIII-20. Жидкий сплав в нормальных условиях (около 30-80 Ат.%K) использовано в органическом synthesis. In лабораторные условия, оно обычно подготовлен путем сжимать части очищенных калия и натрия от китайской пленки окиси Растворы под слоем керосина (взаимодействие сопровождается вспышкой, поэтому операция очень опасна); в технике этот сплав(заключенный в трубную систему) иногда используется для быстрой передачи тепла.
Интересно, что ее формирование сопровождается определенной степенью сжатия системы, но при этом степень ее сжатия не уменьшается и increases. It интересно также, что при длительной передаче постоянного тока через жидкий сплав 1 из 2 металлов накапливается в аноде, но 1 из 2 металлов является small. At в то же время результаты структурных исследований этого сплава указывают на тенденцию к образованию пар из разных атомов.
36) сравните нормальный окислительно-восстановительный потенциал щелочных металлов со следующим(с): У Нс В КС РБ −3.03 −2.71 −2.93 −2.93 −2.92 Эти потенциалы фактически не зависят от рН среды. Энергия гидратации катиона составляет (ккал / моль): 127 (Li). 101 (Na), 81(K), 75(Rb). 67(КС*). 37) в соответствии с ходом изменения потенциала ионизации щелочных металлов, C3, как ожидается, будет размещен на левой стороне всего напряжения, Li-на правой стороне.
Высокое значение стандартного потенциала лития, наблюдаемое экспериментально, обусловлено высокой энергией гидратации его положительного ions. In дело в том, что вследствие гидратации ионов E *(по схеме E * + aq * E E) равновесие E * * f e, возникающее на электроде, смещается вправо, и больше энергии получает этот гидрат. То же самое связано с тем, что обычный электрический потенциал тяжелых щелочных металлов выровнен.
38) щелочные металлы добавляют жидкий аммиак (IX§ 1.27) и растворимы в некоторых органических аминах. Нейтральный аммиак LifNHsh выделяли из раствора лития в жидком аммиаке. Аналогичные соединения щелочноземельных металлов (XII§ 3 доб.31), из пиридинового раствора натрия-темно-зеленый комплекс Na (C & H8N). что касается лития, то известен Li Dipy, аналогичный комплекс с dnpyrndyl. Интересна растворимость калия (Иона) в тетрагидрофурии, дигитриме и других эфирах. Полученное разбавление(около 10-4 г-атом! L) голубое разрешение стабилизировано даже без воздуха.
Аналогичный синий раствор пня получают с водой (выделяющейся из растворенного воздуха) при 0°С, которая неустойчива. Аналогичная система для жидкого аммиака (IX§ 1 add.27) содержит сольватации катионов и полярных ионов. 39) в водном растворе калия такой полярон гидратирует электроны. Его возникновение по схеме K + aq ** K * + & обусловлено тем, что сумма теплоты гидратации K *(81 ккал / моль) и g (38 ккал / моль) примерно равна сумме теплоты атомной кальцификации теленка (21 ккал / моль).Ионизация его атомов (100 ккал / моль).
При отсутствии других возможностей (особенно окислителей) гидратированные электроны взаимодействуют с водой по схеме»Ch-N * Och * ** N + OH«(энергия активации 5 ккал / моль).кроме того, K — [H] [ONT / M(HtOj — «■7-10» ’.Кислотная среда смещает равновесие вправо, щелочная-влево. Однако реакция H + H-H * f вызывает быструю турбулентность. Пропуская атомарный водород через сильно щелочную среду (рН> 12), можно получить значительную концентрацию гидратированных электронов. obtained. In в этом случае атомы водорода диссоциируют по схеме H + aq * * H * + tf%.То есть он ведет себя как слабая кислота (K 2•10 «10).На рисунке Х111-21 показана природа поглощения света гидратированными электронами в щелочных средах (в чистой воде максимум составляет 720 ММК). РНС. XSh-21.
Гндратро-бесполезные электроны для поглощения света. Jjfluho voglb ’пик’ 8 Б. В. НекрасовКак и другие полярности, e7 представляет собой структуру, в которой e-полярные анионы связаны с частицами medium. It предполагается, что электроны находятся в тетраэдрической среде из 4 молекул воды. По-видимому, его заряд распределен в области радиуса 1.4 A. существует также предположение, что раствор содержит полярон типа e1, то есть NX-пару (включая антипараллельный спин), а не отдельный сольватируемый электрон.
Присутствие таких электронно-сольватированных аммиачных электронных пар очень часто встречается в полосатом диамагнитном растворе натрия в жидкости NHj(IX§ 1 add.27). Гидратированный электрон является очень сильным восстановителем(при нормальном потенциал, значение −2.86 в ДАН).Она способна уменьшить некоторые номера〜ионов (ПБ -, компакт-диск», никеля, кобальта», пр -, ЗН»), которые не реагируют с атомарным водородом, и особенно активен в отношении частиц, содержащих неспаренные электроны (нет, и т. д.).
В сложной системе с нижней НХ заряда, нападение в качестве восстановителя обычно направляется в наиболее электрически положительной части молекулы. 40) взаимодействие щелочного металла, растворенного в жидком аммиаке, с монооксидом углерода сопровождается образованием солеобразных продуктов белого (или бледного оттенка) в составе ЭСО. структура nx соответствует уравнению 3j {OCssCOJ * «» и использует параметры annon d (OC)■= 1.37 и<*(CC) 1.19 A.
Такой же продукт может быть получен прямым взаимодействием монооксида углерода со щелочными металлами (кроме Li) при температуре prn ниже 230°C (с другой стороны, при температуре выше prn соль гексаоксина бисола-M» C » 0″).Таким образом, рассматриваемое соединение фактически не является карбонилом щелочного металла, а производным оксида-ацетилена (или гексаоксен-бейсол). Эти вещества гигроскопичны и порфоличны. Нагрев Nx в вакууме влечет за собой разложение по схеме 23jCjOi■= » Э2СО3 + 3.0 + ЗС.
Они бурно взаимодействуют с водой(вплоть до взрыва).Когда Белый Наджой обрабатывают паром, он становится красным, затем пурпурно-черным, затем через несколько дней превращается в вязкую красную жидкость. Oa, который является подобной обработкой черного KC, красноват, а затем желтеет. Первый желтый раствор KtCtOi в большом количестве воды быстро становится красным. Когда он испаряется, он снова становится желтым.
Из него был выделен темно-желтый кристалл хлората калия KjCsOj (кроконовая кислота представляет собой 3 группы CO и 2 СОН-двойной цикл окрашивания связи C = C). Образование взрывчатого вещества KtCjOj может также происходить при раскалении калия, смешанного с углем. Поэтому такой способ не подходит для получения металлического калия (см. Дополнительно 16). 41) под действием со тонкий слой цезия, осажденный в вакууме, образует голубое вещество композиции CsjCOj.
To гидролизуется по схеме CsjCOj-f HjO «CsOH-f-HCOOCs, структура которых должна соответствовать выражению CsCOOCs (что можно рассматривать как замещение обоих атомов водорода цезия муравьиной кислотой) „нагрев под вакуумом предполагает частичное расщепление csium с образованием его оксалата:2csccs = 2Cs + CsjCaO“. 42) металлический цезий связывает этилен и композицию С2Н » С$ 2.Может образовывать коричневое твердое вещество product. In вода, это соединение распадается на C * H «И CsOH.
Цезий медленно реагирует с бензолом при комнатной температуре с образованием черного осадка C H H SCS (который самовоспламеняется на воздухе).Рубидий реагирует аналогично, но только при 70°С. другие щелочные металлы не взаимодействуют с бензолом. 4S) Чистан Наджо, бесцветный, а в продаже препарат обычно желтого цвета (около 10% из-за примесей NAOJ). Не-1 <*(00)= 1,50 а] может содержаться в перекиси натрия Представлен индивидуально в виде сфероида с продольным диаметром около 4,16 а Боковое направление, около 2.46 А. пиролиз по схеме 2naoa= 2naoa + O начинает заметен уже при 400°С, а при 636°с достигает давления кислорода 1 атм. Под своим избыточным давлением Na * 02 плавится при 600°C.
При взаимодействии NaaOa с водой гидрата нет. Сильный нагрев происходит за счет образования 20a-8HaO. Кристаллические соединения состава Naa0a-2Ha02-4H20 также являются known. It теряет воду при хранении в эксикаторах ИАД, содержащих серную кислоту. Подобные соединения калия кристаллизуются без воды. Оба вещества получают обработкой соответствующего гидроксида сильной перекисью водорода при 0°С. 44) тщательно обрабатывая перекись натрия спиртом, охлажденным до 0 ° C, реакция Naoaoa + CaHjOH CaHsONa-f NaOOH вызывает осаждение кислотной соли перекиси водорода в виде белого порошка.
Это вещество-гидропероксид натрия-легче выделяет кислород, чем NaaOa, образуя углекислый газ и Nahcoa (x§ 1 add.50). 45) чистый, или перекись натрия, содержащий различные добавки (например, отбеливатель со смесью солей N1 или Cu), технически называется «оксилт».Смешанные оксалатные препараты особенно пригодны для получения кислорода, который выделяется под воздействием воды. Используя оксилит, запрессованный в куб, можно получить равномерный поток кислорода в обычном устройстве, которое производит газ.
46) когда литий сжигается с потоком кислорода, небольшое количество перекиси лития Uj02 также образуется вместе с LiaO. In в индивидуальных условиях его получают путем взаимодействия кипящего раствора LiOH (2 г / л) с 30% — ным раствором H2O2.Осадок полученной композиции L Трифторуксусной кислоты-Naoa-Zngo промывали спиртом, затем выдерживали под вакуумом на безводном фосфоре (в результате чего терялись как Nao, так и Hoa).
Пиролиз пероксида лития по схеме 2Li202-2LijO + Oj происходит при температуре около 300°C. Существует монография по пероксидам лития. 47) пероксид OJ, не характерный для 3″K, Rb и Cs, получают в виде белого (или желтоватого) осадка, путем воздействия точно рассчитанных количеств кислорода на раствор соответствующего металла в жидком аммиаке.
При избытке кислорода они легко превращаются в Суперпероксид Е02(кроме того, в промежуточном состоянии образуется смесь Егоа и Е02, включающая состав Еаоа).по окислительным свойствам все пероксиды Е20 других щелочных металлов аналогичны пероксиду натрия. 48) характерная особенность К. сверхтекучие свойства ЭОА Rb и Cs получаются при сжигании металла на воздухе[теплота, выделяемая из элементов, примерно одинакова: 68 (K, Rb) или 69(Cs) ккал / моль].Они представляют собой твердое желтое вещество, кристаллическая решетка которого напоминает решетку CaC2 (рисунок X-5).То есть он образован ионами Е и 0〜.
Молекулярные ионы O, входящие в их состав, характеризуются ядерным расстоянием rf (OO) 1,28 а, константой силы связи»6,2 и расчетной структурой[Q — ^ O]», а энергия ее образования по схеме 0+ » — 07 составляет 22 ккал / моль (add $ I. 13). Пиролиз I-пероксидов по схеме 30j Er02 3jO начинает заметен примерно при 400 * C (по другим данным, Кот стабилен до 530°C).Согласно схеме 2EO,+ 2HjO-2EOH + H * 0 ″ + | — Ot (в случае KOA тепловой эффект составляет 13 ккал / моль) реагирует с водой настолько бурно, что при взаимодействии с оксидом она сопровождается взрывом. 49) пероксид калия (ко*) часто вводят в состав oxite.
In в этом случае взаимодействие с углекислым газом следует общей формуле NaaOi + 2KOt + 2COa-Na ^ Oj + KiCO » + 20,+ 100 ккал. То есть углекислый газ заменяется равным количеством кислорода. 50) NaaOa нагревается до 150 * C при давлении кислорода 400 атм. Получен пероксид натрия (NaOa), а также соответствующие производные Rb и Cs, но он обладает низкой стабильностью и характеризуется решеткой свайного типа (рисунок X1U-41).) * Добрынина Т, А, Перекрака Литка, М, Наука, 1964, В1 С、 d (00)= l, 33A. теплота образования от элемента составляет 62 ккал / mol. It представляет собой желтый гигроскопичный порошок, который быстро разлагается во влажном воздухе.
Prn 100°С пероксид натрия взаимодействует с монооксидом углерода по следующему уравнению: 2Na02 +СО = na2c03 — F02.Аналогичная реакция происходит с углекислым газом prn при комнатной температуре, но ниже 10 ° С образуется карбонат: 2Na02 + 2C02 = » Na2C2Oe-f 02.«-80 ° С, цвет Na02 изменяется на Белый, что сопровождается изменением магнитных свойств. 51) взаимодействие между 03 и суспензией фреона-12 li202 (x§ 1 add.164) при PR −65°C было получено желтое твердое вещество, содержащее до 45% Li02.Эта перекись может присутствовать только при температуре ниже 35°C, структурно она напоминает перекись натрия.
52) кроме щелочных металлов, суперпероксиды известны только для элементов кальция subgroup. In отдельные состояния они не разделяли, но за счет разложения при определенных условиях производных псевдоксида типа Е02-2Ng02, максимальное содержание следующего суперпекса(мас. Была получена смесь состава хЭ (он) 2уэ02•э (02) 2: 40 (ca) 30 (SR) N 11(BA).При хранении, избегая контакта с воздухом, они стабилизируются, бурно взаимодействуют с водой и выделяют Сверхкислород. Из производных комплексного катиона был получен стабильный желтый пероксид тетраметиламмония — [N (CH3)]] 100°С 02 (mp 97°С).
53) радикал gndroperokenl (Н02) в основании Суперстраницы существует лишь мгновение, тогда схема 2Н02= Н » 02 +02.Однако некоторые его характеристики известны. Теплота образования от элемента составляет 5 ккал / моль. Потенциал ионизации равен 11,5 в, постоянная связи энл k (HO) равна 6,5 Н〜(00)= 6,2. Энергия связи Н-02 оценивается в 47 ккал / моль. Путем объединения 2 из этих радикалов можно получить перекись водорода (H2O).Существует предположение, что атомы водорода образуются частично в результате взаимодействия твердого озона prn −196°С с атомами водорода (по схеме = 2Н-f 203 «2но, + о, = НГО» + 02). 54) кроме упомянутых выше кольцевых производных Na, K, Rb, Cs,» озонатов » давно известны.
Эти вещества образуются в виде оранжево-коричневых корок на поверхности твердых гидроксидов, которые промываются озоном. Используя растворимость в жидком аммиаке(например, до 15 г / 100 г NH3 для калийных солей), можно выделить Озон ide в почти чистом состоянии. По суммарной схеме 4KOH + 40 ″ = 4K03 + 02 + 2H20(кроме того, вода связана избытком KOH) происходит образование озона калия, что лучше, чем у других объектов исследования. Энергия активации этой реакции составляет всего 3 ккал / моль, а теплота образования К03 из элементов составляет 62 ккал / моль. mol. It является красным кристаллическим веществом и мощным окислителем.
При хранении К03 медленно разлагается по формуле 2К03 = 2К0 + 02-f 11 ккал уже при нормальных условиях (эта реакция протекает быстро и полностью при+ 60°С).Согласно общей схеме 4К03+2НгО = 4 ■ ■ + 502 (по-видимому, промежуточное образование радикалов он), он мгновенно разлагается в water. By для сравнения, KOj-это типичная соль, образованная ионами K и O » [параметр RF (OO) −1.34 A и^ OO =» 100°].Другие рассматриваемые озониды обладают аналогичными свойствами и устойчивы к Na. К-РБ-КС будет увеличиваться. Например, Na03 разлагается уже при pr-10°C и только при Cs03-pr 100°C. Последняя соль синтезируется взаимодействием CsOj с озонированной oxygen.
It оказалось, что сродство молекулы озона к электронам равно 67 ккал / моль (44 ккал / моль, по другим данным).Обзорная статья с \ 55) в случае лития озон и q известны только в виде красных аммиачных комплексов[Lifhniblos, которые разлагаются при разложении NH*.Красные Зоиды также получены. * Токарева С, А.. Успехи химии, If7l, NT2, 296 ″ Аммоний-NH «Oj, уже разложенный согласно уравнению-126°С: 4NH» Oj = 4HjO + 2NH » NOj +Оа. Гораздо более стабильный (до 25°С)красный тетраметиламмониевый озоид-[N(CHj) 4] Os.
Существует специальная монография по пероксидным производным, описанным выше 56) Ляо, полученное сжиганием металла, содержит смесь Ляоа. Чистый оксид лития получают термическим разложением LljCOj(700°C в вакууме). в связи с оксидом натрия взаимодействие NaNj и NaNO *в вакууме позволяет достичь наилучших результатов:5 nanan3 + NaNOj = 8Na + 3NaaO. Оксид K, Rb или Cs рекомендуется получать путем окисления расплавленного металла недостаточным количеством кислорода с последующей отгонкой избытка металла под вакуумом.
Теплота образования оксидов 3jo из элементов равна (ккал / моль): 143 (LI), 99(Na), 86(K), 79 (Rb), 76 (Ca).Производное Li-Rb кристаллизуется в соответствии с типом CaFj (рисунок XI1-37), В то время как Cz20 кристаллизуется в соответствии с типом Cdla(ПК. X1ii-69) кристаллизуется в соответствии с обратной последовательностью катионов и анионов 1 < / (OS$) * = 2.86, d (CsCs) 4.19 A].Оксид лития входит в состав специального стекла (10-24% LlaO, 2-13% BeO, 70-83% BaOa), которое пропускает рентгеновские лучи. При нагревании Белый KjO станет желтым, светло-желтый RbjO станет красным, а оранжевый CsaO будет почти черным.
57) Что касается температур плавления и кипения окна, то приведены значения 1570 и 2600°С, но их испарение начинается гораздо раньше, с частичной диссоциацией элементов(около 1000°с оценивается в 10%). Молекула LijO явно линейна С d (LiO)=-1.60 A (XII§ 2, см. добавление 28). в серии Li-Cs слово volatility увеличивается. Так, при давлении 10 ″* мм рт. ст. LlaO будет испаряться незначительно до 980°с, испарение NaaO будет заметно примерно при 670, kzo-около 430, а CsaO-около 350°C.
At примерно при той же температуре начинается окисление Na-оксида, K. Rb. Cs по схеме 2EaO EaOa + 2E. расчеты показали, что натрий выше 1800°с не взаимодействует с кислородом. 58) некоторые свойства гидроксидов щелочных металлов сравниваются со следующими: LIOH NaOH KOH Rboh CsOH Формировать жару NC E20. ккал / моль. 。 。 。 。 Ил 18.1 24.4 25.3 25.1 Плотность. л / см’…………….. 1.4 2.1 2.1 3.2 3.7 Энергия кристаллической решетки, ккал / моль. 。 。 Двести пять триллионов сто семьдесят шесть миллиардов сто пятьдесят три миллиона сто сорок семь тысяч сто тридцать шесть
Триста двадцать один миллиард четыреста пять миллионов триста восемьдесят две тысячи триста сорок шесть Растворимость, моль / л ю При 15°С……………….. 15.9 19.2 17.9 25.3 При 30°С……………….. 29.8 16.9 22.5 20.2 7 марта 13.2 14.8 17.0 59) расплавленный гидроксид щелочного металла в основном имеет ионный характер structure. To сильно разъедают стеклянную, фарфоровую и платиновую посуду (в том числе воздушную), их растворяют с помощью емкости из серебра, никеля или железа. Система NaOH + KOH, которая содержит 50 моль% каждого компонента, плавится при 170°С.
60) взаимодействие расплавленного гидроксида натрия с окисляемым металлом протекает в основном по схеме (для 2-валентного M) 2NaOH + M — =»MO + NajO + Na + Na», и водород, практически нерастворимый в расплавленной щелочи, покидает зону реакции. Например, Ti, Ta, Cr, Cr, Mn реагируют в соответствии с этим типом. В качестве вторичной реакции могут выступать различные другие процессы. Например, NajO + МО = NasMOf (если будет) или NaaO + м = МО + 2Na(если М является чрезмерным). Расплавы NaOH реагируют с металлическим натрием по следующей схеме: 2Na-f-NaOH Нах + Наджо. с!)
При нагревании гидроксида лития выше температуры плавления пиролиз происходит по схеме 2 LiOH LijO +НзО. * Вольнов И. и щелочные и щелочноземельные металлы перекис, вадперекиск и озинда. М. » Наука.»В 1964 году, страница 123 При 600 ° С (а при 1070°С достигает давления диссоциации 1 атм).Гидроксид остальных щелочных металлов удаляет воду даже при нагревании до температуры кипения (NaOH-1378, KOH-1270 ° C).Однако при температуре более 2000°С, согласно схеме EOH + Q t ** e + OH, происходит диссоциация радикалов металла и он(IV§ 3 add.3) будет заметно.
Где Q 101 101 (Li). 77 (НС). 81 ©. 83 (РБ), 91(КС). 62) при относительно низкой температуре рассматриваемая пара гидроксидов в основном состоит из димерных молекул(например, при 660°с парциальные давления NaOH и (NaOH)^составляют 1•10〜e и 3-10 «* мм рт. ст. соответственно). Для теплоты димеризации по схеме „2EON“ — (EON) приведены следующие значения(ккал): 54(Na), 48 (K).45 (Rb), 40 (Cs) и сродство к протонам молекулы газообразного гидроксида-EON + H * — EON-значения 241(Li), 248(Na), 263(K).269 (КС).
63) насыщение при 600°С результаты микроволновой спектроскопии паров KOH и CsOH свидетельствуют о линейности обеих молекул[d (OH) » 0.97 A для d (KO) и d (CsO) получены соответственно 2.18 и 2.40 A. Аналогичные данные были получены для RbOH[d(RbO) −2.30, d(OH)= 0.95 A].Эти несколько неожиданные результаты могут быть связаны с недооценкой днмеризацни. Для дипольного момента пара CsOH дает ji = 7.1. 64) в нормальных условиях LiOH и NaOH отделяют от раствора, содержащего 1 молекулу кристаллической воды, KOH отделяют от раствора, содержащего 2 молекулы.
Давление водяного пара на насыщенный раствор гидроксида натрия и гидроксида калия при 25°С составляет 1,72 и 1,94 мм рт. ст. соответственно. Искусство. как вы можете видеть из rns. X111-22, точки кипения в общей сложности 50% растворов этих щелочей ω-20СО <t0 50 608%, вблизи друг друга, расходятся. Рисунок X1 I-22.Температура кипения-постоянная диссоциации Эона、 Инна растморская. Шаги 1.5 (Li), 3.4 (Na), 5.1 (K).
Гидроксид натрия И калий легко растворим в спирте метиловом и этиловом спирте:23.6 и 14.7 (NaOH) или 35.5 и 27,9 (ко) вес соответственно.% pr 28°C. растворимость NaOH и KOH в жидком аммиаке очень мала(при −40°C соответственно 3-10-4 и 3-10-4 мас.% ), Растворимость Rboh и CsOH значительно больше(около 1 г / 100 мл prn-40® C) 65) в промышленности часто приходится работать с сильными водными растворами NaOH и KOH, концентрация которых обычно выражается в процентах или плотности путем weight.
As для возможности фантастически преобразить великолепие полезно помнить, что в этих решениях первые 2 знака после запятой (г / см*) плотности примерно соответствуют проценту. Содержание.,.. … 5 U 15 20 25 30 35 40 45 50 Плотность NaOH……… 1.055 1.11 I. l7 1.22 1.28 1.С3 i3s успешно 1.43 1.48 133 Плотность кон……… 1,045 1,09 1,14 1,19 1,24 1.29 1.34 1.40 1.46 1.51 66)под воздействием едкой щелочи кожа человеческого тела становится опухшей, slippery.
In при более длительном действии образуется очень болезненный глубокий ожог. Особенно опасна едкая щелочь в глазах(рекомендуется использовать защитные очки).Щелочь на руках или платье следует немедленно смыть водой, затем смочить пораженный участок очень разбавленным раствором кислоты и снова промыть водой. Ткани из животных волокон быстро разрушаются щелочами, но растительные волокна относительно устойчивы по отношению к им(напротив, кислоты поедают растительные волокна быстрее, чем животные).
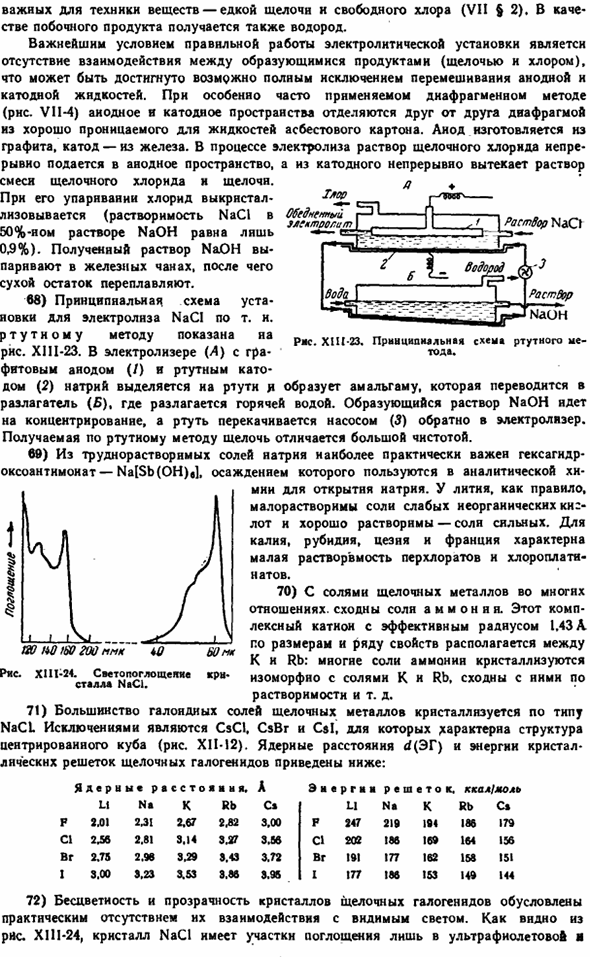
67) электролиз раствора NaCl (и KC1), и является 1 из основных процессов в химической промышленности、 Важные вещества в технологии-едкая щелочь и свободный хлор (VII§ 2).Водород также производится в качестве побочного продукта. Важнейшим условием правильной работы электролизного оборудования является отсутствие взаимодействия между образующимися продуктами (щелочью и хлором).Это может быть достигнуто путем полного исключения смешивания анода и катода.
Наиболее часто используемый фрагментарный метод (RNS. VI1-4), анодное и катодное пространства отделены друг от друга диафрагмой из картона на основе асбеста, которая хорошо проникает в жидкость. Анод выполнен из графита, а катод-из iron. In в процессе электролиза раствор щелочи непрерывно подается в анодное пространство, а раствор смеси хлорида щелочи и щелочи будет непрерывно вытекать из катода. При выпаривании хлорид кристаллизуется (растворимость NaCl в 50% растворе NaOH составляет всего 0,9%).Полученный раствор NaOH испаряется в резервуаре из железа, после чего сухой остаток повторно растворяется. 68) принципиальная схема установки для электролиза T NaCl.
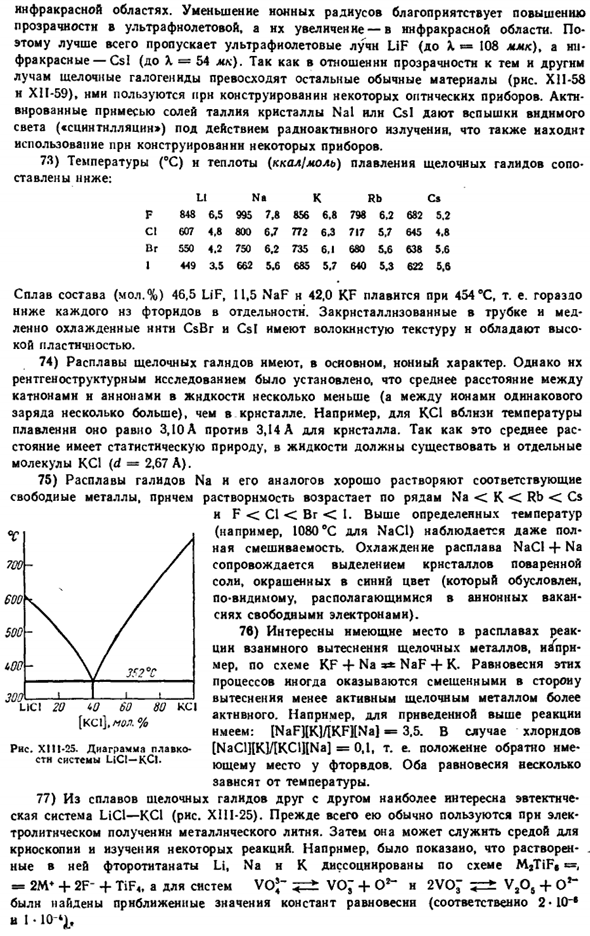
Ртутный показывает РНС. XII1-23.In электролизер (а) с графитовым катодом ( / ) и ртутным катодом(2), натрий выделяется поверх ртути с образованием амальгамы. Амальгама превращается в реагент (B), где она разлагается горячей водой. Полученный раствор NaOH концентрируют, а Ртуть перекачивают обратно в электролизер (5).Щелочь, полученная ртутным методом, очень чистая. 69) среди малорастворимых натриевых солей наиболее важным является гексагидро-оксо-Монат-Na [Sb (OH) g], осаждение которого используется для нахождения натрия в аналитических растворах. Chemistry.
In литий, как правило, слабо растворим в солях слабых неорганических кислот и хорошо растворим-в сильных солях. Калий, рубидий, цезий и Франция характеризуются низкой растворимостью перхлората и хлорат-платиновых солей. 70) во многих отношениях соли аммония сходны с солями щелочных металлов. Это соединение катионов с эффективным радиусом 1,43 и их размер и многие характеристики находятся между K и Rb. Многие соли аммония кристаллизуются в той же форме, что и соли K и Rb, и сходны по растворимости и так далее.
71) большинство галоидных солей щелочных металлов кристаллизуются в виде Nad, исключение составляет CsCI. В. Волков и КВЖД. Характерна структура Куба в центре (рис. XII-12).Ядерное расстояние< * (например) и энергия кристаллической решетки щелочного Галогенида показаны ниже. Ядерная * дистанция. А энергия определяется по ккал / Ил От Л1 на СА РБ от Л1 на РБ Са п 2L1 231 2.82 2.87 3.00 Р 247219194194188179 С1 2.56 2.81 3.14 3.27 3.Для Samsung Галактики С8 С1 202188189164156 Ч 2.98 2.75 3.29 3.43 3.72 Ч 19117718215815151 1 3.00 3.23 3.53 388 395 I 177188153149149144
72) бесцветность и прозрачность галогенированных щелочных кристаллов обусловлены тем, что они практически не взаимодействуют с видимым светом. как вы можете видеть из rns. ■ XI11-24, кристаллы NaCl имеют место абсорбции только к ультрафиолетовому свету Раствора NaOH Гонка XSh-23.Принципиальная схема ртутного метода. Дефицит хлора 5 * 1 9л? 1-1 GS by TSO 200 PMC XI11-24. Группа поглощения света NaCl. Ряса. Инфракрасной области.
Уменьшение ионного радиуса способствует повышению прозрачности ультрафиолетовых лучей и помогает увеличить прозрачность инфракрасных лучей. Таким образом, ультрафиолетовый LIF (до х 108 ММК) и инфракрасный Csl(до I. лучше всего пропускать его (=54 мкм). с точки зрения прозрачности для этих и других лучей щелочные галогениды лучше, чем другие обычные материалы (рисунки Х11-58 и Х1-59).Используется в конструкции некоторых оптических приборов.
Кристаллы n’Al или Csl, которые активируются смесью солей таллия, производят вспышку видимого света («сцинтилляцию») под воздействием радиоактивного излучения, которое также используется в конструкции некоторых приборов. 73) температура плавления щелочных галогенидов (®С) и теплота (ккал / моль) сравниваются ниже. Ли не на CS РБ F 848 6.5 995 7.8 856 6.8 798 6.2 682 5.2 CI G07 4.8 800 67 772 6.3 717 5.7 645 4.8 Br 550 4.2 750 6.2 735 6.1 680 5.6 638 5.6 I 449 3.5 662 5.6 685 5.7 640 54622 5.6 Состав сплава(мол.(% ) 46,5 LiF, 11,5 NaF и 42,0 KF расплавляются при 454 eC.
То есть она будет значительно ниже, чем у каждого фторида. Кристаллизованные в трубке, медленное охлаждение нитей CsBr и Csl имеют волокнистую текстуру и обладают высокой пластичностью. 74) расплавы щелочного блеска обладают свойствами преимущественно noium. Однако их Рентгеноструктурные исследования показали, что среднее расстояние между катионами и анонами в жидкости несколько меньше, чем в кристаллах(а между ионами того же заряда-чуть больше).Например, KC1 вблизи точки плавления составляет 3,14 а относительно 3,10 а Кристалла.
Поскольку это среднее расстояние носит статистический характер, в жидкости также должны быть отдельные молекулы KC1 (d = 2.67 A). 75) расплавы Garland Na и его аналогов хорошо растворяют соответствующий свободный металл, повышая растворимость в серии Na <K < Rb <Cs И F <CI <Br <I. Если определенная температура превышена (например, в случае NaCl, 1080°C), то наблюдается даже полная смешиваемость. NaCl-f Na охлаждение расплава сопровождается выделением кристаллов голубой соли(это, по-видимому, связано со свободными электронами, находящимися в анионных вакансиях).
76) например, согласно KF-f Na Naf-f K, интересна реакция взаимного замещения щелочных металлов, происходящая в расплаве. Например, для реакции, описанной выше: INaFJlKl / lKFKNa) — = 3.5.Хлорид [NaCl] [Kl / IKCll [Na] = 0,1, то есть положение такое же, как и для фторида. Оба равновесия несколько зависят от температуры. 77) среди сплавов в щелочно-галоидных кристаллах, самое интересное, эвтектика LiCl-примесями КС1(рис. XI11-25).
Прежде всего, он обычно используется в электролитическом производстве металлического лития. Затем он может служить средой для криоконсервации и изучения определенных реакций. Например, указывается на растворение. Фтортитанаты Li, Na и K в нем диссоциируют по схеме Matifea=α, — 2M * + 2F- + TiF4, а в системе VOj»VO ^ + O «n 2VO. V305 +О «найдены приближенные значения константы равновесия (2″10〜 n I-10 часов соответственно Рисунок XI11-25. LlCt-KS / схема плавкости системы. 78) при прямом слиянии любых 2 щелочных желез происходит обмен ионов по схеме AH — f-BY * * AY + BX.
Направление равновесного смещения в подобной ионной системе без растворителя определяется образованием солевых пар из наименьшего не-и тем, что образование солевых пар из наибольшего является более энергетически выгодным. Например, система NaCl + Rbl более стабильна, чем система Nal + RbCI. По-видимому, подобное преобладание взаимодействия одних и тех же атомов над взаимодействием разных атомов обусловлено строением эвтектической системы металла(XI§ 3). 79) температура кипения щелочных желез (°С) и теплота испарения (ккал / моль) сравниваются со следующими значениями:
Ли на в РБ КС Р 1724 51.0 1785 50.5 1502 41.3 1408 39.5 1251 CI 1397 36.0 1465 48.8 1407 38.8 1381 36.9 1300 35.7 Чт 1310 35.4 1392 38.7 1383 37.1 1352 37.1 1300 36.0 Я 1171 40.8 1304 38.2 1324 34.7 1304 36.0 1280 35.9 80) при относительно низкой температуре (вблизи точки плавления) щелочные парные железы содержат не только простые молекулы ЭГ, но и часть полимера (ЭГ).Стабильность последних обычно снижается с увеличением ионного радиуса, а именно в сериях Li > Na> K > Rb> Cs и F> CI> Br> I. пары фторида лития содержат около 49%LiF, 36% LijFj, 15% LisF «(и в некоторых случаях очень малые количества макромолекул), пары хлорида натрия-74% NaCl, 25% Na2Cla и 1% Na » Cl и пар.
Иодид цезия-97%Csl и 3%Cs2Ij. 2EG = = 2g2 для энергии daimelanza Sinn по схеме приведены следующие значения(ккал / моль): LljPj Na2Fj KjFj RbjFj CsaPa Cs2Cla Cs2Br2 Csjlj 58 54 48 42 37 32 31 31 Для NaCl эта энергия составляет 45 ккал / mol. As температура повышается, содержание полимера уменьшается, и при температуре кипения пар почти исключительно состоит из молекул мономера nz.
Структурно изучены некоторые димеры Li / IY. {/(Лит) и ЗН. для него даны значения 2.23 A и 108e (C1), 2.35 A и 110e (Br) соответственно. 2.54 а и 116°(1). 81) Как видно из приведенного выше резюме, атомно-ядерное расстояние газообразных молекул ЭГ(g#.А) намного меньше, чем его кристаллическая решетка (добавить 71): Ли на в РБ КС Ф 1.56 1.93 2.17 2.27 2.34 ИЦ 2.02 2.36 2.67 2.91 2.79 БР 2.17 2.50 2.82 2.94 3.07 Я 2.39 2.71 3.05 3.18 331 82)в некоторых молекулах ЭГ величина дипольного момента известна.
Если Исходя из них и вычисляя полярность связей (III§p дополнительно 2), получаем следующий результат: УФ ККИ УБР Лил натра NaBf нал кал примесями КС1 КБР ки РБФ rbci в данный момент RbBr ФГО Цсци ЦНБ с-10、8.33 7.13 6.19 6.25 9.00 9、| 2 9.24 8.62 10.27 10.41 11.05 8.С5 10 10.51 7.88 10.42 10.2 П3р 0.85 0.73 0.60 0.55 0.80 0.76 0.71 0.83 0.80 0.77 0.77 0.78 0.79 0.71 0.70 0.75 0.64 Поэтому связывание молекулы щелочного гуллида существенно отличается от связи чистого Иона(reg-1). По мере повышения температуры эта разница становится больше pronounced. As можно видеть из приведенных ниже данных, например, энергия диссоциации molecules.
By нейтральные атомы меньше, чем еженедельная диссоциация (ккал / моль) Я и атом I a i O i s Ли на К РБ с » Ли На к КБ Калифорния с. 138 115 119 ИИС 116 с. 181 152 137 131 128 C1 113 99 102 111 102 CI 151 118 III 107 Wh 101 89 92 91 91 Bf 144128110107103 I 85 72 78 78 76 I 136118104100 95 95 Таким образом, пиролиз галогенированной щелочи не гетеролитичен, а гомогенен(III§ 5 add.9).
83) растворимость щелочно-Галоидных указано на РНС. Длина X111-3 и нормальные условия показаны в следующей сводке: R 1-я » Восточная вода (моль / л HjO при 18°С) Ли на в РБ КС П 0.1 И. Я 15.9 12.5 24.2 КИ 18.6 5.8 4 ЯШ 7Л 10.9 БР 20.3 8л 8.4 6.5 5.8 1 12.2 IM 8.8 12 2.8 По-видимому, минимальная растворимость намечена для соли (NaF-KCI-RbBr-Csl) элемента с близким атомным весом. Однако такие закономерности носят случайный характер, поскольку относительная растворимость отдельных солей может меняться местами из-за изменения температуры(см. NaCI и KBr, например, RNS XII1-3).
В случае NaF было показано, что растворимость увеличивается до 100°C и непрерывно уменьшается с дальнейшим повышением температуры. 84) большинство щелочных желез отделяются от раствора в безводном виде. Кристаллогидрат образует следующие соли: LiCl-HjO, LiBr-2HjO, EXTR NaBr♦2H | 0, NaI 2H, 0. Кф-2ГА РБФ-ViHjO, ФГО VaHjO. При содержании менее +0,15 эк NaCl-2H, 0 можно отделить в виде кристаллогидрата NaCl-2H, 0. Обратите внимание, что кристаллы NaCI всегда содержат следы NaOH (естественная каменная соль в этом отношении является самой чистой).
85) вязкость водных растворов щелочных галогенидов иногда больше, а иногда ниже, чем вязкость самой воды (IV§ 3 add. 12). поэтому prn 25°relative относительное («1» Вода) значение раствора IM равно 1,14(LIC1). 1.10 (нацмен), 0.99 (ККИ), 0.93(ки).Эффект снижения вязкости становится более выраженным при низких температурах и практически исчезает при 50°С. в растворе К1 он максимизируется при 0°С и концентрации 3 м. При растворении электролита в неводной среде вязкость обычно значительно возрастает.
Например, вязкость I M KI раствора жидкого аммиака (pr-33°C) на 40% выше, чем у самого растворителя. 88) как уже упоминалось (IX§ I дополнение 24), некоторые щелочные галлы легко растворяются в жидком аммиаке. Аммиак, например 1Na (NHs) n fI (mp.3°С) можно отделить от такого раствора. При 25°с, NН3 давления выше-420 мм рт. Искусство. Для константы силовой связи N — ^ Na задается значением » 1.9. 87) растворимость щелочных желез в органических растворителях обычно невелика. Исключение составляет в основном солнце.
Например, молярная плотность насыщенного раствора безводного эфира при 25°С составляет 3 * 10-4 (LIC1), 1,18 (LlBr), 3,48(Lil), в то время как большинство других щелочей в эфире практически нерастворимы. Растворимость в низших спиртах относительно высока(г на 100 г растворителя при комнатной температуре):^. — *. Нацмен NaBr нал ККИ КБР ки CHgOH 1.4 17.4 77.7 0.5 2.0 16£ CjHsOH 0.07 2.3 43.1 0.003 0.14 1.75 В хлоридах растворимость в спирте составляет Li > Na> K <Rb.<. было показано, что в ряду Cs изменяется и увеличивается с нагреванием и уменьшается с ростом.
Молекулярная масса спирта(кроме того, его растворимость в язоспрнт выше, чем обычно).Интересен ход констант диссоциации хлоридов в смеси диоксиданов (70%) и воды (30%)-значения к-10 были равны: 2,9(Li), 5,3(Na), 2,4(K), 2,6 (Rb) и 2,7(Cs).Для изученного в (CH»)»] C1 в то же время одно и то же значение равно 2.2.So, в этой смеси е » −20(см. Рисунок Х-31) оказалось, что все рассмотренные соли являются довольно слабыми электролитами. 88)существуют различные практические применения отдельных щелочей gullies.
So Наф используется для защиты от гнили путем пропитки древесины (железнодорожных шпал и др.). Бромидная и йодидная соль Na до K используется в медицине (часто используется под неправильным названием «бром»,» белый йод » и др.). 89) интересным производным щелочных металлов (и аммония) является полигарид общей формулы MG.Простейшим выпрямителем этого типа образования является Ион IJ (VII§ 4 add.39). Полифториды не были получены, и из Полихлоридов были выделены только отдельные производные очень объемных катионов(например, в (CHS) JCU).
Напротив, многие смешанные полигалогениды типа MG, которые содержат полибромидные и ядерные связи, и в то же время различные галогены, очень хорошо studied. To характеристика их устойчивости зависит от природы комплексообразователя, константы неустойчивости ионов типа G1 сравниваются ниже. В водном растворе 25°C; — м 1У г в ВГ и [Яц] К * в-10-1 в-кг * 7-i0 не- * 90) соли щелочных металлов типа eg безводные, K. It получается только для Rb и Cs (и NH -).Цвет этих соединений варьируется от желтого Торо до красного, почти черного, в зависимости от общего CI, Idn I. их термическая стабильность зависит от природы катионов и состава
Анона, как видно из данных о давлении диссоциации солей типа E1G * при 150°C (мм рт. ст.), приведенных ниже. Rbictj CsICl] RblBfj C * I Bra Rblli C»IIj 607 114 248 86 30 12 Согласно ультракрасной спектроскопии, ионы ICIJ BrCI ^. Br ^ CIFJ, C1J линейны и symmetric. In первый из них, rf (lCI) — 2.55 A. 91) сравнение ядерных расстояний в ионах (IIjl » показывает их зависимость от размера НХ » ли! Ал Ctfllal1.Al. <*(Г-1А) е. 11 2.90 3.03 в д(Я-л) 2.79 2.86 2.90 в Как видно из этих рентгеновских дифракционных данных, по мере увеличения катиона расстояние между атомами йода становится близким, и в триаде очень больших тетрафенилалсоканалов они выравниваются.
Это, очевидно. Положение равновесия I — + Ia * * 1 ″ 1a * * [IIIJ-зависит от силового поля катиона. Относительно большое значение для этого поля (LI . в случае Na) равновесие сдвигается почти полностью влево и трииодион не образуется, но интенсивность катионного поля, поляризационное взаимодействие I—и 1a, усиливается, что в конечном итоге приводит к появлению силовой постоянной 0,71 2 аналогичных связей (возможно, 3 электрона).
Заряд, а также две крайности x-po −0,5 е. форма Иона[Pa] — 3 близка к линейной во всех случаях (Z111 = 176-177°). в то же время было показано, что[N (C2Hs)×] b существует в 2 структурированных симметричных и асимметричных анионах I. 92) более сложные полиноды щелочных металлов известны только в виде кристаллических сольватов, таких как, например, KU-2C, Hfc RbI2-4C «H ^ RbIe-4CiH».
Более типичным является Поли Галоид для очень громоздких катионов. Например, известны отдельные производные типаN (CH»)«, значение «]l-2, 3n4. Результаты рентгеноструктурных исследований их кристаллов указывают на то, что более высоким днем, вероятно, будет то или иное соединение, и что роль сольватированных частиц, вероятно, будет производным кристаллического типа растворителя, играемого 12 молекулами, которые более или менее деформируются в зависимости от природы окружающей среды.
Однако этот вывод применим только к кристаллам. 93) в случае ряда Li-Cs растворимость полигалатов в воде уменьшается, а стабильность улучшается. Наиболее стабильным НС полиглоидным Ионом является АМЛ, который дает желтую соль для всех щелочных металлов (за счет действия хлора на концентрированный соляной раствор соответствующего нодида).
Свободную кислоту N выделяли в виде оранжево-желтого кристаллогидрата HIClj-4H20.Для эффективного атомного заряда ионов(ICIJ) предложены значения −0,52 (CI) и+1,08 (1), а для константы прочности связи κ (1C1)= 1,6.Эта не-форма при рентгеноструктурном исследовании кристаллов KIICIJ — HjO имеет искаженную квадратную форму с 4 различными ядерными расстояниями 4 (1C1)= 2.42.2.47, 2.53 и 2.60 A. очевидно, что их различие обусловлено общим составом кристаллов, а не свойствами самих ионов. 。
Среди других подобных соединений известна бесцветная соль типа M (ГР4) (г-CI, br, I).Стабильность снижается в соответствии с Cs > Rb> K. энергия разложения и взаимодействия с водой изменяется в серии CI> Br> I. Ион[BrFj » представляет собой плоский квадрат rf (BrF)= 1.88 A. для постоянной силы связи в Ионе (ER ^задается значение k (BiF)»)= 2.38 n #c(C! Е) в 2 11. Комплексами рециркуляции выхлопных газов типа CS, RB и K являются также известный (гамма-Бр я).
94) при хранении на воздухе почти все полигалогены распадаются постепенно с удалением свободных галогенов. Этот распад протекает быстрее, когда полигалоген нагревается или контактирует с жидкостью, которая хорошо растворяется в свободных галогенах (SSC, эфир и т. д.).
В случае смешанных полигалогенидов разложение происходит таким образом, что образуются соли щелочных металлов, содержащие наиболее химически активные галогены. Пример, схема K! С!- Это пиролиз по-C1a + KIClj-KC1 + 1CI. Есть обзорная статья о Semi-Галоидных*. 95) при пропускании сухого водорода через нагретый металл образуется гидрид интия и его аналог (Ен).Взаимодействие сопровождается значительным уменьшением (% ) объема исходного металла: 25 (LI), 26 (Na), 40 (K), 41 (Rb), 45 (Cs).по внешнему виду и большинству физических свойств гидрид напоминает солнце соответствующего Галогенида.
Именно поэтому ИГИЛ изучается лучше других продуктов, образуя твердые бесцветные кристаллы. Такое свойство, как соль рассматриваемого гидрида, было также непосредственно доказано образованием водорода при электролизе расплава LiH на аноде. Взаимодействие водорода с нагретыми щелочными металлами происходит медленнее, чем с щелочноземельными металлами. Для Li его нужно нагреть до 700-800°C, но его аналоги будут взаимодействовать даже при 350-400°C. Для максимального использования металла рекомендуется ввести пару в реакционное пространство.
Можно также воспользоваться тем, что при нагревании в атмосфере водорода гидриды сублимируются (хотя и трудно) и оседают в холодной части реакционного сосуда в виде бесцветного, игольчатого или шерстисто спутанного кристаллического вещества mass. An интересным способом образования рассматриваемого гидрида (вместе с оксидом Е20) является взаимодействие щелочного металла с его расплавленным гидроксидом (дополнительно 60).
96) приведены следующие значения теплоты, выделяемой из элементов, ядерного расстояния в Кристалле (например, NaCl) и энергии кристаллической решетки гидрида щелочного металла. * Степам Б. Д.. Плющев В. Е.. Факеев. А.. Успехи химии, 1965, м II, 1881, Ооаловска А, А.. Химический успех, 1967, м 10, 1673、 Теплота образования, ккал / моль. Ядерная дистанция. Л…… Энергия решетки, ккал / моль. 。 。 L1H NaH KH RbH CsH 21.7 13.5 13.8 13.0 13.5 2.44 2.04 2.85 3.02 3.19 Двести семнадцать триллионов сто девяносто три миллиарда сто семьдесят миллионов сто шестьдесят четыре тысячи сто пятьдесят шесть
97) из отдельных молекул наиболее характерен гидрид лития. Молекула ИГИЛ полярна (q = 5,88). Длина связи LI-H равна d = 1,60 А. постоянная k силы в энергии диссоциации 1,0 I составляет 56 ккал / моль. Gndnda молекулы натрия 1.89 А. 98)по термической стабильности гидриды Na-Cs близки друг к другу-давление диссоциации nx достигает 760 liHg. Art. At следующая температура (°C): 420(Na). 427©. 364 (РБ). 389 (Cs). в отсутствие избытка водорода все они разлагаются на элементы еще до достижения температуры плавления.
Напротив того. ИГИЛ даже более стабилен, чем гидрид щелочноземельного металла в стабильности(XII§ 3 add.23): его диссоциации давления пр 500 ° С составляет только 0,07 мм рт. Искусство. Только около 850°c достигает атмосферы под давлением водорода, температура плавления NaH составляет более 800 ° C (то есть она превышает температуру плавления NaCl).
99) гидрид щелочного металла является очень сильным восстановителем. Их окисление кислородом воздуха в сухом состоянии происходит относительно медленно, но в присутствии влаги процесс очень ускоряется, что может привести к самовозгоранию гидридов. Это связано с тем, что гидрид к. это особенно верно для Rb и Cs. Бурная реакция с водой происходит по схеме EN + H20 = H2f + EOH, или Н〜 + H4H2f. при взаимодействии NaH или KH с углекислым газом образуется соответствующая соль муравьиной кислоты.
100) ИГИЛ заметно отличается от своих собратьев по reactivity. At нормальная температура без влаги, не только атмосферный кислород, но и C12 и HCI на нее не действуют. Наоборот, при нагревании или в присутствии воды ведет себя очень похоже на другие гидриды щелочных металлов. При хранении бесцветных кристаллов ИГИЛ на свету они постепенно синеют. Появление этого окна, вероятно, связано с частичным переходом электронов из H в пустоты решетки. 101) гидрид натрия иногда используется в металлургии для отделения редких металлов от соединений.
Используя 2% раствор расплава NaOH, окалину удаляют из стального изделия(после выдержки в течение 1 минуты второстепенный продукт погружают в воду, окалина, восстановленная по формуле Fe304 + 4NaH * * 4NaOH 4-3Fe, исчезнет).При электролизе такого раствора в катоде выделяется натрий, а в аноде-водород. 102) Борат щелочного металла был рассмотрен ранее(добавлен XI§ I. 99).Ядерное расстояние между центрами Ноны и энергией решетки, характерной для кристаллов (таких как NaCl), сравнивается со следующим. L1BH «NaBH» KVN «RbBH» SzVN「 3.08 3.71 3.51 3.36. 。
Сто восемьдесят шесть триллионов сто шестьдесят восемь миллиардов сто пятьдесят девять миллионов сто пятьдесят пять тысяч сто пятьдесят Ядерная дистанция. А. 。Энергетическая сеть. ккал 1 моль Псевдонимы Li, Na и K также рассматривались ранее(XI§ 2 add.78). 103) азид щелочного металла может быть получен по схеме 32COs + 2HNs = » Н20+ C02f-f 23Nj. Они представляют собой бесцветные кристаллические вещества, которые при нагревании начинают разлагаться на элементы еще до достижения температуры плавления.
Растворимость hx в нормальных условиях составляет около 100 (42 (Na), 50 (K), 100 (Rb) и 300(Cs) г на H2O. энергия кристаллической решетки (ккал / моль): 194 (Li), 175 (Na), 157 (K), 152 (Rb) и 146 (Cs).Азид реагирует с сероуглеродом в водной среде по схеме KN3 + CS2 = — KSCSNj, а ASD-тионатом (x§ 1 add.105), а йод (в присутствии следовых количеств ССТ)-реагируют по схеме 2KN3 + b = 2KI +ЗМ2. 104) температура плавления нитрата щелочного металла не очень высока (°C): 253(Li), 306(Na), 334(K). 310 (Rb), 406 (Cs).Когда давление повышается (До 1 млн.)
Температура плавления Линоя. NaNOj и CsNOj увеличиваются последовательно, но для RbNOj они проходят через минимальное значение, а для KNOj они проходят через максимальное значение. Рентгеновские исследования расплавов NaNOj и KNOj показали, что их структура близка к кристаллической. Под вакуумом 350-450 ° С большая часть нитратов, о которых идет речь, удаляется из расплава без какой-либо значительной деградации. При температуре этого разложения, основанной на схеме 23ной 2EMO * + O, значения указаны от 475 (Li) до 585eC(Cs).
Пара молекул Линой и NaNOj иметь параметр D (Лио) * = 1.60 HNOj молекулы (ІХ§ 3 Добавить.45) имеет аналогичную структуру. д (НАО) — 1.90. d (ON)-1.40,d(NO) −1.22 A, Z30N-105°,^ 0 = «N =» 0 = » 134°. 105) сплавы NaNOj и KNOj характеризуются эвтектикой с температурой затвердевания 225,7°C (pr 55 мол.%KNOj).Система имеет высокое значение константы ручки-объема (20,75 градуса) и может быть использована как средство для замерзая осмотра. Например, мы обнаружили, что константы диссоциации PbC12 и CdClj в нем составляют 3-10 * ’и I•10-4 соответственно.
106) XII1-5 из диаграммы видно, что с повышением температуры растворимость нитратов значительно возрастает. Кручение кривой нитрата лития обусловлено различной растворимостью отдельных гидратов (v§ 2).Нитраты других щелочных металлов не образуют кристаллогидратов, поэтому такой поворот кривой их растворимости отсутствует. 107) в случае нитратов, K. Rb и Cs. In добавление к безводной соли кристаллического продукта присоединения азотной кислоты общей формулы 3NOj o HNOj n 3NOj-2HNOj является known.
It выделяется из раствора соответствующих нитратов, содержащих большой избыток свободной HNOj(IX§ 3 add.48).Примером может служить CsNOj•HNOj(decomp. At mp 104°C) и CsNOj-2HNOj (decomp. In mp 39°C). Эвтектика системы HNOj-CsNOj составляет 13 моль. С% соли-это при 62 * С. 108) большая часть потребляемой Нанож получается как побочный продукт производства азотной кислоты (за счет поглощения щелочью оксидов азота из выхлопных газов).Нитрат калия обычно получают путем обменного разложения KCl и NaNOj.
109) нитрит щелочного металла (3N02) представляет собой бесцветное (или слегка желтоватое) кристаллическое вещество, очень растворимое в воде(Лино-и спирте).Точка плавления (®С) равна 220 (Li). 283 (Na), 438(K). 422 (РБ), 398 (КС).Наиболее важными являются NaNOj и KN02.Они главным образом использованы в органическом синтезе.
110) интересной реакцией нитрита в щелочных (щелочноземельных) металлах является взаимодействие оксида азота с твердым гидроксидом по схеме 2EOH + 4NO 23no + NjO + NaO. Процесс протекает медленно в нормальных условиях, и скорость вдоль ряда Li-Cs резко возрастает. При нагревании взаимодействие протекает значительно быстрее, но в основном следует другой схеме: 4EON-f 6NO■= ■ = 43NOj + Nj + 2HjO.
Пиролиз нитрита натрия протекает при температуре около 4°С в соответствии с общей формулой: 4NaN02 = 2NaaO•+2n2 + 302.Под вакуумом 350-500°C нитрит натрия и нитрит калия удаляются из расплава без какой-либо значительной деградации. 111) из перхлоратов щелочных металлов только соли U и Na растворимы в воде и некоторых органических растворителях (25°C в г / 100 г растворителей: H2O CH, 0H C2H $ OH CHjCOCHJ CHJCOOCHj (CjHtfaO ЛИЧИО » 27.2 6Л.6 60.3 57.7 48.8 53.2 Некло » 67.7 33.9 12.8 34.1 8.8 0 Сюй » 1.3 0.15 0.1 0.01 0.001 0 При безводной хлорной кислоте при 0 °
С растворимость изменяется следующим образом (г / 100 г): 0,106 (Li), 0,628(Na), 4,26(K). 22.6 (РБ), 68.4(КС). Термическая стабильность перхлоратов возрастает по ряду Li-Cs, плавление сопровождается разложением (VII§ 2, доп.58).Исключение составляет LiCIO * cat o- Он плавится при 247 ° С, и только около 500 х начинает разлагаться. Эта соль(Линой и др.) представляет интерес для реакционной технологии из-за большого весового содержания в ней активного кислорода.
Эвтектика образуется с обеими солями (46,5 моль.%Линой) плавление пр 172 * С 112) перманганат щелочного металла аналогичен по растворимости перхлорату (VII§ 6 add.53).Их термическая стабильность несколько ниже, а температура разложения задается следующими значениями: 190 (Li). 170 (НС). 240©. 259 (РБ). 320 (КС). FM) чистый бикарбонат натрия получают действием СО *на содовый раствор путем обратной реакции с pyrolysis.
In теплый содовый раствор насыщения (30-40°С), через него проходит струя углекислого газа. Через некоторое время осадки NaHCOj начинается. Кристаллы NaHCOj состоят из цепочек анионов HCOJ. Водородной связью(РНС. XIII-26) соединены друг с другом через, где< / (0 — H) «1,07 n НС ^ ТН ^ У4 ОО#ы» — н Схема XHI-2 и aiyonio цепная схема ■ Кристалл NaflCOj. РФ (О… H)= * > 1.56 A(между обоими положениями происходит колебание протона), и катион Na * находится между этими цепями.
Отличительной особенностью раствора этой соли является концентрационно-зависимое значение рН 8,4. 114)в кондитерской и хлебопекарной промышленности NaHCO1 используется в составе разрыхлителя. Последний обычно представляет собой смесь бикарбоната натрия и других термически стабильных кислотных солей (таких как NaH2PO4).для предотвращения преждевременного взаимодействия обеих солей в смесь часто добавляют крахмал.
При смешивании разрыхлителя с тестом, например, реакция начинается по схеме NaHCOj + NaH2P04 = ««= Na2HP04 + CO » + H20, и пузырьки воздуха выделяющегося углекислого газа задерживаются в тесте. Во время выпечки эти пузырьки расширяются за счет нагрева, придавая тесту необходимую пористость. 115) мелкодисперсный порошок NaHCO3 (содержащий небольшое количество добавок для предотвращения слеживания) используется при сухом тушении пожара.
При выбросе из огнетушителя (под давлением СО2) он образует плотное облако, которое защищает человека от теплового излучения, тем самым давая ему возможность приблизиться к месту пожара. Когда NaHCOj разрушается под воздействием огня, образующаяся газовая смесь COj + HjO подавляет, кроме того, на горящий материал осаждается сухая пленка NaaCOj, что также способствует его изоляции от воздуха.
Такой огнетушитель успешно применяется для тушения горящих масел, масел и др. 116) имеются данные о возможности получения бикарбоната лития путем смешивания раствора LiCl и NH4HCO при 0°C*.Состав осадка быстро разлагается до u2coj-1,65 H / CO / 0°C и выше при последовательной промывке насыщенной CO2 холодной водой, спиртом и эфиром.
Более стабильная форма LiHCOj явно получается осаждением насыщенного углекислым газом раствора LijCOj безводным спиртом. В том числе gelatin. It сообщается, что такой (защищенный желатином) Лихкои не разлагается при комнатной температуре. 117) температура плавления карбонатов щелочных металлов (в атмосфере CO2) очень высока: LUCO,-720, Na2COj-854,KiCOj-901, Rb2COj-873.CsjCOj-794 С. 56 мол.%Na2COj + 44 kjcoj смесь гораздо менее растворима, чем каждая из этих солей (mp 710°С).
При нагревании карбонатов начинается их диссоциация с оксидами металлов и углеродом dioxide. As видно из термическая стабильность карбонатов las XII1-27 увеличивается при переходе от Li к K и уменьшается от K к Cz. Растворимость LIjCOj в нормальных условиях составляет около 0,17 моль! L, он уменьшается с увеличением температуры. Раствор NajCOj показывает сильно щелочную реакцию (0,1 Н раствор, рН =»10,9, а I N-12,3).Смесь равных количеств Na2COj и раствора NaHCO 0,025 М составляет рН = 10,02(25°С).
118) при взаимодействии с перекисью водорода карбонаты щелочных металлов могут образовывать пероксиды E2C0e-1H202 со склонностью к атомам Из лития (вопрос о его существовании пока не ясен) вырастает кессон. L-I или 2 является характеристикой SOD и K, Rb, C3-3 (но для Rb и C3 возможны более высокие значения i).Карбонат цезия обладает превосходной способностью образовывать метиловый спирт и кристаллический сольват-CsjCOj — * 6CH, OH. 119) помимо непосредственного использования соды при стирке белья, для этой цели могут быть приготовлены специальные составы.
Такие стиральные порошки могут быть включены, например. 88%соды, 10% гипосульфита, 2%буры. 120) в РНС приведена принципиальная схема оборудования завода по производству соды по аммиачному способу (Solve, 1863). XII1-28.In в печи (а) известняк сжигается, и полученный CO поступает в Карбидную башню (В), а после того, как CaO гасится водой ©, Ca (OH) 2 закачивается в смеситель (D), непосредственно контактируя с NH4CI (аммиак) высвобождается.
Последние поступают в абсорбционный аппарат (D), где насыщают их сильным раствором NaCl. Затем раствор NaCl перекачивается в Карбидную башню. Образовано NaHCO» и NH » Cl. Первые соли оседают почти полыми и остаются в вакуум-фильтре ( £ ), вторые соли снова закачиваются в смеситель (G).так, NaCl и известняк всегда расходуются, а NaHCOj и CaClj получают(последний в виде отходов перфорации).Бикарбонат натрия переходит при нагревании в соду. 121) для природного источника NajSO, старый сульфатный метод производства соды также может быть экономически эффективным(Leblai, 1791).
Последнее осуществляется путем плавления при 1000°с Na2SO<, смеси известняка и coal. In в этом случае происходит следующая реакция: Na2SO «- f 2C 4- + CaCO» 4-52 ккал » 2COjf 4-Na2CO $ 4-CaS. Сода отделяется от плохо растворимого КАС путем обработки сплава водой. Отходы производства-CaS-выступают в качестве исходного материала для производства H2S и серы. 122) природная сода содержится в водах содового озера (Танатар и др.) в нашей стране в Западной Сибири. Образование соды в них обусловлено бактериальным восстановлением Na * S04 до Na2S (VIII§ 2) и переходом последнего в Na2C03 под действием воды и углекислого газа.
Выделившийся сероводород удаляется соединением железа, обычно содержащимся в воде, образуя черный ил FeS. Сода может быть извлечена из таких озер путем испарения или замораживания воды. 123) иногда даже отложения соды в виде минерала под названием Na2COs-NaHCO *•2H * 0 скапливаются на дне таких озер. Кристаллы этого соединения характеризуются наличием Иона H (CO$) J», который образуется в результате связывания 2 ионов. ООО ВОО РНС. xi11-27.
Равновесие термической диссоциации карбонатов. Рисунок XIII-28.Схема производства соды аммиачным способом. COJ «короткая водородная связь[d (00)» 2.53 A].Аналогичная C0 \ — это попарная комбинация Ионов, но уже есть 2 водородные связи(d (00) 2.52 A], которые характерны для кристаллов KHCO. 124) производство калия из природного КС1 осуществляется 2 способами.1 из них относится к обработке углекислым газом Кон, который получают электролизом раствора КС.
Другой 1 основан на низкой растворимости двойной соли khc0j’mgc1-MgC03-4Hj0, которая образуется при насыщении CO суспензией MgCO3 3HtO в растворе KCC. Под влиянием MgO двойная соль разлагается на KjCOj и MgCOj * ЗН20 и возвращается в производство. J25) среднее содержание калия в золе растений относительно низкое(мас.%). Береза осина, сосна, Иракский картофель, полынь На вершине 20 23 27 30S 7S Основными источниками сопутствующего калия являются зола подсолнечника (содержащая до 50% CaCO3), отходы сахарного производства и переработки шерсти.
126) раствор К из серной кислоты К. Rb и Cs кристаллизуются в безводной форме. Соли L1 и Na выделяются в виде кристаллогидратов LijSO»•HjO и Na3SO » при нормальных условиях.* ООН, 0. 1-ое одно очень стабилизировано и 2-ое одно может только существовать на 32.4°C. точка плавления безводного сульфата очень высока: LijSO » −860, Na, SO «-882,KjS04-1069, RbjSO»-1066, Cs2SO» −1019 cC. Их волатильность варьируется в порядок литий> На <к < 2NaHSO» = — Н2О+ NajSaO; известен также другой кислый сульфат натрия, например Najhfsuih. Имеются признаки того, что нахсоа (в количестве −7 кг / т)является хорошим консервантом для зеленой массы.
129) образование смешанных и двойных сульфатов является наиболее характерным для лития. Соединения типа 3лизоа (где-Na. К, NH4) и Надж(ли (S04) а] — 6Hj0, 94Lij(так))$ — 9HjO (whereЭ —для всех щелочных металлов, смешанные соли типа 3 (Нью-Хэмпшир»), поэтому»получается, и при нагревании он превращается в пиро по схеме 23 (Нью-Хэмпшир»), так»-2NHS сульфат + Н2О + Н + 3Ц ч. Температура плавления последнего(°с): 205(ли), 405(Н), 440(к), 401(РБ), 280(КС). 130) сульфит щелочного металла (3jS0j) представляет собой бесцветное кристаллическое вещество, легко растворимое в воде. water.
At при нормальной температуре натриевую соль отделяют от раствора, содержащего 7H20 (33°С и более-без воды), по-Бурнусную соль-2HjO-натриевая соль сероводорода (3HS0j) известна только в растворе(продаваемый препарат представляет собой смесь различных продуктов разложения, в основном из НАО*). Подобные соли Каруна можно отделить в виде крупных прозрачных кристаллов. Во время хранения он постепенно разлагается. Очень растворим в воде. Бисульфит Rb и Cs также известны(VIII§ 1 add.60).
131) сульфид щелочного металла (32S) представляет собой бесцветное твердое вещество, которое постепенно разлагается на воздухе. Для теплоты образования элемента приведены следующие значения(ккал / моль): 107(Li), 89(Na), 102(K). 83 (Rb) и 81 (Cs) (особое положение калия, вероятно, связано с ошибкой суждения).Они легко растворимы в воде, и известен кристаллический гидрат EHB-1H3O (n = 9 (Na), 5 (K) или 4 (Rb, Cs)). в результате гидролиза их раствор проявляет сильно щелочную реакцию.
Благодаря действию кислорода в атмосфере окисление происходит постепенно за счет образования тиосульфата: 2Na2S■+20 * +Н20″= NajSjOj + + + 2NaOH. Селениды и теллуриды, подобные сульфидам, известны всем щелочным металлам, но они не были изучены. В нормальных условиях они бесцветны (за исключением желтовато-серого цвета). 132) сульфид натрия практически важен почти без исключения. Обычно его получают восстановлением Na2SO с углем при 900°с реакция протекает по оси уравнения Na2SO » +2С + 53 ккал =2С02+ Na2S.
In в присутствии соединений железа (которые играют каталитическую роль) Na2S04 уже восстанавливается до Na2s4 йодидом при 600°С если нет воздуха, то он плавится при 1180°С и начинает заметно испаряться выше 1300 ° С. сульфид натрия в основном используется в производстве органических красителей и в кожевенном производстве. industry. It также является 1 из наиболее часто используемых деаэраторов. 133) путем кипячения раствора сульфида с избытком серы (или слияния сульфида и серы) выделяются все члены ряда 3aS *и K. и около Li l » =2.Гидролиз их раствора уменьшается с увеличением l (VIII§ I дополнительно 33).
134) наиболее изученными являются полисульфиды натрия и Карния, причем с увеличением содержания серы их величина изменяется от светло-желтого до коричневого цвета. Их температура плавления (при отсутствии воздуха) сравнивается ниже (°C): Ka2S * N., S» N » 2S5 I KjSj KjS, K * S «K2Ss K, S, 490 286 2S3 I 520 292 159 211 196 Мы обнаружили, что расстояние Na2S2 d (SS) составляет 2,13 A. судя по данным рентгеновской дифракции, Na2Sa не является специфическим соединением, а представляет собой смесь NajSj и NajSi. Интересно, что полисульфид калия поцелуй является наиболее характерным.
135) структурное исследование кристаллов Cs2S # Auburn (mp 185°C) показало, что он состоит из Cs и Sj〜ионов. Последний имеет неразветвленный атом серы с ZSSS = = — 108-г-109,5°и расстоянием d(SS −2.02-g-2.11 A. соседние Sj-ионы вместе образуют бесконечную спираль атомов С3-серы.
138) удобным способом получения гидросульфида (EH$) является насыщение спиртового раствора алкоксида соответствующего щелочного металла сероводородом с последующим добавлением в жидкость эфира или бензола для осаждения EH5.Гидросульфид представляет собой бесцветное кристаллическое вещество, легко растворимое в воде. water. In по своей структуре они представляют собой соли, состоящие из ионов E и HS.»
Гидросульфид лития стабилен только при температуре ниже 50°C. 137) Лийн (Мп. Только 845°с) легко образуется из нитридов щелочных металлов (3 8 Н).Взаимодействие лития с азотом уже при нормальной температуре протекает медленно, а при 250 * С-быстро. Продукт реакции отраженного света имеет зеленоватый металлический блеск, а в проходящем свете он имеет цвет рубиново-красного цвета. Теплота образования LijN из элемента составляет 47 ккал / моль.
Его Хрустальная струя Раунд имеет ионные характеристики(эффективный радиус Иона равен n -1.48 A).Известны также смешанные нитриды лития, примерами которых являются LI, MnN4,LirVN4 и LisTiNj. Аналогичной производной металлоидного элемента является LijBNj (mp.(870°с).
138) другие нитриды щелочных металлов могут быть получены взаимодействием пара и азота в спокойном поле разряда (или соответствующим пиролизом азида в вакууме).Все они почти идентичны по свойствам нитридам лития, но гораздо менее стабильны. Поэтому Na»N уже при 200°С медленно разлагаются на элементы и нитриды K. Rb и Cz даже explosive. It следует отметить, что имеющиеся данные по первым 3 тяжелым щелочным металлам не очень надежны.
139) при нагревании в атмосфере водорода литий-иптолид превращается в гидрид (при этом образуется аммиак). Li3n, напротив, позволяет нагревать LiH несколько сильнее в азоте atmosphere. As промежуточным продуктом в этом и других направлениях реакции являются амиды лития (LiNH) и m n d (LljNH). 140) в отдельных состояниях Li2NH получают действием NH на литий при 400°C. It бесцветен и кристаллизуется таким же образом с Li20(добавьте 55).
Амид щелочного металла (IX§ 1, дополнительный 53) плавится при следующих температурах (°C): 374(Li), 206 (Na). 338©. 309 (Rb), 261 (Cs). в воде он сильно разрушается из-за высвобождения аммиака (в этом случае CsNHj воспламенится). 141) в виде EzR(E-LI, Na, K) и E2P(E-Na, K, Rb. Cs) является особенностью фосфида щелочного металла. Известен также фосфид лития состава lip. Все эти вещества получаются при непосредственном взаимодействии элементов.
Они легко разлагаются водой. 142) Li2C2 (выделяет тепло 14 ккал / моль) и частично Na2Cj образуется из карбидов щелочных металлов (E2C3) путем прямого поглощающего действия элементов при нагревании. Последний и его аналоги получают путем взаимодействия щелочных металлов и ацетилена. При 50 (K) или 100°C (Na) образуется ацетилид кислоты(по схеме, например, 2K + 2H2C» = 2KNS + H»), при 200°C или более соответствующих карбидов и ацетилена(2KNS» ■ K»C2 + H» C2).
В чистом виде карбид щелочного металла представляет собой бесцветное кристаллическое вещество. Все они (чуть меньше, чем другие лайки) характеризуются очень высокой химической активностью. Если доступ водяного пара происходит медленно, то разложение Lf2C«и его анализ протекают относительно мягко, сопровождаясь выделением ацетилена по схеме. Э | К «+ 2Н, 0-2EOH + С, Н».
143) силицид щелочного металла получают из элементов 600-700 ° С (замкнутая система). что касается лития, то известны сине-фиолетовый LijSl(mp 752 * С) и серебристо-серый LI4SI (MP 633°СС разложение), но тип 3si характерен для других щелочных металлов. Этот тип силицида очень чувствителен к влаге, и его взаимодействие с водой является взрывоопасным.
При температуре более 350°C NaSi разлагается в вакууме на элементы, а производные калия, рубидия и цезия, из которых вырезано большинство металлов, превращаются в силициды 3SI. 144) НАБ и » КБ » боридов щелочных металлов. Оба получают взаимодействием элементов при температуре около 1000°С(под давлением).
Что касается отопления и водоснабжения, то они стабильны. Термическая диссоциация KB *в вакууме(10 ″ * мм рт. ст.) начинается только при 750°С. 145) за счет взаимодействия металлического натрия с разбавленным раствором дипиридила в тетрагидрофуране на воздухе окисляется темно-красное кристаллическое соединение состава Na Dipy-2.64 Thf. Аналогичный состав соединений сирени был получен и для калия.
Смотрите также:
| Подгруппа цинка | Подгруппа меди |
| Первая группа периодической системы | Поляризация ионов |
