Оглавление:










Подгруппа селена
- Подгруппа Селена. По электронной структуре нейтральных атомов селен и теллур являются прямыми аналогами серы. В совокупности эти 3 элемента иногда называют халькоген («медьсодержащий»).Полоний, являющийся самым тяжелым элементом подгруппы, радиоактивен и не является самым распространенным (содержание в земной коре составляет около 2 * 10 -, 5%), который слабо изучен по сравнению с другими. Теллур-1 ′ 10 ″ 7%.
- Присутствие металлов, включая Cu, Pb, Hg, Ag, Au и другие металлы, является наиболее характерным для обоих элементов. 。 Основным источником промышленного производства селена и теллура является осадок («шлам»), который образуется при электролитическом производстве меди. Ежегодное мировое производство селена составляет около 1000 г, теллура-200т5-7
При отделении соединения от раствора оба элемента осаждаются в виде порошка красного и коричневого цвета соответственно. Людмила Фирмаль
Однако эти модификации наиболее характерны для них, некоторые их свойства сравниваются ниже с соответствующими свойствами кислорода, серы и полония. В нормальных условиях-температура плавления. ° C температура кипения. ° C плотность твердого тела li составляет г / с * ’ Цвет физического состояния элемента В) бесцветный газ-218-183 1.3 S-это тяжело.
Хуан 119445 2.1 Se » Серый 221685 4.8 TS » серебряный белый 450 990 6.2 РО » >254 962 93 Селен и теллур стабильны в воздухе и нерастворимы в воде. Все соединения селена являются высокотоксичными.8 ″ 17 В химическом отношении селен и теллур, как правило, похожи на серу. Из металлоидов он наиболее сильно взаимодействует с фтором и хлором, соединяясь с кислородом только после pre-heating.
It частично реагирует с газообразным водородом во время boom. At высокие температуры, это только селен, но теллур не связывается непосредственно с Selenium. In многие металлы, Se и Te являются селенидами и Теллуридами (Crwe. It будет создан список всех файлов (например. K2Te). Действие разбавленных кислот на них получают водородом водорода (H2Se) и водородом теллура (H2Te).в нормальном состоянии оба являются бесцветными газами с неприятным запахом.
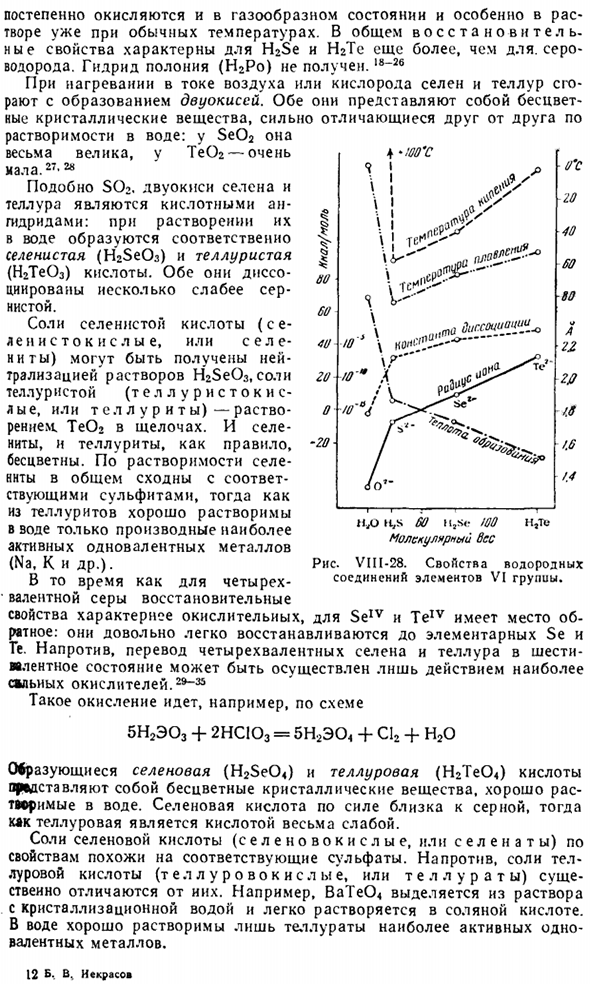
Их растворимость в воде почти такая же, как у сероводорода, и раствор показывает выраженную кислотную реакцию. Некоторые свойства рассматриваемых соединений сравниваются на диаграмме с приведенной ниже таблицей. VII1-28 с аналогичными характеристиками HjO и H2S. для приближенного направления размера соответствующей молекулы также задается ионный радиус
Соединение образует тепло. ккал! моль точка плавления. ° C температура кипения. Константа диссоциации. Ки Радикс ном НПО 68.5 0 100 2-10-1. 32 in H2S 5 −86 −60 1•10 1.74 Ч, ГП −8-66 −41 1.10 ″* 1.91 ЦИАМ −24 −51 −2 2•10〜с 2.11 Из таблицы видно, что H2Se и Н2Те являются более сильными кислотами, чем, например, уксусная кислота (/с = 2 * 10-5).Когда дело доходит до нагрева, чистый H2Se очень стабилен, но H2Te легко распадается на элементы. Соединения кислорода воздуха
Он постепенно окисляется в растворе даже в газообразном состоянии, особенно при комнатной температуре temperature. In в целом, восстановительные свойства больше, чем у H2Se и H2Te. Сероводород. Гидрид полония (H2Po) не получают. При нагревании потоком воздуха или кислорода селен и теллур сгорают вместе с образованием диоксидов. Оба являются бесцветными кристаллическими веществами, и их растворимость в воде существенно отличается друг от друга other.
It очень большой в Se02 и очень маленький в Te02. Как С02.Селен и диоксид теллура являются кислотными ангидридами. Растворенный в воде, он производит селеновую кислоту (HgBeO3) и кислоты теллура (H2Te03).Оба имеют несколько более слабую диссоциацию, чем сера. Селенитные соли (грязь и вода, или селенит) получают путем нейтрализации раствора H2Se03, теллуровых солей (теллурит и соли, или теллурит).
Te02 сплавления с щелочью. Селенит и теллурит обычно являются colorless. In по растворимости селенит в целом аналогичен соответствующему сульфиту, но в случае теллурита-только производным наиболее активных одновалентных металлов (Na, K и др.) очень растворимы в воде. Для четырехвалентной серы восстановимость является окисляющим свойством, а для SeIV и TeIV-наоборот.
Они легко сводятся к элементам Se и Te. Напротив, превращение квадранта селена и теллура в 6 мгновенных состояний может быть осуществлено только действием самого жирного окислителя. Такое окисление, например, по схеме 5N2E03 + 2NS103 = 5N2E04 + С12 + Н20 Полученные селеновая кислота (H2Se04) и теллур (H2Te04) кислоты обеспечивают бесцветное кристаллическое вещество, которое легко растворяется в воде.
Селеновая кислота близка по силе к серной кислоте, а теллуровая кислота очень слаба. Соль селеновой кислоты (селеновая кислота или серная кислота) аналогична по свойствам соответствующему сульфату. Напротив, Теллурид (теллуровая кислота, или теллур) существенно отличается от них. Например, BaTe04 отделяют от раствора, содержащего кристаллическую воду, которая легко растворяется в соляной кислоте.
Только самый активный одновалентный металл Теллурид хорошо растворяется в воде. 12 Б. В. Некрасов От ОЗ 20 40 60 Восемьдесят < / Ля 22 2 // /- мне очень жаль.6 /.6 ’.Четыре Я! Ф’ А ’\ я ^ Г \ Я ! Я 60. Сорок Иди. −20 больше предупреждений ч, с 60 Лл ы<: ч, молекулярная чертенок Диаграмма VIII-28. Свойства водородного соединения элементов VI группы. Рассматриваемые кислоты являются одновременно сильными окислителями и взаимодействуют, например, с НС1 по схеме H2E04 + 2HCI H2E03 + С12 + Н20
В кислой среде равновесие смещается вправо влево в щелочной среде.36-39 соответствует селеновому ангидриду-триацид Селена (FeO3) представляет собой бесцветное кристаллическое вещество, которое при образовании более растворимо в воде. water. In напротив, желтый триоксид теллура (TeO3) почти нерастворим в воде. Но сильный раствор сильной щелочи растворяет его с образованием соответствующего теллура.
Добавь I) теллур был открыт в 1798 году. Селен-1817, полоний-1898.Имеется монография о Селене и его аналогах, а также обзорная статья о полонии. 2) естественный селен имеет массовое число 74(0.9%)、76(9.0%)он состоит из двух изотопов. 77(7.6%)、78(23.5%)、80(49.8%)、82(9.2%)。Теллур является центром изотопов с массовым числом 120 (0,1%). 122(2.4%)、123(0.9%)、124(4.6%)。 125(7.0%)、126(18.7%)。 128(31.8%)、130(34.5%)。
Представленные данные показывают, что в обоих элементах более тяжелые типы атомов имеют количественное преимущество. Для полония известны только радиоизотопы, 1 из них находится в природе}, 0Р®(средняя продолжительность атома составляет 200 дней). 3) по структуре внешнего электронного слоя атомы селена (isHp), теллура (5s25p4) и полония (bSyur*) сходны с атомом серы и также находятся в основном состоянии.
Двойной price. As как видно из рисунка VIII-29, возбуждение четырехвалентного состояния требует достаточно больших энергозатрат. Ниже сравнивается энергия непрерывной ионизации (>c) атомов селена и их аналогов. Я и ИИ! IV V VI Se….. 21л 32.0 42.9 68.3 81.7 18.6 31 38 0 0 72 По. 8.43(18.6)(27.8)(37.6)(80.7)(73Л Сродство атома Селена или теллура к 2 электронам составляет около −100 ккал / г-Атон (см.§ 1, дополнительный пункт 3).
4) ранее источником полония служила полониевая руда. В настоящее время искусственно получено 100 штук(на основе висмута).Элементарный полоний может быть отделен от раствора соединения электролизом (помещен между медью и серебром при ряде напряжений).При изучении этого элемента обычно изучается только количество миллиграммов.
Это вызвано трудностью его получения и очень сильной радиоактивностью подошв (в темноте можно увидеть самоэффективность ярко-синего цвета). 2С * 2р \ ’ 3д 2sl2p3 < * ы ЗС * Zps3p Л2 $ ’ 2o3JS 28С 2 * 0200160 Js23p33d JJPV 3ПС 3С ’* С ^ П 5П СС’ СП ’ ГП 4С * 4p35 $ — 5 секунд* 5p36 секунд Около 120 Л ЗС ’ТП * СС’ СП * Подробнее о S Se Te Рисунок VIII-li. энергетический уровень атома O-Tc \ kcal] goth). * Кудрявцев А. А.
Технология химии-селен и теллур. 2-й. М.. Металлурги」、 1968.333 секунд Б е г и А Л Ь К. Химня Селена, теллура в Полонии. М от английского пер. Атойиздат, 1971, 216 секунд、 * * Гель с> » успехи химии, 1в60. КШ с БВБ、 б) извлечение Se и Te из промышленных отходов металлургической (или серной) промышленности основано на превращении обоих элементов в четырехвалентное состояние, а затем восстанавливается диоксидом серы.
Восстановление первоначально сильное (10-12 Н.) осуществляется соляной кислотой, выделяется только селен. Затем, когда жидкость сильно разбавляется водой, выделяется теллур. 6) очистка Селена от примесей может осуществляться различными способами. Например, вы можете воспользоваться хорошей растворимостью Na2 $ Os в горячем концентрированном растворе-тогда A! A ($ 0 «b. затем раствор охлаждают и выделяют очищенный селен.
Этот селен также может быть очищен путем вдувания потока воздуха в расплав при 450°C, а затем вакуумной перегонки остатка. Теллур очищают вакуумной перегонкой или водородной проточной перегонкой. Для его очистки используют превращение теллура в основной нитрат (композиция сс 2оз (он) 1ч’ Оз), а обратное разделение проводят после перекристаллизации этой соли.
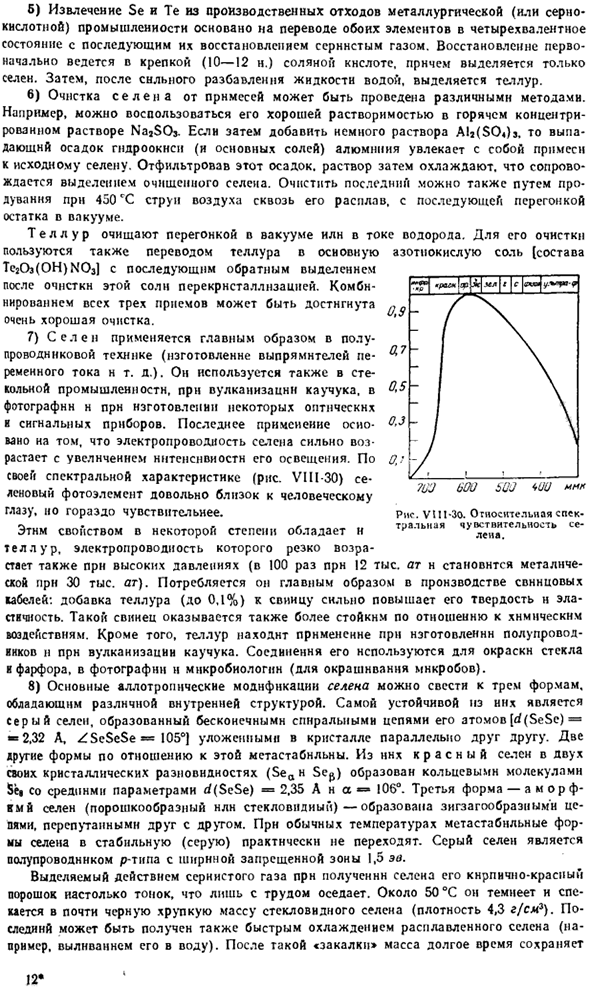
Объединив все 3 метода, можно добиться очень хорошей очистки. 7) селен главным образом использован в технологии полупроводника(как изготовление выпрямителей тока AC).он также использован в стеклянной индустрии, вулканизации резины, фотографии и изготовлении некоторых приборов оптически и сигнала. Последнее применение основано на том, что проводимость Селена значительно возрастает с увеличением интенсивности его освещения.
По своим спектральным характеристикам (рис. VIII-30) селеновые фотоэлементы очень близки к человеческому глазу, но гораздо более чувствительны. Теллур также обладает этим свойством в некоторой степени, и при высоком давлении электропроводность также быстро возрастает(рН 12 000 АТН в 100 раз. Металлический заряд составляет 3 миллиона Ат. Вы также можете использовать его в качестве шаблона. В основном потребляется при изготовлении свинцовых кабелей.
Добавление теллура к свинцу(до 0,1%) значительно повышает твердость и элтафность. Такой свинец также устойчив к воздействию химических веществ influences. In кроме того, теллур используется в производстве полупроводников и вулканизации резины. Его соединения используются при окрашивании стекла и фарфора, в фотографии и микробиологии (окрашивание микроорганизмов). 8) основная аллотропная модификация селена может быть сведена к 3 формам с различными внутренними структурами.
Наиболее стабильным из них является серый селен, который образован бесконечной спиральной цепью атомов, расположенных параллельно друг другу в Кристалле (rf(SeSe)=2.32 A,^ SeSeSe * = 105°).Другие 2 формы на этом метастабильны. Из них красный селен 2 кристаллических видов (SeaH & Se) образуется кольцевой молекулой s^, средний параметр которой D (SeSe) равен 2.35 a и a = 106°. 3-я форма, морфема Селена (порошкообразная или стекловидная), образована зигзагообразными цепями.
Они путаются друг с другом other. At при нормальной температуре метастабильный селен практически не переходит в стабильное состояние (серое).Серый селен представляет собой полупроводник р-типа с запрещенной зоной 1,5 эо. Порошок, который выделяется под действием сернистых газов при производстве Селена, очень тонкий, поэтому его трудно осаждать.
Затемняют при температуре около 50°С и спекают в хрупкую массу почти черного цвета из стекловидного Селена (плотность 4,3 г / гм3).Последний также может быть получен быстрым охлаждением расплавленного Селена(например, заливкой в воду).После этого дубовый Аркан » месил еще долго Рисунок ВУИ-ЗО. Относительная спектральная чувствительность Селена. пластическое состояние.
Уже при 50°с твердый стеклообразный грязевой поток начинает размягчаться, и около 100 СС проходит через процесс превращения со значительным выделением тепла(примерно II ккал / г атомов), которое за короткое время разжижает массу и становится серым. Когда стекловидный селен вступает в контакт с некоторыми органическими жидкостями (такими как «CS»), он медленно движется в темноте и быстрее на свету к красным кристаллам Селена.
Последний слабо растворяется в дисульфиде углерода (около 0,05% при нормальных условиях, при 46°С и 0,1%).Если такой раствор выпаривают при 72°С или менее, то получают моноклинный Кристалл (плотность 4,5 г / см3) моря, а выше этой температуры-гексагональный Se ^Кристалл(плотность 4,4 г / см3).
При быстром нагревании до 180°С Красный селен плавится без изменений, и в целом переход в серую форму начинает прогрессировать уже за пределами Р0°С. Из расплавленного селена можно также получить стабильную серую форму, но это только в условиях очень медленного cooling. It удобнее получить его путем сублимации Селена при пониженном давлении.
Селен становится пластичным при нагревании выше 72°C и более подвержен механической деформации. При повышении давления его температура плавления увеличивается, достигая около 4000 атмосфер, около 270°С. при плавлении он резко увеличивается в объеме (около 16%).Теплота плавления селена составляет 1,6 ккал / г-аюм. В отличие от серы (добавленной в§ I. II), вязкость красновато-коричневой жидкости (плотность около 4,05 г / см) непрерывно уменьшается с повышением температуры.
Теплота испарения селена составляет 7 ккал / г атомов. Его желтоватая пара имеет баланс See \ * See «* Se » \ Sej, смещающийся вправо, а не баланс серы. 9) основная форма теллура-порошкообразный темно-коричневый («аморфный») и серебристо-белый, как металл, — состоит из бесконечной спиральной цепи его атомов (rf (TeTe)= * 2.86 A, ZTeTeTe =102е). Рисунок VI11-31.
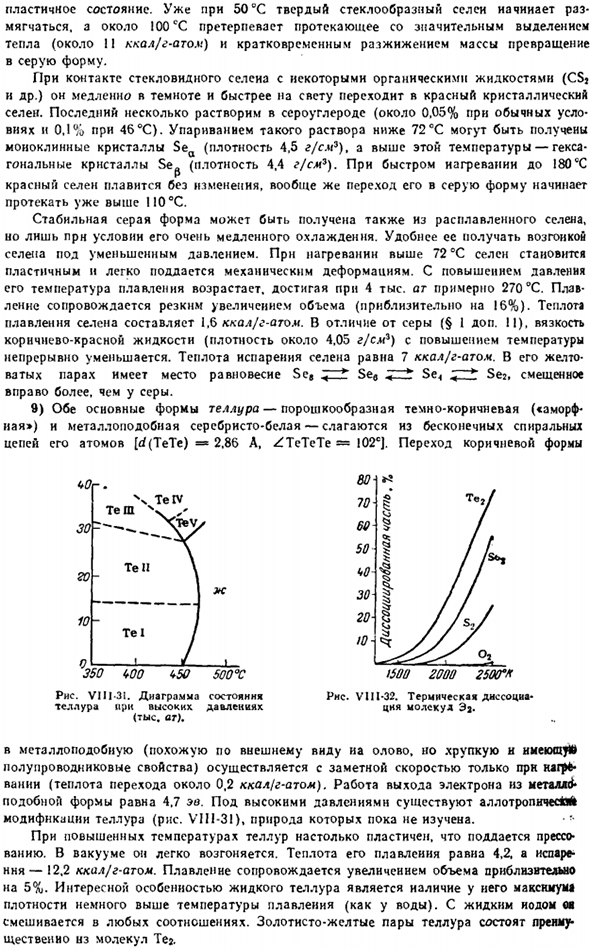
Теллурическая диаграмма состояния дневного времени (тысяча часов). Подобно металлам (полупроводниковые свойства сходны с оловом, но хрупки«), он реализуется с замечательной скоростью только при нагревании (теплота переноса составляет около 0,2 ккал / г атомов).Электронная функция работы в форме как металл4,7 эВ. Под высоким давлением происходит анизотропная модификация теллура ( рис. VIII-31), природа которой до сих пор не изучена. * г- При высоких температурах теллур очень пластичен, поэтому его можно pressed.
In вакуум, он сублимирует легко. Теплота плавления составляет 4,2, испарение-12,2 ккал / г атомов. С плавлением он увеличивается в объеме примерно на 5%.An интересной особенностью жидкого теллура является то, что его максимальная плотность несколько выше температуры плавления (как и у воды). ОА смешивается с жидким йодом в любом соотношении.
Золотая пара теллура состоит в основном из молекул тега. Рисунок VII1-32. Термическая диссоциация молекул ЭА. 10) полоний уже имеет ярко выраженный металлический внутренний pressure. In по физическим свойствам он больше похож на TI, Bi и Pb, чем на Te(по химическим свойствам, наоборот, он очень похож на теллур).Известно, что полоний имеет 2 аллотропа, которые превращаются друг в друга при различных температурах (54°C и 18°C) и сосуществуют в этом диапазоне температур. Из-за его мощной радиоактивности. 11) Как видно из рисунка термической диссоциации молекул VI11-32, Se2 и Te? Это осуществляется гораздо легче, чем в случае с серой или кислородом.
Последнее обусловлено общим характером изменений ядерного расстояния и энергии диссоциации ряда О-Тэ. Молекулы………… 02 С2 SE2 в Те2 д. А…………… 1.21 1.89 2.19 2.57 Энергия диссоциации, ккал} моль 119 100 76 52 Теплота распыления селена и теллура при 25°С составляет 54 и 46 ккал / г атомов соответственно. 12) селен и теллур не соединяются друг с другом (образуются смешанные кристаллы).
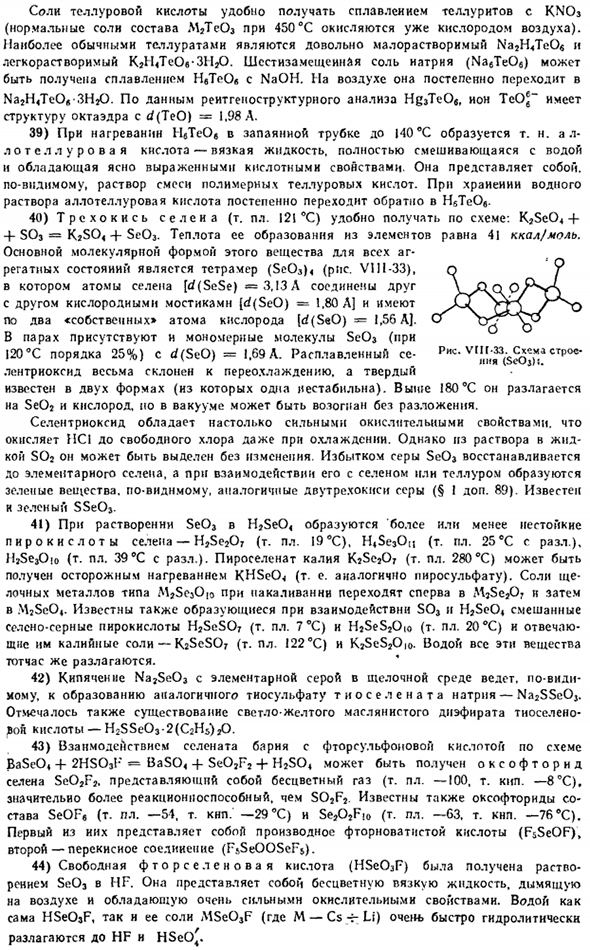
Селен может объединяться с серой для получения циклических смешанных молекул SnSeg-n и кристаллов, которые они образуют. Примером может служить Красный Se <S4 (mp. Iz ® C) и ярко-оранжевый Se2S»(mp.122°с).Для теллура было получено соединение серы TeS7. 13) в нормальных условиях теллур очень медленно взаимодействует с водой по схеме: Te + 2H * 0 = Te02-f 2H2.При нагревании аморфный селен также реагирует с водой, но кристаллический селен также взаимодействует с водой при 150°C. образование SeS2 — или TeSj-ионов приводит к растворению обоих элементов в растворе NA, а мелкодисперсные Se и Te растворяются в холодной серной кислоте.
Se или Te собираются в воде. Найти избыток может быть удален путем нагрева от жидкости, серповидно-ангидрида раствор теллура. В Формуле, соответствующей TeO(но, по-видимому, смеси TeOa + Te), полоний ведет себя аналогично теллуру, производя красный P0SO3 и черный RoO. 14) увеличение содержания селена в почве может привести к частичному замещению серы, за счет чего, в процессе построения белковых молекул растения organism.
As в результате болезни возникают как у самого растения, так и у животных, которые питаются them. It бывает, что шерсть падает с коровы, или копыто становится мягким. Наблюдалось селективное накопление Селена агаровой кислотой. 15) при приеме внутрь соединения селена действуют как мышьяк. После отравления ими появляется очень неприятный запах от всего тела и выдыхаемого воздуха. Газовые производные Селена, уже в очень малых концентрациях, вызывают головные боли, раздражение верхних дыхательных путей, потерю пролонгированного воздействия, длительный насморк.
Когда своя смесь прикреплена к коже, cgfin и тягостное воспаление formed. At в то же время небольшая доза селениновой кислоты(порядка Lmcg на 100 г пищи), по-видимому, предотвращает некротическую болезнь Хаме-Терры. Существует также прямая зависимость между остротой зрения животного и содержанием селена в сетчатке глаза. 16) токсичность соединений теллура значительно выше lower.
In в организме они быстро восстанавливаются до элемента те, а затем медленно выделяются в виде органических производных, которые постепенно образуются, с сильным чесночным ароматом. Последний появляется после приема небольшого количества те (1000 мг на 1 грамм).Известен случай, когда химика, работавшего с теллуром, пришлось эвакуировать из города на несколько недель. И это неудивительно, ведь исходящие от них запахи не могут противостоять окружающим people.
In При лечении отравлений селеном и теллуром рекомендуется прием высоких доз витамина С (аскорбиновой кислоты). 17) недавние исследования подтвердили постоянное присутствие следовых количеств полония в табаке smoke. It оказывается, что с дымом от сигаретной коробки человек поглощает количество воздействия альфа-частиц. Это в 4 раза больше принятого безопасного, но международного консенсуса. Анализ мочи курильщиков показал, что она содержит полония более чем в G раз больше, чем у некурящих.
Это означает, что полоний циркулирует по всему организму и может накапливаться не только в легких, но и в других органах (свинец, продукты его распада и т. д.). Предполагается, что статистически значимо более высокая заболеваемость раком среди курильщиков по сравнению с некурящими обусловлена главным образом радиоактивностью полония.
18) ниже сравнивается окислительно-восстановительный потенциал, соответствующий типичному валентному переходу селена и теллура (на верхнем рисунке показана кислотная среда, на нижнем рисунке-щелочная среда). −2 0 +4 +6 Se………. / −0.40 +0.74 Дж +1.15 я J. U. 92 −0.37! + 0.У3 | Те……….!* −0.72 я +0.53:+1.02! я…14″ −0.57 / +0.4 секунды В случае полония валентность-f4 является наиболее типичной, менее характерными являются −2 (полонд) и+2 (в частности, известны черный PoS и красный P0SO3).
Существование значения облигации+6 установлено, и соответствующие производные от нее еще не выделены. 19) помимо разложения селенидов, можно получить H2Se, пропуская тонну водорода к селену, нагретому до 600°C. It удобнее получить его нагреванием Селена с парафином (см.§ I дополнительно 20) или воздействием воды на Al2Se3.Электролиз сильно охлажденного раствора кислоты с теллуровым катодом приводит к успешному образованию Н2Те.
Вы также можете получить в 4 n действий. НС1 на AljTej. Пиролиз H2Se с замечательной скоростью составляет только более 300 ° С. С другой стороны, Н2Те разлагается постепенно при нормальной температуре. Селен водорода гораздо более токсичен, чем сероводород. Растворимость в воде при нормальных условиях составляет около 3: 1 по объему. Взаимодействие Hjse и серы, схема S + II? Протекают медленно в соответствии с Se = M2S + Se(то есть реакция C12 + 2IVr-2H1 + Br2).
20) из-за структуры молекулы hjse, Н2Те похож на H2S. для водорода Селена, D(seh)= 1.46 A. Zhseh = 9 g, Q 0.24, Q 3.0.Молекулы водорода теллурида не изучались much. So, rf (TeH)= 1.69 A, ZHTeH 89.5 e. средняя энергия связей Se-H и Te — H оценивается в 75 n 63 ккал / моль соответственно. Первый ионизационный потенциал молекул серии H2S (10,5 в)-H2Se (9,9 в)-H2Te (9,1 в) непрерывно снижается. 21) для водорода Селена (K2 = MO-11) известны 2-рядные соли-кислотные и средние, теллура (K7 = 1•I0) — только средние.
Из них наиболее активными производными одновалентных металлов являются бесцветные, легко растворимые в воде. Некоторые соли, связанные здесь, были выделены в виде кристаллических гидратов (например, 1CH’2te-9NgO).Под воздействием кислорода воздуха, с образованием селенидов и полителицидов, подобных полисульфидам, их раствор сразу становится reddish.
It известен в частности. Na2Se»и Na2Tc», но производных SE и Te серо-водородного типа не получено. Большинство селенидов и теллуридов металлов нерастворимы в воде. Имеется монография*. 22) возможность образования Н2® ® была установлена по радиоактивности газов, выделяющихся при обработке соляной кислотой магния. * Чижиков Д. М.. Счастливый В. И. селен и селен. М. » Наука.«1964 год. Теллура и Теллуридов. М..«Наука», IW6. 279р. У. А. Оби-Чи в Селсииди. М..«Металлургия» 1972. 296 секунд、
- Хранение полонием. Гидрид полония менее устойчив, чем H2Te, потому что он не смог отделить n, но ide, полученный из него(например, N’2po), известен. Теплота образования Полинга от элемента оценивается в −45 ккал / моль. 23) все галогенные соединения селена и теллура получают взаимодействием элементов. Известны следующие галогениды:
Состав…….. SeF » SeF4 SeCl4 Se2Cl2 SeBr4 Se2Bra Агрегатное состояние жидкого газа. Трудный. Жндк. Трудный. Жндк. Цвет? 。 …….Дьявол » бесцветный бесцветный Хориг. Желтый клаен. Состав…….. TcFe TeF4 TECIJ TeVg4 TeVg2 TeG4 Физическое состояние газа твердое, твердое. Трудный. Трудный. Трудный. Трудный. Цвет………Бесцветный. Бесцветный бццв. Зелено-оранжевый колдхум.
Серо-черный Молекула галогена 3F «имеет октаэдрическую структуру с атомом Е в центре (</(SeF) 1.69 A, K (SeF))» =5.5.Д(ТЭФ)= 1.82 А].Похоже на SF6.Селен и фторид характеризуются высоким давлением. Твердый пар (т. е. соответственно-46 Н-39°С).Поэтому их температуру плавления (-35 Н-37°С) можно определить только при высоком давлении. 24) в общей природе галогенированный селен подобен соответствующему производному серы, тип E2G2 в этом случае меньше, а тип EG4 более стабилен.
Для образования обоих соединений из элементов характерна значительная лихорадка (246 и 315 ккал / моль). Людмила Фирмаль
Например, Se2Cl2 (q = 2.1) разлагается на Se и SeCl4, даже при осторожном нагревании. Последнее-SeClj и С! Он разлагается и сублимируется, но когда он снова остывает, он образуется из них. Структура молекулы SeF аналогична SF (рисунок VII1-I4), а параметр D (SeF’) равен −1.68. d (SeFJ)= 1.77 A, ZF ’ SeF ’100°,ZF’ SeF * = 169e, q = 1.78. Для SeF4 (mp.-10.Mp.108°C). известно, что SeCl4 (теплота образования 45 ккал / моль NS элементов, а именно 196°C) и Sevr являются бинарными соединениями, содержащими Галогенидные соли (преимущественно Ser4-2mt типа) и безводную серную кислоту (например, бесцветную SeCl4SOj).
Описаны также соединения с композицией HgSeF4.Результирующее взаимодействие СЭФ и ртути. Почти весь галогенированный селен легко разлагается с водой. Гидролиз Сефе протекает наиболее медленно. Интересен вид Селена с хлоридом серы EGC !?Смесь представляет собой жидкость, которая смешивается в нормальных условиях. Очевидно, 2 формы полу-батареи-темно-красная(на основе Se n S2C12) и бледно-оранжевая (на основе S и Se2Cl2).
Различие в двух формах объясняется, естественно, разной структурой. Тип SeSCl1 и SSeCl2.Такая интерпретация, предполагающая центральную валентность центрального атома, основана на структуре SjClj (§ 1 add.44), но более стабильный S2F2 (§ 1 add.41). 25) галогенид теллура существенно отличается по свойствам уже с соответствующим производным серы. Тетрафторэтиленовая сера является газом в нормальных условиях, но TeF4 плавится только при 130°C.
В отличие от гексафторида серы, TeF » может очень легко разлагаться водой и производить дополнительный продукт(известный как TeF-2CsF).С другой стороны, йодид серы (и Селена) не получается вообще, и при трении элементов друг о друга в присутствии воды образуется черный Te14.Теплота образования TeC1 и TeBr4 из элементов составляет 77-47 ккал / моль соответственно.
Хотя TNP-Te2G2 не известен для теллура, соединения, соответствующие типам TeG2 и TeG^, с большей вероятностью содержат соли, чем гало ангидрида. Они разлагаются только частично в воде, а в случае TeG2 олова, при гидролизе, разложение наблюдается по схеме:2TeG2 * = TeG4 + Teg. Определение пространственной структуры TeBr2 показало, что молекула представляет собой треугольник[d (TeBr)= 2.51 A, a = 98°].
Молекула TeSC полярна (q = 2.54) и имеет структуру, аналогичную Иону io2f2[рисунок. В VII-i9 не, д (Тецла)ы = 2.33 а]. Среди рассматриваемых соединений имеются достаточно высокие температуры плавления (испытания-224°С, испытания-208°С).TeVg4-380 ° С, TeVg2-280°C) или температура кипения(испытания-420°С. Есть также те, которые не разлагаются в). Тест-328 СС. TeVg2-340°C).
Напротив, Te14 начинает разлагаться уже при 100°C и выше Тип галогена Teg4 и красителя характеризуется образованием аддуктов продуктов с соответствующей соляной кислотой и особенно некоторых ее солей. Наиболее распространенной из них соответствует общая формула в виде M / TeG. Где M-одновалентный металл[d (TeCl)= 2.64, s /(TeBr)= 2.70 A].Хлорид-желтый, бромид-оранжевый, а йодид-черный.
Для фторида, другой тип характерен-ССРР(где М-СЅ.Rb. К).Эти соли быстро разлагаются в воде. 26) следующий галогенид был получен для полония (в миллиграммах). Pobr4po14poc| 2ровг» Желтый-красный-черный-красно-коричневый Они все твердые. Тетрахлорид плавится при температуре около 300°C и кипит при температуре 390 ° C. двойные соединения типов RoG4-MG и RoG4-2MG также являются known.
In расстояния Po-C1 и Po-Br (производные 2-го типа) мы нашли величиной 2.38 n 2.61 A. 27) Если Se02 получается путем сжигания Селена (горения пламенем), то полезно предварительно насытить оксиды азота оксидами азота (пропуская дым HNOj). в этом случае, поскольку горение происходит намного быстрее. Теплота образования диоксида селена из элемента составляет 54 ккал / моль.
Средняя энергия связи se = O оценивается в 102 ккал / моль. Кристаллический диоксид Селена образуется неплоской цепью O-Se (0) 0 — Se (O) с параметром D (OSe)= 1.78. d (SeO)= » 1.73 A. ZOSeO = 98°,ZSeOSe-125°, при нагревании он сублимируется(т. е. сублимация 337°С, теплота сублимации 22 ккал / моль).Желто-зеленый пар Se02 имеет характерный запах («тухлая редька») и состоит из отдельных молекул[^(ScO)= 1.Г1 а, к (СЕО)= 6.9, м = 2.7].
Сухой диоксид Селена легко образует adjunct. An примером может служить жидкость в нормальных условиях (стабильная до 170°C, если дистиллированная при частичном разложении) желтого цвета Se02-2HCl. 28) te02 (mp 733, mp 1257°C) удобнее окислять сильным HNO, чем сжигать теллуром (сине-зеленым горящим пламенем).При выпаривании или разбавлении полученного раствора водой, при нагревании желтизны теллур осаждается в виде бесцветных кристаллов.
Теплота образования Te02 из элемента составляет 77 ккал / моль, а средняя энергия связи te = 0 оценивается в 59 ккал / моль. Растворимость оксида теллура в воде очень мала, но они растворимы в растворах сильных щелочей и кислот (с образованием солей). 1.No! вы можете получить его при 25°C. Te02 0.01 M решение. Из продуктов присоединения, характерных для диоксида теллура, наиболее интересной является стабильность до 300°С (разлагается сразу водой) 2Te02-НСЮ4.
29) свободная селеновая кислота (/(«=2-10-3,/ C2 = 5-10 ″ 9) может быть получена растворением порошкообразного селена в разбавленном разбавленном HNOa (по реакции 3Se-f 4HNO * + HjO = 3H2Se03-f 4NO) при испарении раствора он отделяется в виде бесцветных кристаллогидратов*, растворяется во влажном воздухе и постепенно исчезает в сухом воздухе. м 4.2 (ср.§ 1 add. 58). он стабилен только при 70°C, и при превышении этой температуры он разлагается на Se02 и воду даже в растворе. Основным продуктом пиролиза является H2Se2Os.
Окислительные свойства селеновой кислоты не особенно выражены. Тейт не может окисляться, поэтому *и G и окисляют Br’.PR » PRK£TECAST по уравнению взаимодействия с: l5h, seoj+ 10kmn04 = 5k2se04-F ioh2se04 + 10mnog + 5H. из солей h2seos необходимо обратить внимание на труднорастворимый AG селенит ag2seoa (PR = mo * 15). SeOj ion — это «трехгранная пирамида с параметрами d (SeO)= 1.69 A и ZOSeO» * 101°.
Присутствие селеновой кислоты, которая имеет очень слабо выраженную основную функцию, наиболее четко выявляется при взаимодействии с безводным HSC4.Реакция в этих условиях протекает по формуле: SeO (OH) 2-fHCY4lSe (0h) J] c104.Развивающаяся экономика Солеподобный продукт содержит пирамидальные катионы (Se (OHb)), бесцветное и очень гигроскопичное кристаллическое вещество (mp 33°C).Известно, что сульфат Селена — (SeO) SO<, Se02 и SO3 получают взаимодействием селената фторсульфоната-Se0 (S03F)} селената при нагревании (в герметичной трубке).
30) теллуровую кислоту получали в виде кристаллогидратов hjteoa-HjO. при рН = 3,8 наблюдается свойство амфотерных электролитов с изоэлектрической точкой (V§b дополнительно 13).Его кислотная функция(/ C | = 2•10 «3,K2-2-10») намного мощнее основной(K \ = 3-10«).Последнее проявляется при растворении TeOj в концентрированной кислоте. Например, согласно схеме TeO3-f 4HI * = t Tel <+ 2HjO, четырехвалентными солями теллура являются formed.
In кроме галогенидов, в твердом состоянии были получены также основные сульфаты и нитраты четырехвалентного Терра. Окислительные свойства теллуровой кислоты несколько более выражены, чем у Селена. Анна Тео, » *имеет треугольную пирамидальную структуру с параметрами t /(TeO)= 1,88 L и ZOTeO)= 100°. 31) и в случае селениновой кислоты, особенно теллуровой кислоты, образование солей типа MgO-pEOg очень characteristic.
In кроме того, в селене известны производные π= 2 и 4, а в η= 2 и 4-6-й теллур. Сера= 2 соединения серы являются эквивалентными соединениями серы. 32) среди других производных рассматриваемого элемента в четырехвалентном состоянии следует отметить селен-оксо-галогенид. Высокотоксичный SeOCl * образуется при совместном нагревании SeCl и ScOa, образуя желтоватую жидкость(mp.11. mp. At 178CC), полярность(m = 2.62) и диэлектрическая проницаемость(стр. 46 20 SS).
Силовые константы связей его молекулы характеризуются значениями x (SeO)= 7,0 и x (SeCl)= 1,9. Это хороший растворитель для многих веществ, в частности, он растворяет серу, селен, теллур, бром, йод. Смесь хлорида селена и S03 может растворять многие оксиды металлов (Cr20z, A120z и др.). Для SeOClj очень характерны окислительные свойства (особенно при нагревании).С водой он разлагается на HCl и селеновую кислоту.
Бесцветный Сеофж(Мп.5. mp.125°C) и желтая Сеобра (mp 42. mp.217°с, разложение) также известен. Молекулы этих первых веществ хорошо характеризуются: d (SeO)= 1.58. д(Сеф)= 1.73 Д. Zosefa= 105e. Zfief = 92е. х (СЕО) — 7Д к(СКФ)= 3.6. г = 2.84. При растворении Se02 в безводном HF, по-видимому, образуется дифтороселевая кислота-HjSeOjFj-(соли состава ZnSeOjFj-6H20 были выделены).
Кроме того, из-за слияния Se02 и KF, аналогичный фторсульфат (§ 1 add.64), а также бесцветные кристаллы JtSe02F(Мп.250°C) было получено. Для теллура характеристики таких соединений гораздо меньше. Однако из-за взаимодействия аморфной и бромной воды в нормальных условиях получается желтоватое твердое вещество Tcovr * solid. 33) растворение селена в растворе Na2SO3 (добавление 6) связано с образованием сульфата селена натрия (Na2SeSO), а также его тиосульфата.
Натрий тиоселата натрия (Na2SSe03) также known. It образуется при кипячении серы в растворе Na ^ SeOs, и когда жидкость подкисляется, она снова выделяет серу. Обе соли были получены в твердом состоянии. Имеются также признаки возможного образования в растворе нестабильного селенита натрия селената (Na2Se2Os). 34) производные селена и теллура (§ 1 add.65)не получено, но известны некоторые продукты замещения серы в селеновых или теллуровых тиопееновых цепях.
Это включает в себя относительно длительное время назад (selenomethanoic кислоты[ГП (S03H) 2ДЖ, selenopentathion{ГП (Ss03h и teluropeatationic (Тэ (Ссош)»)])] существующих индивидуальных солей, кислот и общей кислоты[ГП»(S03H) 2И н 2-г-6. 35) диоксид полония (PoO :)образуется из элемента prn-885 元 元 в виде красного кристалла (т. е. 250 С°С), который при хранении постепенно переходит в более стабильную желтую форму в нормальных условиях.
На химической стороне, он подобен двуокиси теллура, но соответствуя окисоводоподу имеет более основное properties. So для теллура известен только основной золь кислородной кислоты, но для полония также была получена промежуточная соль(в частности, бесцветные Po (S04h и Po(NO)) 4).], Напротив, PoOj или его гидроксид образуется за счет взаимодействия с сильной щелочью солнца l, а кислота (HjPoOj) — полярность-значительно сильнее теллура ((KaPo03)/ lKOHf = 8 10-5).
36) как для селеновой, так и для теллуровой кислот характерно медленное проявление их окислительного действия(особенно в разбавленных растворах), в некоторых случаях окислительно-восстановительный процесс для этого «фактически протекает».Относительно быстрее, чем другие восстановители, галогенид-ионы(G, Br’, SG) окисляются обеими кислотами. Селеновая кислота является более сильным окислителем. Больше, чем Теллуриец.
37) свободная селеновая кислота(/(*•= * 1•10〜x) наиболее легко получается при обработке суспензии AgjSe03 бромной водой. Реакция протекает согласно Ag ^ SeOs-f-Br » + H30 2AgBr | + H2Se04. Отфильтруйте Агбр и вскипятите жидкость, чтобы удалить излишки bromine. By выпаривая в вакууме и кристаллизуя остаток, Hjsco Seric acid » HaO Crystal hydraate(mp 26°С) образуют Безводное состояние (mp 62 °C).2Н * 0 (Мп.- 24°С), 4НзО (Мп.-52°С) и 6Н, 0 (mp.
It также известно, что кристаллический гидрат селеновой кислоты (-68°С). 2H2Se04 < * Н30* » + HSe207-при нагревании Ия растворяет не только серебро (например, H * S04), но и золото, но Платина в нем не растворяется. Селен не растворяется за пределами 260°С.
Подобно серной кислоте, она очень гигроскопична и карбонизирует многие органические вещества прочность селеновой кислоты оценивается в 0,9 от серной кислоты Ион ScOj имеет тетраэдрическую структуру с расстоянием d (SeO)= 1,65 л. Селенит легко образуется под действием щелочного раствора хлора и селенита, или путем слияния селенита и Кноя.
Базео, который растворяется незначительно, обычно отделяется от реакционной смеси при нормальных условиях) Базео, вследствие обменного разложения других металлов сульфатами, селеновая кислота является obtained. In подключение к отоплению. Производным селениновой кислоты является также Se Os формула селенилсерната-(Se0) Se04, образование и свойства которого сходны с сульфатами (см. 27). более удобно получить это бесцветное кристаллическое вещество путем выдерживания расплава FeO3 при 170°C или путем взаимодействия SeOs и SeOj в жидкости SO.
In высокий вакуум, он сублимирует без разложения на 145°С, и когда он превышает 185°С, он входит в Se02. 38) свободная теллуровая кислота (/С,= 2 * 10’*.21 * 10е».= 3-l0-rtj получают взаимодействием элементарного теллура с 30%HjOj(при нагревании на водяной бане).Бесцветный кристаллогидрат HaTeO » — в виде 2HjO. Подобно NOI кислоте (VII§ 4, add 54), водород воды, содержащийся в этом кристаллическом гидрате, может быть частично или полностью заменен Si-металлом.
Основная ортотермическая кислота соответствует полюсу — N «TeO». При нагревании последнего при 100-т-200°С образуется бесцветный порошок H2Te04, но эта форма не распространена в теллуре. Все дизамещенные теллуры получают из Орто-теллуровой кислоты. При температуре менее 10°С HeTeOe-4HjO выделяется в сам раствор в виде кристаллогидратов.
Структура H4TeO » обнаруживает октаэдр с теллуром в центре и другими группами гидроксила сидра 6 vertices. In в концентрированном растворе Ия имеется несколько полимеров * зовац. Теллурат удобно получать сплавлением теллурита и KN03(обычная соль 450°C состава MjTeOj уже окисляется атмосферным кислородом).
Наиболее распространенными теллуридами являются NajH / TeOe, немного менее растворимые, и kznde0v-ZN} 0, который легко растворим. 6 замещенных натриевых солей (Na6teo) получают путем слияния НВТеО и Naoh. In воздух, он постепенно переходит в Na2H Te TeOe3HjO. По данным рентгеноструктурного анализа hg3teo alpha, Ион TeOj имеет октаэдрическую структуру С d (TeO)= 1,98 A. 39) при нагревании NDEOv до 140°C в закрытой трубке так называемая al * lottelluric acid представляет собой вязкую жидкость, которая прекрасно смешивается с водой и имеет ярко выраженную кислотность properties.
It представляет собой, по-видимому, раствор смеси полимеров теллуровой кислоты. Когда водный раствор сохраняется, аллотиловая кислота постепенно возвращается к Н5ТеОв. Селевой триацид a(температура плавления Yu Yu℃), схема: K 2seo «- F+so J = K 2SO » 4-он удобно готовится в соответствии с SE. Теплота образования из элементов составляет 41 ккал / моль.
Основной молекулярной формой этого вещества во всех агрегатных состояниях является тетрамер (Se03) (рис. VII1-33).Атом Селена [(mp 20°С) и соответствующую калиевую соль-K2SCSO7(mp 122 ° С) и KjSeS2Oio. In вода, все эти вещества быстро разлагаются. 42) тиосульфат натрия (тиосульфат натрия) (Na2se03) с элементарной серой кипятят в щелочной среде с образованием тиосульфата натрия (Na2SSe03).
Также было отмечено присутствие бледно-желтого маслянистого Тиоселенатного диэфира H2SSe03-2 (C2H5) 20. 43) при взаимодействии селената бария и фторсульфоновой кислоты по схеме BaSeO + 2HSO3F-BaSO «- f Se02b2-f H2SO » можно получить оксофторид Селена Se02b2, представляющий собой бесцветный газ (Мп.-100, Мп.-8° C) значительно более реактивный, чем S02B2.Оксофторид состава SeOFe (температура плавления-54, Мп.- 29 ° С) и Se ^ Fio (точка плавления-63.Mp.-76°С) также известен.
Первый из них является производным фторсилициловой кислоты(FsSeOF), второй-пероксидным соединением(F » SeOOSeF$). 44) путем растворять Se03 в HF, свободная кислота флуоресцеина (HSe03F) была obtained. It представляет собой бесцветную вязкую жидкость, которая испаряется в воздухе и обладает очень сильными окислительными свойствами. При использовании воды как сам HSe03F, так и его Соль MSeOaF (M-Cs-r-U) очень быстро разлагаются гидролизом на HF и HSe04.
45) аналогичного состава хлорселеновая кислота (HSeOjCl) была синтезирована взаимодействием HCl и SeOj в жидкости SO. It представляет собой бесцветную кристаллическую массу, стабильную максимум до −10°С и бурно реагирующую с водой. Соответствующая соль (хлорселенат) не была получена. 46) в случае теллура известно много кислот в составе TeFn (OH)—более сильных, чем H Te Te.
Из них лучше изучены пейтафтортеллурические Хотефы. Это бесцветный кристалл(Мп.40. Т. Кипятить.60°С) и является очень сильной одноосновной кислотой, но в водных растворах она быстро превращается в HF и H «TeO». Из высокорастворимых солей NH4OTeFs слабо разлагаются и сублимируются при 140°С, в то время как производные калия и цезия стабильны до 350 ° С.
Взаимодействие между XeFj и HOTeF привело к появлению FXeOTeF и Xe (OTeF).Первое из этих соединений представляет собой желтоватую жидкость, второе-бесцветный кристалл (Мп.36 * С). В то же время для гидроксила TeFsOH, который можно рассматривать как основание, соответствующее катиону tefsoh, известно соединение, которое является официальной солью этого катиона TeFjSOjF. TeFsHSO-n (TeF$) jSO / 4.
47) подобные пентафтортерулуровая кислота Селена-HOSeFs наиболее наилучшим образом получены взаимодействием Se02l: 2 с KHF2 и избытком HSOjF. Представляет собой бесцветный Летучий Кристалл (МП 38. Мп.44°с).Она разъедает стекло и металл и высвобождения хлора из раствора NaCl. 48) 3 оксид теллура получают дегидратацией теллуровой кислоты при 300-350°С. образующийся в этом процессе желтый Теодж аморфен и очень трудно растворяется в холодной воде (около 0,5 г / л). TeOe окисляет соляную кислоту только при нагревании (в отличие от SeOj).
49) при длительном воздействии TeOj при 406 ° с образуется светло-желтый оксид в составе Te205. Te02 только становится pr 485°C. It почти не растворяется в воде, но в сильном растворе кон. Об этом говорят данные магнитных исследований. Этот оксл является производным 5-валентного теллура. 50) при температуре −40°С взаимодействие 100% Hseojcl со 100% HjOg с эквимолярным количеством Hseojcl дало h2seo $мононасса. acid.
It представляет собой белое твердое вещество при −10°С и разлагается при нагревании до комнатной температуры при расщеплении 02.Его натриевая соль образуется путем тщательной нейтрализации интенсивно охлажденного 40%H2ScO. Через твердое Naj02. Попытки синтезировать H2Se20 потерпели неудачу. Имеются также признаки возможности получения пересыщенных кислот — (HO) АО, v (Oj) (за счет взаимодействия 100% н * 0 * при 0°С с тонкоизмельченным Se02).
51) в водный раствор теллура добавляют спирт. Мощный H202 также включен. Кристаллы типа K2h4teo и аддукты могут быть разделены. Или KjHJeOa. Эти соли являются неизвестными производными сульфита H * TeOu или NDeO *в свободном состоянии и получают из ортотеруровой кислоты путем замены некоторых гидрохинолов в ней пероксидами группы ООН. Такой разбавленный раствор кислоты получают путем ионного обмена солей на кислую смолу. При попытке сконцентрироваться они разлагаются с удалением кислорода.
Смотрите также:
| Круговорот серы в природе | Подгруппа хрома |
| Катализ | Азот |
