Оглавление:


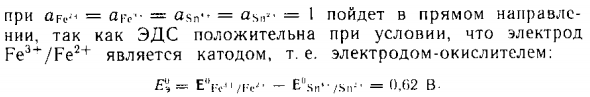

Потенциалы окислительно-восстановительных (редокси) электродов
- Емкость для KI SL и TELN O -VO STAN O V TEL N X (О XI-EL ECTRO DOV В принципе, реакция электрода Окислительно-восстановительная реакция. Но к окислителю Тем не менее, электрод восстановления Реакционный электрод не берется напрямую Металл и газ участие. Такие электроды сделаны из металла Проводник в контакте с ним, в том числе;
- Окисляющие и восстанавливающие агенты. Редокс электрод металла Те же требования, что и к металлу Проводник газового электрода. В качестве примера оксид Восстановительный электрод может направлять систему Fe ‘^ «^’ -f- e В общем, уравновешивание на электродах в простых системах Уравнение O x -f-ne »^ Красное написано. Электродная схема Таким образом, вы можете написать в форме PtIOx, красный Где О х — окисленная форма вещества. Красный — ремонт Форма вещества.
Уравнение Нернста для расчета окислительно-восстановительного электрического потенциала. Людмила Фирмаль
Да, есть формат Эо / р .-. i = I g (V I 1 1 5) O H ион или H «^; потенциал кислородного электрода и водородного электрода, Окислительно-восстановительный потенциал зависит от рН. Например, для системы MnO. ++ 4 N, 0 Ион M pO g представляет собой окисленную форму вещества, И восстановленные формы ионов-веществ, 1 Определяется уравнением F o1), я ‘MnO, afl’, w ,,, g h E \ 1: (): /, v h r ‘= Емпо. / m p- ”-1 F-F-I r —————-: 🙁 V I I. 15 d) Bf fi » Логарифма уравнения нет (UP, 15a) Активность воды во время электродной реакции.
Значение высококонцентрированного раствора) остается постоянным Значения для Noah и E вводятся. «Числовая замена Величины R и P в уравнении (UP.15a) и 1 ^ en- = = -pH, приобретенный при температуре 298 К ИМПО, Emio = E’mpO, ‘/ Mn ^’ 4-0.012! д —— 0,094 рН. Как видите, окислительно-восстановительный потенциал относительно независим. Изменения активности ионов МПО 4 «‘и Mn ^’ ^, Измените рН раствора.
- Стандартное значение потенциала Какой окислительно-восстановительный электрод указан в таблице. V II, 2. Окислительно-восстановительный потенциал электрода Живя в масштабе окислительной способности Си и уменьшая мощность Пункт. Окислительная способность системы увеличивается со сдвигом Окислительно-восстановительный потенциал к положительному значению.
Бунтовщик Инновационные возможности системы растут с потенциальными изменениями На пути к отрицательным значениям. Как видно из таблицы. Организация Объединенных Наций .2 Наиболее мощными окислителями являются ионы ZgO3 ‘”, Co ^’ *”, MnOc “, диоксид свинца. Согласно уравнению Возможности системы Nernstredox Также зависит от активности окисления и восстановления.
Форма вещества и реакции с участием ионов H «^ и ОН» и рН. Людмила Фирмаль
Например, способность окислять ионы MnO ^ «, SG2O 7», $ 0 G растет с уменьшением pH, Определить} {Redox direction- При этом необходимо рассчитать ЭД с разностью потенциалов Редокс-электрод участвует в этом процессе. Реакция протекает в направлении от ЭД ложь, например реакция SIr ^ + 2Pe’- + 2G-s ^ — когда ars- ‘= «zgs» — = идти вперед ЭД имеет электрод Катод или окислительный электрод: P L = -E ^ s „^ ■ / .sn- = 0,62 В.
Смотрите также:
| Потенциалы металлических электродов | Поляризация и перенапряжение |
| Потенциалы газовых электродов | Концентрационная поляризация |
